2. 肥西老母鸡农牧科技有限公司, 合肥 230000
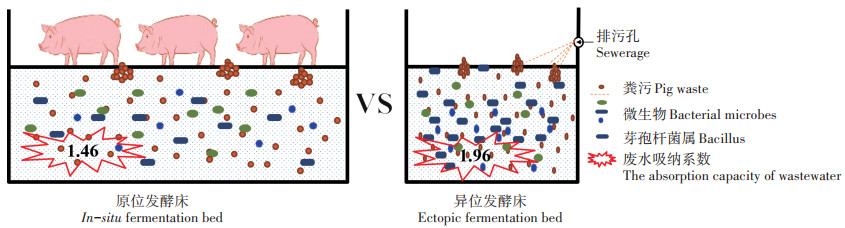 为了对比原位和异位发酵床应用方式和削减污染物能力的差异,本研究分析了在相同条件下两种发酵床模式对生猪养殖废弃物的处理效果。结果表明:异位发酵床温度和pH值的变化幅度均较小,为嗜热菌群的生长繁殖提供了适宜的环境;与原位发酵床相比,异位发酵床更有利于生猪的生长,生猪平均质量增加33 kg左右;发酵结束时,原位发酵床垫料的优势菌门是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes),异位发酵床的优势菌门为放线菌门(Actinobacteria)、厚壁菌门和变形菌门;发酵结束时异位发酵床垫料对生猪养殖废水的吸纳系数为1.96,优于原位发酵床垫料对生猪养殖废水的吸纳系数(1.46)。研究表明,异位发酵床较原位发酵床具有更加稳定的温度和pH值,并且以Bacillus为主的降解菌相对丰度较高,从而加快了微生物的代谢过程,促进了生猪粪污和废弃秸秆的降解。
为了对比原位和异位发酵床应用方式和削减污染物能力的差异,本研究分析了在相同条件下两种发酵床模式对生猪养殖废弃物的处理效果。结果表明:异位发酵床温度和pH值的变化幅度均较小,为嗜热菌群的生长繁殖提供了适宜的环境;与原位发酵床相比,异位发酵床更有利于生猪的生长,生猪平均质量增加33 kg左右;发酵结束时,原位发酵床垫料的优势菌门是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes),异位发酵床的优势菌门为放线菌门(Actinobacteria)、厚壁菌门和变形菌门;发酵结束时异位发酵床垫料对生猪养殖废水的吸纳系数为1.96,优于原位发酵床垫料对生猪养殖废水的吸纳系数(1.46)。研究表明,异位发酵床较原位发酵床具有更加稳定的温度和pH值,并且以Bacillus为主的降解菌相对丰度较高,从而加快了微生物的代谢过程,促进了生猪粪污和废弃秸秆的降解。2. Feixi Old Hen Farming and Animal Husbandry Technology Co., Ltd., Hefei 230000, China
随着人们生活水平的提高和对物质生活需求量的不断增加,肉制品已成为市场中占据相当大比例的食品。生猪养殖在畜禽养殖业中占比最大,对保障我国肉制品供给具有重要作用。据统计,1996—2017年我国生猪养殖规模的增幅年均可达3.35%,使我国成为全球名副其实的生猪第一生产大国[1]。国家统计局资料显示,到2020年底,全国生猪存栏共有4.1亿头,比2019年增加了约1亿头,猪肉产量达到了4 113万t。伴随着生猪养殖规模的扩大,养殖废弃物的产生量逐年增加。研究表明,一个存栏1万头生猪的养殖场每年可以产生约1.38万t粪便,目前我国畜禽养殖废弃物综合利用率低于50%[2-3],同时由于生猪养殖废弃物排放或处置不当引起的环境污染问题越来越受到社会的广泛关注。因此,探索生猪生态养殖和废弃物安全处理方式成为目前的研究热点问题。
传统的微生物发酵床养殖技术,即原位发酵床养殖技术可以从源头解决畜禽粪便的污染问题,实现畜禽废弃物趋零污染[4-6]。有研究表明,原位发酵床技术有时会因发酵床内部温度过高而导致畜禽的生长受到影响,因而必须经常采取翻耙和通风等措施来解决这一问题[7]。近几年,在原位微生物发酵床养殖技术基础上发展起来的异位微生物发酵床技术,可以利用高温好氧发酵在持续、动态的条件下对养殖废弃物进行处理,并完成资源转化[8]。养殖废弃物异位发酵床处理技术将床体与养殖过程分离,可以有效地解决原位发酵床垫料高温不利微生物生长的问题并大幅度提高了处理效率[9]。已有报道都是在不同条件下,针对不同类型养殖废弃物开展原位和异位发酵床控制畜禽养殖污染效果的研究。王浠等[10]的研究发现原位发酵床每30 m2可以饲养20头生猪,并且得出原位发酵垫料休息区的持水性比粪尿区持水性高1.35倍。董立婷等[9]通过异位发酵床处理生猪养殖产生的粪便和污水,每1.5 m3可以处理5头生猪养殖的废弃物,并得出每千克垫料对生猪养殖废水的粪污吸纳系数为2.53,优于对奶牛养殖废水的粪污吸纳系数[11]。
原位和异位发酵床是两种不同的畜禽养殖污染控制技术,其应用方式和对污染物的削减能力存在一定的差异。本研究以原位和异位发酵床为对象,分析了在相同条件下两种模式对生猪养殖废弃物的处理效果,阐明了两种模式生猪生长状况、废水吸纳系数和微生物群落组成变化的差异,为两种技术模式的选择和推广提供了理论基础。
1 材料与方法 1.1 试验装置本研究在北京市顺义区某生猪养殖舍内进行。异位和原位发酵床同时建设,试验装置如图 1和图 2所示。异位发酵床的规格为3 000 mm×1 000 mm×900 mm,原位发酵床规格为4 480 mm×3 000 mm×900 mm。原位发酵床与异位发酵床各养殖生猪3头,共计6头。试验从2019年3月10日开始运行,到5月23日结束,共运行73 d。异位发酵床与养殖区(坡度为5°)之间由排污孔连接,残留粪尿和冲洗污水由排污孔进入异位发酵床。

|
图 1 微生物发酵床俯视图(mm) Figure 1 Planform of microbial fermentation system(mm) |

|
图 2 异位微生物发酵床剖面图(mm) Figure 2 Profile of ectopic microbial fermentation system(mm) |
原位发酵床和异位发酵床的制作方法一致。将玉米秸秆和杨树叶粉碎成约2.0 cm,再将杨树叶、玉米秸秆和椰壳粉按照质量比为55∶35∶10进行混合,按照比例添加微生物菌剂并混合均匀。调节垫料的初始含水率在50%~60%之间,将垫料倒入床内进行发酵床的制作,预发酵4 d后开始试验。杨树叶、玉米秸秆和椰壳粉均由北京顺莉公司提供,原位发酵床和异位发酵床的垫料用量约为320 kg。微生物菌剂为开创阳光公司生产的微生物发酵剂零污染Ⅰ号,用量为每3 m3 500 g,该菌剂以芽孢杆菌(Bacillus)为主,有益菌数>109个·g-1。两种模式发酵床均选择40 kg左右的仔猪,且仔猪生长健康状况良好。
1.3 试验方法原位发酵床通过在猪舍内铺设含有有益微生物的垫料将生猪粪尿原位分解,并利用生猪的拱掘习性对垫料翻堆,无冲水过程。异位发酵床则每日采用人工清粪的方式将大部分生猪废污送至发酵床的表面,并进行简单机械翻堆,而冲洗残留粪便以及尿液的污水是经过排污孔进入异位发酵床。为避免发酵床垫料含水率过高,试验过程中严格控制养殖区的用水量约为每10 d 20 kg。依据《第一次全国污染源普查畜禽养殖业源产排污系数手册》计算每日每只生猪产生的粪便和尿液量,两个处理的生猪饲养采用相同的饲料与饮用水,本试验中异位发酵床和原位发酵床所处的外界环境条件也完全一致。
采用小型翻堆机(2.2 kW电机,220 V电压),对原位与异位发酵床同时进行深度翻堆(深度为60 cm)。按照五点采样法采集原位与异位发酵床的上层(0~20 cm)、中层(20~30 cm)和下层(30~50 cm)垫料样品,并将3层样品混匀后装入自封袋备用。取样时间为第0(即试验开始当天)、8、16、24、32、40、48、56、64、73 d。取一部分新鲜样品进行pH、含水率和微生物数量指标的测定;剩余样品放置在阴凉处风干后磨碎贮存,用于测定总氮、碳氮比、有机质等指标。
1.4 指标测定 1.4.1 垫料温度每日9:00左右根据五点测样法用堆肥温度计测定20、30、40 cm深度处的垫料温度,3个深度处的平均值为该垫料的温度。同时,用干湿温度计观测异位发酵床附近的环境温度。
1.4.2 垫料pH及电导率采用四分法取混合均匀的新鲜样品5 g于100 mL锥形瓶内,加入50 mL去离子水,用振荡器(150 r·min-1)振荡浸提30 min,再用pH计和电导率仪分别测定悬浮液的pH和电导率。
1.4.3 垫料含水率及粪污吸纳系数采用四分法取混合均匀的新鲜样品50 g于铝箔内,然后放入鼓风干燥箱105 ℃烘干8 h,取出冷却30 min后称质量,测定其含水率;按照《第一次全国污染源普查畜禽养殖业源产排污系数手册》计算生猪育肥期的粪便和尿液产生量,将添加的粪污质量与垫料初始质量相比,其比值即为发酵全过程垫料的粪污吸纳系数[9]。
1.4.4 细菌群落多样性按照TIANamp Stool DNA Kit试剂盒的提取步骤进行样品DNA的提取,提取完成的DNA于−20 ℃保存,以备后续微生物多样性的测定使用。采用16S rRNA基因V3~V4区域的通用细菌引物338F(5’-ACT CCT ACG GGA GGC AGC AG-3’)和806R(5’-GGA CTA CHV GGG TWT CTA AT -3’)对样品总DNA进行PCR扩增,目的条带大小正确则采用Illumina MiSeq PE300测序平台进行高通量测序,测序结果由北京奥维森基因科技有限公司提供。
下机数据经过QIIME1(v1.8.0)软件根据Barcode序列拆分样本,使用Pear(v0.9.6)软件对数据进行过滤、拼接。拼接后使用Vsearch(v2.7.1)软件去除长度小于230 bp的序列,并根据Gold Database数据库用uchime方法比对去除嵌合体序列。使用Vsearch(v2.7.1)软件uparse算法对优质序列进行OTU聚类(Operational Taxonomic Units),序列相似性阈值为97%。与Silva128数据库使用RDP Classifier算法进行比对,设置70%的置信度阈值,得到每个OTU对应的物种分类信息。再利用QIIME1(v1.8.0)软件对样本计算Shannon多样性指数。基于物种注释及相对丰度结果,使用R(v3.6.0)软件进行物种组成柱状图分析。
相应的数据释放于SRA(Sequence Read Archive)数据库,编号为PRJNA728848。
1.4.5 垫料中的养分含量采用《有机肥料》(NY 525—2012)中规定的方法进行相关指标的测定。全氮采用硫酸-过氧化氢消煮-凯氏定氮法测定;有机质采用重铬酸钾容量法测定。
1.5 数据分析采用Excel软件对数据进行初级统计分析,采用SPSS 22.0软件对数据进行相关性分析,并用Origin 9.0软件作图分析。
2 结果与分析 2.1 发酵床垫料的温度变化由图 3可见,在整个试验期间室内空气温度呈现波动变化趋势,在11~23 ℃范围内变化。而同期原位发酵床和异位发酵床内温度明显高于室温。发酵最初2 d原位发酵床和异位发酵床内温度从室温急剧升高至60 ℃左右,然后保持在50.0~65.0 ℃范围内变化,至56 d后,发酵能力逐渐减弱,垫料内温度逐渐降低,至第73 d,垫料内温度降低至与室温接近,发酵结束。对比分析可见,异位发酵床在发酵期间床体温度略高于原位发酵床,但差异不明显。整个试验期间异位发酵床床体温度维持在53 ℃左右,而原位发酵床床体温度维持在49 ℃左右,均能够满足微生物活性要求。

|
图 3 不同发酵床发酵过程中垫料温度的变化 Figure 3 Changes of the temperature of padding in different fermentation systems during test period |
由图 4可知,整个试验期内原位发酵床和异位发酵床的pH总体呈现升高下降的波动变化趋势,且整体pH在7.2~8.6范围内变化,并且两种模式发酵床pH的整体变化趋势基本一致。原位发酵床的pH由起始的7.56快速上升,在第48 d达到最大值8.24,试验结束时为7.83。异位发酵床的起始pH为7.96,48 d时达到最高值8.56,试验结束时为8.01。对比分析可见,在发酵过程中异位发酵床的整体pH略高,这说明异位发酵床内微生物的代谢产生了更多的碱性物质。

|
图 4 不同发酵床发酵过程中垫料pH的变化 Figure 4 Changes of the pH value of padding in different fermentation systems during test period |
由表 1可知,原位发酵床和异位发酵床的生猪初始质量均为40 kg左右,试验结束时,两种模式发酵床的生猪质量差异显著,原位发酵床的生猪平均质量为112.96 kg,异位发酵床的生猪平均质量为145.36 kg,两种模式平均生猪的质量相差约33 kg,这说明与原位发酵床相比异位发酵床养殖模式更有利于生猪的生长。
|
|
表 1 发酵前后生猪质量(kg) Table 1 Weight of pigs before and after fermentation(kg) |
由图 5可知,整个试验期内原位发酵床和异位发酵床的含水率总体呈现升高下降的波动变化趋势,且整体处于45%~66%之间,并且两个发酵床的变化趋势基本一致。床体垫料初始含水率约为50%,随着试验的进行和废水的加入,垫料含水率升高,又因为周边环境温度变化以及垫料的持续性高温造成了垫料水分的蒸发,以致垫料含水率呈现波动变化趋势。原位发酵床中的含水率在46%~66%之间变化,波动范围相对较大;而异位发酵床的含水率在47%~60%之间变化,波动范围相对较小。

|
图 5 不同发酵床发酵过程中垫料含水率的变化 Figure 5 Changes of the moisture content of padding in different fermentation systems during test period |
本研究原位发酵床不冲水,异位发酵床用水量如表 2表示,整个试验期间大约每10 d冲洗养殖区域1次,用水量共计159.65 kg。根据《第一次全国污染源普查畜禽养殖业源产排污系数手册》,华北区育肥期生猪粪便的产排污系数为1.81 kg·头-1·d-1,尿液的产排污系数为2.14 L·头-1·d-1。研究期间每个发酵床饲养生猪3头,育肥育成期73 d,共计产生粪便396.39 kg,产生尿液468.66 L。经计算,试验全过程中异位发酵床垫料对生猪养殖粪便和废水的吸纳系数分别为1.24和1.96;原位发酵床垫料对生猪养殖粪便和废水的吸纳系数分别为1.24和1.46。
|
|
表 2 异位发酵过程中冲洗养殖区的用水量(kg) Table 2 Water amount to flush the culture area during fermentation period(kg) |
图 6为两种发酵床在试验开始及结束时垫料中的营养成分(总氮、有机质和碳氮比)的变化情况。由图可知,试验结束时垫料中的总氮较开始时极显著增加(P < 0.01),而垫料中的有机质和碳氮比与开始时比均显著下降(P < 0.01)。原位发酵床总氮含量由初始的0.75%增加到结束时的2.4%;异位发酵床的总氮含量由初始的0.77%增加到结束时的2.54%。对比分析可知,异位发酵床比原位发酵床总氮含量高,发酵后原位发酵床和异位发酵床的总氮含量均比发酵前显著增加,这与有机物质在微生物的作用下挥发,总干物质质量减少及猪粪废水的持续加入有关。原位发酵床垫料的有机质和碳氮比分别由初始的81.54%和62.98减至结束时的54.30%和13.12,分别减少了27.24个百分点和79.17%;异位发酵床垫料的有机质和碳氮比分别由初始的84.16%和63.40减至结束时的50.91%和11.63,分别减少了33.25个百分点和81.66%,发酵结束时原位发酵床和异位发酵床的有机质和碳氮比均差异显著,异位发酵床比原位发酵床的变化幅度大。

|
不同小写字母表示处理间差异显著(P < 0.05),不同大写字母表示不同时间间差异极显著(P < 0.01)。下同 Different lowercase letters indicate significant differences among treatments at P < 0.05. Different uppercase letters indicate significant differences among treatment time at P < 0.01. The same below 图 6 不同发酵床发酵前(第0 d)和发酵后(第73 d)垫料总氮、有机质、碳氮比的比较 Figure 6 Comparison of total nitrogen, organic matter, C/N of padding between the beginning day (0) and the ending day (72) of fermentation |
图 7为原位发酵床和异位发酵床不同层次垫料的α多样性,在发酵结束时,Shannon指数微生物多样性参数呈现出显著的统计学差异(P < 0.05)。由图可以看出,原位发酵床和异位发酵床垫料中层的Shannon指数比上层和下层高,说明中层垫料的细菌群落比上层和下层更为多样化。对比而言,发酵结束时原位发酵床垫料的Shannon指数均值达到7.21,异位发酵床垫料的Shannon指数均值达到5.98,说明原位发酵床比异位发酵床的细菌群落更加多样化。

|
不同小写字母代表组间的差异显著(P < 0.05),不同大写字母代表处理间的差异显著(P < 0.05) Different lowercase letters indicate significant differences among groups, and uppercase letters indicate significant differences among treatments at P < 0.05 levels 图 7 发酵结束时不同发酵床中细菌的多样性 Figure 7 Bacterial diversity in different fermentation systems at the end of fermentation |
基于16S rRNA基因的V3~V4区高通量测序结果,在发酵结束时,原位发酵床和异位发酵床不同层次垫料的细菌群落组成在门水平和属水平上的相对丰度变化规律如图 8所示。如图 8A所示,发酵结束时,原位发酵床和异位发酵床不同层次垫料的优势菌门是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes)。原位发酵床的厚壁菌门相对丰度约为34%,变形菌门的相对丰度约为20%,绿弯菌门的相对丰度约为15%,拟杆菌门的相对丰度约为14%;异位发酵床厚壁菌门的相对丰度约为54%,变形菌门的相对丰度约为14%,放线菌门的相对丰度约为17%;原位发酵床的变形菌门、绿弯菌门和拟杆菌门的相对丰度比异位发酵床高,而异位发酵床的厚壁菌门和放线菌门的相对丰度比原位发酵床高。

|
图 8 发酵结束时不同发酵床中微生物群落门水平和属水平组成的相对丰度 Figure 8 Relative abundance of microbial community phylum level and genes level composition in different fermentation systems at the end of fermentation |
从图 8B可以看出,在属的分类水平上,原位发酵床和异位发酵床的优势菌群存在差异。原位发酵床主要有芽孢杆菌属(Bacillus)、乳杆菌属(Ruminofilibacter)、赖氨酸芽孢杆菌属(Lysinibacillus)等;异位发酵床主要有芽孢杆菌属、严格梭菌属(Clostridium_sensu_stricto_1)、Tepidimicrobium等;发酵结束后,两种模式发酵床大部分细菌都是益生菌。其中原位发酵床的芽孢杆菌属相对丰度约为5.5%,异位发酵床约为30%;原位发酵床的Tepidimicrobium相对丰度约为2%,而异位发酵床约为15%。异位发酵床的严格梭菌属和Tepidimicrobium的相对丰度远高于原位发酵床,且芽孢杆菌属相对丰度比原位发酵床高。
3 讨论 3.1 不同模式发酵床垫料理化性质变化影响微生物发酵床发酵功能的指标主要有垫料的温度、含水率和pH等。温度是反映发酵床效率最为直观的指标,也是反映微生物活性的重要指标之一[8]。有研究表明,床体温度保持在55 ℃以上超过3 d,可以杀灭垫料中的有害微生物,确保垫料卫生合格[12]。本试验所研究的异位发酵床和原位发酵床在处理生猪废弃物过程中垫料温度在初期保证了至少有3 d高于55 ℃,确保了填料卫生合格。微生物可以通过分解畜禽废弃物来满足自身生长繁殖需要并进一步产生热量。本研究中,异位发酵床垫料温度大于原位发酵床,这说明异位发酵床中的嗜热微生物更为活跃[13]。本研究中两种模式发酵床pH的整体变化趋势基本一致。异位发酵床发酵过程中的pH要高于原位发酵床,这是因为异位发酵床中的微生物代谢水平较高,促进了有机物的分解,增加了pH。研究表明,微生物好氧发酵适宜的pH范围在6.5~9.0之间[14-16],此时微生物生长以及有机质的分解速率最大。TAM等[17]的研究发现发酵床垫料过酸(pH < 5.9)或过碱(pH>9.0)均不利于粪尿的发酵分解。试验初期微生物大量繁殖,分解垫料以及生猪废弃物中的含氮物质,释放出氨气,从而导致pH增加;同时微生物进行硝化作用产生H+,导致pH下降,进而导致pH呈现出上下波动的变化趋势。通常发酵床自身具有调节功能,可使pH处于一个动态平衡的状态。异位发酵过程中的pH要高于原位发酵过程,这是由于异位发酵床中微生物降解的有机物质更多造成的。
3.2 不同模式发酵床生猪生长状况变化两种模式发酵床对生猪生长状况的影响是最直接反映其差异性的指标。两种模式发酵床选用的生猪初始质量相近,试验结束时两种模式发酵床的生猪质量差异显著,异位发酵床生猪的平均质量比原位发酵床生猪高约33 kg。研究表明,异位发酵床养殖生猪比原位发酵床养殖生猪的生长疾病少[18]。另外,生猪是一种恒温动物,发酵床的温度过高或过低均会对其生长状况造成一定的影响[19]。异位发酵床的生猪生活在水泥地上,与环境温度一致,而原位发酵床的生猪生活在发酵床填料上,垫料温度对其生长产生了影响。本试验研究中,采用异位发酵床养殖生猪比原位发酵床养殖生猪更有利于生猪的生长。
3.3 不同模式发酵床垫料废水及废弃物的变化含水率直接关系到发酵床填料温度、微生物发酵以及分解粪便的水平。含水率过高会导致厌氧发酵产生有害气体,而含水率过低则会抑制微生物的新陈代谢[20]。含水量能够调节温度、pH和微生物的代谢过程[21]。有研究表明,发酵床适宜微生物好氧发酵的含水量范围为45%~60%[20-22]。在本研究中,异位发酵床的温度较原位发酵床的温度高、蒸发量大,因此原位发酵床比异位发酵床的含水率要高。根据《第一次全国污染源普查畜禽养殖业源产排污系数手册》的相关系数计算,试验全过程中异位和原位发酵床垫料对生猪养殖产生的粪便的吸纳系数均为1.24;异位和原位发酵床垫料对生猪养殖产生的废水的吸纳系数分别为1.96和1.46。因此异位发酵床处理粪污的能力要优于原位发酵床。
异位发酵床的腐熟程度可以用总氮、有机质和C/N等指标指示。在微生物的作用下发酵床填料中不同形态的氮素之间会发生复杂的转化,存在一个动态转变过程[23]。有研究表明,随着填料使用时间的延长,以及畜禽粪便的不断排放,填料中的氮含量呈现不断上升的趋势,然而有机质、C/N则呈现下降趋势[23-24]。本研究中,原位发酵床和异位发酵床垫料的总氮呈现显著增加的趋势,与微生物代谢导致总干物质质量减少及猪粪废水的持续添加有关[25]。而有机质和C/N呈现下降的趋势,这是由于填料中的有机质在发酵过程中发生降解所致[24],本研究结果与前人的研究结果一致。对比分析可知,异位发酵床比原位发酵床总氮含量高,有机质和C/N的变动幅度大,这说明异位发酵床比原位发酵床降解代谢了更多的有机废弃物。
3.4 不同模式发酵床垫料细菌群落的变化微生物是发酵床建立的主体,是影响发酵床发酵过程的决定性因素。发酵结束时,原位发酵床的细菌群落结构比异位发酵床更为多样化,这表明生猪废弃物、肠道微生物及其体表微生物提高了原位发酵床的物种丰富度;然而异位发酵床的养殖模式不利于相关微生物向垫料转移,导致细菌群落多样性降低。有研究表明,养猪发酵床垫料菌群主要是由变形菌门、厚壁菌门、放线菌门、拟杆菌门、芽单胞菌门、绿弯菌门等组成[26-27]。原位发酵床和异位发酵床不同层次垫料的微生物主要有厚壁菌门、变形菌门、放线菌门、绿弯菌门、拟杆菌门、芽单胞菌门(Gemmatimonadetes)[28],这与本研究结果一致。厚壁菌门在原位发酵床和异位发酵床中均占据了很大比例,属于嗜热菌。LI等[29]对连续高温堆肥过程中细菌群落和功能特征的变化进行研究,发现绿弯菌门、厚壁菌门和放线菌门是堆肥后期的主要菌门。放线菌门主要参与纤维素的降解,绿弯菌门属于厌氧生物,与含水量的多少有关,变形菌门在微生物发酵床处理中主要参与氮、碳物质的转化利用[30-31]。本研究原位发酵床的变形菌门、绿弯菌门和拟杆菌门的相对丰度比异位发酵床高,而异位发酵床的厚壁菌门和放线菌门的相对丰度比原位发酵床高。原位发酵床以芽孢杆菌属为主,异位发酵床大部分都是降解菌,可以看出发酵结束后原位发酵床和异位发酵床的菌属大部分都是益生菌。芽孢杆菌属是常见的能参与大分子聚合物如淀粉、木质纤维素等降解的微生物[32]。有研究证明Tepidimicrobium能够分解废弃物中的多糖类物质,且能够参与纤维素的降解[33]。异位发酵床的芽孢杆菌属和Tepidimicrobium的相对丰度比原位发酵床高,说明异位发酵床更有利于废弃物的降解。微生物发酵床中的微生物是一个综合整体,各种理化指标的变化都会对微生物的代谢和生长繁殖产生一定的影响。
4 结论(1)异位发酵床内温度和pH变化稳定,为嗜热菌群的生长繁殖提供了适宜的环境,促进了有机物质的分解和微生物的代谢过程。
(2)温度对于生猪的生长具有重要作用,异位发酵床养殖更有利于生猪的生长。
(3)发酵结束时,异位发酵床垫料对生猪养殖产生的粪便和废水的吸纳系数分别为1.24和1.96;原位发酵床垫料对生猪养殖产生的粪便和废水的吸纳系数分别为1.24和1.46。异位发酵床对生猪养殖废水的吸纳能力优于原位发酵床。
(4)发酵结束时,原位发酵床不同层次垫料的优势菌门是厚壁菌门、变形菌门、绿弯菌门和拟杆菌门,异位发酵床不同层次的优势菌门为厚壁菌门、变形菌门和放线菌门;异位发酵床以芽孢杆菌属为主的降解菌的相对丰度较高,有利于生猪养殖粪污和废弃秸秆的降解。
| [1] |
国家统计局. 中国统计年鉴2018[M]. 北京: 中国统计出版社, 2019: 318-324. National Bureau of Statistics. China statistical yearbook 2018[M]. Beijing: China Statistical Press, 2019: 318-324. |
| [2] |
李彬辉, 杨小毛, 梅立永, 等. 畜禽养殖业粪污处理及资源化利用[J]. 中国资源综合利用, 2018, 36(2): 58-60. LI B H, YANG X M, MEI L Y, et al. Excrement treatment and resource utilization of livestock and poultry husbandry[J]. China Resources Comprehensive Utilization, 2018, 36(2): 58-60. DOI:10.3969/j.issn.1008-9500.2018.02.023 |
| [3] |
印遇龙. 大力发展生态养殖, 撬动大农业循环发展[J]. 饲料与畜牧, 2017(8): 41-42. YING Y L. Vigorously developed ecological breeding and promote the circular development of agriculture[J]. Fodder and Animal Husbandry, 2017(8): 41-42. DOI:10.3969/j.issn.1006-6314.2017.08.011 |
| [4] |
GIRARD M, NIKIEMA J, BRZEZINSKI R, et al. A review of the environmental pollution originating from the piggery industry and of the available mitigation technologies: Towards the simultaneous biofiltration of swine slurry and methane[J]. Canadian Journal of Civil Engineering, 2009, 36(12): 1946-1957. DOI:10.1139/L09-141 |
| [5] |
FOLORUNSO O R, KAYODE S, ONIBON V O. Poultry farm hygiene: Microbiological quality assessment of drinking water used in layer chickens managed under the battery cage and deep litter systems at three poultry farms in southwestern Nigeria[J]. Pakistan Journal of Biological Sciences Pjbs, 2014, 17(1): 74-79. |
| [6] |
MORRISON R S, JOHNSTON L J, HILBRANDS A M. The behaviour, welfare, growth performance and meat quality of pigs housed in a deeplitter, large group housing system compared to a conventional confinement system[J]. Applied Animal Behaviour Science, 2007, 103(1/2): 12-24. |
| [7] |
余苗, 高凤仙. 发酵床养猪及其关键影响因素[J]. 家畜生态学报, 2011, 32(4): 93-96. YU M, GAO F X. The fermented bed for pigraising and the key factors[J]. Acta Ecologae Animalis Domastici, 2011, 32(4): 93-96. DOI:10.3969/j.issn.1673-1182.2011.04.024 |
| [8] |
李路瑶, 李佳彬, 冯烁, 等. 微生物异位发酵床处理蛋鸡养殖废弃物的效果[J]. 中国农业气象, 2020, 41(8): 473-482. LI L Y, LI J B, FENG S, et al. Treatment effects of ectopic microbial fermentation on layer hens waste[J]. Chinese Journal of Agrometeorology, 2020, 41(8): 473-482. DOI:10.3969/j.issn.1000-6362.2020.08.001 |
| [9] |
董立婷, 朱昌雄, 张丽, 等. 微生物异位发酵床技术在生猪养殖废弃物处理中的应用研究[J]. 农业资源与环境学报, 2016, 33(6): 540-546. DONG L T, ZHU C X, ZHANG L, et al. Research and application of ectopic microbial fermentation system in processing piggery waste[J]. Journal of Agricultural Resources and Environment, 2016, 33(6): 540-546. |
| [10] |
王浠, 聂海峰, 汪翠萍, 等. 北方冬季生物发酵床垫料理化性质及温度分布特征研究[J]. 家畜生态学报, 2016, 37(8): 24-30. WANG X, NIE H F, WANG C P, et al. Physicochemical properties and temperature distributions of the bio-fermentation bed litter in winter in north China[J]. Journal of Domestic Animal Ecology, 2016, 37(8): 24-30. DOI:10.3969/j.issn.1673-1182.2016.08.006 |
| [11] |
GUO H, GENG B, LIU X, et al. Characterization of bacterial consortium and its application in an ectopic fermentation system[J]. Bioresource Technology, 2013, 139: 28-33. DOI:10.1016/j.biortech.2013.04.029 |
| [12] |
YANG X, SONG Z, ZHOU S, et al. Insights into functional microbial succession during nitrogen transformation in an ectopic fermentation system[J]. Bioresource Technology, 2019, 284: 266-275. DOI:10.1016/j.biortech.2019.03.135 |
| [13] |
蒋建明, 闫俊书, 白建勇, 等. 微生物发酵床养猪模式的关键技术研究与应用[J]. 江苏农业科学, 2013, 41(9): 173-176. JIANG J M, YAN J S, BAI J Y, et al. Key technology research and application of microbial fermentation bed pig model[J]. Jiangsu Agricultural Sciences, 2013, 41(9): 173-176. DOI:10.3969/j.issn.1002-1302.2013.09.069 |
| [14] |
SUNDBERG C, SMARS S, JONSSON H. Low pH as an inhibiting factor in the transition from mesophilic to thermophilic phase in composting[J]. Bioresource Technology, 2004, 95(2): 145-150. DOI:10.1016/j.biortech.2004.01.016 |
| [15] |
焦洪超, 栾炳志, 宋志刚, 等. 发酵床养猪垫料基础参数变化规律研究[J]. 中国兽医学报, 2013, 33(10): 1610-1614. JIAO H C, LUAN B Z, SONG Z G, et al. Study on the basic parameters of litters in fermenting -bed system of pig production[J]. Chinese Journal of Veterinary Science, 2013, 33(10): 1610-1614. |
| [16] |
曹珍, 陈峰, 张祥斌, 等. 发酵床养殖畜禽基本技术参数的研究进展[J]. 家畜生态学报, 2014, 35(4): 7-11. CAO Z, CHEN F, ZHANG X B, et al. Review of basic parameters of deep-litter system for breeding livestock and poultry[J]. Acta Ecologiae Animalis Domastici, 2014, 35(4): 7-11. DOI:10.3969/j.issn.1673-1182.2014.04.002 |
| [17] |
TAM N, TIQUIA S, VRIJMOED L. Nutrient transformation of pig manure under pig-on-litter system[M]//Dordrecht Springer: The Science of Composting, 1996: 96-105.
|
| [18] |
周黎明, 王均良, 王冲, 等. 异位发酵床在养猪上的应用[J]. 榆林学院学报, 2020, 30(6): 49-54. ZHOU L M, WANG J L, WANG C, et al. Application of ectopic fermentation bed in pig breeding[J]. Journal of Yulin University, 2020, 30(6): 49-54. |
| [19] |
欧秀琼, 郭宗义. 环境温度变化对仔猪和生长肥育猪健康及生产力的影响[J]. 畜牧与兽医, 2014, 46(6): 129-132. OU X Q, GUO Z Y. Effects of ambient temperature change on health and productivity of piglets and growth finishing pigs[J]. Animal Husbandry & Veterinary Medicine, 2014, 46(6): 129-132. |
| [20] |
RYNK R. Monitoring moisture in composting systems[J]. Biocycle, 2000, 41(10): 53-53. |
| [21] |
蓝江林, 宋泽琼, 刘波, 等. 微生物发酵床不同腐熟程度垫料主要理化特性[J]. 福建农业学报, 2013, 28(11): 1132-1136. LAN J L, SONG Z Q, LIU B, et al. The main physical and chemical characteristics of pig litter in the microbial fermentation bed[J]. Fujian Journal of Agricultural Sciences, 2013, 28(11): 1132-1136. DOI:10.3969/j.issn.1008-0384.2013.11.012 |
| [22] |
LIANG C, DAS K C, MCCLENDON R W. The influence of temperature and moisture contents regimes on the aerobic microbial activity of a biosolids composting blend[J]. Bioresource Technology, 2003, 86(2): 131-137. DOI:10.1016/S0960-8524(02)00153-0 |
| [23] |
马晗, 郭海宁, 李建辉, 等. 发酵床垫料中有机质及氮素形态变化[J]. 生态与农村环境学报, 2014, 30(3): 388-391. MA H, GUO H N, LI J H, et al. Variation of organic matter and nutrient forms in pig bio-bed litters[J]. Journal of Ecology and Rural Environment, 2014, 30(3): 388-391. DOI:10.3969/j.issn.1673-4831.2014.03.020 |
| [24] |
GUO H, ZHU C X, GENG B, et al. Improved fermentation performance in an expanded ectopic fermentation system inoculated with thermophilic bacteria[J]. Bioresource Technology, 2015, 198: 867-875. DOI:10.1016/j.biortech.2015.09.105 |
| [25] |
刘海琴, 张志勇, 罗佳, 等. 养猪发酵床废弃垫料高温堆置肥料的研究[J]. 江西农业学报, 2015, 27(8): 44-48. LIU H Q, ZHANG Z Y, LUO J, et al. Research on composting waste bedding material for pig-raising through high-temperature fermentation[J]. Jiangxi Acta Agriculturea, 2015, 27(8): 44-48. DOI:10.3969/j.issn.1001-8581.2015.08.010 |
| [26] |
ANTUNES L P, MARTINS L F, PEREIRA R V, et al. Microbial community structure and dynamics in thermophilic composting viewed through metagenomics and metatranscriptomics[J]. Scientific Reports, 2016, 6(1): 38915. DOI:10.1038/srep38915 |
| [27] |
WEI H, WANG L, HASSAN M, et al. Succession of the functional microbial communities and the metabolic functions in maize straw composting process[J]. Bioresource Technology, 2018, 256: 333-341. DOI:10.1016/j.biortech.2018.02.050 |
| [28] |
陈倩倩, 刘波, 朱育菁, 等. 微生物发酵床不同深度垫料的细菌群落多样性[J]. 农业环境科学学报, 2019, 38(10): 2412-2419. CHEN Q Q, LIU B, ZHU Y J, et al. Bacterial community diversity of litters at different depths in microbial fermentation bed[J]. Journal of Agro-Environment Science, 2019, 38(10): 2412-2419. DOI:10.11654/jaes.2019-0361 |
| [29] |
LI X, SHI X S, LU M Y, et al. Succession of the bacterial community and functional characteristics during continuous thermophilic composting of dairy manure amended with recycled ceramsite[J]. Bioresource Technology, 2019, 294: 122044. DOI:10.1016/j.biortech.2019.122044 |
| [30] |
朱双红. 猪生物发酵床垫料中细菌群落结构动态变化研究[D]. 武汉: 华中农业大学, 2012: 48-50. ZHU S H. The dynamic changes of bacterial community structure on micro-fermentation bed piggery litter[D]. Wuhan: Huazhong Agricultural University, 2012: 48-50. |
| [31] |
FIERER N, BRADFORD M A, JACKSON R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364. DOI:10.1890/05-1839 |
| [32] |
GUO Y P, ZHANG G Q, CHEN Q J, et al. Analysis on bacterial community structure in mushroom(Agaricus bisporus) compost using PCR-DGGE[J]. Agricultural Science & Technology, 2015, 20(8): 1778-1784. |
| [33] |
PHITSUWAN P, TACHAAPAIKOON C, KOSUGI A, et al. A cellulolytic and xylanolytic enzyme complex from an alkalothermoanaerobacterium, Tepidimicrobium xylanilyticum BT14[J]. Journal of Microbiology and Biotechnology, 2010, 20(5): 893-903. DOI:10.4014/jmb.0911.11025 |
 2021, Vol. 40
2021, Vol. 40




