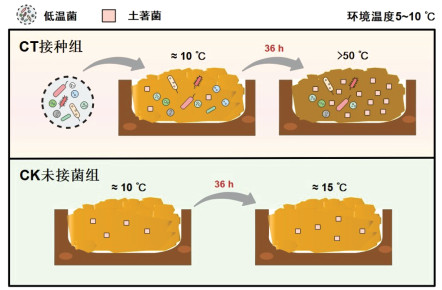
堆肥是易腐有机垃圾处理的主要方式之一[1]。易腐有机垃圾主要来源于农业与工业生产过程中产生的废弃物、畜禽粪便,以及人类活动产生的生活及餐厨垃圾[2-3]。易腐有机垃圾中富含大量生物可利用的营养物质,微生物可通过自身生物氧化作用代谢这些营养物质,产生大量能量[4-5]。这些能量一部分被微生物正常活动利用,另一部分以热能的形式散失,促进堆肥发酵物升温[6-7]。因此,堆肥过程中微生物的活性对于发酵温度的变化至关重要。
当堆肥原料的起始温度低于20.0 ℃时,堆肥进程温度的动态变化可分成4个阶段,其中,除升温、高温和降温阶段外,堆肥进程还要经历一个从低温到20 ℃的阶段,这一阶段对于微生物的大量繁殖和堆肥进程的启动具有重要意义,被称为起爆阶段[8-10]。温度是堆肥起爆进程中与微生物活动密切相关的因素。当堆肥发酵物周围环境温度过低时,微生物活性减弱,其代谢活动产生的热量很快散失到空气中,会导致堆肥进程很难快速起爆。在这种低温环境下,如果堆体小,发酵物受外界环境温度影响更为严重,即使微生物有活性,分解有机组分产生的热量对于堆肥升温来说也是微乎其微,因此堆肥很难起爆,甚至失败;如果发酵物体积过大甚至成一定规模,还会造成土地的浪费,同时也会导致二次污染。此外,这种大堆体堆肥还存在升温慢、温度不均匀等问题,有些部位达不到正常起爆温度(20.0 ℃),会导致有机垃圾堆肥进程起爆不完全[6]。因此,如何实现低温条件下堆肥的快速起爆是亟待解决的关键科学问题。
为了确保堆肥进程的正常起爆,保证微生物正常的代谢活动,提高有机垃圾去除效率,研究者采用了一系列的保温加热措施,如采用外加热水套的方式保证内部秸秆堆肥发酵的顺利起爆[11];还有一些研究者分别利用电加热[12]及沼气加热[13]的方式帮助堆肥快速起爆升温。虽然这些加热技术可以提升生物反应器的温度,并在较低的环境温度下保证有机垃圾堆肥进程的正常运行,但既不节能,也不经济。特别是对于大型的堆肥工厂,加热成本将占整个运行成本的很大一部分。因此,本研究拟采用生物强化接种技术提升堆肥起爆效率,为冷凉地区有机垃圾高质资源化技术提供新途径,具有理论与实际意义。
1 材料与方法 1.1 菌株活化试验用菌株来源于东北农业大学环境微生物实验室,筛选自冬季低温土壤样品。供试低温菌为混合菌剂,经宏基因组测序,确认其属于Pseudomonas及Psychrobacter。将菌种于-80.0 ℃超低温冰箱中取出缓冻后,吸取200.0 μL菌液接入20.0 mL经过高温灭菌的LB活化培养基中,于20.0 ℃、180 r·min-1条件下培养24 h后,置于4.0 ℃培养箱中备用。
1.2 供试材料试验采用鸡粪及稻壳作为堆肥原料进行堆肥试验。鸡粪主要来源于东北农业大学动物医学学院动物养殖基地,稻壳来源于东北农业大学农学院试验田。采集到的鸡粪由于水分较大,需要进行适当的晾晒处理,水分含量达到50%~60%时完成晾晒,将原料放入保鲜冷室备用。此外,对堆肥原料进行理化指标的测定,堆肥初始物料的理化性质如表 1所示。
|
|
表 1 原料的基本性质 Table 1 Physical and chemical characteristics of raw materials |
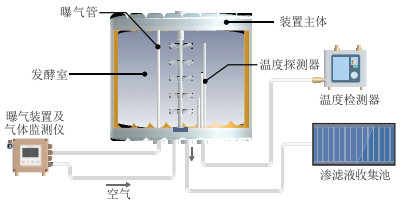
堆肥起爆试验设置接种低温菌(CT组)与未接种(CK组)两个处理,每个处理设置3个平行。堆肥装置内部下层撒一层生物炭,并用枯枝覆盖,以增加空隙,加大接触面积,而后将鸡粪与稻壳按照测定比例混合,将活化的混合菌剂以1.5%的比例(浓度为1.0× 108 CFU·mL-1)接入堆肥并混匀,调节水分至60% 左右,碳氮比至20~30[14]。每组试验堆体质量(湿质量)约为12.0 kg,置于10.0 ℃冷室中,通气量为0.5 L· kg-1·h-1,插入温度测定装置,放入冷室2 h后开始每隔2 h观察温度,并记录有效温度。图 1为试验用装置图。堆肥装置主体为PVC材质,装置长360.0 mm、宽350.0 mm、高450.0 mm,容积约为56.7 L。
|
图 1 试验装置图 Figure 1 Diagram of composting set-up |
堆肥起爆试验根据温度变化取样,每次分别从堆肥装置上、中、下3个位置分别取样,每次取样量约600.0 g,并且随机分成3份,分别贮存于4.0 ℃保鲜室、-80.0 ℃低温(液氮浸泡后)及常温避光室。常温避光室样品风干后粉碎过筛。
1.4 测试方法 1.4.1 总有机质含量测定将烘干水分的样品放入马弗炉中,于(550.0 ± 5.0)℃灼烧,4 h后关闭电源,待温度降低到100.0~ 150.0 ℃后,将样品取出,放入干燥器中。待温度降低到室温后称质量,重复此步骤,直至样品达到恒质量为止,计算样品质量差值,即可得到各样品总有机质含量[15]。
1.4.2 碳水化合物含量测定采用酸水解法测定堆肥起爆进程样品碳水化合物含量[16]。称取样品过0.25 mm筛,置于带塞玻璃试管内,加入0.1 mL 12 mol·L-1硫酸溶液消解,并加热煮沸,获得待测液。取0.5 mL待测液,顺次加入0.5 mL水、1.0 mL 5% 苯酚溶液及5.0 mL浓硫酸溶液混匀。将试管静置1.0 h,在485 nm波长下,以稀释的硫酸溶液(V硫酸∶V水=5∶2)作参比,测定各个样品的吸收值,根据差值计算碳水化合物含量。
1.4.3 粗蛋白质含量测定采用考马斯亮蓝法测定堆肥样品中粗蛋白含量[17]。称取1.0 g新鲜堆肥样品,放入适量PBS缓冲液冰浴研磨后,放入2.0 mL浓度为0.1% 的三氟乙酸溶液,将混合物在4 ℃下振荡2 h。将振荡后的混合物取出,1 000 r·min-1离心5 min,取上清液依据考马斯亮蓝试剂盒(碧云天)进行蛋白质含量测定。
1.4.4 油脂含量测定依据《食品安全国家标准食品中脂肪的测定》(GB 5009.6—2016)中的索氏抽提法对不同时段堆肥样品油脂含量进行测定[18]。首先取2.0~5.0 g风干后的样品置于已烘干并称过质量的滤纸上,用细线绳捆绑包装后再称质量,将其置于索氏抽提装置中,在索氏抽提的底部收集瓶中装入2/3体积的石油醚作为溶剂,石油醚的沸程为30.0~60.0 ℃。将装置置于加热套中,蒸馏温度依据石油醚冷凝成液体的速度而定,一般为40.0~45.0 ℃,蒸馏时间10 h(回流液无黄色即视为蒸发结束)。蒸发后,将回流器中的样品包取出(105.0±1.0)℃下烘干后置于干燥器中,称其质量。利用下式进行粗油脂含量的计算。

|
式中:m0为滤纸质量,g;m1为样品包装后质量,g;m2为蒸发、干燥后样品质量,g。
1.4.5 pH及电导率(EC)称取不同测定时间段的新鲜堆肥样品1.0 g,置于20.0 mL锥形瓶中,按照1∶20(m∶V)的比例加入双蒸水后,将锥形瓶放入摇床中200 r·min-1振荡2 h[19]。将瓶中的浸提液利用普通定性滤纸过滤,采用多功能pH计同时测定pH及EC。
1.4.6 16S rRNA扩增子测序技术本试验的16S rRNA扩增子测序由天津诺禾致源有限公司完成。DNA检测合格后,基于IonS5TMXL测序平台,利用单端测序方式,构建小片段文库进行单端测序。测序得到的数据根据以下流程进行分析:通过上述平台得到的测序数据全部为fastq格式,利用软件过滤以及拆分后,即可以进行OTUs(Opera⁃ tional taxonomic units)分类分析[20]。随后,依据OTUs的结果对物种进行注释,得到的数据就是相应的物种丰度及其分布情况。
1.5 数据分析方法采用SPSS 23.0对数据进行统计学分析,采用Canoco 5.1进行NMDS分析,采用GraphPad Prism 9完成数据绘图,采用R中的vegan实现方差分解分析(Variation partitioning analysis,VPA)和相似性百分比分析(SIMPER)。
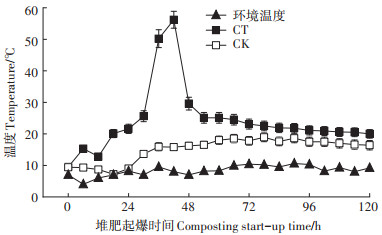
2 结果与分析 2.1 低温菌强化堆肥起爆进程中温度变化堆肥是一个微生物自热过程,微生物通过分解有机组分放热促进堆体升温[21]。低温菌强化冬季堆肥试验温度变化见图 2。环境温度在5.0~10.0 ℃浮动。CK组温度虽然呈现上升趋势,但上升缓慢,且温度上限并没有在120 h内突破20.0 ℃,无法快速起爆。而CT组在18 h时快速通过起爆期,温度达到20.1 ℃,并在36 h温度达到了50.2 ℃,此时CK组的温度仅为15.8 ℃。CT组温度最高可达到56.2 ℃,但达到温度峰值后开始下降,直至20.0 ℃左右后保持稳定。
|
图 2 低温菌强化冬季堆肥起爆温度动态变化 Figure 2 Dynamics change of composting start-up temperature with cryogenic bacteria enhance in winter |
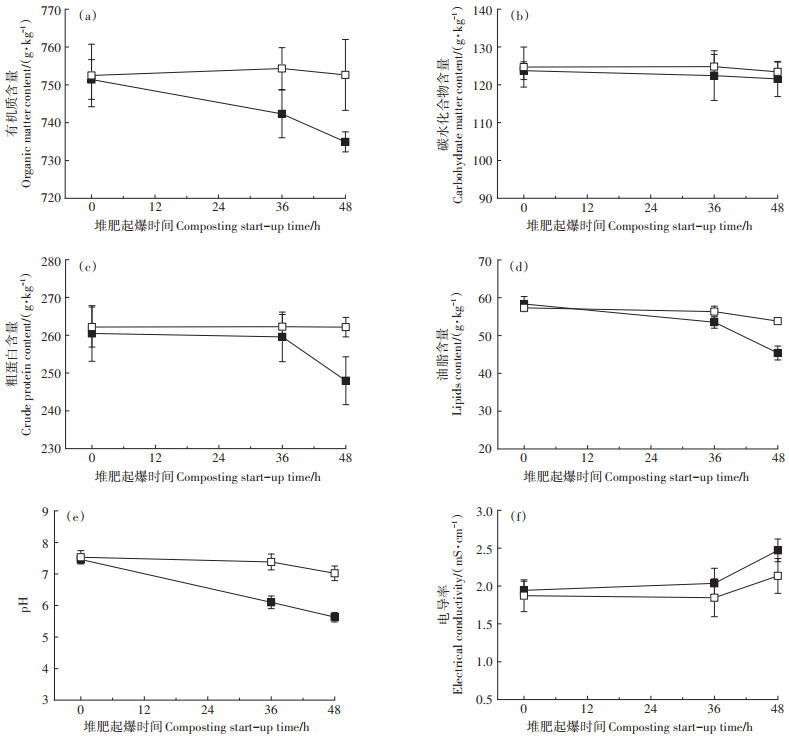
有机组分的分解转化是堆肥升温的主要热量来源[22]。在低温堆肥起爆阶段,微生物通过在有氧条件下分解转化堆肥中的简单有机组分(如糖类、蛋白质及脂质)来获取能量,并放出热量[23]。本试验中,3种有机组分变化情况见图 3a~图 3d。由图可知,与CK组相比,CT组中的有机质、碳水化合物、粗蛋白及油脂含量均呈下降趋势。其中,蛋白质与油脂含量在36~48 h下降量多于0~36 h。因此,低温菌接种强化了有机组分的快速分解,促进了堆体的快速升温。
|
图 3 低温菌强化冬季堆肥起爆微生境因子动态变化 Figure 3 Dynamics of microhabitat factors in psychrophiles-enhanced winter compost start-up |
pH及EC是堆肥过程中衡量微生物活动的重要指标[24]。pH变化见图 3e,CK组0~48 h堆肥pH呈现下降趋势,相比于CT组,CK组堆肥pH变化较平缓。CT组中,pH在0~48 h迅速下降到5.80左右,说明此时微生物代谢旺盛,产生大量酸性物质。随后,CT组中pH变化趋于平稳。pH的动态变化揭示了堆肥进程中不同的微生物活动状态。
堆肥进程中EC可以衡量无机盐以及有机酸的含量,能间接反映堆肥体系中微生物利用无机盐的情况,从而判断微生物的活动[25]。本试验堆肥中EC的动态变化见图 3f。CT组与CK组中EC都在1.5~2.5 mS·cm-1波动。CK中EC整体变化趋势不同于CT组,间接证实了接菌与未接菌试验组微生物活动不同。
2.3 低温菌强化堆肥起爆进程中细菌群落动态变化堆肥起爆期细菌群落的变化可以反映堆肥整体细菌群落演替状况,同时也能明确接种低温菌属在堆肥中的变化情况[7],结果见图 4。结果表明,在门水平上,CT组中多数菌门在接种菌初期相对丰度最高,如Bacteroidetes、Actinobacteria、Verrucomicrobia及Fibrobacteres等。Firmicutes菌门在CT组中36、48 h及CK组的48 h相对丰度高于其他时间。此外,门水平相对丰度结果表明,接种低温菌初期,堆肥中群落多样性相对较高。
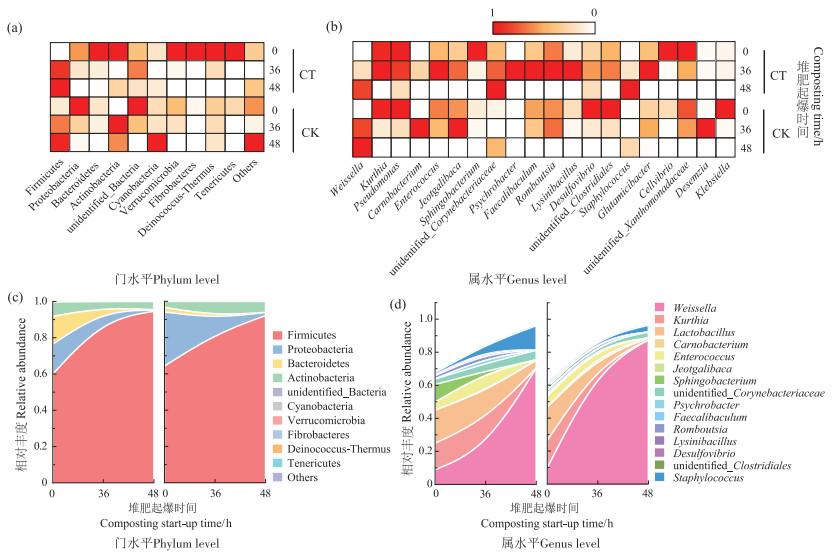
|
图 4 门及属水平堆肥起爆进程中细菌群落变化 Figure 4 Changes in bacterial communities during compost start-up at the phylum and genus level |
属水平上,接种菌属Pseudomonas在CT组的36 h及48 h相对丰度较高,是此阶段的优势微生物菌属。而Psychrobacter在堆肥温度20.0 ℃左右时相对丰度较高。图 4b为属水平上TOP 15的细菌群落相对丰度变化情况。结果表明,接种低温菌的CT试验组群落多样性较高。随着堆肥温度的升高,CT中Weissella及Staphylococcus等菌属相对丰度呈上升趋势。CK组群落多样性低于CT组,且整个过程中Weissella为主要的优势菌属。另外,虽然接种菌Pseudomonas及Psychrobacter在CK试验组中也存在,但其相对丰度较低,且整体相对丰度在该时间段内呈下降趋势。
2.4 低温菌强化堆肥起爆进程biomarkers分析NMDS分析可以将多维变量简化到低维度,并通过对各指标之间距离的定位分析来确定变量之间的相似性[26]。图 5a为各试验组在堆肥初始、36 h及48 h时细菌群落NMDS分析结果。通过比较各组各相邻取样时间点之间的距离变化可知,CT组与CK组相比,微生物群落结构发生了明显的变化。堆肥初期接种低温菌后,CT组的细菌群落与CK组初期的细菌群落存在明显差异。CT组中,与堆肥初期接菌后的群落结构相比,36 h及48 h时的堆肥群落结构差异较大。综上表明,低温菌的添加促进了微生物群落结构的演变。
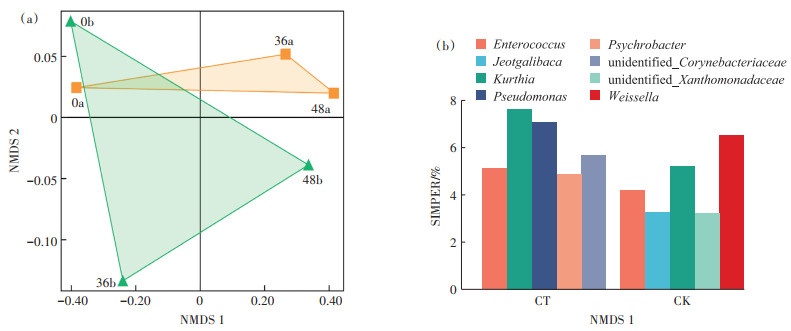
|
图 5 细菌群落变化及生物标志物分析 Figure 5 Bacterial community changes and biomarkers analysis |
SIMPER是基于分解不同微生物群落之间的差异指数来计算单个物种对样本的差异贡献度的方法[27],可以帮助认知堆肥起爆进程中起主要作用的生物标志物。如图 5b所示,Enterococcus在CT组及CK组中均对群落演替有较高贡献度。值得注意的是,CT中Pseudomonas及Psychrobacter对群落的演替具有较高贡献度,说明在CT组中低温菌对于群落结构的改变起关键作用,属于起爆进程中促进堆肥温度升高的主要生物标志物。
2.5 低温菌强化堆肥起爆进程中细菌群落与温度提升响应研究为进一步探究低温菌强化堆肥起爆试验中不同因素对温度变化的影响程度,以温度变化为基础,探究各组堆肥起爆试验组基础微生境因子(有机组分变化量、EC和pH)、接种菌属丰度变化及细菌群落对温度变化的驱动作用[28]。VPA的结果如图 6所示。CT组中,从单个因子解释量分析,接种菌对堆体温度变化的解释量为17.3%(P < 0.05),微生境因子及细菌群落变化对堆肥温度变化的解释量仅为0.2% 及6.6%(P < 0.05),显著低于接种菌对温度的影响。对温度变化影响较大的堆肥因素为微生境因子、接种菌及细菌群落的交互作用,相关解释量为27.1%(P < 0.05)。而CK组中,虽然接种菌属也存在,但丰度相对较低,对CK细菌群落并没有显著影响。因此,CT中堆体温度的变化主要受到接种低温菌丰度的影响,增加低温菌的丰度可加速有机垃圾在低温环境中的高效起爆。
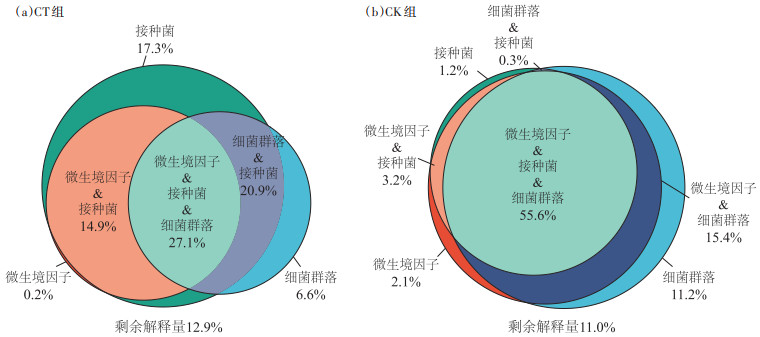
|
图 6 堆体温度对堆肥起爆进程各因素响应值 Figure 6 Values for the response of compost temperature to factors in the compost start-up process |
我国北方地区冬季气候寒冷,冰冻期时间长,有机垃圾堆肥低温起爆效率低,堆肥过程显著变慢甚至停止,若通过人工加热的方法使物料的温度上升到20.0 ℃以上,则会大幅增加成本,还可能造成二次污染,不利于堆肥技术的推广[29]。因此,本研究借助低温菌在低温环境中高活性的优势,采用生物强化接种的方式,在短时间内快速将有机垃圾的化学能转化为热能,加速堆肥温度的升高[30-32]。微生物在生长过程中的主要生长要素变化会直接影响微生物的新陈代谢,影响微生物的数量以及微生物的群落变化[33]。
本研究中,环境温度在5.0~10.0 ℃,CK组在72 h时达到20.0 ℃左右,并且维持在该温度以下直到起爆试验结束,说明在未接种低温菌的情况下,堆体内部的温度影响了多数微生物的正常代谢。接种低温菌的CT试验组,其堆体温度可迅速升高至20.0 ℃以上,达到大多数中温菌均能生长的温度[34],此时堆肥进程中的多数微生物被激活,微生物通过自身分泌的酶蛋白等物质迅速分解堆体中的有机组分,保证了堆肥温度的进一步升高。当堆肥起爆进程进行到48 h时,CT组温度达到峰值(56.2 ℃),随后温度开始下降,直至120 h起爆试验结束时仍平稳保持在20.0 ℃左右。但在低温起爆过程中存在高温持续时间短、微生物活性降低的现象,究其原因可能是核心微生物必要营养源的减少以及高温引起的微生物活性降低[14, 35]。低温菌按照生长上限温度及最适生长温度划分为嗜冷菌和耐冷菌两种。嗜冷菌的生长上限温度约为20.0 ℃,且其最适生长温度在15.0 ℃以下;而耐冷菌的最适生长温度为20.0~25.0 ℃,并且在0 ℃依然可以存活[36-37],其生长温度窗口较宽,作用时间更长[38]。前期经实验室测定,本研究接种的低温菌属于耐冷菌范畴,且其可生长的温度上限为45.0 ℃。在堆体温度达到50.0 ℃以上后,多数低温菌的生存受到高温的威胁,活性降低。另外,为模拟冬季低温环境,堆肥起爆试验进程中会持续通气,带走大部分热量。在低温菌活性下降后,其余堆体微生物会不可避免地受到低温胁迫,导致起爆后温度的下降[39-40]。因此,堆肥中温度的变化可以从堆肥微生境角度表征堆肥整体微生物群落的变化及代谢活性。
3.2 低温堆肥起爆进程中低温菌对堆体细菌群落变化的影响堆肥是一个微生物自热过程,此过程中不同时期的优势微生物角色各有分工[41-42]。生物自热过程的实质为微生物对有机组分的生物氧化过程。低温起爆堆肥进程中生物氧化普遍存在,微生物分解有机组分释放热量,从而促进堆肥在低温环境中快速起爆。堆体温度的变化也从侧面表征了堆肥中微生物的代谢及多样性变化。基于16S rRNA扩增子测序结果,从细菌群落门和属水平相对丰度的变化可以确定,接种低温菌可以改变微生物群落多样性和丰度。Firmicutes在堆肥起爆进程各时期均属于优势微生物菌门,与以往报道一致[43-44]。
属水平上,由SIMPER结果可知,接种菌属在堆肥整体群落变化中起关键作用。接种菌Pseudomonas为堆肥中常见的细菌菌属,其多数菌种可在低温环境中生存,并正常进行分解代谢活动[45]。Pseudomonas可在低温寡营养的废水中去除硝酸盐[46-47],还可以在低温环境中高效分解油脂类物质,去除污染物[48]。此外,接种低温菌显著增加了CT组中初始Pseudomonas的丰度,而CK组中Pseudomonas的初始含量较低,且不是堆肥进程中的优势细菌类群,因此并不能帮助堆肥在短时间内快速起爆。Psychrobacter是耐冷菌种的典型代表,其在低温胁迫下依然可以有效分解环境中的硝基苯及硝基苯酚等物质[49],还可以通过鼠李糖脂等生物表面活性剂高效乳化油污[50]。因此,接种后低温菌对堆肥中有机组分的分解起促进作用,帮助堆体启动升温。Psychrobacter在CT组整个堆肥进程中虽然不是高丰度菌属,但其在起爆进程中对微生物群落的演替起着重要的作用。通常,在微生物网络中,每种微生物都有其独特的生态位,一些微生物在过程中扮演“生产者”,又称“矿工”[51],一些微生物在过程中扮演“消费者”,又称“领导者”。“消费者”可以指挥“生产者”完成某项生命活动,“生产者”可依靠自身优势分解物质,为“消费者”提供营养源[52]。上述现象在各种微生物生态过程中十分常见[53]。因此,丰度并不是判断微生物相互作用能力的唯一标准,低丰度微生物也可以是影响微生物群落的主导因素。在本研究中,Psychrobacter和Pseudomonas为堆肥起爆进程中其他微生物群落演替的生物标志物,可以作为帮助堆肥快速起爆升温的“激活剂”。
3.3 低温堆肥起爆进程中的主要响应调控因素由VPA结果可知,接种低温菌后堆肥中影响温度变化的主要因素为接种菌、细菌群落及微生境因子的联合交互作用。在起爆进程中,单个因素对温度的影响小于多个因素对其的影响,说明若想调控堆体温度,使温度快速升高,需考虑多重因素。此外,对比单个因素的贡献解释量,接种菌的丰度是影响温度变化的最主要因素,说明若想更快更高效地改善堆肥进程温度,提升效率,需首要考虑低温菌的丰度和数量,改变堆体内微生物群落结构[52]。还可根据有机垃圾和微生物的特性,分质按需调控堆肥微生境因子,帮助低温菌增长并在低温环境中代谢有机组分,促进堆体快速升温。本研究得出的改良调控措施能够快速增加有机组分的分解量,增加堆体温度提升效率,为进一步提高低温复合菌在冷凉环境中的作用效果提供理论支撑。低温菌强化堆肥起爆进程的研究对堆肥发展具有重要意义,未来将得到更加广泛的应用。
4 结论(1)低温菌强化可促进冷凉环境畜禽粪便堆肥温度的快速提升,使畜禽粪便堆肥在18 h即通过起爆期,48 h达到56.2 ℃。
(2)低温菌通过快速分解畜禽粪便中的有机组分,将化学能转化为热能,帮助堆体快速升温,保证了堆肥的正常快速启动。
(3)低温菌强化接种改变了堆体细菌群落结构,接种菌Pseudomonas及Psychrobacter是堆肥细菌演替的“激活剂”,可以激发堆肥发酵进程细菌群落的演替。此外,堆肥温度的改变是微生境因子、低温菌丰度及细菌群落交互作用的结果。增加低温菌的丰度和数量有利于加速低温堆肥起爆进程。
| [1] |
SUN Y, REN X, RENE E R, et al. The degradation performance of different microplastics and their effect on microbial community during composting process[J]. Bioresource Technology, 2021, 332: 125133. DOI:10.1016/j.biortech.2021.125133 |
| [2] |
LIU T, AWASTHI M K, JIAO M, et al. Changes of fungal diversity in fine coal gasification slag amendment pig manure composting[J]. Bioresource Technology, 2021, 124703. |
| [3] |
ZHANG S, XIA T, WANG J, et al. Role of Bacillus inoculation in rice straw composting and bacterial community stability after inoculation: Unite resistance or individual collapse[J]. Bioresource Technology, 2021, 337: 125464. DOI:10.1016/j.biortech.2021.125464 |
| [4] |
HENAULT-ETHIER L, MARTIN V J J, GELINAS Y. Persistence of Escherichia coli in batch and continuous vermicomposting systems[J]. Waste Management, 2016, 56: 88-99. DOI:10.1016/j.wasman.2016.07.033 |
| [5] |
QI H, ZHAO Y, WANG X, et al. Manganese dioxide driven the carbon and nitrogen transformation by activating the complementary effects of core bacteria in composting[J]. Bioresource Technology, 2021, 330: 124960. DOI:10.1016/j.biortech.2021.124960 |
| [6] |
QUIROS R, VILLALBA G, MUNOZ P, et al. Environmental assessment of two home composts with high and low gaseous emissions of the composting process[J]. Resources Conservation and Recycling, 2014, 90: 9-20. DOI:10.1016/j.resconrec.2014.05.008 |
| [7] |
QI H, ZHAI W, DU Y, et al. Core bacterial community driven the conversion of fulvic acid components during composting with adding manganese dioxide[J]. Bioresource Technology, 2021, 337: 125495. DOI:10.1016/j.biortech.2021.125495 |
| [8] |
TATEDA M, LE D T, HUNG N V, et al. Comprehensive temperature monitoring in an in-vessel forced-aeration static-bed composting process[J]. Journal of Material Cycles & Waste Management, 2002, 4(1): 62-69. |
| [9] |
XIE X Y, ZHAO Y, SUN Q H, et al. A novel method for contributing to composting start-up at low temperature by inoculating cold-adapted microbial consortium[J]. Bioresource Technology, 2017, 238: 39-47. DOI:10.1016/j.biortech.2017.04.036 |
| [10] |
SUN Q, DI W, ZHANG Z, et al. Effect of cold-adapted microbial agent inoculation on enzyme activities during composting start-up at low temperature[J]. Bioresource Technology, 2017, 244: 635-640. DOI:10.1016/j.biortech.2017.08.010 |
| [11] |
MUSSOLINE W, ESPOSITO G, LENS P, et al. Design considerations for a farm-scale biogas plant based on pilot-scale anaerobic digesters loaded with rice straw and piggery wastewater[J]. Biomass Bioenerg, 2012, 46: 469-478. DOI:10.1016/j.biombioe.2012.07.013 |
| [12] |
MASSÉ D, MASSE L, CROTEAU F. The effect of temperature fluctuations on psychrophilic anaerobic sequencing batch reactors treating swine manure[J]. Bioresource Technology, 2003, 89(1): 57-62. DOI:10.1016/S0960-8524(03)00009-9 |
| [13] |
XU Z, WU H, WU M. Energy performance and consumption for biogas heat pump air conditioner[J]. Energy, 2010, 35(12): 5497-5502. DOI:10.1016/j.energy.2010.01.040 |
| [14] |
XIE X, WANG Y, WEI Z, et al. Continuous insulation strategy of organic waste composting in cold region: Based on cold-adapted consortium[J]. Bioresource Technology, 2021, 335: 125257. DOI:10.1016/j.biortech.2021.125257 |
| [15] |
WANG Y, LI Y, HUANG Q, et al. Impact of organic matter on thermal desorption of DDTs in contaminated soils[J]. Chinese Journal of Environmental Engineering, 2011, 5(6): 1419-1424. |
| [16] |
沈金雄. 土壤碳水化合物总量的直接测定[J]. 土壤学进展, 1994(2): 41-44. SHEN J X. Direct determination of total soil carbohydrates[J]. Advances in Soil Science, 1994(2): 41-44. |
| [17] |
王艾平, 周丽明. 考马斯高蓝法测定茶籽多糖中蛋白质含量条件的优化[J]. 河南农业科学, 2014, 43(3): 150-153. WANG A P, ZHOU L M. Determination of protein content in camellia oleifera seed polysaccharides by coomassie brilliant blue method[J]. Journal of Henan Agricultral Sciences, 2014, 43(3): 150-153. DOI:10.3969/j.issn.1004-3268.2014.03.033 |
| [18] |
SHI L M, LIU M M, WANG X H, et al. Study on accelerated solvent extraction of n-alkanes in soil samples[J]. Rock and Mineral Analysis, 2010, 29(2): 104-108. |
| [19] |
LIU X, XIAO R, LI R, et al. Bioremediation of Cd-contaminated soil by earthworms(Eisenia fetida): Enhancement with EDTA and bean dregs[J]. Environmental Pollution, 2020, 115191. |
| [20] |
MAHE F, ROGNES T, QUINCE C, et al. Swarm: Robust and fast clustering method for amplicon-based studies[J]. PeerJ, 2014, 2: 593. DOI:10.7717/peerj.593 |
| [21] |
MASON I G, MILKE M W. Physical modelling of the composting environment: A review. Part 1:Reactor systems[J]. Waste Management, 2005, 25(5): 481-500. DOI:10.1016/j.wasman.2005.01.015 |
| [22] |
杨金明, 杨卉, 李绪坤, 等. 高浓度有机质水生物蒸发处理技术及展望[J]. 工业水处理, 2017, 37(6): 6-11. YANG J M, YANG H, LI X K, et al. Novel bio-evaporation process for the treatment of highly concentrated organic wastewater and its prospect[J]. Industrial Water Treatment, 2017, 37(6): 6-11. |
| [23] |
STABNIKOVA O, LIU X Y, WANG J Y. Digestion of frozen/thawed food waste in the hybrid anaerobic solid-liquid system[J]. Waste Management, 2008, 28(9): 1654-1659. DOI:10.1016/j.wasman.2007.05.021 |
| [24] |
LIU T, AWASTHI M K, AWASTHI S K, et al. Influence of fine coal gasification slag on greenhouse gases emission and volatile fatty acids during pig manure composting[J]. Bioresource Technology, 2020, 123915. |
| [25] |
LIU X, GUO D, REN C, et al. Performance of Streptomyces pactumassisted phytoextraction of Cd and Pb: In view of soil properties, element bioavailability, and phytoextraction indices[J]. Environmental Science and Pollution Research, 2020, 27(35): 43514-43525. DOI:10.1007/s11356-020-09842-6 |
| [26] |
WANG J, JING M, ZHANG W, et al. Assessment of organic compost and biochar in promoting phytoremediation of crude-oil contaminated soil using Calendula officinalis L. in the Loess Plateau, China[J]. Journal of Arid Land, 2021, 13(6): 612-628. DOI:10.1007/s40333-021-0011-7 |
| [27] |
SUN R, CHEN Y, HAN W, et al. Different contribution of species sorting and exogenous species immigration from manure to soil fungal diversity and community assemblage under long-term fertilization[J]. Soil Biology & Biochemistry, 2020, 151: 108049. |
| [28] |
WEN Y, WANG X, LIN C. Bacterial community dynamics in an activated sludge system based on Miseq sequencing[J]. Chinese Journal of Environmental Engineering, 2015, 9(11): 5225-5230. |
| [29] |
TATEDA M, LE D T, HUNG N V, et al. Comprehensive temperature monitoring in an in-vessel forced-aeration static-bed composting process[J]. Journal of Material Cycles & Waste Management, 2002, 4(1): 62-69. |
| [30] |
JIA X, QIN X, TIAN X, et al. Inoculating with the microbial agents to start up the aerobic composting of mushroom residue and wood chips at low temperature[J]. Journal of Environmental Chemical Engineering, 2021, 9(4): 105294. DOI:10.1016/j.jece.2021.105294 |
| [31] |
WEI Z, WANG B, ZHAO Y, et al. Cold-tolerant bacteria screening and its inoculation in composting at low temperatures[J]. Research of Environmental Sciences, 2015, 28(6): 981-986. |
| [32] |
徐智, 张陇利, 张发宝, 等. 接种内外源微生物菌剂对堆肥效果的影响[J]. 中国环境科学, 2009, 29(8): 856-860. XU Z, ZHANG L L, ZHANG F B, et al. Effects of indigenous and exogenous microbial inocula on composting in a bioreactor[J]. China Environmental Science, 2009, 29(8): 856-860. DOI:10.3321/j.issn:1000-6923.2009.08.014 |
| [33] |
JURADO M, LOPEZ M J, SUAREZ-ESTRELLA F, et al. Exploiting composting biodiversity: Study of the persistent and biotechnologically relevant microorganisms from lignocellulose-based composting[J]. Bioresource Technology, 2014, 162: 283-293. DOI:10.1016/j.biortech.2014.03.145 |
| [34] |
ZHENG Q, HU Y, ZHANG S, et al. Growth explains microbial carbon use efficiency across soils differing in land use and geology[J]. Soil Biology & Biochemistry, 2019, 128: 45-55. |
| [35] |
XIE X Y, ZHAO Y, SUN Q H, et al. A novel method for contributing to composting start-up at low temperature by inoculating cold-adapted microbial consortium[J]. Bioresource Technology, 2017, 238: 39-47. DOI:10.1016/j.biortech.2017.04.036 |
| [36] |
DE MAAYER P, ANDERSON D, CARY C, et al. Some like it cold: Understanding the survival strategies of psychrophiles[J]. Embo Reports, 2014, 15(5): 508-517. DOI:10.1002/embr.201338170 |
| [37] |
GEORLETTE D, BLAISE V, COLLINS T, et al. Some like it cold: Biocatalysis at low temperatures[J]. Fems Microbiology Reviews, 2004, 28(1): 25-42. DOI:10.1016/j.femsre.2003.07.003 |
| [38] |
SIDDIQUI K S. Some like it hot, some like it cold: Temperature dependent biotechnological applications and improvements in extremophilic enzymes[J]. Biotechnology Advances, 2015, 33(8): 1912-1922. DOI:10.1016/j.biotechadv.2015.11.001 |
| [39] |
XU Z, QI C, ZHANG L, et al. Bacterial dynamics and functions for gaseous emissions and humification in response to aeration intensities during kitchen waste composting[J]. Bioresource Technology, 2021, 337: 125369. DOI:10.1016/j.biortech.2021.125369 |
| [40] |
ZHANG S, WANG J, CHEN X, et al. Industrial-scale food waste composting: Effects of aeration frequencies on oxygen consumption, enzymatic activities and bacterial community succession[J]. Bioresource Technology, 2021, 320: 124357. DOI:10.1016/j.biortech.2020.124357 |
| [41] |
SUN X, ZHAO J, WANG Q, et al. Behaviors and related mechanisms of Zn resistance and antibiotic resistance genes during co-composting of erythromycin manufacturing wastes and pig manure[J]. Bioresource Technology, 2020, 318: 124048. DOI:10.1016/j.biortech.2020.124048 |
| [42] |
ALI A, SHAHEEN S M, GUO D, et al. Apricot shell- and apple treederived biochar affect the fractionation and bioavailability of Zn and Cd as well as the microbial activity in smelter contaminated soil[J]. Environmental Pollution, 2020, 264: 114773. DOI:10.1016/j.envpol.2020.114773 |
| [43] |
宋彩红, 齐辉, 魏自民, 等. 耐热复合菌系强化全程高温堆肥快速处理餐厨垃圾[J]. 环境工程, 2021, 39(5): 111-117, 130. SONG C H, QI H, WEI Z M, et al. High-speed treatment of food waste by continuous high-temperature composting enhanced by thermophilic microbial consortium[J]. Environmental Engineering, 2021, 39(5): 111-117, 130. |
| [44] |
魏自民, 王佰洁, 赵越, 等. 堆肥低温起爆微生物筛选及其初步应用[J]. 环境科学研究, 2015, 28(6): 981-986. WEI Z M, WANG B J, ZHAO Y, et al. Cold-tolerant bacteria screening and its inoculation in composting at low temperatures[J]. Research of Environmental Science, 2015, 28(6): 981-986. |
| [45] |
FONSECA P, MORENO R, ROJO F. Growth of Pseudomonas putida at low temperature: Global transcriptomic and proteomic analyses[J]. Environmental Microbiology Reports, 2011, 3(3): 329-339. DOI:10.1111/j.1758-2229.2010.00229.x |
| [46] |
REN H J, SU J, WANG C, et al. Application of response surface methodology to optimize nitrate removal at low temperature by aerobic denitrificator Pseudomonas strain An-1[J]. Water & Environment Journal, 2017, 32(2): 235-241. |
| [47] |
ZHANG D, LIU Y, HAN Y, et al. Nitrate removal from low C/N wastewater at low temperature by immobilized Pseudomonas sp. Y39-6 with versatile nitrate metabolism pathways[J]. Bioresource Technology, 2021, 326(19): 124794. |
| [48] |
HE S, DING L L, XU K, et al. Effect of low temperature on highly unsaturated fatty acid biosynthesis in activated sludge[J]. Bioresour Technol, 2016, 211: 494-501. DOI:10.1016/j.biortech.2016.03.069 |
| [49] |
WANG Y, HOU Y, WANG Q, et al. The elucidation of the biodegradation of nitrobenzene and p-nitrophenol of nitroreductase from Antarctic psychrophile Psychrobacter sp. ANT206 under low temperature[J]. Journal of Hazardous Materials, 2021, 413: 125377. DOI:10.1016/j.jhazmat.2021.125377 |
| [50] |
AMATO P, CHRISTNER B C. Energy metabolism response to lowtemperature and frozen conditions in Psychrobacter cryohalolentis[J]. Applied & Environmental Microbiology, 2009, 75(3): 711-718. |
| [51] |
MAMET S D, MA B, ULRICH A, et al. Who is the rock miner and who is the hunter? The use of heavy-oxygen labeled phosphate (P18O4)to differentiate between C and P fluxes in a benzene-degrading consortium[J]. Environmental Science & Technology, 2018, 52(4): 1773-1786. |
| [52] |
GOLDFORD J E, LU N, BAJIC D, et al. Emergent simplicity in microbial community assembly[J]. Science, 2018, 361(6401): 469-474. DOI:10.1126/science.aat1168 |
| [53] |
MEDLOCK G L, CAREY M A, MCDUFFIE D G, et al. Inferring metabolic mechanisms of interaction within a defined gut microbiota[J]. Cell Systems, 2018, 245-257. |
 2021, Vol. 40
2021, Vol. 40



