 全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)广泛应用于各种工业和家居产品的生产和使用中,因其具有热稳定性、化学稳定性和环境持久性等特殊性质,已在世界范围内广泛检出。目前,对于PFOA和PFOS在环境介质中的行为研究已有一些进展,本研究归纳总结了PFOA和PFOS在环境介质中的迁移行为和相关数学模型的研究进展。具体针对影响PFOA和PFOS在环境介质中迁移的机制(静电相互作用、疏水作用、配体交换和氢键)和因素(有机质含量、矿物类型、矿物含量、介质含水率、离子类型、离子强度和pH)以及可用于模拟的数学模型(对流-弥散模型、非平衡两点吸附模型、非平衡两区吸附模型、多速率模型、多过程限速传质模型,TOSD迁移模型)进行探讨和总结,以为后续更深入的科学研究提供综合性参考依据。
全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)广泛应用于各种工业和家居产品的生产和使用中,因其具有热稳定性、化学稳定性和环境持久性等特殊性质,已在世界范围内广泛检出。目前,对于PFOA和PFOS在环境介质中的行为研究已有一些进展,本研究归纳总结了PFOA和PFOS在环境介质中的迁移行为和相关数学模型的研究进展。具体针对影响PFOA和PFOS在环境介质中迁移的机制(静电相互作用、疏水作用、配体交换和氢键)和因素(有机质含量、矿物类型、矿物含量、介质含水率、离子类型、离子强度和pH)以及可用于模拟的数学模型(对流-弥散模型、非平衡两点吸附模型、非平衡两区吸附模型、多速率模型、多过程限速传质模型,TOSD迁移模型)进行探讨和总结,以为后续更深入的科学研究提供综合性参考依据。全氟化合物(PFCs)是一类人为有机氟化物,其生产始于20世纪中期,并广泛应用于工业和家居用品,如造纸和纺织物的保护层、不粘炊具的涂层、食品包装或消防泡沫组成部分[1-3]。这使得PFCs通过多种途径大量释放到环境中,如PFCs的制造和使用过程,以及反应杂质或前驱物的降解[2, 4]。目前,PFCs在世界各地的环境介质中被广泛检出,浓度从pg·kg−1到μg·kg−1不等;由于化合物类型和氟碳链长度的差异,PFCs在全球范围内造成不同程度的环境暴露风险[5-6]。表 1列出了环境中常见的PFCs,其中对全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)关注度较高。
|
|
表 1 环境中常见的全氟化合物 Table 1 Perfluorinated compounds commonly found in the environment |
PFOA和PFOS是检出率较高的PFCs环境污染物,2011年进行的一项检测发现,PFOA被检出频率为66.0%,PFOS为48.0%[7]。PFOA和PFOS含有强大的C—F键,对热降解、化学降解和微生物降解均具有极强的耐受力,能够广泛存在于环境介质、野生动植物[8]和人类血液中[9-10],其在人体中的半衰期可达到3~5 a[11-12]。同时,大量研究结果显示,PFOA和PFOS可导致生物体内过氧化物酶体增殖、脂质和某些代谢酶的活性增加,以及其他重要生化过程的改变[13],因而对生物体具有发育毒性、免疫毒性、神经毒性、遗传毒性等多重毒性[9, 14-15]。
由于PFOA和PFOS的普遍存在和难降解性,研究者们对PFOA和PFOS在环境中的迁移和吸附行为产生了极大的兴趣,研究了高岭石、蒙脱石、渥太华砂、壤质砂土以及泥沙等多种介质中PFOA和PFOS的迁移和吸附行为[16-19]。研究发现,PFOA和PFOS在环境中的迁移非常依赖于与周围介质的相互作用,如静电作用、疏水作用、π-π键、氢键和配体交换等;并且,PFOA和PFOS在介质上的吸附和迁移行为受介质理化性质(如比表面积、有机质、矿物质以及含水率等)[3, 20-22]和溶液化学性质(如pH、离子类型和强度等)的影响较大[3, 23-24]。为了更好地理解PFOA和PFOS的吸附和迁移行为,研究者对PFOA和PFOS在介质上的吸附动力学进行建模,针对PFOA和PFOS的吸附动力学模型有准一级吸附模型、准二级吸附模型和颗粒内扩散模型等[25],其中准二级吸附模型被大多数研究用于数据拟合,并且该模型可以成功模拟吸附过程[26-27]。其次,为了进一步理解和预测PFOA和PFOS在环境中的迁移行为,溶质运移模型的应用尤为关键。目前,针对PFOA和PFOS迁移的模型有对流-弥散模型(Convective-dispersive model,CDE)、两点吸附模型(Two-site sorption model,TSM)、两区吸附模型(Two-region model,TRM)、多速率模型(Continuousdistribution multirate model,CDMR)、多过程限速传质模型(Multiprocess rate - limited mass-transfer model,MPMT)和TOSD迁移模型(Tempered one-sided stable density based model,TOSD)等,其中使用较多的是两点吸附模型[3, 28]。
因此,了解PFOA和PFOS的迁移机制,探究PFOA和PFOS在环境介质中的迁移规律并选择合适的数学模型和数值模拟手段进行预测分析对于评估其环境影响和了解其潜在风险至关重要。基于这些需求,本综述对控制和影响PFOA和PFOS在环境中迁移的机制和因素及可使用的数学模型进行了归纳和讨论,并且取得相关研究结论以用于指导后续研究。
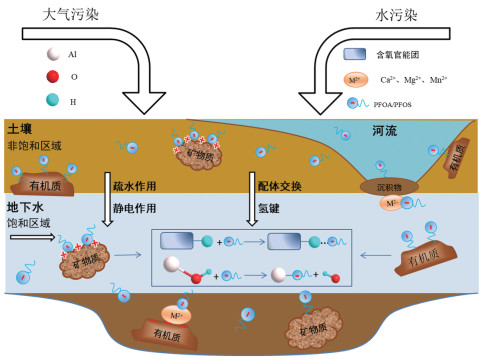
1 影响PFOA和PFOS在介质中迁移的机制PFOA和PFOS可通过多种途径从各种来源进入环境。PFOA和PFOS被广泛应用于消防泡沫、消费品和工业产品,因此其可通过上述物质的使用以及二者的生产过程而进入垃圾填埋场、废水处理厂和空气,最终被释放到土壤、沉积物及地下水环境中[29-30]。在PFOA和PFOS的多种来源中,消防泡沫的使用以及垃圾填埋场中纺织品、纸张的浸渍是土壤中PFOA和PFOS污染的主要来源[31-32];此外,PFOA和PFOS还可通过污水处理厂以及各种工厂产生的污泥进入土壤[33]。PFOA和PFOS进入土壤后会被吸收,进而淋滤到地下水中,地下水中的PFOA和PFOS将进一步迁移到饮用水源、江海湖泊和其他环境介质中。最终,PFOA和PFOS通过水源进入人体、动植物和其他生物体并对其产生毒害作用。因此,了解影响PFOA和PFOS在环境中迁移的机制是评估PFOA和PFOS环境风险的关键。本章总结了影响PFOA和PFOS在环境中迁移的4种主要机制,分别为静电作用、疏水作用、配体交换和氢键作用。
1.1 静电作用静电作用是影响PFOA和PFOS吸附和迁移的主要机制之一,该作用力发生在PFOA和PFOS的亲水性官能团与环境介质之间,以及相邻的PFOS或PFOA阴离子之间。静电作用示意图如图 1。环境介质表面带正电的官能团(质子化基团)静电吸引PFOA的羧基(—COOH)和PFOS的磺酸基团(—SO3H),从而抑制PFOA和PFOS的迁移;环境介质表面带负电的官能团则静电排斥PFOA和PFOS,使其迁移率升高。此外,环境介质表面的一些极性基团,如—NH、—OH,也可吸附PFOA或PFOS,这是源于这些极性基团可与PFOA和PFOS阴离子之间形成较弱的离子-偶极子相互作用[34]。而这种相互作用本质上也是静电作用。其次,由介质表面吸附的物质而引起的静电相互作用在PFOA和PFOS的迁移过程中也发挥着重要作用[25, 35]。如环境介质在吸附PFOA和PFOS阴离子之后,表面携带更多的负电荷,这对溶液中的其余PFOA和PFOS阴离子产生静电排斥作用,从而抑制介质对PFOA和PFOS的吸附[23, 36]。而二价阳离子则能将介质表面的负电位转正,从而成为介质静电吸引PFOA和PFOS的桥梁[37-38]。

|
图 1 吸附过程中的静电吸引和静电排斥作用机制[42] Figure 1 The mechanism of electrostatic attraction and electrostatic repulsion in the adsorption process[42] |
溶液pH和离子强度对PFOA和PFOS在介质中迁移的影响已经证明了静电相互作用的存在[39-40]。改变溶液pH是通过引起介质某些官能团的质子化或去质子化而导致介质表面电荷的电性和大小发生变化[41]。这种变化将直接影响介质与PFOA、PFOS之间的静电作用;随着pH的增加,介质表面带负电的程度增加或带正电程度降低,因此导致PFOA和PFOS与介质之间具有更强的静电斥力或更弱的静电引力,进而使PFOA和PFOS在介质中的迁移率上升。增大溶液阳离子强度则是由于双电层压缩和表面电荷中和,一方面令PFOA和PFOS与介质之间的静电相互作用减弱,从而改变PFOA和PFOS在介质中的迁移性;另一方面削弱了PFOA和PFOS阴离子之间的静电斥力,导致PFOA和PFOS在介质中的吸附量降低,迁移率上升[35]。
1.2 疏水作用疏水作用的本质来源于熵驱动力,是由于疏水基团(一般是非极性基团)彼此靠近聚集,从而排斥水分子的一种作用。相关研究结果表明,PFOA和PFOS可以克服静电排斥作用而被带负电的介质吸附[41, 43-44]。如图 2(A)所示,即使天然沉积物或某些有机质(NOM)带负电荷,PFOA和PFOS仍可以吸附在其表面;此外,研究表明沸石、碳纳米管和树脂的疏水性均有助于PFOA和PFOS的吸附[26, 45];且介质通常对PFOS的吸附量高于PFOA,这是由于PFOS具有更长的碳链,因此具有更高的疏水性所致[27, 38]。上述发现均证实了疏水作用影响PFOA和PFOS在介质中的吸附和迁移。

|
图 2 疏水相互作用和PFOA、PFOS的自聚集行为原理[42] Figure 2 Hydrophobic interaction and self-aggregation behavior principle of PFOA and PFOS[42] |
PFOA和PFOS通过C—F键的疏水性可以聚集在介质中形成胶束或半胶束以及双层结构,如图 2(B)所示。PFOA/PFOS的疏水尾部可被吸附在疏水性介质表面,从而形成半胶束结构[42]。而当介质表面带正电荷时,PFOA/PFOS的亲水性羧基和磺酸基团会由于静电引力而被吸附在其表面,在吸附过程中也可形成胶束和半胶束结构[41]。此外,PFOA/PFOS的疏水尾部有相互聚集的趋势,这成为PFOA/PFOS形成双层结构的关键来源[42]。一方面,胶束、半胶束和双层结构的形成增强了PFOA和PFOS在介质表面的吸附量,从而抑制了PFOA和PFOS在环境中的迁移[40, 42, 46];另一方面,也阻碍了PFOA和PFOS扩散进入介质内部,最终阻止了后续PFOA和PFOS在介质中的吸附,进而对PFOA和PFOS在环境中的迁移产生影响[42, 47]。
1.3 配体交换PFOA和PFOS阴离子可能通过配体交换被吸附在一些金属矿物表面,并作为某些功能基团的配对[42]。可进行配体交换的金属矿物通常还有大量羟基;WANG等[23]假设了PFOA和PFOS可通过配体交换代替氧化铝的表面羟基,反应如式(1)所示。GAO等[48]探究了PFOA吸附在氧化铁上的机理,他们发现PFOA可通过配体交换形成铁-羧酸盐内球络合物,反应如式(2)所示。

|
(1) |

|
(2) |
由此可见,配体交换作用使PFOA和PFOS更多地吸附在介质中,从而减弱PFOA和PFOS在环境中的迁移性。
1.4 氢键尽管PFOA和PFOS的C—F键具有强烈的疏水性,很难与介质中某些官能团(如—NH、—OH和—COOH等)形成氢键;但PFOA和PFOS阴离子的头部官能基团(—COO-和—SO3-)则可以作为上述基团中氢键的受体。相关研究表明,氢键作用也是影响PFOA和PFOS在环境介质中吸附和迁移的机制之一[49]。此外,对可电离化合物在碳纳米管上的吸附机理的研究结果表明,羧酸盐可通过电荷辅助的氢键与碳纳米管的含氧官能团结合[42, 50],反应如式(3)所示;并且,若介质表面含O或N的基团的pKa值与PFOA和PFOS相当,则电荷辅助的氢键比普通氢键的作用更大[42]。

|
(3) |
因此,氢键作为控制PFOA和PFOS在环境中吸附和迁移的重要机制之一,可使PFOA和PFOS在介质中受到更大程度的吸附,从而导致其在环境中的迁移率降低。
2 影响PFOA和PFOS在环境中迁移的因素 2.1 介质物理性质已有的研究表明介质的物理性质强烈影响PFOA和PFOS的吸附和迁移。介质物理性质包括介质的粒径、表面粗糙度、有机质含量、矿物类型和含量以及含水率等,其主要通过吸附作用影响PFOA和PFOS在环境中的迁移。表 2概况了介质的各种物理性质对PFOA和PFOS迁移的影响和机制。
|
|
表 2 介质物理性质对PFOA和PFOS迁移行为的影响 Table 2 Effect of physicochemical properties of media on transport of PFOA and PFOS |
有机质(腐植酸、干酪根等)作为环境介质的重要组成部分,在土壤、地下水以及沉积物中分布广泛,对PFOA和PFOS的迁移有着显著影响。在土壤中,有机质主要通过疏水作用吸附PFOA和PFOS[56],因此有机质含量越高,对PFOA和PFOS的吸附作用越强,从而对其的迁移起抑制作用。LYU等[51]使用不同体积(180.0 mL和360.0 mL)的H2O2处理黑土,得到了有机质含量不同的3种土壤,试验研究表明,有机质含量越低,PFOA在土壤中的迁移率越高。ZHANG等[17]的研究也得到了相似的观点,即PFOS在土壤中的迁移率随有机质含量的降低而升高;并且进一步发现腐植酸和干酪根是吸附PFOS的主要有机质,这是因为腐植酸和干酪根具有的缩合和交联结构使其具有更高的表面疏水性和更大的范德华力。
但当有机质存在于某些矿物表面时,则表现出不同的影响作用。WANG等[36]研究了腐植酸对勃姆石(Boehmite,AlOOH)吸附PFOS的影响,研究表明,腐植酸的增加对勃姆石吸附PFOS有抑制作用。这是因为在腐植酸、勃姆石和PFOS的体系中,PFOS和腐植酸在勃姆石表面存在激烈的竞争吸附;其次,腐植酸吸附在勃姆石表面引起介质表面负电荷增多,导致介质与PFOS的静电排斥增强,因此勃姆石对PFOS的吸附程度减弱。WANG等的研究还表明腐植酸对勃姆石吸附PFOS的影响易受pH的控制,pH的降低会增强腐植酸中酸性官能团(如—COOH)的质子化程度,这减弱了介质与PFOS的静电排斥,从而促进了更多的PFOS吸附在勃姆石表面。
综上所述,在环境中有机质对PFOA和PFOS在介质中迁移的影响主要表现在两方面:一是有机质通过疏水作用吸附PFOA和PFOS,从而降低PFOA和PFOS在介质中的迁移率;另一方面,有机质通过增强介质表面带负电程度,使PFOA和PFOS与介质表面的静电斥力增强或静电引力减弱,或通过静电作用和PFOA、PFOS竞争介质表面的吸附位点,以此降低PFOA和PFOS在介质表面的吸附程度,使其迁移性提高。
2.1.2 矿物类型及含量矿物质(如Al2O3、α-FeOOH、SiO2)是土壤、地下水和沉积物等天然介质的组成成分之一,对PFOA和PFOS的迁移有着潜移默化的影响。JOHNSON等[52]进行的吸附试验结果表明,随着针铁矿(α-FeOOH)表面正电荷的减少,其对PFOS的吸附量也相应降低,这是α-FeOOH与PFOS之间的静电吸引作用减弱所致。HELLSING[57]和LYU等[53]的研究结果也证实了这一观点,结果表明PFOA和PFOS可吸附到Al2O3表面,但很少吸附在SiO2表面,这归因于Al2O3(带正电)和SiO2(带负电)表面所带电荷的不同[57]。LYU等[53]将Al/Fe氧化物负载在石英砂介质表面进行PFOA的迁移试验,结果表明当介质表面存在较高含量的Al/Fe羟基氧化物时,PFOA受到的阻滞作用更明显。并且进一步的研究表明,Al的羟基氧化物对PFOA的阻滞作用强于Fe的羟基氧化物,这是由于Al羟基氧化物的zeta电势高于Fe羟基氧化物,与PFOA之间的静电引力更强所致。
然而有研究表明,除矿物质表面静电作用影响PFOA和PFOS的迁移外,还存在其他非静电作用的影响(如矿物质疏水作用)。TANG等[35]的研究结果表明,SiO2对PFOS的吸附量不受溶液化学性质(如pH、离子强度)的影响,由此推断SiO2对PFOS的吸附是由非静电作用(如疏水作用)引起的。在LIN等[58]的研究中,发现Zn(OH)2絮凝剂对PFOA/PFOS的去除率最高(达96.7%),但试验发现,在去除PFOA/PFOS阶段,Zn(OH)2的zeta电位为负值,与PFOA/PFOS之间是静电排斥作用,由此说明Zn(OH)2吸附PFOA/PFOS并不是静电作用引起,并且研究同时排除了氢键、π-π键、配体交换等的作用。同时,有研究表明,Zn(OH)2具有一定的疏水性[59],由此推断并证实了疏水作用在Zn(OH)2吸附PFOA/PFOS的过程中起关键作用。
综上所述,矿物质主要通过静电相互作用和非静电作用(疏水作用)影响PFOA和PFOS在介质中的迁移(图 3)。一方面,当矿物(如Al2O3、α-FeOOH)表面高度带正电/负电时,静电相互作用是影响PFOA和PFOS迁移的主导因素;并且带电程度越高,静电吸引或静电排斥作用越强,对PFOA和PFOS迁移的影响越大。同时,PFOA/PFOS分子之间也存在静电排斥作用,这对其自身迁移有促进作用。另一方面,当某些矿物[如SiO2、Zn(OH)2]具有一定疏水性时,疏水作用是影响PFOA和PFOS迁移的主要因素,由于PFOA和PFOS的C—F键具有强疏水性,因此可被吸附在具有一定疏水性的矿物表面。

|
图 3 带电矿物表面吸附PFOA/PFOS的概念模型[35] Figure 3 A conceptual model for PFOA/PFOS adsorption by a charged mineral surface[35] |
环境是一个复杂的整体,其中不仅存在固相吸附对PFOA和PFOS的迁移产生影响,气-水界面吸附和分配也会对PFOA和PFOS的迁移产生阻滞作用[20]。BRUSSEAU等[60]在非饱和石英砂中对PFOA的迁移行为进行研究,结果表明,非饱和条件下PFOA的穿透曲线明显右移,这说明石英砂含水率不足时,对PFOA迁移的阻滞作用更大,这归因于空气-水的界面吸附对PFOA迁移的影响。SILVA等[54]的研究描述了由于空气-水的界面吸附产生的阻滞因子的关系式,根据前期的研究结果,空气-水界面面积随着含水率的减小而持续增加,由此推测,介质含水率越低,空气-水界面吸附产生的阻滞因子越大,即对PFOA迁移的阻滞作用越大。BRUSSEAU等[61]的研究结果证实了这一推测,当石英砂水饱和度从1.0减小至0.4时,空气-水界面吸附对PFOA产生的阻滞因子从0增大至140。LYU等[62]的研究结果也证明了空气-水界面吸附对PFOA在石英砂中的迁移产生更大的阻滞作用,并且进一步说明了PFOA的初始浓度越低,受到的阻滞作用越强烈。此外,离子强度和pH也会对空气-水界面吸附产生影响,其中离子强度的影响更大[55]。LI等[63]的研究结果表明离子强度的增加促进了空气-水界面吸附对PFOA在不饱和石英砂中迁移的阻滞作用,且Ca2+作用大于Na+,这是由于电解质离子降低了空气-水界面PFOA阴离子羧基官能团之间的静电排斥力,并且增加了PFOA疏水基在溶液中的活性[55]。
综上所述,由于介质含水率不足而引起的空气-水界面吸附对PFOA和PFOS在介质中的迁移产生额外的阻滞作用,尤其在固相吸附能力较差的介质(如石英砂)中,该因素造成的阻滞作用更为显著。并且介质含水率越低,产生的阻滞作用越大,从而导致PFOA和PFOS在介质中的迁移性越差。
2.2 溶液化学性质溶液化学性质对PFOA和PFOS在环境中的迁移也会产生强烈影响。溶液化学性质主要指溶液包含的离子类型、离子强度和pH,这些因素可以改变PFOA和PFOS与周围环境之间的相互作用。表 3是溶液化学性质对PFOA和PFOS迁移影响的一些研究。
|
|
表 3 溶液化学性质对PFOA和PFOS迁移行为的影响 Table 3 Effect of solution chemistry on transport of PFOA and PFOS |
环境介质并不是单一的,其中存在各种离子,这些离子的存在可能会影响有机污染物的形态变化和迁移特性。许多研究表明,某些二价阳离子更能增强PFOA和PFOS在介质中的吸附程度,从而降低PFOA和PFOS的迁移率。LV等[3]的研究结果表明,当石灰石介质中的CaCl2和NaCl为相同离子浓度时,PFOA在含CaCl2的石灰石中受到的阻滞作用更强,说明Ca2+比Na+更有效地中和石灰石表面负电荷,从而降低石灰石与PFOA之间的静电斥力,使PFOA在石灰石中的迁移率降低。CHEN等[64]的研究结果表明,PFOS在稀释后的海水体系中的吸附量随Ca2+浓度的增加而升高,但Na+和K+对PFOS的吸附性则只有微弱影响,因此认为,在PFOS与沉积物官能团(如—COOH、—OH等)的相互作用过程中,Ca2+表现出了特殊的协同作用,但Na+和K+没有表现出这种作用。XING等[28]的研究也证实了这一观点,其结果表明,当背景电解质从NaCl变为CaCl2时,PFOS的最大出水浓度下降了12.2%,回收率降低了12.8%。以上研究结果进一步证实了Ca2+可在介质与PFOS或PFOAf物上的吸附量提高6.0倍,l之间起到桥梁作用,使介质对PFOS或PFOA的吸附量增加,从而降低PFOS或PFOA的迁移率。除Ca2+之外,Mg2+和Mn2+也表现出这种特殊的桥连作用。XIANG等[21]的研究结果表明,当介质中Na+与Mg2+强度相同时,相较于空白溶液和Na+存在的条件,PFOA的Kd值在Mg2+存在的条件下显著增大,这证实了Kd值的增大是由于Mg2+的桥连效应而非表面电荷中和的原因。CHEN等[65]的研究结果表明,Mn(Ⅱ)在被氧化为MnOx颗粒物的过程中,对PFOA有一定的富集作用,且随着Mn(Ⅱ)浓度的升高,富集效果和速率明显上升。这是由于Mn(Ⅱ)可作为桥梁,将MnOx的表面羟基(Mn—OH)和PFOA的羧基(—COOH)结合,从而使PFOA富集在MnOx颗粒物中。
此外,某些阴离子的存在也会对PFOA和PFOS在介质中的迁移产生影响。先前的研究证明了介质中存在Cl-竞争吸附现象会对PFOA和PFOS的吸附产生阻滞作用[23, 51]。QIAN等[66]的研究结果表明,向土壤样品中加入磷酸盐溶液后,PFOS在土壤中的吸附量明显下降。这可能是因为磷酸盐的吸附增加了土壤表面的负电荷,从而降低了土壤对PFOS的吸附,进而导致PFOS迁移率的提高。
以上研究表明,二价阳离子可以更有效地中和介质表面负电荷而降低介质与PFOS或PFOA之间的静电斥力,或增加介质表面正电荷而增强介质与PFOS或PFOA之间的静电引力,从而导致PFOS或PFOA在介质中更高的吸附率和更低的迁移率。其次,Ca2+、Mg2+、Mn2+与介质中一些官能团(如—COOH、—OH等)以及PFOS的磺酸基团、PFOA的羧酸基团之间具有一定的桥连能力,因此可以增加PFOS或PFOA与介质之间的静电吸引和络合作用,使PFOS或PFOA在介质中的吸附程度提高,迁移率降低。此外,介质中Cl-和磷酸盐的存在也会对PFOA和PFOS的迁移产生影响;Cl-和磷酸盐会与PFOA和PFOS竞争介质表面的吸附位点,从而使PFOA和PFOS的吸附量降低,从而导致其迁移性增强。
2.2.2 离子强度根据以往对污染物的研究经验,背景溶液离子强度也会对PFOA和PFOS的迁移特性产生影响。TANG等[35]的研究表明,当针铁矿(α-FeOOH)表面带微弱电荷(pH=9)时,PFOS与α-FeOOH表面的静电引力或斥力可忽略不计,相邻PFOS分子之间的静电斥力占据主导地位;离子强度的增强会抑制相邻PFOS分子之间的静电斥力,使PFOS迁移率降低。当针铁矿表面带正电荷(pH=7)时,PFOS与介质表面的静电作用占主导地位;在较高的离子强度条件下,由于双电层压缩效应和zeta电位的降低,PFOS与α-FeOOH表面的静电吸引作用受到抑制,PFOS吸附降低,迁移率提高。WANG等[23]的研究也表明,PFOS和PFOA在带正电的勃姆石(γ-AlOOH)上的吸附量随着CaCl2浓度的增加而降低,这是由于Ca2+浓度增加会导致PFOS/PFOA和γ-AlOOH介质之间的静电引力下降。而在带负电的介质中,离子强度增加则会对PFOS/PFOA的迁移性产生相反的影响。YOU等[68]的试验结果表明,当Ca2+浓度升高100.0倍时,沉积物的zeta电位相应增加,PFOS在沉积物上的吸附量提高6.0倍,lgKd从2.03增大至3.41(Kd为吸附系数)。在CHEN等[67]的研究中,Ca2+浓度从0.5 mmol·L-1增大至50.0 mmol·L-1时,PFOS在黑炭上的吸附量提高了6.0倍。LV等[3]的研究结果表明,Ca2+浓度从0.5 mmol·L-1增加至30.0 mmol·L-1,石灰石表面zeta电位增加6.6 mV,PFOA在石灰石中的保留率由40.5%增至48.4%,废水回收率由58.9%降至51.0%。YOU、CHEN和LV等的研究结果表明,在带负电的介质中,较高的离子强度不仅会中和介质表面负电荷,而且会增强Ca2+的桥连效应,从而使PFOS/PFOA在介质中的吸附量增加,迁移率降低[3, 67-68]。
以上研究表明,在弱带电介质表面,PFOS/PFOA与介质表面的静电引力或斥力可忽略不计,相邻PFOS/PFOA分子之间的静电斥力占据主导地位,此时离子强度的增强会抑制PFOS/PFOA分子之间的静电斥力,使其迁移率降低。而在高带电介质表面,PFOS/PFOA与介质表面的静电作用占主导地位,在较高的离子强度条件下,PFOS/PFOA与介质表面的静电相互作用受到抑制;当介质带正电时,由于双电层压缩效应和zeta电位的降低使PFOS/PFOA与介质表面的静电引力减弱,导致PFOS/PFOA在介质中的吸附降低,迁移率提高;当介质带负电时,离子强度的增加会使介质带负电程度降低,PFOS/PFOA与介质表面的静电斥力减弱,使PFOS/PFOA在介质中的吸附提高,迁移率降低。
2.2.3 pH在土壤、地下水等复杂环境中,pH并非一成不变,而pH的改变会对介质的表面性质以及PFOA和PFOS在环境中的迁移行为产生影响。例如,介质表面所带的正电荷数量或带负电程度随pH降低而升高或降低,PFOA和PFOS在介质中的吸附和迁移行为也因此受到影响。WANG等[24]的研究表明,当pH从7.0降至4.5时,PFOA和PFOS在Al2O3上的吸附浓度均增加了3.0~4.0倍。XING等[28]的试验结果表明,当pH从9.0降至5.0时,PFOS的最大出水浓度与回收率均降低约50.0%。此外,降低pH对PFOA和PFOS迁移的抑制作用会受到离子强度的影响。TANG等[35]对PFOS在针铁矿上的吸附研究中发现,在3种离子强度(1、10、100 mmol·L-1)条件下,降低pH均会导致PFOA在针铁矿上的吸附增强;在NaCl浓度为100 mmol·L-1的条件下,pH从9.0降至4.0,PFOS的吸附量仅增加了0.9 μg·m-2;而在相同pH范围内,在1 mmol· L-1和10 mmol·L-1的条件下,PFOS吸附量则增加3.0~5.0倍。由此推测,当离子强度较高时,介质对PFOS的吸附受pH影响程度降低,这是因为pH降低造成的影响被离子强度增强引起的静电引力降低而抵消。
pH通过改变溶液中溶质的存在形态、介质的表面性质和氢键影响PFOA和PFOS的吸附性,从而控制其在环境介质中的迁移性。如图 4所示,在较低的pH条件下,PFOS或PFOA阴离子与介质存在静电引力,在土壤矿物表面形成络合物和氢键[69],或与土壤矿物发生配体交换,从而使PFOA和PFOS吸附程度增强,迁移率降低。在强碱性(pH≥10)环境下,介质表面几乎完全去质子化,因此PFOS或PFOA与介质表面的络合作用或氢键消失,静电引力减弱,从而导致吸附显著下降,进而极大地促进了PFOS或PFOA的迁移。此外,pH变化对PFOS迁移性产生的影响会被较高的离子强度条件而抵消,因此,在离子强度较高的条件下,pH对PFOS在介质中迁移的影响程度降低。

|
图 4 不同pH对PFOS/PFOA吸附程度的影响[70] Figure 4 The influence of different pH on the adsorption degree of PFOA/PFOS[70] |
在应用数学模型对PFOA和PFOS进行数值模拟前,研究者们进行了静态吸附试验和混合置换试验,以获得描述PFOA和PFOS迁移的相关参数用于数值模拟。首先进行静态吸附试验,获取吸附等温线,并采用Langmuir方程或Freudlich方程或其他吸附等温方程拟合试验数据,以获得PFOA或PFOS在相关试验介质中的吸附系数Kd。混合置换试验即一维砂柱迁移试验,用试验的多孔介质填充色谱柱,以蠕动泵为动力,促使PFOA或PFOS溶液穿透色谱柱,从而模拟PFOA或PFOS在实际环境介质中的迁移。混合置换试验分为两部分:第一部分为使用非反应性示踪剂穿透试验介质,获得该示踪剂的穿透曲线,并应用相关软件(如STANMOD)计算该种介质的弥散系数D;第二部分为使用PFOA或PFOS溶液穿透试验介质,获得PFOA或PFOS的穿透曲线,用以判断后续模型的拟合度,为选择合适的数学模型模拟PFOA和PFOS在环境介质中的迁移奠定基础。在上述试验获得基本参数的基础上,本文列举了6种数学模型,并简述了应用所述模型模拟PFOA和PFOS在环境介质中迁移的研究进展。
3.1 数学模型 3.1.1 平衡对流-弥散模型(Convective-dispersive model,CDE)稳定流条件下,溶质在均质介质中的一维迁移过程可以用对流-弥散方程来表达[71-72]:

|
(4) |
式中:t表示时间,d;x表示纵向迁移距离,cm;θ表示介质饱和体积含水量,cm3·cm-3;S为根系吸水项或其他源汇项,cm3·cm-3·d-1;D表示水动力弥散系数,cm2·d-1;C表示介质溶液中溶质的浓度,mg·L-1;Jw表示达西流速,cm·d-1;ρb表示介质容重,g·cm-3。
在实际运算过程中,为了使主要矛盾更突出,需要适当忽略其余参数的分析。为了更轻松地使用CDE模型分析介质中的污染物,研究者们进一步改进和优化了传统CDE模型以提高其可用性。当PFOA和PFOS在介质中的吸附解析采用线性平衡方程,且Jw可以用θ与介质孔隙流速v的乘积表示,所以确定性平衡模型可以简化为[71]:

|
(5) |
式中:R表示阻滞因子;v表示孔隙流速,cm·d-1。
3.1.2 非平衡模型许多通过室内土柱试验得到的穿透曲线通常会出现拖尾或偏移等不对称现象,这说明了溶质迁移过程中非平衡状态的存在[73]。
(1)非平衡两点模型(Two-site model,TSM)
TSM可用来描述化学非平衡作用,化学非平衡作用基本是由离子的动态交换吸附和滞后吸附作用引起[74]。两点吸附理论假设介质中的吸附点位可分为两种类型:第一类是瞬间平衡吸附点;第二类是速率受限的非平衡吸附点位[75],即假定吸附过程与时间有关,并且遵循一阶动力学方程[76-77]。包含两种或两种以上吸附类型的模型更贴合实际,但是实际使用时较为困难,而非平衡两点吸附模型则可以兼顾准确度和实际适用性。非平衡两点模型的控制方程如式(6)~式(8)所示。

|
(6) |

|
(7) |

|
(8) |
式中:f表示瞬时平衡吸附点所占百分比;S1和S2表示吸附位点1和位点2的吸附浓度,mg·kg-1;θν表示体积含水率,cm3·cm-3;k1和k2分别是位点1和位点2的一级吸附系数,h-1;k3是位点2的解吸系数,h-1。
(2)非平衡两区吸附模型(Two-region model,TRM)
TRM通常用于描述物理非平衡作用,物理非平衡作用主要由介质的非均质性、优势流和动态扩散等因素引起[74]。根据这一理论,介质溶液分为流动水区域和不动水区域,动水区和不动水区都含有化学物质,化学物质可以在两区间发生运移,两个区域之间溶质的交换取决于浓度差[74]。两区模型的控制方程如式(9)和式(10)所示。

|
(9) |

|
(10) |
式中:下标m和im分别表示动态区域和停滞区域;θm + θim= θv,q= θv,ν = θmνm;q为容积水通量密度,cm ·min-1;f为流动区域达到平衡时吸附点所占的分数;α表示在流动区域和停滞区域之间溶质交换速率的一阶质量传递系数,min-1。
(3)多速率模型(Continuous-distribution multi⁃ rate model,CDMR)
CDMR将连续分布的区域和相关的吸附-解析速率系数结合[78-81],较好地反映了介质的非均质性对吸附/解吸的影响[73]。该模型可通过优化吸附动力学参数(F、μ和σk2)而达到对吸附-解析滞后现象的高拟合度[82]。该模型用来表示变量吸附/解吸动力学的参数为k2,作为ln-正态分布的随机变量,其数学表达式如式(11)所示。

|
(11) |
式中:μ是lnk2的平均值;σk是lnk2的方差。将可变的吸附/解吸动力学与对流-弥散方程结合,其分布为S和k2,相关数学表达式如式(12)~式(14)所示。

|
(12) |

|
(13) |

|
(14) |
式中:m为停滞区的总数。通过对实测数据的校正,对3个参数(F、μ和σk2)进行优化。
(4)多过程限速传质模型(Multiprocess rate-limit⁃ ed mass-transfer model,MPMT)
MPMT用于模拟具有非对流域的体系中,受速率限制的固相吸附、优先流动和扩散传质影响的溶质运移[83]。MPMT模型的4个无量纲控制方程如式(15)~式(18)所示。

|
(15) |

|
(16) |

|
(17) |

|
(18) |
式中:ω和k皆为无量纲的速率传质系数,可作为描述传质过程中速率限制程度的指标。
其中,式(15)和式(16)分别是对流域和非对流域的质量平衡;式(17)和式(18)分别是对流域和非对流域的限速吸附相平衡。
(5)TOSD(Tempered one-sided stable density,TOSD)迁移模型
TOSD模型是描述吸附-解吸和扩散传质对土壤中PFAS迁移综合效应的通用模型[84]。该模型的控制方程如式(19)所示。

|
(19) |
式中:α为时间指标;β为容量系数;λ为截断系数。
3.2 PFOA和PFOS迁移数值模拟研究进展数学模型的建立对PFOA和PFOS在多孔介质中迁移的模拟和预测具有重要意义。数学模型计算的结果可用于研究PFOA和PFOS的空间分布以及预判PFOA和PFOS的未来迁移趋势,从而为相关部门在污染防治时间和地点等方面提供科学的数据分析和决策依据。然而,应用数学模型对PFOA和PFOS在多孔介质中的迁移进行模拟的研究尚且不足,只有少数人进行了相关研究。表 4是应用数学模型模拟PFOA和PFOS在多孔介质中迁移的一些研究。
|
|
表 4 PFOA和PFOS迁移模拟数学模型及适用范围 Table 4 Application of mathematical models to simulate PFOS and PFOA transport |
邰托娅等[3]基于对流-弥散方程,建立了主要考虑吸附作用的数值模型对PFOA和PFOS在一维土柱的迁移进行模拟,结果表明,PFOA和PFOS迁移的模拟值和实测值的均方根误差(RMSE)均小于0.12,C/C0的模拟结果与实测结果的R2也均高于0.96,这足以证明模拟结果与实测结果吻合良好,基本可以反映PFOA和PFOS在土柱中的迁移行为。LV等[3]和XING等[28]均应用对流-弥散方程耦合非平衡两点迁移模型对PFOA和PFOS的迁移行为进行模拟。LV等分别模拟了在石英砂和石灰石两种介质中,不同离子类型和离子浓度对PFOA迁移行为的影响,XING等模拟了在不同pH和离子类型的条件下,PFOA和PFOS在石英砂中的迁移行为。研究结果表明,PFOA和PFOS迁移的模拟值与实测值的R2均大于0.90,证明模拟曲线与实测穿透曲线拟合程度高,该模型可以用于模拟PFOA和PFOS在饱和多孔介质中对流-弥散-吸附作用的迁移行为。GUELFO等[86]也应用非平衡两点模型模拟了PFOS在土壤中的迁移过程,但结果表明,该模型对后期拖尾现象的拟合度较差,在有机质含量较高的两种土壤中模拟值与实测值的R2均小于0.50,表明非平衡两点模型无法模拟由半胶束形成而产生的拖尾现象。BRUSSEAU等[73]考虑了对流-弥散-吸附-多速率化学反应的作用并应用多速率模型对PFOS在土壤中的迁移进行模拟,结果表明相比于非平衡两点模型,多速率模型的模拟结果与实测结果更加吻合。BRUSSEAU等[60-61]提出了一种描述PFAS在环境中迁移的综合概念模型,该模型包括了可能影响PFAS在环境中迁移的所有过程,并提出了估计关键变量的方法以参数化模型,研究结果表明,该模型可以很好地模拟PFOA和PFOS在沙子和土壤中的相关迁移和滞留过程。
4 结论及展望 4.1 结论(1)影响PFOA和PFOS在环境介质中迁移的作用机制主要包括静电相互作用、疏水作用、配体交换和氢键,其中静电相互作用和疏水作用占主导地位。
(2)有机质主要通过疏水作用吸附PFOA和PFOS,金属矿物主要通过静电作用吸附PFOA和PFOS,不同含水率导致PFOA和PFOS迁移性的差异归因于空气-水界面吸附;有机质含量越高、矿物所带正电荷越多、介质含水率越低,PFOA和PFOS的迁移性越差。
(3)溶液化学性质中,离子强度的影响程度更大;阳离子通过静电作用和桥连作用(二价阳离子)增大介质对PFOA和PFOS的吸附,降低PFOA和PFOS迁移率;阴离子通过竞争吸附促进PFOA和PFOS迁移;pH越低,PFOA和PFOS在介质中的迁移性越差。
(4)模拟PFOA和PFOS迁移行为的数学模型主要有CDE、TSM、TRM、CDMR、MPMT、TOSD模型,其中TSM多用于模拟PFOA和PFOS在多孔介质中的迁移行为,并基本可以反映其迁移特征。
4.2 展望(1)除上述之外,可能还存在其他作用和因素对PFOA和PFOS的迁移产生影响。如土壤中植物和微生物作为PFOA和PFOS毒害的直接受体,未来可深入探索植物和微生物作用对PFOA和PFOS迁移的影响,以便对PFOA和PFOS在环境中的迁移行为和机制有更全面的了解。
(2)本文提出的6种模型更适用于在多孔介质中的模拟,对于适用于大气和水环境的模型未曾提及,因此,后续将进一步完善对迁移模型的认知和了解。
(3)本文对PFOA和PFOS的共性进行论述,并未针对其特性(如链长、官能团)进行相关探讨,在后续的研究工作中可加以补充。
| [1] |
LINDSTROM A B, STRYNAR M J, LIBELO E L. Polyfluorinated compounds: Past, present, and future[J]. Environmental Science & Technology, 2011, 45(19): 7954-7961. |
| [2] |
BOULANGER B, VARGO J D, SCHNOOR J L, et al. Evaluation of perfluorooctane surfactants in a wastewater treatment system and in a commercial surface protection product[J]. Environmental Science & Technology, 2005, 39(15): 5524-5530. |
| [3] |
LV X Y, SUN Y Y, JI R, et al. Physicochemical factors controlling the retention and transport of perfluorooctanoic acid(PFOA) in saturated sand and limestone porous media[J]. Water Research, 2018, 141(15): 251-258. |
| [4] |
PREVEDOUROS K, COUSINS I T, BUCK R C, et al. Sources, fate and transport of perfluorocarboxylates[J]. Environmental Science & Technology, 2010, 40(1): 32-44. |
| [5] |
RAYNE S, FOREST K. Perfluoroalkyl sulfonic and carboxylic acids: A critical review of physicochemical properties, levels and patterns in waters and wastewaters, and treatment methods[J]. Environmental Science and Health, 2009, 44(12): 1145-1199. DOI:10.1080/10934520903139811 |
| [6] |
VAN ASSELT E D, RIETRA R P J J, RÖMKENS P F A M, et al. Perfluorooctane sulphonate(PFOS) throughout the food production chain[J]. Food Chemistry, 2011, 128(1): 1-6. DOI:10.1016/j.foodchem.2011.03.032 |
| [7] |
LOOS R, LOCORO G, COMERO S, et al. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water[J]. Water Research, 2010, 44(14): 4115-4126. DOI:10.1016/j.watres.2010.05.032 |
| [8] |
SPAAN K M, NOORDENBURG C V, PLASSMANN M M, et al. Fluorine mass balance and suspect screening in marine mammals from the northern Hemisphere[J]. Environmental Science & Technology, 2020, 54(7): 4046-4058. |
| [9] |
LAU C, ANITOLE K, HODES C, et al. Perfluoroalkyl acids: A review of monitoring and toxicological findings[J]. Toxicological Sciences, 2007, 99(2): 366-394. DOI:10.1093/toxsci/kfm128 |
| [10] |
POOTHONG S, THOMSEN C, PADILLA-SANCHEZ J A, et al. Distribution of novel and well-known poly-and perfluoroalkyl substances (PFASs) in human serum, plasma, and whole blood[J]. Environmental Science & Technology, 2017, 51(22): 13388-13396. |
| [11] |
OLSEN G W, BURRIS J M, EHRESMAN D J, et al. Half-life of serum elimination of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in retired fluorochemical production workers[J]. Environmental Health Perspectives, 2007, 115(9): 1298-1305. DOI:10.1289/ehp.10009 |
| [12] |
ZHANG Y F, BEESOON S, ZHU L Y, et al. Biomonitoring of perfluoroalkyl acids in human urine and estimates of biological half-life[J]. Environmental Science & Technology, 2013, 47(18): 10619-10627. |
| [13] |
GIESY J P, NAILE J E, KHIM J S, et al. Aquatic toxicology of perfluorinated chemicals[J]. Reviews of Environmental Contamination Toxicology, 2010, 202: 1-52. |
| [14] |
BACH C C, BECH B H, BRIX N, et al. Perfluoroalkyl and polyfluoroalkyl substances and human fetal growth: A systematic review[J]. Critical Reviews in Toxicology, 2015, 45(1): 53-67. DOI:10.3109/10408444.2014.952400 |
| [15] |
CHANG E T, ADAMI H O, BOFFETTA P, et al. A critical review of perfluorooctanoate and perfluorooctanesulfonate exposure and immunological health conditions in humans[J]. Critical Reviews in Toxicology, 2016, 46(4): 279-331. DOI:10.3109/10408444.2015.1122573 |
| [16] |
VIERKE L, MOLLER A, KLITZKE S. Transport of perfluoroalkyl acids in a water-saturated sediment column investigated under nearnatural conditions[J]. Environmental Pollution, 2014, 186: 7-13. DOI:10.1016/j.envpol.2013.11.011 |
| [17] |
ZHANG R M, YAN W, JING C Y. Experimental and molecular dynamic simulation study of perfluorooctane sulfonate adsorption on soil and sediment components[J]. Journal of Environmental Science, 2015, 29: 131-138. DOI:10.1016/j.jes.2014.11.001 |
| [18] |
MCKENZIE E R, SIEGRIST R L, MCCRAY J.E, et al. Effects of chemical oxidants on perfluoroalkyl acid transport in one-dimensional porous media columns[J]. Environmental Science & Technology, 2015, 49(3): 1681-1689. |
| [19] |
YOUSOF H A, CHEN L, DANIEL P M, et al. In situ remediation method for enhanced sorption of perfluoro-alkyl substances onto ottawa sand[J]. Journal of Environmental Engineering, 2018, 144(9): 04018086. DOI:10.1061/(ASCE)EE.1943-7870.0001418 |
| [20] |
LYU X Y, LIU X, SUN Y Y, et al. Importance of surface roughness on perfluorooctanoic acid(PFOA) transport in unsaturated porous media[J]. Environmental Pollution, 2020, 266: 115343. DOI:10.1016/j.envpol.2020.115343 |
| [21] |
XIANG L, XIAO T, YU P F, et al. Mechanism and Implication of the sorption of perfluorooctanoic acid by varying soil size fractions[J]. Agricultural and Food Chemistry, 2018, 66(44): 11569-11579. DOI:10.1021/acs.jafc.8b03492 |
| [22] |
ZAREITALABAD P, SIEMENS J, HAMER M, et al. Perfluorooctanoic acid(PFOA) and perfluorooctanesulfonic acid(PFOS) in surface waters, sediments, soils and wastewater: A review on concentrations and distribution coefficients[J]. Chemosphere, 2013, 91(6): 725-732. DOI:10.1016/j.chemosphere.2013.02.024 |
| [23] |
WANG F, LIU C S, SHIH K. Adsorption behavior of perfluorooctanesulfonate(PFOS) and perfluorooctanoate(PFOA) on boehmite[J]. Chemosphere, 2012, 89(8): 1009-1014. DOI:10.1016/j.chemosphere.2012.06.071 |
| [24] |
WANG F, SHIH K. Adsorption of perfluorooctanesulfonate(PFOS) and perfluorooctanoate(PFOA) on alumina: Influence of solution pH and cations[J]. Water Research, 2011, 45(9): 2925-2930. DOI:10.1016/j.watres.2011.03.007 |
| [25] |
YU J, LV L, LAN P, et al. Effect of effluent organic matter on the adsorption of perfluorinated compounds onto activated carbon[J]. Journal of Hazardous Materials, 2012, 225/226: 99-106. DOI:10.1016/j.jhazmat.2012.04.073 |
| [26] |
YU Q, ZHANG R Q, DENG S B, et al. Sorption of perfluorooctane sulfonate and perfluorooctanoate on activated carbons and resin: Kinetic and isotherm study[J]. Water Research, 2009, 43(4): 1150-1158. DOI:10.1016/j.watres.2008.12.001 |
| [27] |
ZHOU Q, DENG S B, YU Q, et al. Sorption of perfluorooctane sulfonate on organo-montmorillonites[J]. Chemosphere, 2010, 78(6): 688-694. DOI:10.1016/j.chemosphere.2009.12.005 |
| [28] |
XING Y N, LI Q, CHEN X, et al. Different transport behaviors and mechanisms of perfluorooctanoate(PFOA) and perfluorooctane sulfonate(PFOS) in saturated porous media[J]. Journal of Hazardous Materials, 2020, 402: 123435. |
| [29] |
GALLEN C, DRAGE D, KASERZON S, et al. Occurrence and distribution of brominated flame retardants and perfluoroalkyl substances in Australian landfill leachate and biosolids[J]. Journal of Hazardous Materials, 2016, 312: 55-64. DOI:10.1016/j.jhazmat.2016.03.031 |
| [30] |
HATTON J, HOLTON C, DIGUISEPPI B. Occurrence and behavior of per -and polyfluoroalkyl substances from aqueous film-forming foam in groundwater systems[J]. Remediation, 2018, 28(2): 89-99. DOI:10.1002/rem.21552 |
| [31] |
DAUCHY X, BOITEUX V, COLIN A, et al. Deep seepage of per-and polyfluoroalkyl substances through the soil of a firefighter training site and subsequent groundwater contamination[J]. Chemosphere, 2019, 214: 729-737. DOI:10.1016/j.chemosphere.2018.10.003 |
| [32] |
LANG J R, ALLRED B M, PEASLEE G F, et al. Release of per-and polyfluoroalkyl substances(PFASs) from carpet and clothing in model anaerobic landfill reactors[J]. Environmental Science & Technology, 2016, 50(10): 5024-5032. |
| [33] |
ALDER A C, VAN DER VOET J. Occurrence and point source characterization of perfluoroalkyl acids in sewage sludge[J]. Chemosphere, 2015, 129: 62-73. DOI:10.1016/j.chemosphere.2014.07.045 |
| [34] |
KAROYO A H, WILSON L D. Tunable macromolecular-based materials for the adsorption of perfluorooctanoic and octanoic acid anions[J]. Journal of Colloid and Interface Science, 2013, 402: 196-203. DOI:10.1016/j.jcis.2013.03.065 |
| [35] |
TANG C Y Y, FU Q S, GAO D, et al. Effect of solution chemistry on the adsorption of perfluorooctane sulfonate onto mineral surfaces[J]. Water Research, 2010, 44(8): 2654-2662. DOI:10.1016/j.watres.2010.01.038 |
| [36] |
WANG F, SHIH K, LECKIE J O. Effect of humic acid on the sorption of perfluorooctane sulfonate(PFOS) and perfluorobutane sulfonate (PFBS) on boehmite[J]. Chemosphere, 2015, 118: 213-218. DOI:10.1016/j.chemosphere.2014.08.080 |
| [37] |
ZHOU Q, PAN G, ZHANG J. Effective sorption of perfluorooctane sulfonate(PFOS) on hexadecyltrimethylammonium bromide immobilized mesoporous SiO2 hollow sphere[J]. Chemosphere, 2013, 90(9): 2461-2466. DOI:10.1016/j.chemosphere.2012.11.009 |
| [38] |
ZHOU Q, DENG S B, ZHANG Q Y, et al. Sorption of perfluorooctane sulfonate and perfluorooctanoate on activated sludge[J]. Chemosphere, 2010, 81(4): 453-458. DOI:10.1016/j.chemosphere.2010.08.009 |
| [39] |
OLIVER D P, LI Y, ORR R, et al. The role of surface charge and pH changes in tropical soils on sorption behaviour of per-and polyfluoroalkyl substances(PFASs)[J]. Science of the Total Environment, 2019, 673(10): 197-206. |
| [40] |
ZHANG Q Y, DENG S B, YU G, et al. Removal of perfluorooctane sulfonate from aqueous solution by crosslinked chitosan beads: Sorption kinetics and uptake mechanism[J]. Bioresource Technology, 2011, 102(3): 2265-2271. DOI:10.1016/j.biortech.2010.10.040 |
| [41] |
DENG S B, ZHANG Q Y, NIE Y, et al. Sorption mechanisms of perfluorinated compounds on carbon nanotubes[J]. Environmental Pollution, 2012, 168(5): 138-144. |
| [42] |
DU Z W, DENG S, BEI Y, et al. Adsorption behavior and mechanism of perfluorinated compounds on various adsorbents: A review[J]. Journal of Hazardous Materials, 2014, 274(15): 443-454. |
| [43] |
AHRENS L, YEUNG L W Y, TANIYASU S, et al. Partitioning of perfluorooctanoate(PFOA), perfluorooctane sulfonate(PFOS) and perfluorooctane sulfonamide(PFOSA) between water and sediment[J]. Chemosphere, 2011, 85(5): 731-737. DOI:10.1016/j.chemosphere.2011.06.046 |
| [44] |
JIA C X, YOU C, PAN G. Effect of temperature on the sorption and desorption of perfluorooctane sulfonate on humic acid[J]. Journal of Environmental Sciences, 2010, 22(3): 355-361. DOI:10.1016/S1001-0742(09)60115-7 |
| [45] |
VALERIA O H, REYES S A. Removal of perfluorinated surfactants by sorption onto granular activated carbon, zeolite and sludge[J]. Chemosphere, 2008, 72(10): 1588-1593. DOI:10.1016/j.chemosphere.2008.04.029 |
| [46] |
CHEN X, XIA X H, WANG X L, et al. A comparative study on sorption of perfluorooctane sulfonate(PFOS) by chars, ash and carbon nanotubes[J]. Chemosphere, 2011, 83(10): 1313-1319. DOI:10.1016/j.chemosphere.2011.04.018 |
| [47] |
DENG S B, YU Q, HUANG J, et al. Removal of perfluorooctane sulfonate from wastewater by anion exchange resins: Effects of resin properties and solution chemistry[J]. Water Research, 2010, 44(18): 5188-5195. DOI:10.1016/j.watres.2010.06.038 |
| [48] |
GAO X D, CHOROVER J. Adsorption of perfluorooctanoic acid and perfluorooctanesulfonic acid to iron oxide surfaces as studied by flowthrough ATR-FTIR spectroscopy[J]. Environmental Chemistry, 2012, 9(2): 148. DOI:10.1071/EN11119 |
| [49] |
XU J J, NIU J F, ZHANG S Y. Sorption of perfluorooctane sulfonate (PFOS) on electrospun fiber membranes[J]. Procedia Environmental Sciences, 2013, 18: 472-477. DOI:10.1016/j.proenv.2013.04.063 |
| [50] |
LI X, PIGNATELLO J J, WANG Y, et al. New insight into adsorption mechanism of ionizable compounds on carbon nanotubes[J]. Environmental Science & Technology, 2013, 47(15): 8334-8341. |
| [51] |
LYU X Y, LIU X, SUN Y Y, et al. Transport and retention of perfluorooctanoic acid(PFOA) in natural soils: Importance of soil organic matter and mineral contents, and solution ionic strength[J]. Journal of Contaminant Hydrology, 2019, 225: 103477. DOI:10.1016/j.jconhyd.2019.03.009 |
| [52] |
JOHNSON R L, ANSCHUTZ A J, SMOLEN J M, et al. The adsorption of perfluorooctane sulfonate onto sand, clay, and iron oxide surfaces[J]. Journal of Chemical Engineering Data, 2007, 52(4): 1165-1170. DOI:10.1021/je060285g |
| [53] |
LYU X Y, LIU X, WU X L, et al. Importance of Al/Fe oxyhydroxide coating and ionic strength in perfluorooctanoic acid(PFOA) transport in saturated porous media[J]. Water Research, 2020, 175: 115685. DOI:10.1016/j.watres.2020.115685 |
| [54] |
SILVA J A K, MARTIN W A, JOHNSON J L, et al. Evaluating airwater and NAPL-water interfacial adsorption and retention of Perfluorocarboxylic acids within the Vadose zone[J]. Journal of Contaminant Hydrology, 2019, 223: 103472. DOI:10.1016/j.jconhyd.2019.03.004 |
| [55] |
LYU Y, BRUSSEAU M L. The influence of solution chemistry on airwater interfacial adsorption and transport of PFOA in unsaturated porous media[J]. Science of the Total Environment, 2020, 713: 136744. DOI:10.1016/j.scitotenv.2020.136744 |
| [56] |
MILINOVIC J, LACORTE S, VIDAL M, et al. Sorption behaviour of perfluoroalkyl substances in soils[J]. Science of the Total Environment, 2015, 511(1): 63-71. |
| [57] |
HELLSING M S, JOSEFSSON S, HUGHES A V, et al. Sorption of perfluoroalkyl substances to two types of minerals[J]. Chemosphere, 2016, 159: 385-391. DOI:10.1016/j.chemosphere.2016.06.016 |
| [58] |
LIN H, WANG Y J, NIU J F, et al. Efficient sorption and removal of perfluoroalkyl acids(PFAAs) from aqueous solution by metal hydroxides generated in situ by electrocoagulation[J]. Environmental Science & Technology, 2015, 49(17): 10562-10569. |
| [59] |
MUSTER T H, NEUFELD A K, COLE I S. The protective nature of passivation films on zinc: Wetting and surface energy[J]. Corrosion Science, 2004, 46(9): 2337-2354. DOI:10.1016/j.corsci.2004.01.001 |
| [60] |
BRUSSEAU M L, NI Y, SARAH V G, et al. Comprehensive retention model for PFAS transport in subsurface systems[J]. Water Research, 2019, 148: 41-50. DOI:10.1016/j.watres.2018.10.035 |
| [61] |
BRUSSEAU M L. Assessing the potential contributions of additional retention processes to PFAS retardation in the subsurface[J]. Science of the Total Environment, 2018, 613/614: 176-185. DOI:10.1016/j.scitotenv.2017.09.065 |
| [62] |
LYU Y, BRUSSEAU M L, CHEN W, et al. Adsorption of PFOA at the air-water interface during transport in unsaturated porous media[J]. Environmental Science & Technology, 2018, 52(14): 7745-7753. |
| [63] |
LI Z Y, LYU X Y, GAO B, et al. Effects of ionic strength and cation type on the transport of perfluorooctanoic acid(PFOA) in unsaturated sand porous media[J]. Journal of Hazardous Materials, 2021, 403(5): 123688. |
| [64] |
CHEN H, ZHANG C, YU Y X, et al. Sorption of perfluorooctane sulfonate(PFOS) on marine sediments[J]. Marine Pollution Bulletin, 2012, 64(5): 902-906. DOI:10.1016/j.marpolbul.2012.03.012 |
| [65] |
CHEN R Y, ZHUANG Y, YU Y, et al. Enhanced perfluorooctanoic acid(PFOA) accumulation by combination with in-situ formed Mn oxides under drinking water conditions[J]. Water Research, 2021, 190: 116660. DOI:10.1016/j.watres.2020.116660 |
| [66] |
QIAN J, SHEN M M, WANG P F, et al. Adsorption of perfluorooctane sulfonate on soils: Effects of soil characteristics and phosphate competition[J]. Chemosphere, 2017, 168: 1383-1388. DOI:10.1016/j.chemosphere.2016.11.114 |
| [67] |
CHEN H, CHEN S, QUAN X, et al. Sorption of perfluorooctane sulfonate(PFOS) on oil and oil-derived black carbon: Influence of solution pH and[Ca2+][J]. Chemosphere, 2009, 77(10): 1406-1411. DOI:10.1016/j.chemosphere.2009.09.008 |
| [68] |
YOU C, JIA C X, PAN G. Effect of salinity and sediment characteristics on the sorption and desorption of perfluorooctane sulfonate at sediment-water interface[J]. Environmental Pollution, 2010, 158(5): 1343-1347. DOI:10.1016/j.envpol.2010.01.009 |
| [69] |
ZHAO L X, BIAN J N, ZHANG Y H, et al. Comparison of the sorption behaviors and mechanisms of perfluorosulfonates and perfluorocarboxylic acids on three kinds of clay minerals[J]. Chemosphere, 2014, 114: 51-58. DOI:10.1016/j.chemosphere.2014.03.098 |
| [70] |
CAMPOS-PEREIRA H, KLEJA D B, SJÖSTEDT C, et al. The adsorption of per-and polyfluoroalkyl substances(PFASs) onto ferrihydrite is governed by surface charge[J]. Environmental Science & Technology, 2020, 54(24): 15722-15730. |
| [71] |
焦艺博. 重金属Cd、Pb在土壤中纵向迁移的数值模拟[D]. 开封: 河南大学, 2018. JIAO Y B. Numerical simulation of vertical transport of heavy metal Cd, Pb in soil[D]. Kaifeng: Henan University, 2018. |
| [72] |
TORIDE N F, LEIJ F J, GENUCHTEN M. The CXTFIT code for estimating transport parameters from laboratory or field tracer experiments: Version 2.0[J]. Research Roport, 1995. |
| [73] |
BRUSSEAU M L, NAIMA K, WANG Y, et al. Nonideal transport and extended elution tailing of PFOS in soil[J]. Environmental Science & Technology, 2019, 53(18): 10654-10664. |
| [74] |
孙军娜, 徐绍辉. Cu/Pb/Zn/Cd在石英砂中的迁移实验及模拟[J]. 土壤学报, 2010, 47(6): 1101-1109. SUN J N, XU S H. Modeling Cu/Pb/Zn/Cd transport in quartz sand column[J]. Acta Pedologica Sinica, 2010, 47(6): 1101-1109. |
| [75] |
KAMRA S K, LENNARTZ B, VAN GENUCHTEN M T. Evaluating non-equilibrium solute transport in small soil columns[J]. Journal of Contaminant Hydrology, 2001, 48(3/4): 189-212. |
| [76] |
VAN GENUCHTEN M T, WAGENET R J. Two-Site/Two-Region models for pesticide transport and degradation: Theoretical development and analytical solutions[J]. Soil Science Society of America Journal, 1989, 53(5): 1303-1310. DOI:10.2136/sssaj1989.03615995005300050001x |
| [77] |
GENUCHTEN M T V. Non-equilibrium transport parameters from miscible displacement experiments[J]. USDepAgric Res Rep, 1981. |
| [78] |
CHEN W, WAGENET R J. Solute transport in porous media with sorption-site heterogeneity[J]. Environmental Science & Technology, 1995, 29(11): 2725-2734. |
| [79] |
TERESA B C, STEPHEN P H, DIPAK S, et al. Modeling the desorption of organic contaminants from long-term contaminated soil using distributed mass transfer rates[J]. Environmental Science & Technology, 1997, 31(6): 1581-1588. |
| [80] |
LI Z Y, BRUSSEAU M L. Nonideal transport of reactive solutes in heterogeneous porous media: 6.Microscopic and macroscopic approaches for incorporating heterogeneous rate-limited mass transfer[J]. Water Resources Research, 2000, 36(10): 2853-2867. DOI:10.1029/2000WR900089 |
| [81] |
SAIERS J E, TAO G. Evaluation of continuous distribution models for rate-limited solute adsorption to geologic media[J]. Water Resources Research, 2000, 36(7): 1627-1639. DOI:10.1029/2000WR900050 |
| [82] |
SCHNAAR G, BRUSSEAU M L. Nonideal transport of contaminants in heterogeneous porous media: 11.Testing the experiment condition dependency of the continuous-distribution rate model for sorption-desorption[J]. Water Air Soil Pollut, 2014, 225(11): 2136. DOI:10.1007/s11270-014-2136-1 |
| [83] |
BRUSSEAU M L. Simulating PFAS transport influenced by rate-limited multi-process retention[J]. Water Research, 2020, 168: 115179. DOI:10.1016/j.watres.2019.115179 |
| [84] |
ZHOU D B, BRUSSEAU M L, ZHANG Y, et al. Simulating PFAS adsorption kinetics, adsorption isotherms, and nonideal transport in saturated soil with tempered one-sided stable density(TOSD) based models[J]. Journal of Hazardous Materials, 2021, 411: 125169. DOI:10.1016/j.jhazmat.2021.125169 |
| [85] |
邰托娅, 郑跃军, 王金生. 应用HYDRUS-1D模型模拟分析PFCs在土壤中的迁移特征[J]. 农业环境科学学报, 2018, 37(10): 2175-2182. TAI T Y, ZHENG Y J, WANG J S. Simulation and analysis of PFCs migration in the soil column using Hydrus-1D model[J]. Journal of Agro-Environment Science, 2018, 37(10): 2175-2182. DOI:10.11654/jaes.2017-1637 |
| [86] |
GUELFO J L, WUNSCH A, MCCRAY J, et al. Subsurface transport potential of perfluoroalkyl acids(PFAAs): Column experiments and modeling[J]. Journal of Contaminant Hydrology, 2020, 233: 103661. DOI:10.1016/j.jconhyd.2020.103661 |
 2021, Vol. 40
2021, Vol. 40






