专家/团队介绍:
张宝刚,山东淄博人,中国地质大学(北京)水资源与环境学院教授,博士生导师,国家优秀青年基金获得者,国家生态环境保护专业技术青年拔尖人才,兼任SCI期刊Chinese Chemical Letters青年编委、国际水协会中国青年委员会委员、中国土壤学会青年工作委员会委员。
一直致力于重金属环境生物地球化学过程及高效修复研究,涉及微生物、地质学、电化学、光催化及能源材料领域。以第一/通信作者身份发表SCI论文80余篇,包括环境、地球科学领域Top期刊Environmental Science & Technology、Geochimica et Cosmochimica Acta等,H指数为37,SCI他引2 700余次。主持国家自然科学基金5项。以第一发明人身份获授权发明专利7项。入选“北京市科技新星计划”,获中国地质学会第十六届青年地质科技奖(银锤奖)、第二届中国环境科学学会青年科学家奖(优秀奖)等荣誉;团队现有青年教师2名,博士后1名,在读博士生9名,硕士生22名。团队与美国普林斯顿大学、弗吉尼亚理工学院及英国爱丁堡大学等紧密合作,与国内大型修复公司、环保公司开展产学研合作。
2. 上海市环境科学研究院, 上海 200233
2. Shanghai Academy of Environmental Sciences, Shanghai 200233, China
铬(Cr)是地壳中含量最多的元素之一[1],在环境中,三价铬[Cr(Ⅲ)]和六价铬[Cr(Ⅵ)]是其最主要且最稳定的两种存在形态[2]。Cr(Ⅲ)能够作为营养补充剂,在动物和人体的脂质、蛋白质代谢中发挥作用[3]。而Cr(Ⅵ)具有剧毒,能够诱导细胞氧化应激,损伤DNA与蛋白质[4]。Cr(Ⅵ)与Cr(Ⅲ)迁移性、水溶性以及进入细胞能力的差异,使前者的毒性是后者的100倍以上[5]。Cr(Ⅵ)污染通常是由工业活动引发的[6-7],主要是在染料合成、皮革鞣制、金属电镀、木材防腐等工业活动中产生[8-9]。降水期间铬渣场发生的泄露和含铬工业废水不合理的排放导致Cr(Ⅵ)进入地表水体和地下水系统中[7, 10]。
将Cr(Ⅵ)还原为Cr(Ⅲ)是修复受Cr(Ⅵ)污染环境的关键途径。化学还原被认为是彻底去除铬污染的较为经济且稳定的方法[11]。尽管已有多种还原剂被证实可以还原Cr(Ⅵ),然而其却存在不同的缺点,例如动力学上反应缓慢或还原剂具有毒性[12-13]。添加无机纳米材料作为还原Cr(Ⅵ)的催化剂能够提高反应速率,形成不溶性铬沉淀,避免Cr(Ⅲ)被有机物再次氧化[11]。催化剂在Cr(Ⅵ)的催化还原中发挥了关键作用,常用的无机纳米催化剂包括TiO2、Pd和Fe等[14-17]。其中,由于钯纳米颗粒(Pd-NPs)对还原剂具有很强的亲和力[18],且材料容易实现稳定化[19],因此受到了越来越多的关注。
常用的制备Pd-NPs的方法是化学合成,但该方法存在使用的化学试剂毒性较大或合成的Pd-NPs尺寸偏大等缺点[20]。近年来,微生物合成Pd-NPs逐渐成为研究的热点,其主要是利用特定微生物做催化剂,还原含钯化合物,用以制备Pd-NPs。生物法合成纳米材料被认为是环境友好的方法,且制得的颗粒在形状、尺寸及理化性质等方面具有更优越的性能,应用前景更广[21]。能催化还原的功能微生物是生物合成Pd-NPs的核心,常用的功能微生物有硫酸盐还原菌(Desulfovibrio等)和铁还原菌(Shewanella等)[22-23]。发掘可制备Pd-NPs的菌种资源尤为重要。最近,反硝化菌Thauera在环境中的应用日益兴起,其具有优异的催化还原特性,异养、自养下均可生活,对环境条件要求较为宽泛,其脱氢酶和细胞色素能够参与到氧化还原的电子传输过程中,被认为是一种能够用于环境修复的潜在菌种[24]。有研究证实,Thauera可用于修复土壤地下水中的多种有机物、硝酸盐等污染[25]。但Thauera合成Pd-NPs的潜力尚未评估,其合成的Pd-NPs还原固定Cr(Ⅵ)的能力也尚未揭示。
因此,为了研究反硝化菌Thauera合成Pd-NPs的可行性,并探究试验条件对反硝化菌Thauera合成Pd-NPs的影响规律,本研究使用材料分析技术表征所合成的Pd-NPs,并通过与化学方法合成的Pd(0)对比,评估Thauera合成Pd-NPs催化还原Cr(Ⅵ)的性能。
1 材料与方法 1.1 菌种及其培养菌种Thauera humireducens来自广东省生态环境技术研究所,其分离于微生物燃料电池,能还原腐殖质、三价铁和硝酸盐[26]。将T. humireducens接种到含胰蛋白胨(10 g·L-1)、酵母提取物(5 g·L-1)、氯化钠(10 g·L-1)、pH为(7±0.1)的100 mL无菌液体培养基中,在(30±2)℃振荡培养,通过光密度计数(OD=600 nm),在18 h时进入快速生长期,收集此阶段的菌体进行后续试验。
1.2 Pd-NPs的合成取快速生长期的菌液40 mL于50 mL离心管中,在4 000 r·min-1下离心10 min,用去离子水冲洗下层沉淀3次后,接种到含100 mL人工模拟地下水的血清瓶中。模拟地下水配方如下[27]:氯化钙(0.246 4 g·L-1,氯化镁1.057 2 g·L-1,氯化钠0.445 9 g·L-1,氯化钾0.028 3 g·L-1,碳酸氢钠0.808 2 g·L-1,氯化铵0.155 7 g·L-1,磷酸二氢钾0.029 9 g·L-1,调节溶液pH为(7± 0.1),同时加入1.700 g·L-1 HCOONa与0.294 0 g·L-1 Na2PdCl4,最后用丁基橡胶塞密封。同样的条件下,制备不含菌液的混合液,用以得到非生物合成钯材料。在(30±2)℃条件下,于150 r·min-1的恒温振荡箱中振荡培养24 h,获得生物合成的Pd-NPs,并对其形貌、成分、结构等进行表征。随后研究了试验条件对T. humireducens合成Pd-NPs的影响,分别探究了Pd(Ⅱ)初始浓度(0.5、1.0、1.5、2.0 mmol·L-1),HCOONa初始浓度(5、10、25、50 mmol·L-1),接种生物量(10、25、50、100 mL)和pH(3、5、7、9)的影响规律。同样的条件下,不添加T. humireducens,获得了化学合成的Pd(0)作为对照。标准酸(0.1 mol·L-1 HCl)和碱(0.1 mol·L-1 NaOH)用于调节pH。
1.3 Pd-NPs催化去除Cr(Ⅵ)在100 mL血清瓶中加入0.5 µL ·mL-1 HCOOH(88%),0.5 mg·mL-1 T. humireducens合成的Pd-NPs和0.5 mmol·L-1以K2Cr2O7形态存在的Cr(Ⅵ),调节pH为(3.0±0.1),反应周期为1.5 h,在不同时间点取样并用0.22 µm滤膜过滤,监测溶液吸光度与其中Cr(Ⅵ)浓度的变化,同时对比化学合成的Pd-NPs催化还原Cr(Ⅵ)的能力。一个周期结束后,通过离心获得反应中生成的沉淀并回收Pd-NPs,利用材料分析手段表征生成的沉淀。在相同的条件下,使用回收的Pd-NPs继续进行去除Cr(Ⅵ)的研究,如此循环3个周期,用以评估T. humireducens合成的Pd-NPs的稳定性。同时,探究了pH(3、5、7、9)和初始Cr(Ⅵ)浓度(0.1、0.25、0.5、1.0 mmol·L-1)对Pd-NPs催化还原Cr(Ⅵ)的影响。
1.4 分析测试方法溶液中Pd(Ⅱ)的测定采用分光光度法[28],以溶液中Pd(Ⅱ)的减少反推Pd-NPs的生成。使用紫外可见分光光度计(UV 8000S,Metash,中国)对溶液在250~450 nm范围内进行全波长扫描,并用分光光度法测定Cr(Ⅵ)浓度。pH用pH计(PH-201,Hanna,意大利)测定。
透射电子显微镜(TEM)被用于观察Pd-NPs的形貌及尺寸,并用软件Nano Measurer分析TEM图像中的粒径分布情况。成分使用能量散射X射线谱(EDS)进行评估。用铜靶辐射(波长为1.540 56 Å)的X射线衍射仪对材料进行X射线衍射(XRD)。应用X射线光电子能谱(XPS)分析Pd-NPs中Pd和沉淀中Cr的化学价。
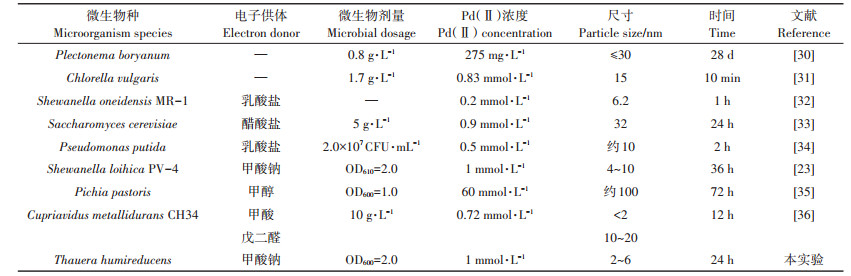
2 结果与讨论 2.1 T. humireducens合成Pd-NPs在24 h的运行周期内,观测到溶液中Pd(Ⅱ)的还原效率逐渐升高,同时溶液的颜色由红棕色逐渐变为无色透明(图 1),伴随着溶液中出现肉眼可见的黑色颗粒。紫外光谱图也显示Pd(Ⅱ)吸光度峰随着时间的推移而逐渐衰减(图 1),24 h后,Pd(Ⅱ)得到了全部还原。说明T. humireducens能以Pd(Ⅱ)为电子受体,完成自身的新陈代谢活动,从而实现Pd(Ⅱ)的催化还原以制备Pd-NPs。T. humireducens可以将多种高价化合物如Fe(Ⅲ)、硝酸盐作为电子受体[24],而本研究是第一次证实其可以利用Pd(Ⅱ)作为电子受体,用以合成Pd-NPs。在利用生物法制备Pd-NPs中,T. humireducens展示了较高的合成速率(表 1),显著高于相同条件下Shewanella loihica催化制备Pd-NPs的速率,这主要是由于T. humireducens具有较强的环境适应性,这也是利用T. humireducens制备Pd-NPs的优势。但实际上,地下水普遍受到硝酸盐的污染,高浓度的硝酸盐会与Pd(Ⅱ)竞争电子[29],从而降低T. humireducens制备Pd-NPs的效率。
|
图 1 T. humireducens合成Pd-NPs过程的光谱变化 Figure 1 Spectrum variations during Pd-NPs synthesis by T. humireducens |
|
|
表 1 生物法制备Pd-NPs的微生物名称及相关参数 Table 1 Microorganism species and related parameters used for biosynthesis of Pd-NPs |
Pd(Ⅱ)的还原速率随着初始Pd(Ⅱ)浓度的增加而增加(图 2a),说明T. humireducens在高浓度Pd(Ⅱ)下可以更快的制备Pd-NPs,也说明Pd(Ⅱ)对细胞的毒害性较低[37],高浓度Pd(Ⅱ)未对T. humireducens的代谢活性造成影响。在Pd(Ⅱ)初始浓度为0.5 mmol·L-1时,24 h内Pd(Ⅱ)的还原效率仅为29%,而在其他3个更高的Pd(Ⅱ)初始浓度水平下,溶液中的Pd(Ⅱ)在24 h内基本完全去除,Pd(Ⅱ)最大还原速率也从0.02 mmol·L-1·h-1增加到0.35 mmol·L-1·h-1。

|
图 2 试验条件对T. humireducens合成Pd-NPs的影响 Figure 2 The influence of operating conditions on the synthesis of Pd-NPs by T. humireducens |
Pd(Ⅱ)的还原速率随着HCOONa浓度的增加而加快(图 2b),说明高碳源浓度更利于T. humireducens合成Pd-NPs,这主要是由于高浓度的HCOONa提供了更多的电子用于Pd(Ⅱ)的还原,并释放了更多的能量支持T. humireducens的代谢。KOTTENHAHN等[38]在生物催化甲酸制氢的实验中,同样发现了高浓度甲酸钠并未对反应产生抑制作用。当碳源浓度从5 mmol·L-1增加到10 mmol·L-1时,24 h内Pd(Ⅱ)的还原效率从9% 仅增长到25%,但当进一步增加HCOO-Na浓度时,可实现Pd(Ⅱ)的完全去除,Pd(Ⅱ)的最大还原速率也从0.01 mmol·L-1·h-1增加到0.13 mmol·L-1·h-1。
随着接种量的增加,Pd(Ⅱ)的还原速率不断升高(图 2c)。当微生物量为10 mL时,Pd(Ⅱ)的还原效率仅为12%,随生物量提高,Pd(Ⅱ)的还原效率也逐渐提高,在50 mL和100 mL条件下均可实现Pd(Ⅱ)的全部去除。这同时也暗示T. humireducens催化还原Pd(Ⅱ)可能具有群体效益,即微生物量达到一定浓度时,才能触发Pd(Ⅱ)还原反应的进行。同时,较高的生物量被认为有利于形成更小尺寸的Pd-NPs[39]。当微生物量从10 mL增加到100 mL时,Pd(Ⅱ)的最大还原速率从0.02 mmol·L-1·h-1增加到0.14 mmol·L-1·h-1。
随着pH的逐渐升高,Pd(Ⅱ)的还原速率先升高、后降低(图 2d)。强酸性条件(pH=3.0)与碱性条件(pH=9.0)下,Pd(Ⅱ)还原受到显著抑制,主要是由于此环境不利于T. humireducens的生长。在中性条件下,24 h的运行周期可实现Pd(Ⅱ)的全部还原,说明pH形成的环境条件对T. humireducens合成Pd-NPs有显著影响。在弱酸性条件下(pH=5.0)Pd(Ⅱ)的还原速率比中性条件下(pH=7.0)更快,Pd(Ⅱ)完全被还原为Pd(0),这主要与氢化酶偏向于在偏酸性条件下产氢有关[40],而产生的氢气也可以促进Pd(Ⅱ)的有效还原[41]。
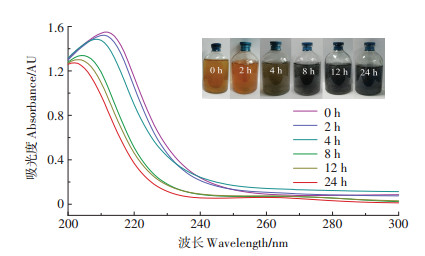
2.3 Pd-NPs的物化表征TEM图像显示在T. humireducens细胞上均匀分布着光滑的球形颗粒物(图 3a),微生物细胞作为载体,为Pd-NPs提供了大量附着点,避免了颗粒的聚集,增强了材料的稳定性[42]。颗粒物的尺寸具有窄分布区间(1~14 nm),并集中分布在2~6 nm(图 3b)。EDS分析显示Pd是这些颗粒物的主要成分(图 3c),从而证实了T. humireducens可催化合成Pd-NPs。与已有研究相比,本研究采用HCOONa作为电子供体的体系,所合成的Pd-NPs尺寸较小,且反应速率较快(表 1),显示出使用T. humireducens合成Pd-NPs的优越性。XRD图谱展示了Pd-NPs的立方结构,在2 θ= 40.233°、46.805°、68.288°、82.183°、86.703°处观测到(111)、(200)、(220)、(311)、(222)晶面标志的特征衍射峰(图 3d),其中,以(111)晶面占主导。通过谢乐公式对最主要衍射峰进行计算,可以获得合成的Pd-NPs亚晶尺寸[43],得到在(111)晶面观察到的Pd-NPs纳米材料尺寸为2.6 nm,这与图 3b中所给出的粒径分布基本吻合,证明了T. humireducens合成的Pd-NPs尺寸较为均匀。高分辨率的TEM图显示了合成的Pd-NPs在(111)晶面的晶格条纹(图 3e)。在XRD图谱中计算所得(111)晶面间距dhkl为2.239 7Å,晶格常数为3.879Å,发生了轻微的晶格收缩。而WANG等[23]发现的是晶格膨胀,这可能是由于所合成的Pd-NPs中掺入了杂质[44]。此外,晶格收缩也提高了Pd-NPs对H的催化活性[45]。XPS图谱显示Pd(0)的3d核心能级谱有335.5 eV和341.2 eV两个峰(图 3f),分别对应5/2和3/2自旋轨道[46];XPS中观察到的少量Pd(Ⅱ)可能是由于测样过程中造成的表面氧化形成了PdO[47]。
|
图 3 T. humireducens合成的Pd-NPs的表征 Figure 3 Characterizations of Pd-NPs synthesized by T. humireducens |
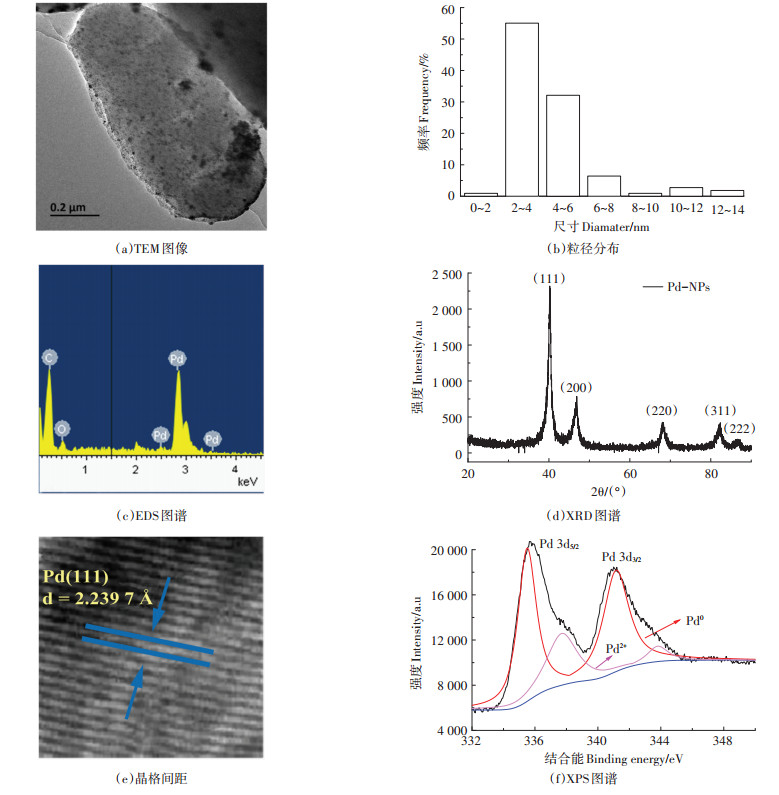
在添加了T. humireducens合成Pd-NPs的体系中,随着反应进行,含Cr(Ⅵ)溶液由黄色逐渐变为无色透明。在0、10、20、30、60、90 min对Cr(Ⅵ)浓度进行监测。紫外光谱图结果显示,350 nm处观察到最大吸收峰(图 4a),这是HCrO4-的特征峰[48-49],此峰值随着运行时间延长而逐步衰减,指示了Cr(Ⅵ)的逐步去除。在90 min的运行周期内,Pd-NPs对Cr(Ⅵ)的还原效率达到了95%。反应满足一级动力学方程(r2 = 0.969)且反应速率在0~20 min增加,20~90 min减小,这可能与其作用机理相关。过量的HCOOH逐渐占满Pd-NPs表面而被选择性分解为H2与CO2,且分解速率不断提高,直到HCOOH占满催化剂的表面,而吸附在Pd-NPs上的H2再与Cr(Ⅵ)发生反应,反应速率随着Cr(Ⅵ)浓度的降低而降低。化学合成的Pd(0)对Cr(Ⅵ)的还原效率仅为27%(图 4b)。这证明由T. humireducens合成的Pd-NPs具备高的催化活性,这可能是源于其极小的颗粒尺寸。此结果展示了T. humireducens合成的Pd-NPs优越的催化除铬性能。地下水中通常不含Pd(Ⅱ),故需额外添加,以实现微生物合成Pd-NPs,从而用于Cr(Ⅵ)污染地下水的修复。经验证明,虽然T. humireducens也可直接还原Cr(Ⅵ),但效率非常低,也难以耐受高浓度的Cr(Ⅵ),这进一步体现了使用T. humireducens制备的Pd-NPs催化去除Cr(Ⅵ)的优势。
|
图 4 T. humireducens合成的Pd-NPs催化还原铬的性能 Figure 4 The catalytic reduction of chromium by T. humireducens synthesized Pd-NPs |
收集反应体系生成的沉淀,并用XPS分析显示,Cr(Ⅲ)的2p核心能级谱在586.9 eV和577.4 eV有两个峰,分别对应1/2和3/2自旋轨道[50],Cr(Ⅲ)是沉淀的主要成分(图 4c)。说明T. humireducens合成的Pd-NPs催化Cr(Ⅵ)成功转化为Cr(Ⅲ),反应后溶液的pH上升至6.3,在此环境中,Cr(Ⅲ)可自发沉淀[51],Cr(OH)3占据主导[52],从而实现铬污染地下水的有效净化。
循环使用3个周期后,T. humireducens合成的Pd-NPs仍保持较高的催化活性(图 4d),Cr(Ⅵ)的去除率从第一个循环周期的97% 下降到第三个循环周期的84%,展示了T. humireducens合成的Pd-NPs稳定的催化性能。催化剂活性的下降可能是由于在循环过程中损失了小且轻质的Pd-NPs。
pH与初始Cr(Ⅵ)浓度对Pd-NPs的影响如图 5所示。酸性环境有利于Cr(Ⅵ)的去除(图 5a)。在pH3的环境下,Cr(Ⅵ)还原效率最大,随着溶液pH升高,Cr(Ⅵ)还原效率逐渐下降。在pH7和9的环境下,溶液中Cr(Ⅵ)浓度没有明显变化。随着Cr(Ⅵ)初始浓度的升高,Cr(Ⅵ)还原效率逐渐降低(图 5b)。当Cr(Ⅵ)初始浓度为0.1 mmol·L-1和0.25 mmol·L-1时,Cr(Ⅵ)被完全去除。然而,当进一步增大Cr(Ⅵ)浓度至0.5 mmol·L-1和1.0 mmol·L-1时,Cr(Ⅵ)的还原效率分别下降到了94%和和84%。有研究表明,当甲酸含量一定时,可还原的Cr(Ⅵ)的量是固定的,且较高浓度的Cr(Ⅵ)在反应中可更快地消耗氢离子,加速了溶液pH的升高,进一步抑制了反应的进行[53]。同时,较高的pH也影响了Pd-NPs的表面电位,使得催化剂对甲酸或Cr(Ⅵ)的吸附能力下降,从而对反应产生了抑制作用[54]。

|
图 5 影响因素对Pd-NPs催化除铬的作用 Figure 5 Impacts of influencing factors for catalytic reduction of chromium by Pd-NPs |
(1)首次证明了T. humireducens能够在24 h内快速制得尺寸集中分布在2~6 nm、分散性良好的PdNPs。
(2)增加Pd(Ⅱ)、HCOONa初始浓度及微生物接种量,或弱酸性环境条件均能加快T. humireducens产出Pd-NPs的速率。
(3)0.5 mg·mL-1 T. humireducens合成的Pd-NPs能在1.5 h内还原95% 的Cr(Ⅵ),相比于化学合成的Pd(0)具有极高的催化性能,可用于铬污染地下水的有效修复。
(4)T. humireducens合成的Pd-NPs催化性能较为稳定,在循环使用3个周期后仍保持较高的除铬性能。
| [1] |
GENCHI G, LAURIA G, CATALANO A, et al. The double face of metals: The intriguing case of chromium[J]. Applied Sciences, 2021, 11(2): 638. DOI:10.3390/app11020638 |
| [2] |
VELMA V, VUTUKURU S S, TCHOUNWOU P B. Ecotoxicology of hexavalent chromium in freshwater fish: A critical review[J]. Reviews on Environmental Health, 2009, 24(2): 129-145. |
| [3] |
SHI J, ZHANG B, QIU R, et al. Microbial chromate reduction coupled to anaerobic oxidation of elemental sulfur or zerovalent iron[J]. Environmental Science & Technology, 2019, 53(6): 3198-3207. |
| [4] |
SUN H, BROCATO J, COSTA M. Oral chromium exposure and toxicity[J]. Current Environmental Health Reports, 2015, 2(3): 295-303. DOI:10.1007/s40572-015-0054-z |
| [5] |
SAHA R, NANDI R, SAHA B. Sources and toxicity of hexavalent chromium[J]. Journal of Coordination Chemistry, 2011, 64(10): 1782-1806. DOI:10.1080/00958972.2011.583646 |
| [6] |
HAUSLADEN D M, ALEXANDER-OZINSKAS A, MCCLAIN C, et al. Hexavalent chromium sources and distribution in California groundwater[J]. Environmental Science & Technology, 2018, 52(15): 8242-8251. |
| [7] |
HASHEM M A, ISLAM A, MOHSIN S, et al. Green environment suffers by discharging of high-chromium-containing wastewater from the tanneries at Hazaribagh, Bangladesh[J]. Sustainable Water Resources Management, 2015, 1(4): 343-347. DOI:10.1007/s40899-015-0033-4 |
| [8] |
BILICI Z, IŞIK Z, AKTAŞ Y, et al. Photocatalytic effect of zinc oxide and magnetite entrapped calcium alginate beads for azo dye and hexavalent chromium removal from solutions[J]. Journal of Water Process Engineering, 2019, 31: 100826. DOI:10.1016/j.jwpe.2019.100826 |
| [9] |
SUGANYA E, SARANYA N, SIVAPRAKASAM S, et al. Experimentation on raw and phosphoric acid activated Eucalyptuscamadulensis seeds as novel biosorbents for hexavalent chromium removal from simulated and electroplating effluents[J]. Environmental Technology & Innovation, 2020, 19: 100977. |
| [10] |
BHATTACHARYA M, SHRIWASTAV A, BHOLE S, et al. Processes governing chromium contamination of groundwater and soil from a chromium waste source[J]. ACS Earth and Space Chemistry, 2020, 4(1): 35-49. DOI:10.1021/acsearthspacechem.9b00223 |
| [11] |
WANG T, LIU Y Y, WANG J J, et al. In-situ remediation of hexavalent chromium contaminated groundwater and saturated soil using stabilized iron sulfide nanoparticles[J]. Journal of Environmental Management, 2019, 231: 679-686. |
| [12] |
SADIK O A, NOAH N M, OKELLO V A, et al. Catalytic reduction of hexavalent chromium using palladium nanoparticles: An undergraduate nanotechnology laboratory[J]. Journal of Chemical Education, 2014, 91(2): 269-273. DOI:10.1021/ed300229r |
| [13] |
REGAN J, DUSHAJ N, STINCHFIELD G. Reducing hexavalent chromium to trivalent chromium with zero chemical footprint: Borohydride exchange resin and a polymer-supported base[J]. ACS Omega, 2019, 4(7): 11554-11557. DOI:10.1021/acsomega.9b01194 |
| [14] |
高园园, 周启星. 纳米零价铁在污染土壤修复中的应用与展望[J]. 农业环境科学学报, 2013, 32(3): 418-425. GAO Y Y, ZHOU Q X. Application of nanoscale zero-valent iron to contaminated soil remediation: A review[J]. Journal of Agro-Environment Science, 2013, 32(3): 418-425. |
| [15] |
ISLAM J B, FURUKAWA M, TATEISHI I, et al. Photocatalytic reduction of hexavalent chromium with nanosized TiO2 in presence of formic acid[J]. ChemEngineering, 2019, 3(2): 33. DOI:10.3390/chemengineering3020033 |
| [16] |
LV X S, ZHANG Y L, FU W Y, et al. Zero-valent iron nanoparticles embedded into reduced graphene oxide-alginate beads for efficient chromium(Ⅵ) removal[J]. Journal of Colloid and Interface Science, 2017, 506: 633-643. DOI:10.1016/j.jcis.2017.07.024 |
| [17] |
TRIPATHI R M, CHUNG S J. Reclamation of hexavalent chromium using catalytic activity of highly recyclable biogenic Pd(0) nanoparticles[J]. Scientific Reports, 2020, 10(1): 640. DOI:10.1038/s41598-020-57548-z |
| [18] |
KONDA S K, CHEN A. Palladium based nanomaterials for enhanced hydrogen spillover and storage[J]. Materials Today, 2016, 19(2): 100-108. DOI:10.1016/j.mattod.2015.08.002 |
| [19] |
FAROOQI Z H, AKRAM M W, BEGUM R, et al. Inorganic nanoparticles for reduction of hexavalent chromium: Physicochemical aspects[J]. Journal of Hazardous Materials, 2021, 402: 123535. DOI:10.1016/j.jhazmat.2020.123535 |
| [20] |
CHEN A, OSTROM C. Palladium-based nanomaterials: Synthesis and electrochemical applications[J]. Chemical Reviews, 2015, 115(21): 11999-12044. DOI:10.1021/acs.chemrev.5b00324 |
| [21] |
MOHANPURIA P, RANA N K, YADAV S K. Biosynthesis of nanoparticles: Technological concepts and future applications[J]. Journal of Nanoparticle Research, 2008, 10(3): 507-517. DOI:10.1007/s11051-007-9275-x |
| [22] |
LLOYD J R, YONG P, MACASKIE L E. Enzymatic recovery of elemental palladium by using sulfate-reducing bacteria[J]. Applied Environmental Microbiology, 1998, 64(11): 4607-4609. DOI:10.1128/AEM.64.11.4607-4609.1998 |
| [23] |
WANG W, ZHANG B G, LIU Q S, et al. Biosynthesis of palladium nanoparticles using Shewanella loihica PV-4 for excellent catalytic reduction of chromium(Ⅵ)[J]. Environmental Science: Nano, 2018, 5(3): 730-739. DOI:10.1039/C7EN01167A |
| [24] |
MA C, YU Z, LU Q, et al. Anaerobic humus and Fe(Ⅲ) reduction and electron transport pathway by a novel humus-reducing bacterium, Thauera humireducens SgZ-1[J]. Applied Microbiology and Biotechnology, 2015, 99(8): 3619-3628. DOI:10.1007/s00253-014-6254-x |
| [25] |
YANG G Q, ZHANG J, KWON S W, et al. Thauera humireducens sp.nov., a humus-reducing bacterium isolated from a microbial fuel cell[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(3): 873-878. |
| [26] |
MA C, YANG G, ZHANG Q, et al. Complete genome of Thauera humireducens SgZ-1, a potential bacterium for environmental remediation and wastewater treatment[J]. Journal of Biotechnology, 2016, 225: 59-60. DOI:10.1016/j.jbiotec.2016.03.029 |
| [27] |
WANG S, ZHANG B G, DIAO M H, et al. Enhancement of synchronous bio-reductions of vanadium(Ⅴ) and chromium(Ⅵ) by mixed anaerobic culture[J]. Environmental Pollution, 2018, 242(Pt A): 249-256. |
| [28] |
NAGARAJ P, BHAT G. Spectrophotometric determination of palladium by the coloration with 2-mercaptoethanol[J]. Research Journal of Chemical Sciences, 2015, 5(9): 19-26. |
| [29] |
ZHOU C, WANG Z, ONTIVEROS-VALENCIAA A, et al. Coupling of Pd nanoparticles and denitrifying biofilm promotes H2-based nitrate removal with greater selectivity towards N2[J]. Applied Catalysis B: Environmental, 2017, 206: 461-470. DOI:10.1016/j.apcatb.2017.01.068 |
| [30] |
LENGKE M F, FLEET M E, SOUTHAM G. Synthesis of palladium nanoparticles by reaction of filamentous cyanobacterial biomass with a palladium(Ⅱ) chloride complex[J]. Langmuir, 2007, 23(17): 8982-8987. DOI:10.1021/la7012446 |
| [31] |
ARSIYA F, SAYADI M H, SOBHANI S. Green synthesis of palladium nanoparticles using Chlorella vulgaris[J]. Materials Letters, 2017, 186: 113-115. DOI:10.1016/j.matlet.2016.09.101 |
| [32] |
WU R R, TIAN X C, XIAO Y, et al. Selective electrocatalysis of biofuel molecular oxidation by palladium nanoparticles generated on Shewanella oneidensis MR-1[J]. Journal of Materials Chemistry A, 2018, 6(23): 10655-10662. DOI:10.1039/C8TA01318G |
| [33] |
SRIRAMULU M, SUMATHI S. Biosynthesis of palladium nanoparticles using Saccharomyces cerevisiae extract and its photocatalytic degradation behaviour[J]. Advances in Natural Sciences: Nanoscience and Nanotechnology, 2018, 9(2): 025018. DOI:10.1088/2043-6254/aac506 |
| [34] |
NIU Z Y, JIA Y T, CHEN Y C, et al. Positive effects of bio-nano Pd (0) toward direct electron transfer in Pseudomona putida and phenol biodegradation[J]. Ecotoxicology and Environmental Safety, 2018, 161: 356-363. DOI:10.1016/j.ecoenv.2018.06.011 |
| [35] |
ELAHIAN F, HEIDARI R, CHARGHAN V R, et al. Genetically modified Pichia pastoris, a powerful resistant factory for gold and palladium bioleaching and nanostructure heavy metal biosynthesis[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2020, 48(1): 259-265. DOI:10.1080/21691401.2019.1699832 |
| [36] |
TAN L, JONES T R, POITRAS J, et al. Biochemical synthesis of palladium nanoparticles: The influence of chemical fixatives used in electron microscopy on nanoparticle formation and catalytic performance[J]. Journal of Hazardous Materials, 2020, 398: 122945. DOI:10.1016/j.jhazmat.2020.122945 |
| [37] |
CHE C L, CHEN X Z, WANG H M, et al. A novel 6-quinoxalinamine-based fluorescent probe for real-time detection of palladium (Ⅱ) ion in pure water and bio-imaging[J]. New Journal of Chemistry, 2018, 42(15): 12773-12778. DOI:10.1039/C8NJ01614C |
| [38] |
KOTTENHAHN P, SCHUCHMANN K, MÜLLER V. Efficient whole cell biocatalyst for formate-based hydrogen production[J]. Biotechnol Biofuels, 2018, 11(1): 93. DOI:10.1186/s13068-018-1082-3 |
| [39] |
SØBJERG L S, LINDHARDT A T, SKRYDSTRUP T, et al. Size control and catalytic activity of bio-supported palladium nanoparticles[J]. Colloids and Surfaces B: Biointerfaces, 2011, 85(2): 373-378. DOI:10.1016/j.colsurfb.2011.03.014 |
| [40] |
NOGUCHI K, RIGGINS D P, ELDAHAN K C, et al. Hydrogenase-3 contributes to anaerobic acid resistance of Escherichia coli[J]. PLoS One, 2010, 5(4): e10132. DOI:10.1371/journal.pone.0010132 |
| [41] |
RANJBAR M, FARDINDOOST S, MAHDAVI S M, et al. Palladium nanoparticle deposition onto the WO3 surface through hydrogen reduction of PdCl2: Characterization and gasochromic properties[J]. Solar Energy Materials and Solar Cells, 2011, 95(8): 2335-2340. DOI:10.1016/j.solmat.2011.04.002 |
| [42] |
VEERAKUMAR P, THANASEKARAN P, LIN K C, et al. Biomass derived sheet-like carbon/palladium nanocomposite: An excellent opportunity for reduction of toxic hexavalent chromium[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(6): 5302-5312. |
| [43] |
AHMAD N, SHARMA S, ALAM M K, et al. Rapid synthesis of silver nanoparticles using dried medicinal plant of basil[J]. Colloids Surf B Biointerfaces, 2010, 81(1): 81-86. DOI:10.1016/j.colsurfb.2010.06.029 |
| [44] |
LAMBER R, WETJEN S, JAEGER N I. Size dependence of the lattice parameter of small palladium particles[J]. Physical Review B, 1995, 51(16): 10968-10971. DOI:10.1103/PhysRevB.51.10968 |
| [45] |
KHANUJA M, MEHTA B R, AGAR P, et al. Hydrogen induced lattice expansion and crystallinity degradation in palladium nanoparticles: Effect of hydrogen concentration, pressure, and temperature[J]. Journal of Applied Physics, 2009, 106(9): 093515. DOI:10.1063/1.3253733 |
| [46] |
PACHFULE P, PANDA M K, KANDAMBETH S, et al. Multifunctional and robust covalent organic framework-nanoparticle hybrids[J]. Journal of Materials Chemistry A, 2014, 2(21): 7944-7952. DOI:10.1039/C4TA00284A |
| [47] |
NYHOLM R, MARTENSSON N. Core level binding energies for the elements Zr-Te(Z=40-52)[J]. Journal of Physics C: Solid State Physics, 1980, 13(11): L279-L284. DOI:10.1088/0022-3719/13/11/008 |
| [48] |
BUEGE I J, HUG S J. Influence of organic ligands on chromium(Ⅵ) reduction by iron(Ⅱ)[J]. Environmental Science & Technology, 1998, 32(14): 2092-2099. |
| [49] |
HACHAIR A S, HOFMANN A. Hexavalent chromium quantification in solution: Comparing direct UV -visible spectrometry with 1, 5-diphenylcarbazide colorimetry[J]. Comptes Rendus Chimie, 2018, 21(9): 890-896. |
| [50] |
CHEN Y N, AN D, SUN S N, et al. Reduction and removal of chromium(Ⅵ) in water by powdered activated carbon[J]. Materials, 2018, 11(2): 269. DOI:10.3390/ma11020269 |
| [51] |
HUANG L, YU C H, HOPKE P K, et al. Measurement of soluble and total hexavalent chromium in the ambient airborne particles in New Jersey[J]. Aerosol and Air Quality Research, 2014, 14(7): 1939-1949. DOI:10.4209/aaqr.2013.10.0312 |
| [52] |
张定一, 林成谷, 阎翠萍. 水体铬污染的防治[J]. 农业环境保护, 1991, 10(2): 56-59. ZHANG D Y, LIN C G, YAN C P. Studies on the conditions for Cr removement form water[J]. Agro-environmental Protection, 1991, 10(2): 56-59. |
| [53] |
ZHANG L L, GUO Y L, IQBAL A, et al. Palladium nanoparticles as catalysts for reduction of Cr(Ⅵ) and Suzuki coupling reaction[J]. Journal of Nanoparticle Research, 2017, 19(4): 150. DOI:10.1007/s11051-017-3829-3 |
| [54] |
POURMORTAZAVI S M, SAHEBI H, ZANDAVAR H, et al. Fabrication of Fe3O4 nanoparticles coated by extracted shrimp peels chitosan as sustainable adsorbents for removal of chromium contaminates from wastewater: The design of experiment[J]. Composites Part B: Engineering, 2019, 175: 107130. |
 2021, Vol. 40
2021, Vol. 40