2. 西北农林科技大学黄土高原土壤侵蚀与旱地农业国家重点实验室, 陕西 杨凌 712100
2. State Key Laboratory of Soil Erosion and Dryland Farming on Loess Plateau, Northwest A&F University, Yangling 712100, China
土壤是陆地生态系统中最大的碳库,碳储量约2 500 Pg,约是大气碳库(760 Pg)的3.3倍,约是陆地生物量的4.5倍[1],因此,探索土壤碳库功能并采取合理的管理措施,对于调控全球碳汇具有重要意义[2]。对于农业生态系统而言,土壤碳库容量决定着农田土壤质量和农业可持续发展程度[3],而农业管理措施是影响农田土壤有机碳(Soil organic carbon,SOC)含量的重要因素。SOC对土壤的物理、化学和生物特性都有影响[4-6],是土壤肥力的关键属性,常被认为是评价土壤质量的重要指标,但总有机碳(Total organic carbon,TOC)并不是土壤质量变化的敏感指标[7]。活性有机碳(Labile organic carbon,LOC)由土壤中含碳的化学和生物组分共同组成,在TOC中比例较小,但它可以在短时间内降解,且直接作为微生物活动的能量来源,并参与土壤生物化学转化和土壤养分循环,对碳输入和农业管理措施具有高度响应,因此,被认为是SOC变化的初始和敏感指标[8-10]。
土壤有机质的矿化过程主要是非生物机制氧化或代谢过程的生物催化,因此,最初用于分析土壤有机质的方法是基于氧化途径的,如Walkley-Black标准氧化法[11]。由于氧化过程引发了碳从有机形态到无机形态(CO2)的变化,因此土壤有机质稳定性研究变得至关重要,出现了利用氧化性梯度递减的方法,如KMnO4氧化法[12]和改进的Walkley - Black氧化法[13];由于微生物受含碳底物的生化特征影响,而且许多指标(如C/N)被提出都是基于这一观点,因此酸水解方法应运而生[14]。这些测定方法可以将土壤有机碳库分为不同的组分,它们不仅可以在不同程度上反映SOC的有效性,也可以通过相关碳指数来系统监测土壤质量的动态变化[15-16]。碳库管理指数(Carbon management index,CMI)被认为是定量评价土壤质量指数的最有效工具[15, 17]。固碳指数(Recalcitrant index,RI)可以有效评估农业管理措施对土壤惰性有机碳(Recalcitrant organic carbon,ROC)的影响[18]。CMI可以作为农业管理措施引起土壤质量变化的早期指标,用于评估和改进现有农业管理措施,也有助于增加土壤有机碳库和改善土壤质量[17]。ROC是土壤有机碳库的稳定组分,可以在土壤中长期停留,而且将碳固定在土壤中也是一种既能提高粮食产量又能改善土壤质量的双赢策略[19]。
SOC组分的测定包括不同的实验方法和限制因素,深入了解各测定方法分类SOC组分的特点是正确解释实验结果的关键。当前针对土壤有机碳库分类的研究已有很多[20-23],但大多未能清楚阐释各测定方法分类SOC组分的优缺点、适用范围及其与碳指数之间的关系。本文旨在在前人研究的基础上,比较不同测定方法分类SOC组分的异同点,梳理SOC组分与碳指数之间的关系,并在此基础上明确了需进一步研究的重点问题,为揭示土壤碳循环机理、监测土壤质量动态变化和提高土壤固碳潜力提供参考。
1 SOC及其组分化学测定方法 1.1 Walkley-Black标准氧化法 1.1.1 原理Walkley和Black[11]在1934年最先利用K2Cr2O7-H2SO4溶液测定SOC。该方法原理是在浓硫酸稀释放热条件下,用过量的K2Cr2O7-H2SO4溶液氧化SOC,剩余的重铬酸钾用标准硫酸亚铁滴定,由所消耗标准硫酸亚铁的量计算出TOC。
1.1.2 特点和适用范围Walkley-Black氧化法广泛适用于土壤、植物、岩石等固体样品的SOC含量测定。与干烧法相比,干烧法工序繁琐而且需要特殊的设备,而该方法操作简便、快速,有足够的准确度,适用于大批量样品的分析,但该方法只能氧化77% 的SOC,且无法细分SOC组分。
1.2 KMnO4氧化法 1.2.1 原理Logninow等[12]最早于1987年提出利用不同浓度(33~333 mmol·L-1)KMnO4对SOC的氧化敏感性不同的原理来分选SOC组分。经过多年研究,33 mmol·L-1和333 mmol·L-1的KMnO4最终被作为一种温和的氧化剂来模拟土壤有机质的酶分解[15, 24],并将TOC划分为极易氧化有机碳(Very easily oxidizable carbon,VEO)、易氧化有机碳(Easily oxidizable carbon,EO)、可氧化有机碳(Oxidizable carbon,O)3个组分。
组分1(CVEO):被33 mmol·L-1 KMnO4氧化的SOC。
组分2(CEO):被333 mmol·L-1 KMnO4和33 mmol·L-1 KMnO4氧化的SOC的差值。
组分3(CO):TOC和333 mmol·L-1 KMnO4条件下被氧化的SOC的差值。
Lefroy等[24]研究发现,在耕作土壤中被不同浓度KMnO4氧化的SOC是一种更敏感的指标,其中能被333 mmol·L-1 KMnO4氧化的碳占比最大,间接表明这部分碳可能是活性组分。Blair等[15]在1995年修正了利用单一浓度KMnO(4 333 mmol·L-1)氧化SOC的过程,并将SOC划分为活性碳库(Labile carbon pool,LCP)和惰性碳库(Recalcitrant carbon pool,RCP),其中,在1 h内能被333 mmol·L-1 KMnO4氧化的SOC被称作活性有机碳(Labile organic carbon,LOC),而不能被氧化的部分被称作惰性有机碳(Recalcitrant organic carbon,ROC),并由此提出了碳库指数(Carbon pool index,CPI)和CMI的计算方法。LOC的快速测定,使得CMI被提出和易被计算。CMI可以实现对土壤碳库的动态监测,不仅可以反映土壤碳库对管理措施的敏感响应,也可以深入分析气候变化、土壤利用方式等因素对CMI的影响,提高了对土壤质量的监控和管理水平[15, 21]。
1.2.2 特点和适用范围KMnO4氧化法具有许多优点:KMnO4的深紫色能够作为自己的指示剂;比微生物量碳(Microbial biomass carbon,MBC)测定方法操作简单、快捷,无需预培养,受环境影响小,适用于大批样品的分析;与TOC相比,333 mmol·L-1 KMnO4确定的LOC与土壤氮、磷等养分和土壤理化性质相关性更高。但该方法也有要求实验器皿洁净度高和注意避光的缺点,而且,333 mmol·L-1 KMnO4溶液也被认为浓度过于强烈,对于检测某些土壤碳的活性变化不够敏感。对此,有研究者提出降低浓度的解决办法[25-26]。Weil等[26]使用了不同浓度(20~333 mmol·L-1)的KMnO4来测定LOC,结果显示,稀释浓度越低(20~33 mmol·L-1),对不同管理措施的敏感性越高,其中,20 mmol·L-1 KMnO4在实验室和野外利用手持色度计均产生一致的结果。这种在2 min内被20 mmol·L-1 KMnO4氧化的SOC组分被称为高锰酸钾极易氧化碳(Permanganate oxidizable carbon,POX-C),POX-C与土壤微生物活性的大多数指标以及颗粒有机碳(Particulate organic carbon,POC)和SOC均显著相关[27]。除浓度外,KMnO4氧化法也存在如受反应时间和土壤样品水分含量影响[25-26]以及KMnO4在光照下分解或与MnO2反应等诸多问题[15]。
KMnO4与土壤中不同有机化合物的反应性,可以反映KMnO4氧化法的适用范围。Blair等[15]的研究表明,13%~28% 的SOC可被333 mmol·L-1 KMnO4氧化。Tirol-Padre等[28]的研究显示,333 mmol·L-1 KMnO4不能氧化纤维素,但能够氧化部分木质素;而33 mmol·L-1 KMnO4与糖、氨基酸等有机酸反应缓慢,但对含有乙二醇官能团的化合物氧化速度较快。
虽然有研究显示LOC与MBC和POC相关性较好[29],但Tirol-Padre等[28]报道了LOC与MBC或水溶性碳(Water solution organic carbon,WSOC)之间仅存在弱相关性,认为该方法不是测定LOC的可靠方法。此外,芳香族结构和腐殖质与KMnO4发生反应的事实[28, 30-31],也使Tirol-Padre和Ladha对该方法分离SOC活性组分和稳定组分的有效性产生了怀疑。他们认为,由于缺少LOC与MBC和WSOC相关的证据,仅与总碳显著相关,333 mmol·L-1 KMnO4不能有效度量LOC,但能够代表总碳中的稳定组分。
1.3 改进的Walkley-Black氧化法 1.3.1 原理Walkley[13]最早于1947年提出通过梯度增加浓硫酸浓度来比较在增加氧化条件下提取的不同的可氧化SOC,该方法利用了不同浓度浓硫酸产生的反应热不同,导致SOC的氧化程度不同的原理。Chan等[7]在2001年研究不同牧场可氧化有机碳组分与土壤质量的关系时,分别用酸-水溶液比为0.5∶1、1∶1和2∶1(对应硫酸浓度为6、9、12 mol·L-1)的浓硫酸测定可氧化碳的量,将TOC分为4个氧化性降低的部分,并定义为:极高活性有机碳(Very labile carbon,VL)、活性有机碳(Labile carbon,L)、低活性有机碳(Less labile carbon,LL)和非活性有机碳(Non-labile carbon,NL)。
第1部分(CVL):被6 mol·L-1 H2SO4氧化的SOC。
第2部分(CL):9 mol·L-1 H2SO4和6 mol·L-1 H2SO4条件下被氧化的SOC的差值。
第3部分(CLL):12 mol·L-1 H2SO4和9 mol·L-1 H2SO4条件下被氧化的SOC的差值。
第4部分(CNL):TOC与12 mol·L-1 H2SO4氧化的SOC的差值。
前两部分共同构成LCP,后两部分构成RCP[32]。
1.3.2 特点和适用范围改进的Walkley-Black氧化法相较于WalkleyBlack标准氧化法只需使用一半的硫酸,同时可以将SOC细分为4个组分。与KMnO4氧化法相比,测定的SOC组分是研究土壤质量参数变化更敏感的指标[7],有研究表明[33],这两种方法测得的SOC活性组分均是以新鲜植物残渣转变的稳定有机物且周转时间小于10 a为特征的有机物。
一般情况下,LCP比RCP的损失要严重得多,这是因为LOC参与碳循环并释放营养物质,而且土壤物理因素对活性组分的影响也极为重要[34]。随着农田管理方式的改变,LCP变化相对较快,改进的Walkley-Black氧化法是研究土壤团聚体碳库及在特定管理实践下测定LCP和计算RI的有效工具。然而,土壤有机质是一种异构的复杂实体,由多种具有不同功能和生物利用度的化合物组成[35],化学氧化测定过程破坏了SOC组分的生化稳定性。
1.4 酸水解法 1.4.1 原理酸水解法可以有效研究土壤有机质的生化抗降解性。Berendse等[36]在1985年提出土壤中未分解植物残体可以分为3个基本库:不被木质素掩蔽的游离碳水化合物,被木质素掩蔽的碳水化合物(主要是纤维素),木质素本身。未分解的植物残体中的木质素通常被量化为克拉森木质素,即浓硫酸水解后的残渣;而大多数稳定有机聚合物(木栓脂、树脂、蜡等)也具有耐酸水解的特性。因此,强酸的侵蚀可以作为分离SOC活性组分和稳定组分的标准[14]。Rovira等[14]于2002年利用酸水解法将土壤有机碳库分为两个活性程度不同的组分(不稳定组分1 Labile carbon pool 1,LCP1;不稳定组分2 Labile carbon pool 2,LCP2)和一个稳定组分(Recalcitrant carbon pool,RCP)。
LCP1:由2.5 mol·L-1 H2SO4在105 ℃水解30 min得到。
LCP2:由13 mol·L-1 H2SO4在室温下水解12 h,然后在105 ℃下用1 mol·L-1 H2SO4水解3 h得到。
RCP:未水解的残渣。
不稳定组分1和不稳定组分2共同构成LCP,稳定组分构成RCP。
1.4.2 特点和适用范围酸水解法可以将土壤有机碳库分为3个组分,但操作较为繁琐。Rovira等[14]的研究表明,根据酸水解技术,有机质的显著下降只发生在易分解的植物材料上,因此可以有效评价植物残基的分解程度。
LCP1主要由来自于植物细胞或微生物细胞的非纤维素多糖组成,LCP2的主要成分是植物源纤维素,这些化合物具有较高的生物利用度,对环境变化具有敏感性[37-38]。因此,SOC活性组分通常被认为是土地管理措施变化前后有机碳动态变化的早期指标[39-40]。由于RCP的主要化合物是木质素、脂肪、蜡、树脂、亚磷脂和腐殖质等高度耐生物降解的化合物[37-38],SOC的化学组成和分子结构的抗逆性对SOC固定时间起关键作用,因此,SOC中RCP所占比例越高,其生物化学抗性越强[41-42]。通过改变土壤LCP和RCP的大小,可以改变SOC的生化抗性程度,进而影响SOC的固碳时长[43]。因此,可以利用该方法评估土壤活性碳组分和惰性碳组分对农业管理措施的响应,也可以通过计算RI更好地了解农业管理措施在区域和全球碳固定中所起的作用。
2 SOC组分与碳指数 2.1 SOC活性组分与碳库管理指数(CMI)碳库管理指数是由碳库指数(Carbon pool index,CPI)和碳库活度指数(Lability index,LI)经过一系列计算得出的,计算公式如下[15]:
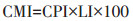
|
其中,CPI=样品总碳含量/参照点土壤总碳含量;LI=样品土壤碳库活度/参照点土壤碳库活度;碳库活度=土壤活性有机碳含量/土壤惰性有机碳含量。
一般来说,活性有机碳是指能被333 mmol·L-1 KMnO4氧化的有机碳,但改进的Walkley-Black氧化法对于可氧化碳更为细致的划分,使得LI能够被更加科学地计算。Majumder等[44]以改进的Walkley -Black氧化法的3个碳组分(CVL、CL和CLL)为基础,根据其氧化难易程度配以各自权重3、2、1后相加,得到新的LI计算公式:
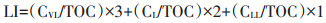
|
显然,这也使得CMI的计算更加准确。由于化学氧化可能会氧化一些被矿物吸附的有机物,而这些物质被认为是不能用于生物活动的,而且化学氧化是一种表面氧化,大块颗粒物内的一些不稳定化合物可能不会被氧化。对于化学氧化法的这些限制,Vieira等[45]提出利用密度分离法和粒径分离法两种物理分离法测定LOC含量,即轻组有机碳(Light fraction organic carbon,LFOC)和POC。虽然化学分类法和物理分类法的原理完全不同,而且这两种方法测定的LOC含量也不完全吻合,但其相同之处在于两种方法都提供了一个评价LOC的相对指标,可以对管理措施进行比较评估,进一步完善了CMI评价体系[45]。
2.2 SOC惰性组分与固碳指数(RI)RI是土壤惰性碳库(惰性碳库指不能被333 mmol·L-1 KMnO4氧化的有机碳)和总有机碳库的比值,该指数可以有效评估不同管理措施对土壤碳稳定性的影响[46]。但根据改进的Walkley-Black氧化法所分类的SOC活性组分和惰性组分,可以推导出两种SOC固碳指数RI1和RI2[46]:
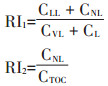
|
Jat等[47]研究表明,RI1在表层土壤中的值低于深层土壤,而RI2则相反;RI1在不同处理之间和不同深度间均呈现显著差异,而RI2没有任何显著差异。这表明,RI1比RI2敏感。RI也与土壤中粉黏粒含量相关,粉黏粒会将SOC化合物吸附在团聚体表面,形成稳定SOC[48];低土壤肥力和去除作物残茬导致微生物降解有效性降低,也是提高RI的可能原因[49];在较低层的稳定碳库中,较高稳定碳含量可能是由于SOC通过土壤剖面向下移动时插入黏土晶格层所致[50]。
相对于改进的Walkley-Black氧化法,酸水解法不仅可以用于计算固碳指数(RIC),也可以用于计算固氮指数(RIN)[14]。
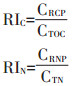
|
式中:CRCP为未水解的碳,CTOC为土壤总有机碳,CRNP为未水解的氮,CTN为土壤总氮。
3 基于文献计量学的对比分析为有效分析以上3种SOC组分测定方法的引用情况,本研究从Web of Science文献数据库检索这3种测定方法报道文献(KMnO4氧化法[15]、改进的Walkley-Black氧化法[7]和酸水解法[14])在近19年(2001—2019)的年被引频次(图 1)。由图 1可知,近19年来3种测定方法引用量均成上升趋势,引用量顺序为KMnO4氧化法>改进的Walkley-Black氧化法≈酸水解法;近3年来的引用趋势与整体趋势不同,其引用量顺序为KMnO4氧化法>改进的Walkley-Black氧化法>酸水解法。该结果大致可以表明,KMnO4氧化法占绝对优势,而另外两种方法在近几年也被越来越多的研究者认可。
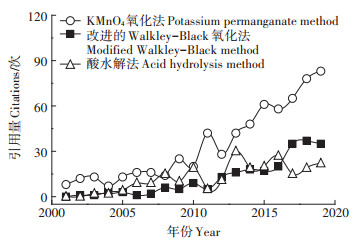
|
图 1 近19年3种有机碳组分测定方法被引频次趋势 Figure 1 Citation trend of the three organic carbon component determination methods in recent 19 years |
为比较近年来利用3种SOC组分测定方法计算CMI和RI的引用趋势,利用Web of Science数据库对引用3种SOC组分测定方法施引文献结果进行检索,设定检索时间“2010—2019”,分别选择“carbon management index”和“carbon sequestration”为关键词进行检索,并对检索结果进行甄别,分别记录3种方法在2010—2019年用于CMI计算和固碳研究的文献数量(图 2)。由图 2a可知,对于CMI的计算,KMnO4氧化法的引用量远高于其他两种方法,但从2017年起利用改进的Walkley-Black氧化法计算CMI的研究开始逐渐增多。由图 2b可知,对于土壤固碳研究,3种方法使用量均在逐渐上升,其中,改进的Walkley-Black氧化法的增长速度最快,引用量已超过KMnO4氧化法。酸水解法在CMI计算和土壤固碳研究中的引用量均低于KMnO4氧化法和改进的Walkley-Black氧化法。这表明,KMnO4氧化法在计算CMI或评价LOC的研究中认可度较高,改进的Walkley-Black氧化法在碳固定研究中的认可度较高,而酸水解法在评价LOC和碳固定研究中引用量均相对较少。
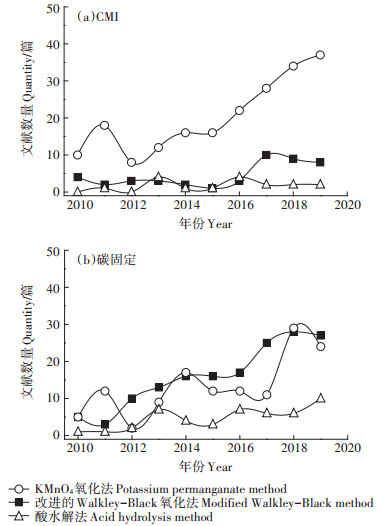
|
图 2 近10年3种有机碳组分测定方法与CMI和碳固定相关的施引文献数量 Figure 2 Number of citing articles related to CMI and carbon sequestration by the three organic carbon fraction determination methods in the past 10 years |
SOC活性组分被认为在许多与土壤生产力和环境恢复有关的土壤功能中起主要作用,可以作为反映土壤质量的综合指标。现有SOC组分化学测定方法有效区分了SOC的活性组分和惰性组分。综合以上研究结果可知:KMnO4氧化法适用于LOC的测定和CMI的计算,且测定POX-C时能够有效规避该方法的多数缺点;改进的Walkley-Black氧化法适用于土壤固碳研究和CMI的加权计算;酸水解法适用于以探究SOC生化稳定性为目标的SOC活性组分和稳定组分测定。
4.2 展望根据现有研究结果及进展,围绕SOC活性组分动态变化对农业管理措施的响应特点、提高农业管理措施对土壤ROC的固定能力以及如何建立更科学的碳指数或模型等重点问题,未来应该在以下几个方面深入研究:
(1)实现测定方法的标准化,依据农业管理措施合理整合使用不同方法。虽然SOC组分的测定方法较多,但部分方法没有统一的标准,如KMnO4氧化法在20~333 mmol·L-1的不同浓度下均可行,而且,反应时间、土壤含水量、光照强度等均会对测定结果产生影响。农业管理措施也会影响SOC组分的含量,如施用有机肥会增加SOC,而耕作则会减少SOC,而且物理、化学和生物分类方法均有自身的优点和缺点,在分析研究条件和研究目标后,从中选择不同的方法可以实现优势互补,也为研究土壤碳循环提供了一个新思路。
(2)完善SOC组分测定方法,定量比较区分不同SOC组分。当前,SOC组分的测定方法较多,表面上看各方法的机理和目标均不同,但实际所测得的各有机组分存在着诸多交叉和重叠,如以氧化效率区分的SOC组分与以化学组成区分的SOC组分在量上的关系仍不清楚,因此,定量区分各有机组分是解决LOC转化研究问题的关键。除了量化比较各有机组分外,既可以利用同位素示踪技术追踪碳元素在土壤碳库中的迁移转化,也可以选择如磷脂脂肪酸等具有特异性和稳定性的标记物来区分SOC来源,并不断探索新的测定方法和技术。
(3)开展表层土壤固碳潜力研究,加强深层土壤固碳机理研究,结合“3S”技术评估区域土壤固碳潜力。农田土壤固碳潜力高,因为在大多数耕地中已观察到表层SOC储量明显枯竭,但由于固碳潜力受到土壤环境和区域环境差异影响,因此难以合理量化估测。应当在土壤碳饱和假说基础上建立土壤固碳潜力评估体系,系统比较各种农业管理措施下的固碳潜力,并选取合适的农业措施,以提高表层土壤碳储量。虽然超过50%的碳位于30 cm以上的表层土壤中,但深层土壤碳的平均存在时间更长。但在有利于微生物活动的环境变化下(如温度升高或LOC输入),深层土壤碳和在表层一样容易分解,因此,深入研究深层土壤固碳机理和影响因素有助于避免深层土壤碳的释放。定量评估可能影响固碳潜力的主要环境参数,在此基础上利用“3S”技术编制区域碳饱和亏缺表,即建立一个全面的区域土壤信息系统,该系统可以支持对SOC储量的量化、监测和报告,从而强化对区域土壤质量的管理。
(4)定量分析LOC含量对异养微生物的限制,探索从微观尺度建立土壤碳储量变化新模型。微生物在土壤碳氮动态变化中处于核心地位,微生物碳源的限制反馈了植物对土壤养分的需求,从而解释整个生态系统对非稳态条件的反应。LOC作为一种初级元素能量源,对异养微生物的生长最具限制作用。在没有其他元素限制生长的前提下,可以利用阈值元素比率(Threshold element ratio,TER,指微生物本身的碳氮比与微生物对底物的氮、碳元素利用效率比值的乘积)来评估微生物所受到碳和氮的共同限制。
然而,固有的模型和指数不能有效反映微生物对SOC转化效率的影响,也难以反映LOC变化的内在机理过程及其对环境的响应。因此,必须脱离以植物为中心的生态系统思维,利用新的分子技术测定和量化受碳限制的微生物如何驱动有机质的转化。新模型需要集成土壤微生物群落资源可用性及生态系统养分循环和碳储量变化多种因素,同时,充分研究养分比率、气候和生态系统储存和释放CO2能力之间的反馈和交互影响,并将氮循环和磷循环引入到新模型中,以期为预测生态系统碳平衡提供一个强有力的工具。
| [1] |
Lal R. Soil carbon sequestration impacts on global climate change and food security[J]. Science, 2004, 304: 1623-1627. DOI:10.1126/science.1097396 |
| [2] |
Xu S, Sheng C, Tian C. Changing soil carbon: Influencing factors, sequestration strategy and research direction[J]. Carbon Balance Manage, 2020, 15(1): 2. DOI:10.1186/s13021-020-0137-5 |
| [3] |
Lal R. Digging deeper: A holistic perspective of factors affecting soil organic carbon sequestration in agroecosystems[J]. Globle Change Biology, 2018, 24: 3285-3301. DOI:10.1111/gcb.14054 |
| [4] |
Cheng M, Xiang Y, Xue Z, et al. Soil aggregation and intra-aggregate carbon fractions in relation to vegetation succession on the Loess Plateau, China[J]. Catena, 2015, 124: 77-84. DOI:10.1016/j.catena.2014.09.006 |
| [5] |
de Moraes Sá J C, Potma Gonçalves D R, Ferreira L A, et al. Soil carbon fractions and biological activity based indices can be used to study the impact of land management and ecological successions[J]. Ecological Indicators, 2018, 84: 96-105. DOI:10.1016/j.ecolind.2017.08.029 |
| [6] |
Doetterl S, Stevens A, Six J, et al. Soil carbon storage controlled by interactions between geochemistry and climate[J]. Nature Geoscience, 2015, 8: 780-783. DOI:10.1038/ngeo2516 |
| [7] |
Chan K Y, Bowman A, Oates A. Oxidizible organic carbon fractions and soil quality changes in an Oxic Paleustalf under different pasture leys[J]. Soil Science, 2001, 166: 61-67. DOI:10.1097/00010694-200101000-00009 |
| [8] |
Guimarães D V, Gonzaga M I S, da Silva T O, et al. Soil organic matter pools and carbon fractions in soil under different land uses[J]. Soil & Tillage Research, 2013, 126: 177-182. |
| [9] |
Plaza-Bonilla D, Álvaro-Fuentes J, Cantero-Martínez C. Identifying soil organic carbon fractions sensitive to agricultural management practices[J]. Soil & Tillage Research, 2014, 139: 19-22. |
| [10] |
Nandan R, Singh V, Singh S S, et al. Impact of conservation tillage in rice-based cropping systems on soil aggregation, carbon pools and nutrients[J]. Geoderma, 2019, 340: 104-114. DOI:10.1016/j.geoderma.2019.01.001 |
| [11] |
Walkley A, Black I A. An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method[J]. Soil Science, 1934, 37(1): 29-38. DOI:10.1097/00010694-193401000-00003 |
| [12] |
Logninow W, Wisniewski W, Strony W M, et al. Fractionation of organic carbon based on susceptibility to oxidation[J]. Polish Journal of Soil Science, 1987, 20(1): 47-52. |
| [13] |
Walkley A. A critical examination of a rapid method for determining organic carbon in soils: Effect of variations in digestion conditions and inorganic soil constituents[J]. Soil Science, 1947, 63(4): 251-263. DOI:10.1097/00010694-194704000-00001 |
| [14] |
Rovira P, Vallejo V R. Labile and recalcitrant pools of carbon and nitrogen in organic matter decomposing at different depths in soil: An acid hydrolysis approach[J]. Geoderma, 2002, 107(1/2): 109-141. |
| [15] |
Blair G J, Lefroy R D B, Lisle L. Labile soil carbon fractions based on the degree of oxidation and the development of carbon management index for agricultural systems[J]. Australian Journal of Soil Research, 1995, 46(7): 1459-1466. |
| [16] |
Haynes R J. Labile organic matter as an indicator of organic matter quality in arable and pastoral soils in New Zealand[J]. Soil Biology & Biochemistry, 2000, 32(2): 211-219. |
| [17] |
Cavalcante D M, Castro M F d, Chaves M T L, et al. Effects of rehabilitation strategies on soil aggregation, C and N distribution and carbon management index in coffee cultivation in mined soil[J]. Ecological Indicators, 2019, 107: 105668. DOI:10.1016/j.ecolind.2019.105668 |
| [18] |
Datta A, Basak N, Chaudhari S K, et al. Soil properties and organic carbon distribution under different land use in reclaimed sodic soils of North-West India[J]. Geoderma Regional, 2015, 4: 134-146. DOI:10.1016/j.geodrs.2015.01.006 |
| [19] |
Ghosh A, Bhattacharyya R, Meena M C, et al. Long-term fertilization effects on soil organic carbon sequestration in an Inceptisol[J]. Soil & Tillage Research, 2018, 177: 134-144. |
| [20] |
方华军, 杨学明, 张晓平. 农田土壤有机碳动态研究进展[J]. 土壤通报, 2003, 34(6): 562-568. FANG Hua-jun, YANG Xue-ming, ZHANG Xiao-ping. The progress of study on soil organic carbon dynamics in cropland[J]. Chinese Journal of Soil Science, 2003, 34(6): 562-568. |
| [21] |
杨丽霞, 潘剑君. 土壤活性有机碳库测定方法研究进展[J]. 土壤通报, 2004, 35(4): 502-506. YANG Li-xie, PAN Jian-jun. Progress in the study of measurements of soil active organic carbon pool[J]. Chinese Journal of Soil Science, 2004, 35(4): 502-506. |
| [22] |
张国, 曹志平, 胡婵娟. 土壤有机碳分组方法及其在农田生态系统研究中的应用[J]. 应用生态学报, 2011, 22(7): 1921-1930. ZHANG Guo, CAO Zhi-ping, HU Chan-juan. Soil organic carbon fractionation methods and their applications in farmland ecosystem research: A review[J]. Chinese Journal of Aplied Ecology, 2011, 22(7): 1921-1930. |
| [23] |
徐洪文, 卢妍. 土壤碳矿化及活性有机碳影响因子研究进展[J]. 江苏农业科学, 2014, 42(10): 4-7. XU Hong-wen, LU Yan. Progresses on influencing factors of soil carbon mineralization and labile organic carbon[J]. Jiangsu Agricultural Sciences, 2014, 42(10): 4-7. |
| [24] |
Lefroy R D B, Blair G J, Strong W M. Changes in soil organic matter with cropping as measured by organic carbon fractions and 13C natural isotope abundance[J]. Plant and Soil, 1993, 155/156(1): 399-402. DOI:10.1007/BF00025067 |
| [25] |
Shang C, Tiessen H. Organic matter lability in a Tropical Oxisol: Evidence from shifting cultivation, chemical oxidation, particle size, density, and magnetic fractionations[J]. Soil Science, 1997, 162(11): 795-807. DOI:10.1097/00010694-199711000-00004 |
| [26] |
Weil R R, Islam K R, Stine M A, et al. Estimating active carbon for soil quality assessment: A simplified method for laboratory and field use[J]. American Journal of Alternative Agriculture, 2003, 18: 3-17. DOI:10.1079/AJAA2003003 |
| [27] |
Culman S W, Snapp S S, Freeman M A. Permanganate oxidizable carbon reflects a processed soil fraction that is sensitive to management[J]. Soil Science of American Journal, 2012, 76(2): 494-504. DOI:10.2136/sssaj2011.0286 |
| [28] |
Tirol-Padre A, Ladha J K. Assessing the reliability of permanganateoxidiz-able carbon as an index of soil labile carbon[J]. Soil Science Society of America Journal, 2004, 68(3): 969-978. DOI:10.2136/sssaj2004.9690 |
| [29] |
Murage E W, Karanja N K, Smithson P C P L, et al. Diagnostic indicators of soil quality in productive and non-productive smallholders' fields of Kenya's Central Highland[J]. Agriculture, Ecosystems & Environment, 2000, 79: 1-8. |
| [30] |
Matsuda K, Schnitzer M. The permanganate oxidation of humicacids extracted from acid soils[J]. Soil Science, 1972, 114(3): 185-193. DOI:10.1097/00010694-197209000-00005 |
| [31] |
Stevenson F J. Humus chemistry. Genesis, composition, reactions, second edition[M]. New York: Wiley, 1994.
|
| [32] |
Bhattacharyya R, Kundu S, Srivastva A K, et al. Long term fertilization effects on soil organic carbon pools in a sandy loam soil of the Indian sub-Himalayas[J]. Plant and Soil, 2011, 341(1/2): 109-124. |
| [33] |
Benbi D K, Toor A S, Kumar S. Management of organic amendments in rice wheat cropping system determines the pool where carbon is sequestered[J]. Plant and Soil, 2012, 360(1/2): 145-162. DOI:10.1007/s11104-012-1226-3 |
| [34] |
Ghosh B N, Meena V S, Alama N M, et al. Impact of conservation practices on soil aggregation and the carbon management index after seven years of maize-wheat cropping system in the Indian Himalayas[J]. Agriculture, Ecosystems & Environment, 2016, 216: 247-257. |
| [35] |
Paul E A. The nature and dynamics of soil organic matter: Plant inputs, microbial transformations, and organic matter stabilization[J]. Soil Biology & Biochemistry, 2016, 98: 109-126. |
| [36] |
Berendse F, Berg B, Bosatta E. The effect of lignin and nitrogen on the decomposition of litter innutrient-poor ecosystems: A theoretical approach[J]. Canadian Journal of Botany-revue Canadienne de Botanique, 1985, 65: 1116-1120. |
| [37] |
Ding X, Han X, Liang Y, et al. Changes in soil organic carbon pools after 10 years of continuous manuring combined with chemical fertilizer in a Mollisol in China[J]. Soil & Tillage Research, 2012, 122: 36-41. |
| [38] |
Sheng H, Zhou P, Zhang Y, et al. Loss of labile organic carbon from subsoil due to land-use changes in subtropical China[J]. Soil Biology & Biochemistry, 2015, 88: 148-157. |
| [39] |
da Silva Oliveira D M, Paustian K, Cotrufo M F, et al. Assessing labile organic carbon in soils undergoing land use change in Brazil: A comparison of approaches[J]. Ecological Indicators, 2017, 72: 411-419. DOI:10.1016/j.ecolind.2016.08.041 |
| [40] |
Rovira P, Vallejo V R. Labile, recalcitrant, and inert organic matter in Mediterranean forest soils[J]. Soil Biology & Biochemistry, 2007, 39(1): 202-215. |
| [41] |
Liu X, Chen D T, Yang T, et al. Changes in soil labile and recalcitrant carbon pools after land-use change in a semi-arid agro-pastoral ecotone in Central Asia[J]. Ecological Indicators, 2020, 110: 105925. DOI:10.1016/j.ecolind.2019.105925 |
| [42] |
Tang G, Li K. Tree species controls on soil carbon sequestration and carbon stability following 20 years of afforestation in a valley-type savanna[J]. Forest Ecology and Management, 2013, 291: 13-19. DOI:10.1016/j.foreco.2012.12.001 |
| [43] |
Anderson T H, Domsch K H. Ratio of microbial biomass carbon to total carbon in arable soils[J]. Soil Biology & Biochemistry, 1989, 21(4): 471-479. |
| [44] |
Majumder B, Mandal B, Bandyopadhyay P K, et al. Soil organic carbon pools and productivity relationships for a 34 year old rice-wheatjute agroecosystem under different fertilizer treatments[J]. Plant and Soil, 2007, 297(1/2): 53-67. |
| [45] |
Vieira F C B, Bayer C, Zanatta J A, et al. Carbon management index based on physical fractionation of soil organic matter in an Acrisol under long-term no-till cropping systems[J]. Soil and Tillage Research, 2007, 96(1/2): 195-204. |
| [46] |
Datta A, Mandal B, Basak N, et al. Soil carbon pools under long-term rice-wheat cropping system in Inceptisols of Indian Himalayas[J]. Archives of Agronomy & Soil Science, 2017, 1-6. |
| [47] |
Jat H S, Datta A, Choudhary M, et al. Climate smart agriculture practices improve soil organic carbon pools, biological properties and crop productivity in cereal-based systems of North-West India[J]. Catena, 2019, 181: 104059. DOI:10.1016/j.catena.2019.05.005 |
| [48] |
Choudhury S G, Srivastava S, Singh R, et al. Tillage and residue management effects on soil aggregation, organic carbon dynamics and yield attribute in rice-wheat cropping system under reclaimed sodic soil[J]. Soil and Tillage Research, 2014, 136: 76-83. DOI:10.1016/j.still.2013.10.001 |
| [49] |
Choudhury S G, Yaduvanshi N P S, Chaudhari S K, et al. Effect of nutrient management on soil organic carbon sequestration, fertility, and productivity under rice-wheat cropping system in semi-reclaimed sodic soils of North India[J]. Environmental Monitoring and Assessment, 2018, 190: 117. DOI:10.1007/s10661-018-6486-9 |
| [50] |
Kennedy M J, Lohr S C, Fraser S A, et al. Direct evidence for organic carbon preservation as clay-organic nanocomposites in a Devonian black shale: From deposition to diagenesis[J]. Earth and Planet Science Letter, 2014, 388(18): 59-70. |
 2021, Vol. 40
2021, Vol. 40


