2. 汕头大学工学院, 广东 汕头 515063
2. College of Engineering, Shantou University, Shantou 515063, China
塑料制品因其制作成本低廉、延展性良好、耐腐蚀、耐用等特点而被广泛应用于工业制品、农用地膜和个人护理用品等方面[1-2]。据统计,全球每年消耗大约2.8亿t塑料[3]。进入水和土壤环境中的塑料在机械破碎和光降解等作用下裂解成微米或纳米级塑料颗粒[4],从而对环境生物的生长造成威胁。研究表明,进入海洋水体的微塑料可被水生生物吸收,引起生殖毒性,加剧氧化应激反应,破坏抗氧化防御系统,甚至导致生物体死亡[5-6]。此外,生物体内的微塑料可以通过食物链进入人体,对人类健康造成潜在的威胁[7]。Jiang等[8]发现100 nm的聚苯乙烯(PS) 微球可以在蚕豆豆茎根中积累,而且很可能会阻断运输营养物质的细胞壁孔。李连祯等[9]通过共聚焦荧光显微镜和扫描电镜观察发现粒径小于200 nm的PS微球可以被生菜吸收富集,而粒径为1 000 nm的PS微球则不能进入生菜体内,表明微塑料对植物的毒性一定程度上取决于其大小、形状和种类。
邻苯二甲酸酯(PAE)主要用于塑料制品和其他工业产品的生产,以提高塑料制品的韧性、强度及可塑性[10]。全球每年生产的PAE大约有600万t[11],其已成为全世界使用最广泛的合成有机化合物[12]。邻苯二甲酸二丁酯(DBP)是PAE化合物中极其重要的一种增塑剂,在饮用水、地表水、室内外空气粉尘、河底沉积物和土壤中频繁检出[13-15]。已有研究表明,蔬菜能吸收和积累DBP,从而抑制植物的光合作用、引起氧化损伤、降低生物量,甚至降低作物品质[16]。此外,由于DBP具有致癌性、致畸性和致突变性,其已被美国环境保护署、中国国家环境监测中心列为环境优先污染物[17-18]。
众所周知,环境中绝对意义上的单一污染极少,更多的是多种污染物并存[19]。由于微塑料比表面积大,疏水性和吸附能力强,导致其可能成为各种污染物的理想载体,包括持久性有机污染物、重金属和病原体等[20-22]。微塑料和PAE作为两类重要的污染物,已引起国内外研究者的广泛关注。因此,探究二者复合污染对高等植物生长和品质的影响,对农业生产中的污染防治有着重要的意义。本文以绿叶生菜(Lactuca sativa L. var. ramosa Hort) 为研究对象,采用水培实验调查两种不同粒径的聚苯乙烯微球(100~ 400 nm,SPS和10~15 μm,LPS) 和DBP复合污染对生菜幼苗的植物毒性,主要包括:不同粒径PS和DBP复合污染对生菜光合参数、荧光参数、叶绿素含量和核酮糖-1,5二磷酸羧化酶(RuBisCo) 的影响;复合污染对生菜非酶抗氧化防御系统的影响;复合污染对生菜品质的影响。
1 材料与方法 1.1 供试材料不同粒径的PS微球购自于华创化工有限公司(广东,中国)。色谱甲醇和无水乙醇由赛默菲斯科技有限公司(上海,中国) 提供。DBP (99.8%) 购自于深圳市萊科科技有限公司(深圳,中国)。酶试剂盒购自科明科技发展有限公司(苏州,中国)。
1.2 培养液的配制用色谱纯甲醇将DBP标准溶液稀释成浓度为1 000 mg·L-1的储备液。试验前,用1/4 Hoagland (霍格兰氏) 营养液将其稀释至5 mg·L-1。分别将0.125、0.250、0.500 g LPS和SPS加入到500 mL 1/4 Hoagland营养液中(包含1% 的甲醇),配制成浓度为0.25、0.50、1.00 g · L-1的LPS和SPS溶液,记为LPS0.25、SPS0.25、LPS0.5、SPS0.5、LPS1、SPS1。分别将不同浓度的LPS和SPS溶液与DBP溶液混合,制成DBP+ LPS0.25、DBP+ SPS0.25、DBP+LPS0.5、DBP+ SPS0.5、DBP+LPS1、DBP+SPS1的复合污染溶液。以1/4 Hoagland营养液处理组作为对照组。在本试验中,甲醇既是PS溶液的分散剂,也作为DBP的助溶剂,因此设置1% 的甲醇处理组以评估甲醇对生菜生长的影响。每个处理设置3个平行试验。设置的DBP和PS浓度能对生菜生长产生明显抑制作用,但不会导致其死亡[23-24]。
1.3 试验设计绿叶生菜(Lactuca sativa L. var. ramosa Hort.) 种子用0.02% NaClO消毒20 min,再用蒸馏水反复洗涤以去除种子表面残余的NaClO。然后在每个蛭石托盘上播撒数粒、大小均匀一致的种子,将其置于培养箱内发芽。明暗周期为12 h:12 h,温度控制在(25 ± 2) ℃,相对湿度控制在60% 左右。在第二片真叶展开之前,将生菜幼苗由托盘移植到1/4 Hoagland营养液中,并每3 d更换一次营养液。当生菜第三片真叶展开后,选取5株大小一致的幼苗移栽到装有不同处理液的棕色瓶中,每5 d补充一次1/4 Hoagland营养液。为了保持PS悬浮液均质,每日需将棕色瓶轻轻摇动30 min。培养28 d后,分别收集根和叶样品用于分析生理生化指标。
1.4 测定项目 1.4.1 光合参数采收生菜前1 d的10:00—11:00,利用便携式光合分析仪(Li-6400,Li-COR,Lincoln,NE,USA) 分别测定光合速率(Pn,μmol CO2·m-2·s-1)、气孔导度(Gs,mol H2O·m-2·s-1)、蒸腾速率(Tr,mmol H2O·m-2·s-1) 和胞间CO2浓度(Ci,μmol CO2 ·mol-1)。分析仪通量密度设置为1 000 mmol·m-2·s-1,蒸汽压控制在1 kPa,空气流量设置为500 mmol·s-1,温度保持在25 ℃,CO2浓度与光强分别控制在458 mmol · m-2 · s-1和1 000 mmol·m-2·s-1。
1.4.2 叶绿素荧光参数将生菜样品置于黑暗中30 min,然后使用PAM-2000叶绿素荧光计(Walz GmbH,Effeltrich,Germany) 测定光合系统PSⅡ的光能转换效率(Fv/Fm) 和光合电子传输速率(ETR)。
1.4.3 叶绿素含量取0.2 g新鲜生菜叶片组织,用去离子水洗净后置于研钵中,加入1.5 g碳酸钙粉末和2 mL 95% 乙醇研磨。期间再次加入10 mL 95% 乙醇持续研磨直至样品呈现无色,研磨后的样品过滤至25 mL容量瓶中,并用95% 乙醇冲洗数次后移入容量瓶定容。测量前振荡摇匀试液,用紫外可见分光光度计(UV-1800,岛津公司,日本京都) 在663 nm和665 nm下测量提取物的吸光度。叶绿素a(Ca)和叶绿素b(Cb)含量(mg·g-1 FW) 计算公式如下:
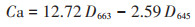
|
(1) |
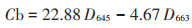
|
(2) |

|
(3) |
式中:D663和D645分别代表663 nm和645 nm波长下的吸光度;Ct表示总叶绿素的含量,mg·g-1。
1.4.4 酶活测定取0.2 g生菜的叶或根组织作为样本,用液氮迅速冷冻并研磨成细粉。将样品转移至含2 mL生理盐水(NaCl,0.9%) 的离心管中提取,4 ℃、8 000 g离心10 min,将上清转移至10 mL的试管中。根据试剂盒说明测定RuBisCo活性和抗坏血酸(ASA)、谷胱甘肽(GSH) 含量。
1.4.5 生菜品质测定取0.2 g新鲜的生菜叶片,液氮冷冻并研磨成细粉状,装入含有2 mL提取液的离心管中进行提取。4 ℃、8 000 g离心20 min,然后将上清液移入10 mL的试管中。根据试剂盒的说明测定可溶性蛋白含量。
取0.1 g新鲜生菜叶片在1 mL蒸馏水中研磨成匀浆后移入离心管中,并在95 ℃水浴中提取10 min,待冷却后,在25 ℃、8 000 g下分离10 min。根据试剂盒说明测定上清液中的可溶性糖含量。
亚硝酸盐的测定:在盐酸酸化条件下,亚硝酸盐与对氨基苯磺酸反应生成重氮化合物,再与N-1-萘基乙二胺偶联反应生成紫红色化合物,该化合物特征吸收峰在540 nm处测出。
1.5 数据处理试验数据均表示为3次重复的平均值±标准差。采用Origin 9.1 (Originlap Northampton,MA,USA) 做图。使用SPSS (version 23.0,IBM,USA) 进行单因素方差分析,P < 0.05表明处理间具有显著差异。
2 结果与分析与对照相比,1%甲醇组中生菜光合参数、荧光参数、叶绿素含量、RuBisCo活性、ASA和GSH含量以及生菜品质等均无显著差异(P>0.05),表明1% 甲醇对生菜的生长和品质无显著影响。
2.1 DBP和PS对生菜光合作用的影响表 1是DBP和PS复合污染对生菜光合参数和荧光参数的影响。由表 1可以看出,与对照组相比,DBP和LPS (SPS) 单一处理组中生菜Pn、Gs和Tr均显著降低(P < 0.05),而Ci的变化趋势正好相反。例如,LPS1 (SPS1) 和DBP处理导致生菜叶片中Pn含量分别降低24.25% (27.57%) 和14.00%,Ci值增加9.23% (11.43%) 和5.08%。与单一DBP污染相比,复合污染显著降低了生菜的Pn、Gs和Tr,而增加了Ci (P < 0.05)。如LPS的存在使Pn较DBP降低了4.63%~ 17.32%,SPS存在降低了5.76%~20.35%。荧光参数Fv/Fm和ETR的变化趋势与Pn一致。
|
|
表 1 聚苯乙烯(PS) 和邻苯二甲酸二丁酯(DBP) 对生菜光合参数、荧光参数和叶绿素含量的影响 Table 1 Effects of polystyrene (PS) and di-butyl phthalate (DBP) on photosynthetic and fluorescence parameters and chlorophyll content |
表 1还显示了不同浓度LPS (SPS) 与DBP胁迫下生菜叶绿素含量的响应。与对照组相比,当PS浓度为0.5 g·L-1时,Ca和Ct含量显著降低(P < 0.05)。单一DBP处理对Ca和Cb无显著影响(P>0.05),但显著降低了Ct含量(P < 0.05)。在LPS1 (SPS1) 与DBP复合处理组中Ca和Ct含量最低。例如,与单一DBP污染相比,LPS (SPS) 和DBP复合污染导致Ca含量降低了2.89%~9.05% (3.18%~10.88%),Ct含量降低了2.43%~7.41% (2.90%~9.41%)。
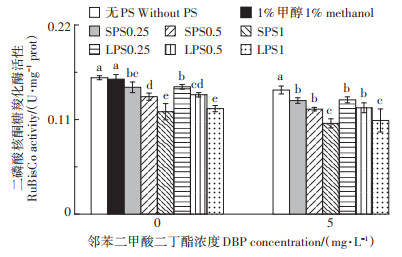
2.2 RuBisCo活性对PS和DBP胁迫的响应图 1为不同浓度LPS (SPS) 和DBP胁迫作用下,生菜体内RuBisCo活性的变化。与对照相比,单一PS胁迫下,生菜叶片中RuBisCo酶活性明显受到抑制作用(P < 0.05);单一DBP处理组中,生菜叶片RuBisCo酶活性降低了9.01%。与单一DBP处理组相比,LPS1 (SPS1) 的存在使DBP胁迫下生菜叶片中RuBisCo活性显著下降了24.55% (26.86%) (P < 0.05)。
|
不同小写字母表示各处理组之间差异显著(P < 0.05)。下同 Different lowercase letters mean significant difference among treatments (P < 0.05). The same below 图 1 聚苯乙烯(PS) 和邻苯二甲酸二丁酯(DBP) 对生菜叶片RuBisCo活性的影响 Figure 1 Effects of di-butyl phthalate (DBP) on RuBisCo activity in lettuce leaves with and without polystyrene (PS) |
LPS (SPS) 和DBP胁迫下,生菜叶片和根系内ASA和GSH含量如图 2所示。在不同浓度LPS (SPS) 胁迫下,生菜细胞内ASA含量被显著诱导上升(P < 0.05),而且诱导的程度与PS浓度剂量成正比(图 2A)。当LPS (SPS) 浓度为1 g·L-1时,生菜叶片和根部ASA含量分别升高了49.55% (51.78%) 和50.78%(52.46%)。单一DBP处理组对生菜体内ASA含量同样起到诱导激活效应,激活率为23.65%。与单一DBP处理相比,复合污染显著提高了生菜叶片和根系中ASA含量。当LPS (SPS) 浓度为1 g·L-1时,复合处理组中生菜叶片和根系ASA含量分别增加38.64%(38.66%) 和40.88% (41.25%)。由此可见,PS的存在增强了DBP对生菜ASA含量的影响。此外,生菜叶片和根系内GSH含量变化趋势与ASA一致(图 2B)。
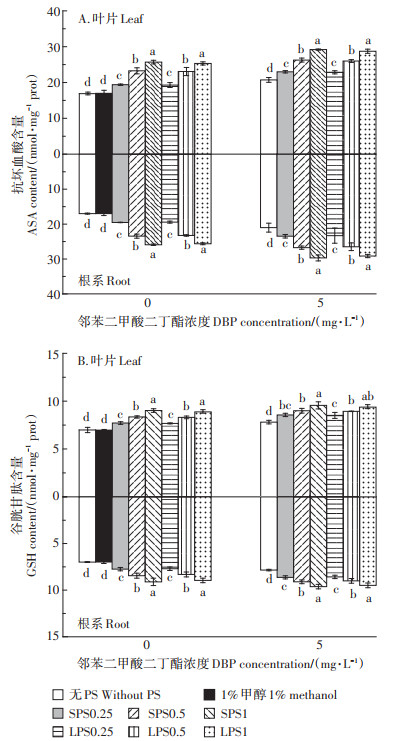
|
图 2 聚苯乙烯(PS) 和邻苯二甲酸二丁酯(DBP) 对生菜抗坏血酸和谷胱甘肽含量的影响 Figure 2 Effects of di-butyl phthalate (DBP) on ascorbic acid and glutathione content in lettuce with and without polystyrene (PS) |
LPS (SPS) 和DBP胁迫下生菜叶片内的可溶性蛋白、可溶性糖和亚硝酸盐含量的变化如图 3所示。与对照相比,随着LPS (SPS) 浓度的增加,生菜叶片内的可溶性蛋白含量分别显著降低了3.84% (4.33%)、6.87% (7.89%) 和9.88% (11.65%) (P < 0.05,图 3A)。由此可以看出,SPS对于生菜叶片内可溶性蛋白含量的影响大于LPS。此外,DBP单一处理组可溶性蛋白含量相较于对照组降低了5.01%。与单一DBP处理组相比,LPS1和SPS1与DBP复合污染使可溶性蛋白含量分别下降了10.16%和12.25%。
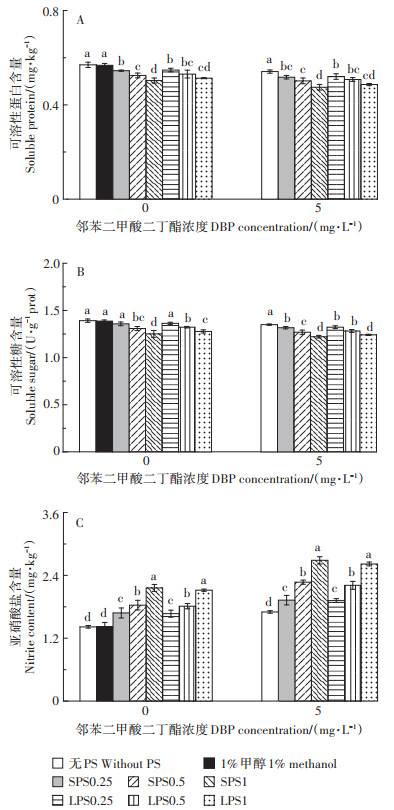
|
图 3 聚苯乙烯(PS) 和邻苯二甲酸二丁酯对(DBP) 对生菜品质的影响 Figure 3 Effects of di-butyl phthalate (DBP) on the quality of lettuce with and without polystyrene (PS) |
由图 3B可以看出,LPS0.25 (SPS0.25) 单一处理组生菜叶片内可溶性糖含量与对照组相比没有显著差异(P>0.05);当LPS (SPS) 浓度为0.5 g·L-1和1.0 g·L-1时,可溶性糖含量显著小于对照组(P < 0.05),抑制率分别为4.96% (5.97%) 和8.21% (10.04%)。与单一DBP处理组相比,PS的存在显著增加了DBP对可溶性糖的抑制作用(P < 0.05)。
图 3C表明,随着LPS (SPS) 浓度增加,生菜叶片中亚硝酸盐的含量显著增加(P < 0.05)。如LPS1 (SPS1) 处理组中,亚硝酸盐含量较对照组明显提高49.29% (52.35%)。DBP单一处理组中亚硝酸盐含量组增加了20.02%。与DBP单一处理相比,LPS (SPS) 和DBP复合处理生菜叶片的亚硝酸盐含量分别增加了12.74% (13.21%)、29.85% (33.39%) 和53.84% (57.92%)。
3 讨论光合作用通常是指绿色植物通过吸收光能,并利用水和二氧化碳制造有机物,同时释放氧气的过程。植物通过光合作用把太阳能转换并储存在有机物中,为人类活动提供主要能源[25]。光合抑制也是自然界中植物普遍存在的一种现象,而光合速率降低通常被认为由两种因素引起,一是由气孔导度决定的气孔性限制,二是受细胞内光合活性下降引起的非气孔性限制[11]。其中气孔性限制可使Ci降低,而非气孔性限制则相反。本研究结果显示,在LPS、SPS及DBP单一及复合胁迫下,生菜细胞内Pn、Gs和Tr均较空白组显著降低,而Ci含量则显著升高,表明光合作用受到抑制是由非气孔性限制所引起。Fv/Fm反映叶片的光能转化效率,通常植物体内PSⅡ反应中心的Fv/Fm值比较稳定,不易受到外界干扰。当植物受到环境胁迫时,Fv/Fm值也会相应降低[26]。本研究中PS的存在增加了DBP对Fv/Fm和ETR的抑制作用,表明PS和DBP的胁迫作用破坏了生菜叶片叶绿体类囊体结构,导致PSⅡ反应中心受到一定程度的损伤,光合的原初反应、光合电子的传递过程均受到抑制。本课题组之前的研究也指出聚乙烯和DBP复合污染抑制了生菜的光合作用[27]。
叶绿素是植物进行光合作用的主要色素,并为地球上的生命活动提供能量来源[26]。通常叶绿素也是显示高等植物生命力的一个重要特征,环境胁迫会引起植物叶片叶绿体中色素蛋白脂质复合物的弱化甚至解体,或使与叶绿素分子合成有关的蛋白酶受到限制,进而使叶绿素含量下降[28]。本研究结果表明,与单一DBP处理组相比,复合污染显著降低了Ca和Ct的含量,而且PS的存在加重了DBP对Ca含量的抑制作用。我们推测叶绿素含量下降是由于胁迫作用导致细胞中活性氧的积累,破坏了叶绿素结构,进而影响光合作用[29]。本课题组先前的研究也指出聚乙烯和DBP复合污染显著降低了水培生菜的叶绿素含量[27],这与本研究结果一致。Zhang等[30]发现,聚氯乙烯降低了藻类体内叶绿素的含量。Lee等[21]研究发现,微塑料具有较大的比表面积和吸附能力,可能会吸附培养液中的营养物质[31],影响生菜对氮元素的吸收,从而导致叶绿素合成下降。
RuBisCo由8个大亚基和8个小亚基组成,通常存在于自养细菌和高等植物细胞内,既参与光呼吸途径又参与光合作用,是进行光合碳同化过程极为重要的一种酶[32]。本研究中,单一的PS与DBP胁迫下,生菜细胞内RuBisCo活性相较于对照组显著下降,而且PS的存在加剧了DBP对RuBisCo的抑制作用。这可能是因为外源污染物胁迫条件下,生菜体内的自由基过量积累,导致膜脂过氧化,从而抑制RuBisCo活性,进而干扰叶片叶绿素的合成。类似地,徐晓昀等[33]研究发现,在水培条件下,油菜素内脂抑制了黄瓜幼苗体内RuBisCo的活性。
通常情况下,植物体内都有一个较为完善的抗氧化防御体系[34],当植物受到外界环境胁迫时,该防御体系能够清除体内多余且有毒害作用的自由基以降低植物所受到的损伤[35]。而ASA、GSH作为植物抗氧化系统中的非酶性物质,对于抵御外界胁迫同样具有重要作用[36-37]。郭伟等[38]研究发现,在N-苯基-2-萘胺和邻苯二甲酸复合作用下,生菜体内的超氧化物岐化酶活性及GSH含量明显增加,表明生菜细胞内部产生了应激反应。在ASA-GSH循环中,许多抗氧化酶和非酶物质共同清除植物体内积累的过量的活性氧自由基,以提高植物的抗逆性[39]。此外,Caverzan等[34]研究指出,ASA-GSH循环存在于细胞质和叶绿体中,在维持蛋白质的稳定和生物膜的结构完整性方面也发挥着重要作用,并能有效防止膜脂过氧化。本研究结果表明,与对照和单一污染相比,PS和DBP复合污染显著增加了对ASA和GSH的刺激作用,这是植物在逆境下的典型应激反应。表明在PS及DBP胁迫作用下,生菜细胞内的ASA-GSH循环被诱导激活,从而可以清除体内过量的自由基,稳定细胞结构。因此,这两种非酶抗氧化性物质相辅相成,并联合植物体内的抗氧化酶共同提高抵抗逆境的能力。
可溶性蛋白作为一种调控物质,在调节植物体内生理代谢过程中发挥着重要作用,是衡量生菜品质的重要指标[40]。当植物受到外界胁迫作用时,体内细胞中某些合成蛋白的基因可能会受阻,进而影响可溶性蛋白的合成。可溶性糖是植物体内的一种营养物质,主要作用是合成纤维素进而促进细胞壁的形成[41]。本研究结果显示,不同浓度LPS (SPS) 的存在显著加重了DBP对生菜体内可溶性蛋白与可溶性糖的抑制作用。说明在胁迫处理28 d后,生菜代谢平衡受到破坏,进而使可溶性蛋白和可溶性糖的合成受到抑制,含量显著下降。杨青青等[42]研究发现,铅、镉复合污染导致小白菜可溶性蛋白含量显著下降。此外,可溶性糖也是光合作用的主要产物[43]。PS的存在加剧了DBP对生菜RuBisCo活性的抑制,降低了叶绿素含量,从而导致生菜的光合作用受到抑制。因此认为,光合作用降低也是导致生菜可溶性糖含量下降的重要原因。Li等[44]认为PS被蔬菜吸收后,其在叶片中降解产生的苯是导致叶绿素代谢和糖代谢受到抑制的主要原因,但这还需要进一步的研究验证。
亚硝酸盐作为一种有毒物质,其在酸性条件下,可与次级胺生成具有致癌作用的亚硝胺[45]。含有过量硝酸盐或亚硝酸盐的蔬菜被人体食用后,可能会氧化人体血红蛋白中的Fe2+,进而降低体内输氧能力,严重时会造成急性中毒[46]。本研究结果表明,单一PS或DBP污染明显增加了生菜叶片中亚硝酸盐的含量,且随着PS浓度增加显著提高(P < 0.05)。与单一DBP污染相比,复合污染进一步增加了生菜叶片中亚硝酸盐的含量。推测可能是因为在不同浓度LPS (SPS) 和DBP胁迫下,生菜细胞内的硝酸盐还原酶含量增加所致[47]。根据国内对食品安全国家标准(GB 2762—2017) 规定,蔬菜及其制品中亚硝酸盐的含量应低于20 mg·kg-1,农业行业标准(NY/T 437— 2012) 规定,蔬菜中的亚硝酸盐含量不超过4 mg· kg-1。本研究中,LPS1+DBP和SPS1+DBP处理中生菜叶片中亚硝酸盐含量最高,分别为2.62 mg·kg-1和2.69 mg·kg-1,虽然满足国家食品安全标准和农业行业标准要求,但显著高于对照(1.42 mg·kg-1) 和单一DBP处理组(1.70 mg·kg-1)。因此,PS和DBP复合污染增加了人类暴露亚硝酸盐的风险。已有研究指出,当维生素C与亚硝酸盐的比例达到2∶1时,可以通过阻断N-亚硝基化合物形成,进而消除亚硝酸盐的负面影响[48]。但在本研究中Vc (ASA) 与亚硝酸盐的比例远低于2∶1,因此生菜中的Vc无法完全消除亚硝酸盐的影响。
无论在单一污染还是复合污染中,SPS与LPS对生菜光合作用和品质的影响无显著差异。这可能是因为在培养液中SPS更容易发生团聚,从而导致其动力学直径增加[49]。因此,微塑料团聚体只能附着在根系表面,造成物理性阻塞,从而影响生菜对养分和水分的吸收[24]。Bosker等[24]发现,不同粒径的微塑料(50、500、4 800 nm) 对水芹的根系生长和发芽率无显著影响。而有研究表明,较小粒径的微塑料对作物有显著的毒性效应[8-9]。这表明微塑料的毒性取决于微塑料的粒径、浓度、形状和作物的品种等,具体机制有待进一步研究。
4 结论(1) PS的存在加剧了DBP对生菜幼苗RuBisCo活性和叶绿素合成的抑制作用,导致光合作用降低。
(2) 虽然生菜体内抗氧化防御系统非酶物质ASA和GSH含量增加,但仍引起生菜品质的下降,说明PS的存在加重了DBP对生菜的毒性效应,表现为协同作用。
(3) 大粒径PS与小粒径PS对生菜毒性效应无显著差异。
| [1] |
Do Sul J A L, Costa M F. The present and future of microplastic pollution in the marine environment[J]. Environmental Pollution, 2014, 185: 352-364. DOI:10.1016/j.envpol.2013.10.036 |
| [2] |
廖苑辰, 李梅, 王晓琳, 等. 微塑料对小麦生长及生理生化特性的影响[J]. 环境科学, 2019, 40(10): 4661-4667. LIAO Yuan-chen, LI Mei, WANG Xiao-lin, et al. Effects of microplastics on the growth, physiology, and biochemical characteristics of wheat(Triticum aestivum)[J]. Environmental Science, 2019, 40(10): 4661-4667. |
| [3] |
Duis K, Coors A. Microplastics in the aquatic and terrestrial environment: Sources(with a specific focus on personal care products), fate and effects[J]. Environmental Sciences Europe, 2016, 28(1): 2. DOI:10.1186/s12302-015-0069-y |
| [4] |
Eriksen M, Lebreton L C M, Carson H S, et al. Plastic pollution in the world's oceans: More than 5 trillion plastic pieces weighing over 250, 000 tons afloat at sea[J]. PLoS One, 2014, 9(12): e111913. DOI:10.1371/journal.pone.0111913 |
| [5] |
Sutton R, Mason S A, Stanek S K, et al. Microplastic contamination in the San Francisco Bay, California, USA[J]. Marine Pollution Bulletin, 2016, 109(1): 230-235. DOI:10.1016/j.marpolbul.2016.05.077 |
| [6] |
Wright S L, Thompson R C, Galloway T S. The physical impacts of microplastics on marine organisms: A review[J]. Environmental Pollution, 2013, 178: 483-492. DOI:10.1016/j.envpol.2013.02.031 |
| [7] |
Lwanga E H, Vega J M, Quej V K, et al. Field evidence for transfer of plastic debris along a terrestrial food chain[R]. Scientific Reports, 2017, 7(1): 14071.
|
| [8] |
Jiang X F, Chen H, Liao Y C, et al. Ecotoxicity and genotoxicity of polystyrene microplastics on higher plant Vicia faba[J]. Environmental Pollution, 2019, 250: 831-838. DOI:10.1016/j.envpol.2019.04.055 |
| [9] |
李连祯, 周倩, 尹娜, 等. 食用蔬菜能吸收和积累微塑料[J]. 科学通报, 2019, 64(9): 928-934. LI Lian-zhen, ZHOU Qian, YIN Na, et al. Uptake and accumulation of microplastics in an edible plant[J]. Chinese Science Bulletin, 2019, 64(9): 928-934. |
| [10] |
Boonnorat J, Chiemchaisri C, Chiemchaisri W, et al. Removals of phenolic compounds and phthalic acid esters in landfill leachate by microbial sludge of two-stage membrane bioreactor[J]. Journal of Hazardous Materials, 2014, 277: 93-101. DOI:10.1016/j.jhazmat.2014.02.044 |
| [11] |
Niu J F, Feng Z Z, Zhang W W, et al. Non-stomatal limitation to photosynthesis in Cinnamomum camphora seedings exposed to elevated O3[J]. PLoS One, 2014, 9(6): e98572. DOI:10.1371/journal.pone.0098572 |
| [12] |
Ma T T, Christie P, Luo Y M, et al. Phthalate esters contamination in soil and plants on agricultural land near an electronic waste recycling site[J]. Environ Geochem Health, 2012, 35(4): 465-476. |
| [13] |
王程, 刘慧, 蔡鹤生, 等. 武汉市地下水中酞酸酯污染物检测及来源分析[J]. 环境科学与技术, 2009, 32(10): 118-123. WANG Cheng, LIU Hui, CAI He-sheng, et al. Source analysis and detection of trace phthalate esters in groundwater in Wuhan[J]. Environmental Science and Technology, 2009, 32(10): 118-123. DOI:10.3969/j.issn.1003-6504.2009.10.028 |
| [14] |
王夫美, 陈丽, 焦姣, 等. 冬季天津家庭室内空气颗粒物中邻苯二甲酸酯污染研究[J]. 环境科学, 2012, 33(5): 1446-1451. WANG Fu-mei, CHEN Li, JIAO Jiao, et al. Phthalate esters pollution in household indoor air particles of Tianjin in winter[J]. Environmental Science, 2012, 33(5): 1446-1451. |
| [15] |
张利飞, 杨文龙, 董亮, 等. 苏南地区农田表层土壤中多环芳烃和酞酸酯的污染特征及来源[J]. 农业环境科学学报, 2011, 30(11): 2202-2209. ZHANG Li-fei, YANG Wen-long, DONG Liang, et al. Pollution characteristics and sources of polycyclic aromatic hydrocarbons and phthalic acid esters in agricultural surface soil from the southern Jiangsu Province, China[J]. Journal of Agro-Environment Science, 2011, 30(11): 2202-2209. |
| [16] |
Yin R, Lin X G, Wang S G, et al. Effect of DBP/DEHP in vegetable planted soil on the quality of capsicum fruit[J]. Chemosphere, 2003, 50(6): 801-805. DOI:10.1016/S0045-6535(02)00222-9 |
| [17] |
Jin D C, Kong X, Cui B J, et al. Biodegradation of di-n-butyl phthalate by a newly isolated halotolerant Sphingobium sp.[J]. International Journal of Molecular Sciences, 2013, 14(12): 24046-24054. DOI:10.3390/ijms141224046 |
| [18] |
Li H X, Wan J Q, Ma Y W, et al. Synthesis of novel core-shell Fe0@Fe3O4 as heterogeneous activator of persulfate for oxidation of dibutyl phthalate under neutral conditions[J]. Chemical Engineering Journal, 2016, 301: 315-324. DOI:10.1016/j.cej.2016.04.147 |
| [19] |
Posthuma L, Baerselman R, Van Veen R P, et al. Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils[J]. Ecotoxicology and Environmental Safety, 1997, 38(2): 108-121. DOI:10.1006/eesa.1997.1568 |
| [20] |
Hartmann N B, Rist S, Bodin J, et al. Microplastics as vectors for environmental contaminants: Exploring sorption, desorption, and transfer to biota[J]. Integrated Environmental Assessment and Management, 2017, 13(3): 488-493. DOI:10.1002/ieam.1904 |
| [21] |
Lee H, Shim W J, Kwon J H. Sorption capacity of plastic debris for hydrophobic organic chemicals[J]. Science of the Total Environment, 2014, 470: 1545-1552. |
| [22] |
Breivik K, Armitage J M, Wania F, et al. Tracking the global distribution of persistent organic pollutants accounting for e-waste exports to developing regions[J]. Environmental Science and Technology, 2016, 50(2): 798-805. DOI:10.1021/acs.est.5b04226 |
| [23] |
Gao M L, Dong Y M, Zhang Z, et al. Growth and antioxidant defense responses of wheat seedlings to di-n-butyl phthalate and di(2-ethylhexyl) phthalate stress[J]. Chemosphere, 2017, 172: 418-428. DOI:10.1016/j.chemosphere.2017.01.034 |
| [24] |
Bosker T, Bouwman L B, Brun N R, et al. Microplastics accumulate on pores in seed capsule and delay germination and root growth of the terrestrial vascular plant Lepidium sativum[J]. Chemosphere, 2019, 226: 774-781. DOI:10.1016/j.chemosphere.2019.03.163 |
| [25] |
王曦. 园林植物光合生理特征研究进展[J]. 中国园艺文摘, 2014(11): 46. WANG Xi. Progress research on the landscape plant photosynthetic physiological characteristics[J]. Chinese Horticulture Abstract, 2014(11): 46. DOI:10.3969/j.issn.1672-0873.2014.11.020 |
| [26] |
Jiang Z Y, Guo P Y, Chang C C, et al. Effects of allelochemicals from Ficus microcarpa on Chlorella pyrenoidosa[J]. Brazilian Archives of Biology and Technology, 2014, 57(4): 595-605. |
| [27] |
Gao M L, Liu Y, Song Z G. Effects of polyethylene microplastic on the phytotoxicity of di-n-butyl phthalate in lettuce(Lactuca sativa L. var. ramosa Hort)[J]. Chemosphere, 2019, 237: 124482. DOI:10.1016/j.chemosphere.2019.124482 |
| [28] |
Baker N R. Chlorophyll fluorescence: A probe of photosynthesis in vivo[J]. Annual Review of Plant Biology, 2008, 59: 89-113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [29] |
Moinuddin M, Gulzar S, Hameed A, et al. Differences in photosynthetic syndromes of four halophytic marsh grasses in Pakistan[J]. Photosynthesis Research, 2016, 131: 51-64. DOI:10.1007/s11120-016-0296-0 |
| [30] |
Zhang C, Chen X H, Wang J T, et al. Toxic effects of microplastic on marine microalgae Skeletonema costatum: Interactions between microplastic and algae[J]. Environmental Pollution, 2017, 220: 1282-1288. DOI:10.1016/j.envpol.2016.11.005 |
| [31] |
Avio C G, Gorbi S, Milan M, et al. Pollutants bioavailability and toxicological risk from microplastics to marine mussels[J]. Environmental Pollution, 2015, 198: 211-222. DOI:10.1016/j.envpol.2014.12.021 |
| [32] |
Jamaludin R, Mat N, Mohd K S, et al. Influence of exogenous hydrogen peroxide on plant physiology, leaf anatomy and rubisco gene expression of the Ficus deltoidea jack var. deltoidea[J]. Agronomy-Basel, 2020, 10(4): 497. DOI:10.3390/agronomy10040497 |
| [33] |
徐晓昀, 郁继华, 颉建明, 等. 2, 4-表油菜素内酯对亚适温弱光下黄瓜幼苗光合特性和抗氧化系统的影响[J]. 核农学报, 2017, 31(5): 979-986. XU Xiao-yun, YU Ji-hua, XIE Jian-ming, et al. Effects of 2, 4-epibrassinolide on photosynthesis characteristics and antioxidant system of cucumber seedlings under suboptimal temperature and low light[J]. Acta Agriculturae Nucleatae Sinica, 2017, 31(5): 979-986. |
| [34] |
Caverzan A, Passaia G, Rosa S B, et al. Plant responses to stresses: Role of ascorbate peroxidase in the antioxidant protection[J]. Genetics and Molecular Biology, 2012, 35(Suppl 4): 1011-1019. |
| [35] |
Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930. DOI:10.1016/j.plaphy.2010.08.016 |
| [36] |
Asada K. The water-water cycle in chloroplasts: Scavenging of active oxygens and dissipation of excess photons[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50: 601-639. DOI:10.1146/annurev.arplant.50.1.601 |
| [37] |
Hasan M K, Liu C, Wang F, et al. Glutathione-mediated regulation of nitric oxide, s-nitrosothiol and redox homeostasis confers cadmium tolerance by inducing transcription factors and stress response genes in tomato[J]. Chemosphere, 2016, 161: 536-545. DOI:10.1016/j.chemosphere.2016.07.053 |
| [38] |
郭伟, 孙海燕, 王炎. N-苯基-2-萘胺和邻苯二甲酸对生菜抗氧化系统及矿质养分吸收的影响[J]. 植物生理学报, 2017, 53(1): 71-78. GUO Wei, SUN Hai-yan, WANG Yan. Effect of N-phenyl-2-naphthylamine and phthalic acid on antioxidant system and mineral nutrient uptake of lettuce[J]. Plant Physiology Communications, 2017, 53(1): 71-78. |
| [39] |
付娆, 张海洋, 梁晓艳, 等. 蒲公英对NaCl单盐和海水复合盐胁迫的生理响应[J]. 山东农业科学, 2020, 52(2): 33-37. FU Rao, ZHANG Hai-yang, LIANG Xiao-yan, et al. Physiological response of dandelion(Taraxacum mongolicum Hand.-Mazz.) to single salt stress of NaCl and compound salt stress of seawater[J]. Shandong Agricultural Sciences, 2020, 52(2): 33-37. |
| [40] |
Zhao Y T, Yue Z C, Zhong X M, et al. Distribution of primary and secondary metabolites among the leaf layers of headed cabbage(Brassica oleracea var. capitata)[J]. Food Chemistry, 2020, 312: 126028. DOI:10.1016/j.foodchem.2019.126028 |
| [41] |
Li L Q, Deng M S, Lyu C C, et al. Quantitative phosphoproteomics analysis reveals that protein modification and sugar metabolism contribute to sprouting in potato after BR treatment[J]. Food Chemistry, 2020, 325: 126875. DOI:10.1016/j.foodchem.2020.126875 |
| [42] |
杨青青, 王丹, 崔正旭, 等. Pb、Cd复合污染对不同品种的小白菜生长及营养品质的影响[J]. 中国农学通报, 2018, 35(9): 12-21. YANG Qing-qing, WANG Dan, CUI Zheng-xu, et al. Effects of combined pollution of Pb and Cd on growth and nutritional quality of Chinese cabbage varieties[J]. Chinese Agricultural Science Bulletin, 2018, 35(9): 12-21. |
| [43] |
Bodelon O G, Blanch M, Sanchez-Ballesta M T, et al. The effects of high CO2 levels on anthocyanin composition, antioxidant activity and soluble sugar content of strawberries stored at low non-freezing temperature[J]. Food Chemistry, 2010, 122(3): 673-678. DOI:10.1016/j.foodchem.2010.03.029 |
| [44] |
Li Z X, Li R J, Li Q F, et al. Physiological response of cucumber(Cucumis sativus L.) leaves to polystyrene nanoplastics pollution[J]. Chemosphere, 2020, 255: 127041. DOI:10.1016/j.chemosphere.2020.127041 |
| [45] |
王友保, 黄伟, 刘登义. 芜湖市几种常见蔬菜中亚硝酸盐含量分析[J]. 应用生态学报, 2005, 16(1): 189-192. WANG You-bao, HUANG Wei, LIU Deng-yi. Nitrite content of common vegetables in Wuhu City[J]. Chinese Journal of Applied Ecology, 2005, 16(1): 189-192. DOI:10.3321/j.issn:1001-9332.2005.01.039 |
| [46] |
Bahadoran Z, Mirmiran P, Jeddi S, et al. Nitrate and nitrite content of vegetables, fruits, grains, legumes, dairy products, meats and processed meats[J]. Journal of Food Composition and Analysis, 2016, 51: 93-105. DOI:10.1016/j.jfca.2016.06.006 |
| [47] |
Du S T, Zhang Y S, Lin X Y, et al. Regulation of nitrate reductase by nitric oxide in Chinese cabbage pakchoi(Brassica chinensis L.)[J]. Plant Cell and Environment, 2008, 31(2): 195-204. |
| [48] |
李国富. 鹤山市18种蔬菜中硝酸盐和亚硝酸盐及VC含量研究[J]. 现代农业科技, 2017(5): 238-240. LI Guo-fu. Study on contents of nitrate, nitrite and vitamin C of 18 vegetables in Heshan City[J]. Modern Agricultural Science and Technology, 2017(5): 238-240. DOI:10.3969/j.issn.1007-5739.2017.05.152 |
| [49] |
Lian J P, Wu J N, Xiong H X, et al. Impact of polystyrene nanoplastics(PSNPs) on seed germination and seedling growth of wheat(Triticum aestivum L.)[J]. Journal of Hazardous Material, 2020, 385: 121620. DOI:10.1016/j.jhazmat.2019.121620 |
 2021, Vol. 40
2021, Vol. 40