2. 西北农林科技大学资源环境学院, 陕西 杨凌 712100
2. College of Resources and Environmental Science, Northwest A&F University, Yangling 712100, China
锌参与人体内200多种酶和蛋白质的组成,作为许多酶的催化剂,是人体必需的微量元素。目前,世界人口锌缺乏是一个全球性的健康问题,主要原因是锌摄取量低。因此,越来越多研究致力于食品增锌,希望通过增加作物锌含量来提高人体对锌的摄入量。施用锌肥作为一种普遍应用的方法,可在短期内有效增加作物锌含量,同时也可以增加土壤有效锌含量,为生物强化奠定基础。近年来,作为生产量位居世界第三的金属纳米材料,纳米氧化锌(Zinc oxide nanoparticles,ZnO NPs)在农业方面的应用越来越受到重视,且增锌效果已初见成效[1-3]。然而,广泛大规模的使用,在给人类带来巨大利益的同时也存在着潜在风险。ZnO NPs的生产、使用和处置,使其最终不可避免地进入环境中,影响生态环境及生物健康。尤其是在土壤环境中,ZnO NPs作为锌肥和杀虫剂广泛使用[4-5],其生物安全性及潜在影响已不容忽视。
近年来,越来越多的研究表明,ZnO NPs的独特性质会使其毒性增加。Xiang等[6]研究发现1~80 mg· L-1的ZnO NPs溶液明显抑制了白菜根的伸长。Hira等[7]证实了NPs对黑菜萌发和茎部生长的影响。He等[8]研究了ZnO NPs在线蚓中的动态积累和毒性效应,通过计算ZnO NPs悬浮液中的Zn2+浓度,发现悬浮液中以NPs颗粒为主,而不是Zn2+。Świątek等[9]发现在暴露于ZnO NPs污染土壤中48 h后,蚯蚓肠道上皮受到一定程度的损伤。Alves等[10]研究发现,ZnO NPs超过400 mg·kg-1时会对蚯蚓的繁殖率产生毒性影响,而浓度大于4 000 mg·kg-1时会对弹尾虫的繁殖率产生显著影响。因此,研究ZnO NPs对土壤生态环境的毒理效应是一个越来越受到科学关注的重要课题,可以为评估ZnO NPs对土壤带来的环境风险提供依据。
黄瓜是一种富含多种营养元素的蔬菜,具有生长速度快、对锌浓度的响应较好的特点[11]。黄瓜叶片面积较大,蒸腾速率高,比其他粮食作物的需水量大,这意味着黄瓜幼苗可能对纳米颗粒的吸收更大,导致ZnO NPs颗粒可能通过食物链对人体带来健康风险。作为一种重要的土壤动物,蚯蚓约占土壤动物生物总量的60%~80%[12],参与土壤有机质的分解、养分循环利用,且能促进微生物的生命活动[13]。有研究表明,蚯蚓具有体积大、生物量高等特征,且相比其他土壤无脊椎动物更易受到金属污染影响,适宜作为反映土壤质量的生物指示物,广泛用于重金属污染和食物链传递的生态毒理学研究[14],其存活率、抗氧化酶活性、抗氧化物质含量等是重要的生物标志物,可以有效地反映土壤的健康和安全状况[12]。赤子爱胜蚓繁殖率高、适应性强,是国际上蚯蚓毒性试验常用的品种。现有的研究发现,蚯蚓能有效降低土壤环境中污染物的毒性作用,促进作物的生长。Jiang等[15]研究指出,蚯蚓能抵抗纳米颗粒对番茄植株产生毒性,通过增强植物的抗逆性来帮助植物应对纳米颗粒的胁迫。Mkhinini等[16]也发现,蚯蚓能够显著促进废水灌溉后的蚕豆植株的生长,保护作物抵抗氧化应激。
目前,有关ZnO NPs对蚯蚓的毒性效应已有相关报道,但大部分研究都采用非天然土壤介质[17]或单一的培养体系[14],忽略了土壤系统中植物的存在,这种做法可能导致与自然环境条件下所观察到的毒性作用明显不同。土壤是一个非常复杂的系统,具有多种生物种群。土壤性质和系统多样性在很大程度上决定着ZnO NPs的环境行为、土壤中的锌形态及其生物利用度,因此无法正确、全面地评估ZnO Nps的生态毒性。此外,有关ZnO NPs在自然种植系统中的毒性研究未见报道。综上所述,本研究采用盆栽试验,评估ZnO NPs作为新型肥料,在自然土壤中对黄瓜幼苗生长、蚯蚓生理的影响,以期为评价ZnO NPs对土壤环境中的作物生长及动物安全的影响提供科学依据。
1 材料与方法 1.1 试验材料 1.1.1 试验试剂试验所用试剂盒购于南京建成生物工程研究所,纳米氧化锌(ZnO NPs,粒径70±10 nm,纯度>99.6%)购自山东宏升材料科技有限公司。
1.1.2 供试动物赤子爱胜蚓(Eisenia fetida)购于河北石家庄某养殖场,在试验开始前驯化一周,选取体型饱满、色泽鲜艳、环带发育健康的蚯蚓进行试验。
1.1.3 供试作物供试作物品种为对锌敏感的蔬菜黄瓜(亮优106)。在试验开始前先进行发芽,4 d后移栽,发芽期不做任何处理。
1.1.4 供试土壤供试土壤采自陕西省咸阳市永寿县御驾宫镇御中村农田耕作层(北纬34°49′,东经108°11′,海拔1 127 m),年平均降雨量为610 mm,平均气温为10.2 ℃,无霜期210 d。随机采集表层土壤(15~20 cm),自然风干后过2 mm网筛。土壤基本理化性质如表 1所示。
|
|
表 1 基地土壤基本理化性质 Table 1 Basic physical and chemical properties of base soil |
本研究以盆栽试验的形式进行。在整个试验过程中,平均日温度为25 ℃,平均夜温度为20 ℃,平均每日光照时间为16 h,相对湿度为65%,土壤湿度约为田间最大持水量的60%。
现阶段,预测环境中工程纳米颗粒(ENP)的浓度仍然存在许多阻碍问题。根据Jos'ko[18]和Sun等[19]的研究表明,土壤和污泥中ZnO NPs的浓度分别为10~ 100、17~110 mg·kg-1,且自然土壤中ZnO NPs的含量每年以0.06 μg·kg-1的速度逐渐增加[19]。虽然该预估值远小于现有研究得出的对土壤环境产生毒性效应的浓度,但随着纳米技术的发展和应用,ZnO NPs的环境浓度会快速增加,当其累计到一定程度就会对土壤环境造成威胁。基于此,本试验选择了更高的浓度来预测其在土壤环境中的毒性效应,试验共设置4个浓度梯度(mg·kg-1):0(CK)、50(Z50)、500(Z500)、1 000(Z1000),以纯锌计量。按N 46 mg·kg-1、P2O5 39 mg·kg-1、K2O 93 mg·kg-1作为基肥施入,与土壤充分混匀。每组浓度设置16个重复,每个重复加入2 kg供试土壤,移栽3株幼苗。其中,8个重复加蚯蚓(SE),蚯蚓添加量为每盆20条,另8个处理不加蚯蚓(S)。培养28 d后将蚯蚓和黄瓜幼苗取出,用超纯水将蚯蚓冲洗干净,放于25 ℃培养箱中过夜吐泥,备用。
1.3 测定指标及方法 1.3.1 蚯蚓的分析方法准确称取待测组织的质量,按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的生理盐水,冰水浴条件机械匀浆,2 500 r·min-1离心10 min,取上清液,即为10%的组织匀浆,用于蛋白定量(TP)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、丙二醛(MDA)的测定。具体测定方法和步骤按照相应的试剂盒进行。其中,SOD测定采用羟胺法,CAT测定采用紫外法,POD测定采用比色法,MDA测定采用TBA法,TP测定采用考马斯亮蓝法。
用质量分数为68% 的浓HNO3对干燥的蚯蚓样品进行微波消解,AAS测定锌含量。
1.3.2 黄瓜的分析方法黄瓜幼苗收获后,分别称取地上部和地下部的鲜质量,并计算总生物量。根部用0.01 mol·L-1 HNO3清洗,再用去离子水冲洗3次后吸干表面水分。根系活力测定采用氯化三苯基四氮唑(TTC)法,SOD测定采用NBT光还原法,POD测定采用愈创木酚比色法,CAT测定采用紫外法,MDA测定采用TBA法,锌含量采用AAS进行分析测定。
1.4 质量控制与质量保证本研究中使用的化学试剂均为优级纯试剂。采用经认证的标准参考材料[GBW10046(GSB-24)]验证分析过程的准确性,平均回收率为93%。在分析过程中,每测定20个样品进1次标准样品进行质量控制。
1.5 数据处理试验数据处理采用SPSS 19.0进行统计分析,采用LSD法进行多重比较,显著性水平为P < 0.05。
2 结果与分析 2.1 ZnO NPs对蚯蚓的影响 2.1.1 对存活率的影响从表 2可以看出,在28 d的培养周期中,不同浓度的ZnO NPs处理均未对蚯蚓的存活率产生显著影响,且存活率均大于87%,表明蚯蚓对ZnO NPs具有较强的耐受性。
|
|
表 2 ZnO NPs对蚯蚓存活率的影响 Table 2 Effects of ZnO NPs on earthworm survival rate |
SOD是一种天然的氧自由基清除剂,在整个酶促防御系统中占有重要地位。从图 1(A)可以看出,与对照组相比,SOD活性有增加的趋势,尤其是50、1 000 mg · kg-1处理组,分别较对照提高了16.6%、16.5%,但未达到显著水平。在图 1(B)中,与对照相比,不同浓度ZnO NPs处理中,CAT活性在50、500 mg·kg-1略微降低,在高浓度逐渐恢复至超过对照水平,较对照增加了25.7%,但仍未达到显著水平。如图 1(C)所示,在不同浓度ZnO NPs处理下,POD活性变化差异显著。在50、500 mg·kg-1时分别较对照显著降低了29.7%、21.9%,但在高浓度时逐渐恢复至对照水平,这与CAT活性变化趋势相似,表明POD和CAT具有协同清除H2O2的作用[20]。
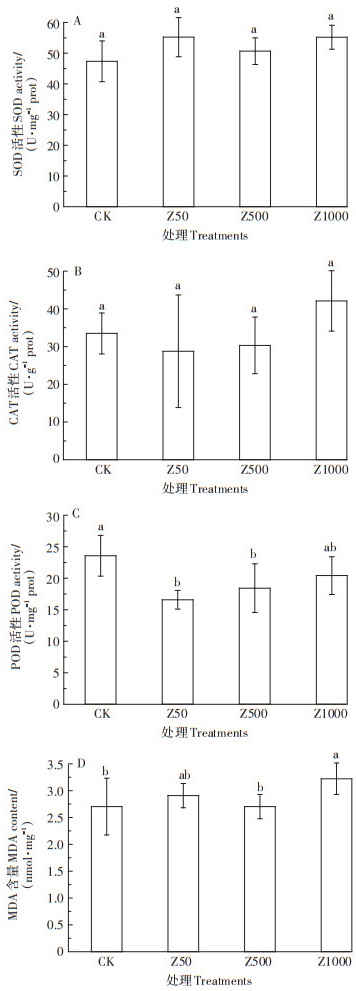
|
图中不同的小写字母表示处理间有显著差异(P < 0.05)。下同 Different lowercase letters in the figure indicate significant differences among treatments (P < 0.05). The same below 图 1 ZnO NPs对蚯蚓的抗氧化酶活性及MDA含量的影响 Figure 1 Effects of ZnO NPs on antioxidant enzyme activity and MDA content of earthworms |
MDA是自由基引发的脂质过氧化作用的最终分解产物,其含量的多少可间接反映ROS对机体的损伤程度。本试验中,随着处理浓度增加,MDA含量有增加的趋势,在浓度为1 000 mg·kg-1时变化显著,达到3.22 nmol·mg-1,较对照提高了19.2%。
2.1.3 对组织锌含量的影响锌是蚯蚓生长、成熟和繁殖所必需的基本元素,因此代谢过程中需要一定水平的锌元素。从表 3可以看出,与对照相比,随着ZnO NPs处理浓度增加,蚯蚓体内的锌含量有增加的趋势,但没有显著差异,总体维持在201.91~212.26 mg·kg-1的水平。
|
|
表 3 ZnO NPs对蚯蚓组织锌含量的影响 Table 3 Effects of ZnO NPs on Zn content in earthworm tissues |
从表 4可以看出,不同浓度ZnO NPs处理下,黄瓜的生物量发生了显著变化。在未添加蚯蚓的处理中,随着ZnO NPs浓度的增加,黄瓜的生物量先增加后降低。50 mg·kg-1处理显著促进了幼苗生长,此时生物量最大,为15.81 g,相比对照增加了33.1%;在500 mg·kg-1和1 000 mg·kg-1处理中,生物量呈现下降趋势,但与对照相比未达到显著水平。同样,黄瓜幼苗的根系活力也呈现先增加后降低的趋势。在ZnO NPs浓度为50 mg·kg-1时,根系活力显著增加,高达25.50 mg·g-1·h-1,是对照的2.1倍。随着处理浓度的增加,根系活力又降低至对照水平,其变化趋势与生物量一致。
|
|
表 4 ZnO NPs对黄瓜幼苗生物量及根系活力的影响 Table 4 Effects of ZnO NPs on biomass and root activity of cucumber seedlings |
观察同浓度ZnO NPs处理下蚯蚓对黄瓜幼苗生长的调节作用,发现在添加蚯蚓后,生物量和根系活性均显著提高。其中,生物量分别是未添加蚯蚓时的1.99、1.35、2.47、2.65倍,根系活力是未添加蚯蚓时的3.68、1.37、3.04、3.56倍,说明蚯蚓极大地促进了黄瓜幼苗的生长。
2.2.2 对抗氧化酶活性和MDA含量的影响当受到环境污染物等非生物胁迫时,植物体内会产生过多的ROS,从而激活细胞中去除ROS的抗氧化机制,防止ROS的潜在毒性危害。SOD、CAT、POD等能清除代谢过程中产生的ROS,使其处于一个较为稳定的水平。
图 2是ZnO NPs对黄瓜幼苗的抗氧化酶活性及MDA含量的影响。在未加蚯蚓的处理中,如图 2(A)所示,随着ZnO NPs浓度的增加,SOD活性先增加后降低,均显著高于对照组。在500 mg·kg-1 ZnO NPs处理中,SOD活性最大,为3.22 U-1·g-1·min-1,是对照组的3.7倍;50 mg·kg-1和1 000 mg·kg-1分别是对照组的2.45、1.83倍。在图 2(B)中,随着ZnO NPs处理浓度的增加,CAT活性逐渐增加,但低浓度处理未达到显著水平;500 mg·kg-1和1 000 mg·kg-1分别较对照增加了131.1%、127.0%。图 2(C)中,与对照相比,在50、500 mg·kg-1处理中,POD活性均未发现明显变化,但1 000 mg · kg-1处理组的POD活性显著增加,达2 854.58 U-1·g-1·min-1,比对照增加了22.4%。如图 2所示,研究同浓度ZnO NPs处理中是否添加蚯蚓对黄瓜幼苗抗氧化酶活性的影响,结果表明在添加蚯蚓后,除对照外,SOD活性在低、中、高浓度中均降低,在500 mg·kg-1和1 000 mg·kg-1处理中,SOD活性变化显著,不加蚯蚓处理组的SOD活性是添加蚯蚓的4.29、2.74倍。在对照组和低浓度处理下,添加蚯蚓可使黄瓜幼苗的CAT活性增加,且低浓度处理组差异显著,是不加蚯蚓的1.77倍;但在中、高浓度下,添加蚯蚓对CAT活性影响较小。对于植株POD活性来说,在对照组和所有ZnO NPs处理组中,添加蚯蚓后均未对POD活性造成显著影响。

|
图 2 ZnO NPs对黄瓜幼苗SOD、CAT、POD、MDA的影响 Figure 2 Effects of ZnO NPs on SOD, CAT, POD and MDA of cucumber seedlings |
ZnO NPs对黄瓜幼苗MDA含量的影响如图 2(D)所示。在不加蚯蚓的处理中,随着ZnO NPs浓度的增加,MDA含量有增加的趋势,1 000 mg·kg-1处理组增加达到显著水平,相比对照增加了34.1%。在同浓度ZnO NPs处理中,500 mg·kg-1和1 000 mg·kg-1浓度下,添加蚯蚓后的MDA含量较未添加蚯蚓时有降低的趋势,在1 000 mg·kg-1处理中达到显著水平,仅为不加蚯蚓处理的76.3%。
2.2.3 对锌含量的影响图 3为黄瓜幼苗地上部和地下部的锌含量。在不加蚯蚓的处理中,随着ZnO NPs处理浓度增加,地上部和地下部的锌含量显著增加。其中,地上部锌含量分别是对照的2.79、6.38、8.30倍,地下部分别是对照的1.31、3.72、6.19倍。同一浓度的两种处理中,在添加蚯蚓后,不管是地上部还是地下部锌含量均有降低的趋势,说明蚯蚓可能会影响黄瓜幼苗对ZnO NPs的吸收。
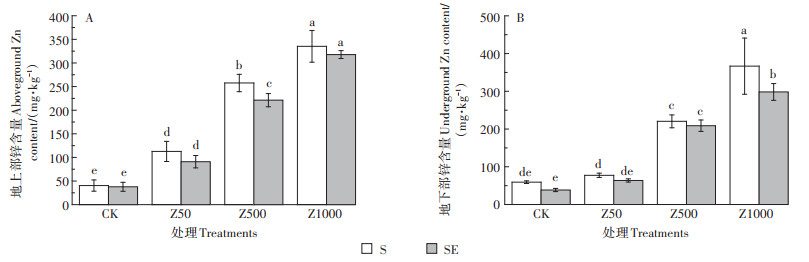
|
图 3 ZnO NPs对黄瓜幼苗地上部、地下部锌含量的影响 Figure 3 Effects of ZnO NPs on Zn content of aboveground parts and underground parts of cucumber seedlings |
本研究结果表明,即使在1 000 mg·kg-1 ZnO NPs处理中,蚯蚓的存活率也大于87%。同样,在GarcíaGómez等[21]的研究中,观察到蚯蚓在1 000 mg·kg-1 ZnO NPs处理中培养28 d后未发生死亡现象。Alves等[10]也发现,ZnO NPs浓度达到4 000 mg·kg-1,蚯蚓在土壤中的存活率大于90%。以往的研究表明在自然土壤中,ZnO NPs对蚯蚓的死亡率没有显著影响,证实了其生长状况和死亡率不受土壤中分散的NPs的影响[14]。这可能是因为蚯蚓能够自我修复,对ZnO NPs有一定的耐受机制。这说明在本研究中,以存活率为指标来表征ZnO NPs的毒性有限。这种毒害作用可能不会直接造成蚯蚓死亡,但会导致生物体的紊乱和疾病[10]。因此,还需关注其他生理指标,如抗氧化酶和MDA含量的变化等。
生物对环境胁迫的生物化学反应被认为是环境污染的早期警告指数,许多酶活性已被认为是环境污染的生物标志物。暴露于环境污染物的生物体中会产生活性氧(ROS),过量ROS能氧化诱导破坏脂质、蛋白质和核酸,从而干扰细胞的正常功能。氧化应激在NPs诱导的毒性影响中起着关键性的作用,可激活抗氧化酶活性,如SOD、CAT、POD等。在本试验中,随着ZnO NPs处理浓度的增加,与对照相比,蚯蚓的SOD、CAT和POD活性大多未发生显著性变化,但呈现出不同的变化趋势。Bao等[22]研究了ZnO NPs对蚯蚓的影响,发现在400 mg·kg-1处理下,其SOD活性与对照无显著差异,这与本试验结果一致,表明高浓度处理虽未对蚯蚓产生明显毒害作用,但在一定程度上诱导了ROS的产生,激活SOD作为抵抗氧化应激的机制。分析原因可能与供试土壤呈碱性有关。在碱性条件下,ZnO NPs不易水解,即产生的Zn2+较少,而Zn2+是造成纳米毒性的主要原因[23],并且土壤的pH值随ZnO NPs处理浓度的增加而升高,导致NPs更易聚集成微米级别颗粒,从而降低影响。胡长伟等[24]采用滤纸法研究了ZnO NPs对蚯蚓的毒性效应,结果表明随着处理浓度的增加,CAT活性均接近对照组,CAT反应不敏感,这与本试验结果相似。在50 mg·kg-1和500 mg·kg-1处理下,CAT活性有降低的趋势可能是因为蚯蚓体内抗氧化防御系统的介入,快速消除了ROS,故CAT活性并未增强。有研究表明重金属可以占据CAT活性位点,抑制底物的吸附,从而降低酶的活性,导致其活性比对照组低[25]。随着ZnO NPs处理浓度不断增加,蚯蚓受到氧化胁迫,CAT活性逐渐升高,在1 000 mg·kg-1处理下达到42.11 U·g-1 prot。这可能是因为CAT的作用底物为H2O2,是SOD的产物,此时蚯蚓体内SOD活性的增加会引起H2O2的积累,从而促进CAT活性的增强,使蚯蚓适应环境变化,平衡ROS[26]。在Liu等[27]的研究中,当蚯蚓暴露于不同浓度的甲霜灵后,体内的POD活性没有明显变化,说明在该试验中,CAT在清除过量H2O2时发挥了主要作用,从而降低了POD的负担,使POD活性变化不显著。Hu等[12]的研究结果表明当ZnO NPs浓度大于0.1 g·kg-1时,与对照相比,蚯蚓体内的MDA含量开始显著增加,但在浓度大于0.5 g·kg-1时,该趋势减小。曹圣来[28]的研究发现,在水稻土中,1 000 mg·kg-1的ZnO NPs处理下,蚯蚓的MDA含量显著升高。这些结果都表明在高浓度ZnO NPs处理下,蚯蚓受到的损伤不能完全被抗氧化酶中和,最终引起细胞损伤。然而,Bao等[22]的研究结果表明在400 mg·kg-1的ZnO NPs处理下,蚯蚓的MDA有降低的趋势,作者认为在其试验中ZnO NPs有保护蚯蚓不受氧化损伤的作用,也有部分研究同样提出了该观点[29-30],但作用机理还需进一步探究。大部分研究指出,不同的试验条件对ZnO NPs的毒性影响较大,包括土壤的基本理化性质、暴露时间以及NPs颗粒本身的影响等,这也可能是造成MDA变化不一致的主要原因。
3.2 对蚯蚓组织锌含量的影响在本试验中,不同浓度的ZnO NPs处理虽然对蚯蚓的生理造成了一定的影响,但蚯蚓体内的锌含量变化均未达到显著水平,锌含量变化范围为201.91~ 212.26 mg·kg-1。有研究表明,当土壤中ZnO NPs浓度达到1 000 mg·kg-1时,蚯蚓体内的锌浓度基本维持在100~200 mg·kg-1,这与本试验结果一致[21, 31]。同样地,Świątek等[32]对蚯蚓进行毒代动力学研究发现,当ZnO NPs浓度达到500、1 000 mg·kg-1时,蚯蚓能有效调节体内的锌浓度。以往有研究表明许多无脊椎动物对锌有非常高的排泄率,这说明在无脊椎动物体内,锌的解毒途径主要是通过排泄作用[33]。由此推测在本试验中,造成蚯蚓体内锌含量变化不显著的主要原因可能是蚯蚓对锌的排泄率较高。也有研究提出,当NPs颗粒通过摄食途径被蚯蚓摄入时,它们很有可能停留在蚯蚓的消化道而不能被吸收[34]。Lapied等[35]的试验表明当TiO2 NPs浓度在0~100 mg·kg-1时,蚯蚓在添加马粪的土壤中暴露2~8周后,没有发生生物积累,作者认为可能是由于TiO2 NPs没有穿过蚯蚓的肠道上皮或角质层屏障。Richardson等[36]通过研究镉对蚯蚓上角质层的影响发现,在受到污染物影响时,蚯蚓的上角质层加厚,增加镉进入蚯蚓体内的阻力,降低蚯蚓对镉的吸收,这可能是蚯蚓受到毒性影响的一种自身适应机制。蚯蚓能够调节其组织中的基本金属元素(如铜和锌)的浓度达到平衡,加之ZnO NPs的粒径、浓度等均能影响其生物有效性,所以这也可能造成锌含量变化不显著。García-Gómez等[37]提出,土壤pH每增加一个单位,土壤中锌的溶解度就降低100倍,碱性土壤的黏土含量高于酸性土壤,有助于锌的保留,从而降低蚯蚓对锌的可利用性,导致蚯蚓组织锌含量变化未达到显著水平。这也从侧面证实了蚯蚓对ZnO NPs的耐受性,故蚯蚓能在高浓度的ZnO NPs处理中保持较高的存活率。
3.3 对黄瓜幼苗生长的影响本试验的研究结果表明,在不加蚯蚓的处理中,随着ZnO NPs浓度的增加,黄瓜幼苗的生物量和根系活力均呈现先增加后降低的趋势,说明低浓度ZnO NPs可显著促进幼苗的生长,中、高浓度下这种促进作用减弱,甚至开始出现抑制生长的现象。高浓度ZnO NPs对植物根系的抑制作用可能表现为破坏植物的根部细胞。Amooaghaie等[38]在小麦的盆栽试验中发现,50 mg·L-1的ZnO NPs显著增加了茎和根的鲜质量,但当ZnO NPs浓度增加到大于100 mg·L-1时,其茎和根鲜质量均受到抑制。有试验表明,以200 mg·kg-1为临界浓度,ZnO NPs处理下的玉米的根、茎干质量呈现先增加后减小的趋势,最高浓度(3 200 mg·kg-1)处理组小于对照组[39],这与本试验结果一致。Zhao等[40]通过试验表明,在400 mg·kg-1和800 mg·kg-1 ZnO NPs处理下,黄瓜根系干生物量分别增加10.5% 和63%,这与本试验结果相反,分析原因可能也与供试土壤有关,该研究认为在有机土壤中,ZnO NPs不会影响黄瓜幼苗的生长。有研究指出,ZnO NPs可通过影响植物生长的根际细菌抑制吲哚乙酸的产生[41]。这说明在本试验条件下,当浓度大于50 mg·kg-1时,ZnO NPs可能抑制了黄瓜幼苗分泌吲哚乙酸,从而使其生物量和根系活力呈现出降低的趋势。
在同浓度的ZnO NPs处理下,添加蚯蚓的盆栽中,黄瓜幼苗的生物量和根系活力较未添加时显著增加。这说明蚯蚓极大地促进了植物生长,对作物发育有积极作用[42]。作为一种非常重要的土壤动物,蚯蚓可以通过掘穴、消化、排泄等活动改变土壤结构,改善土壤理化性质,改变微生物活性等[13, 43]。在蚯蚓的生命活动过程中,土壤的疏松度增加,有利于气体交换,改变了土壤的水特性,有机物加速分解,从而增加植物生长所需的营养成分。此外,蚯蚓还在碳、氮、磷循环中发挥重要作用,为土壤表面提供食物网,最终使黄瓜幼苗的生物量和根系活力显著提高。Puga-Freitas等[44]通过研究指出蚯蚓能够通过影响植物的根系直接影响生态系统的功能,通过粪便释放矿物质营养素和植物激素支持作物生长。Banerjee等[45]研究发现,蚯蚓的肠道细菌能调节吲哚乙酸、赤霉酸和铵离子的产生,增强1-氨基环丙烷羧酸脱氨酶活性以及磷酸盐溶解能力,进而促进植物生长和修复有毒微量元素的毒害作用。这种调节作用可能强于ZnO NPs对吲哚乙酸的抑制作用,从而促进幼苗生长。
3.4 对黄瓜幼苗抗氧化酶和MDA含量的影响在环境胁迫下,SOD是抵御ROS损伤的第一道屏障,分布广泛,可通过歧化反应将O2-转化为H2O2,再通过其他酶类将其分解为H2O。这说明在本试验条件下,随着浓度的增加,ZnO NPs对黄瓜幼苗的胁迫作用逐渐增大,植物体内产生的ROS越来越多,从而使SOD活性不断上升。当浓度超过500 mg·kg-1时,由于ROS含量不断增加,大量SOD被植物消耗,并且高浓度处理中,由ROS积累所引起的氧化胁迫可能超过了SOD的抗氧化作用,抑制了SOD活性,导致SOD活性显著下降,体内ROS的产生和清除达到动态平衡。Kim等[46]在黄瓜幼苗的水培试验中发现随着ZnO NPs处理浓度的增加(0~1 000 mg·L-1),CAT活性显著增加,这与本试验结果类似。由于CAT和POD均能清除H2O2,但POD活性在低、中浓度处理组中变化不显著,说明黄瓜植株受到氧化损伤后,CAT在清除H2O2的过程中占主导地位。在添加蚯蚓的处理组中,由于随着ZnO NPs浓度的增加,蚯蚓体内的SOD活性有增加的趋势,说明蚯蚓可能抵御了部分ZnO NPs产生的毒性,使黄瓜幼苗受到的胁迫降低,从而使SOD活性与未加蚯蚓处理相比有降低的趋势。近来也有试验证明蚯蚓的存在能够显著降低暴露于污染物的植物SOD活性[15]。SOD活性的下降可能与幼苗体内的O2-减少有关,使其氧化应激下调。对于幼苗的POD活性,虽然蚯蚓的存在削弱了ZnO NPs对黄瓜幼苗的氧化胁迫,降低了SOD的活性,但是即使是在这种情况下,植株体内本身还维持在较高的氧化应激水平,仍然需要大量CAT和POD保持在较为活跃的状态,以清除体内产生的H2O2。这说明蚯蚓在某种程度上可以缓解ZnO NPs对植株造成的氧化应激,抑制或稳定其抗氧化酶的活性。
ROS可干扰细胞膜,促进脂质过氧化,导致MDA的释放。因此,ROS的浓度直接反映了细胞对这种胁迫的响应程度。在低、中浓度下,由于氧化应激的作用,SOD等抗氧化酶活性增加,在清除ROS的同时对细胞起到了保护作用[28],故植株MDA含量变化不显著。然而,在高浓度处理下,植株受到的损伤不能完全被抗氧化酶中和,导致MDA含量显著上升。在本试验中,发现MDA含量的增加与幼苗生长参数的降低有关,生物量和根系活力越小,MDA含量越高,这与Mkhinini等[16]的试验结论一致。添加蚯蚓后,MDA含量呈现出降低的趋势,且与SOD活性变化趋势一致,进一步说明了蚯蚓能抑制一部分由ZnO NPs产生的毒害作用,使幼苗的脂质过氧化程度降低,证实了蚯蚓对植株生长的促进作用。
3.5 对黄瓜幼苗锌含量的影响作为一种新型肥料,ZnO NPs能显著提高黄瓜幼苗地上部和地下部的锌含量,这与现有研究结果一致。Zhang等[1]在其研究中证明了ZnO NPs对小麦的锌强化能力高于普通锌肥,在乳熟期喷施ZnO NPs,收获后小麦籽粒锌含量相比对照提升了44.02%。Du等[3]发现在盆栽试验中,ZnO NPs浓度超过20 mg·kg-1时能显著提高小麦各组织锌的含量,当浓度达到1 000 mg·kg-1时,籽粒锌含量是对照组的3.3倍。然而,在加入蚯蚓后,锌含量均有所降低。近年来,有研究提出蚯蚓不仅可以通过掘穴活动极大地减少真菌生物量,还可以加速细菌代谢的不稳定有机底物的释放,从而使细菌比例升高,有利于形成以细菌为主导地位的微生物群落[47]。蚯蚓对黄瓜幼苗吸收锌的影响是否与此种特殊的微生物群落相关,还需进一步研究说明。
4 结论(1) 随ZnO NPs处理浓度的增加,蚯蚓组织的锌含量未产生显著变化。高浓度处理中,蚯蚓MDA含量显著升高,SOD、POD和CAT均无显著差异。表明蚯蚓对ZnO NPs的响应较低,对高浓度处理耐受性较强。
(2) 与对照相比,以500 mg·kg-1为临界浓度,土施ZnO NPs对黄瓜幼苗的生长具有低浓度促进、高浓度抑制的效应。当处理浓度高于临界浓度时,黄瓜幼苗受到氧化损伤。ZnO NPs能显著提高植株地上和地下部的锌含量。
(3) 蚯蚓的加入能显著促进黄瓜幼苗的生长,能在一定程度上抑制或缓解ZnO NPs对植株的损伤,中、高浓度处理组的MDA含量表现尤为明显。总体上,ZnO NPs作为一种新型肥料,能显著促进幼苗生长,且不会对蚯蚓造成影响。
| [1] |
Zhang T, Sun H, Lv Z, et al. Using synchrotron-based approaches to examine the foliar application of ZnSO4 and ZnO nanoparticles for field-grown winter wheat[J]. Journal of Agricultural & Food Chemistry, 2018, 66(11): 2572-2579. |
| [2] |
孙宏达, 钟民正, 张腾, 等. 黄土高原潜在缺锌区施用纳米氧化锌(ZnO NPs) 对冬小麦生长及籽粒品质的影响[J]. 农业环境科学学报, 2019, 38(9): 2041-2048. SUN Hong-da, ZHONG Min-zheng, ZHANG Teng, et al. Effects of ZnO NPs application on winter wheat growth and grain quality in a potentially zinc-deficient area of the Loess Plateau, China[J]. Journal of Agro-Environment Science, 2019, 38(9): 2041-2048. |
| [3] |
Du W, Yang J, Peng Q, et al. Comparison study of zinc nanoparticles and zinc sulphate on wheat growth: From toxicity and zinc biofortification[J]. Chemosphere, 2019, 227: 109-116. DOI:10.1016/j.chemosphere.2019.03.168 |
| [4] |
Chhipa H. Nanofertilizers and nanopesticides for agriculture[J]. Environmental Chemistry Letters, 2016, 15(1): 15-22. |
| [5] |
Duhan J S, Kumar R, Kumar N, et al. Nanotechnology: The new perspective in precision agriculture[J]. Biotechnology Reports, 2017, 15: 11-23. DOI:10.1016/j.btre.2017.03.002 |
| [6] |
Xiang L, Zhao H, Li Y, et al. Effects of the size and morphology of zinc oxide nanoparticles on the germination of Chinese cabbage seeds[J]. Environmental Science and Pollution Research, 2015, 22(14): 10452-10462. DOI:10.1007/s11356-015-4172-9 |
| [7] |
Hira Z, Attarad A, Ali J S, et al. Effect of ZnO nanoparticles on brassica nigra seedlings and stem explants: Growth dynamics and antioxidative response[J]. Frontiers in Plant Science, 2016, 7: 535. |
| [8] |
He E, Qiu H, Huang X, et al. Different dynamic accumulation and toxicity of ZnO nanoparticles and ionic Zn in the soil sentinel organism Enchytraeus crypticus[J]. Environmental Pollution, 2019, 245: 510-518. DOI:10.1016/j.envpol.2018.11.037 |
| [9] |
Świątek Z M, Woznicka O, Bednarska A J. Unravelling the ZnO-NPs mechanistic pathway: Cellular changes and altered morphology in the gastrointestinal tract of the earthworm Eisenia andrei[J]. Ecotoxicology and Environmental Safety, 2020, 196: 110532. DOI:10.1016/j.ecoenv.2020.110532 |
| [10] |
Alves M L, Oliveira Filho L C I, Nogueira P, et al. Influence of ZnO nanoparticles and a non-nano ZnO on survival and reproduction of earthworm and springtail in tropical natural soil[J]. Revista Brasileira de Ciência do Solo, 2019, 43: e0180133. DOI:10.1590/18069657rbcs20180133 |
| [11] |
Moghaddasi S, Fotovat A, Khoshgoftarmanesh A H, et al. Bioavailability of coated and uncoated ZnO nanoparticles to cucumber in soil with or without organic matter[J]. Ecotoxicology and Environmental Safety, 2017, 144: 543-551. DOI:10.1016/j.ecoenv.2017.06.074 |
| [12] |
Hu C, Li M, Cui Y, et al. Toxicological effects of TiO2 and ZnO nanoparticles in soil on earthworm Eisenia fetida[J]. Soil Biology and Biochemistry, 2010, 42(4): 586-591. DOI:10.1016/j.soilbio.2009.12.007 |
| [13] |
Wu Y, Shaaban M, Peng Q, et al. Impacts of earthworm activity on the fate of straw carbon in soil: A microcosm experiment[J]. Environmental Science and Pollution Research, 2018, 25(11): 11054-11062. DOI:10.1007/s11356-018-1397-4 |
| [14] |
Romero-Freire A, Lofts S, Martin Peinado F, et al. Effects of aging and soil properties on zinc oxide nanoparticle availability and its ecotoxicological effects to the earthworm Eisenia andrei[J]. Environmental Toxicology and Chemistry, 2017, 36(1): 137-146. DOI:10.1002/etc.3512 |
| [15] |
Jiang L, Wang B, Liang J, et al. Reduced phytotoxicity of nonylphenol on tomato (Solanum lycopersicum L.) plants by earthworm casts[J]. Environmental Pollution, 2020, 265: 115020. DOI:10.1016/j.envpol.2020.115020 |
| [16] |
Mkhinini M, Helaoui S, Boughattas I, et al. Earthworm Eisenia andrei modulates oxidative stress in bean plants Vicia faba irrigated with treated wastewater[J]. Ecotoxicology, 2020, 29(7): 1003-1016. DOI:10.1007/s10646-020-02243-y |
| [17] |
Servin A D, White J C. Nanotechnology in agriculture: Next steps for understanding engineered nanoparticle exposure and risk[J]. Nanoimpact, 2016, 1: 9-12. DOI:10.1016/j.impact.2015.12.002 |
| [18] |
Jośko I, Oleszczuk P. Influence of soil type and environmental conditions on ZnO, TiO2 and Ni nanoparticles phytotoxicity[J]. Chemosphere, 2013, 92(1): 91-99. DOI:10.1016/j.chemosphere.2013.02.048 |
| [19] |
Sun T Y, Gottschalk F, Hungerbuehler K, et al. Comprehensive probabilistic modelling of environmental emissions of engineered nanomaterials[J]. Environmental Pollution, 2014, 185(2): 69-76. |
| [20] |
Li X, Zhu L, Du Z, et al. Mesotrione-induced oxidative stress and DNA damage in earthworms(Eisenia fetida)[J]. Ecological Indicators, 2018, 95: 436-443. DOI:10.1016/j.ecolind.2018.08.001 |
| [21] |
García-Gómez C, Babin M, Obrador A, et al. Toxicity of ZnO nanoparticles, ZnO bulk, and ZnCl2 on earthworms in a spiked natural soil and toxicological effects of leachates on aquatic organisms[J]. Archives of Environmental Contamination & Toxicology, 2014, 67(4): 465-473. |
| [22] |
Bao S, Huang M, Tang W, et al. Opposite effects of the earthworm Eisenia fetida on the bioavailability of Zn in soils amended with ZnO and ZnS nanoparticles[J]. Environmental Pollution, 2020, 260: 114045. DOI:10.1016/j.envpol.2020.114045 |
| [23] |
Waalewijn-Kool P L, Rupp S, Lofts S, et al. Effect of soil organic matter content and pH on the toxicity of ZnO nanoparticles to Folsomia candida[J]. Ecotoxicology and Environmental Safety, 2014, 108: 9-15. DOI:10.1016/j.ecoenv.2014.06.031 |
| [24] |
胡长伟, 崔益斌, 李丁生, 等. 纳米ZnO与TiO2对赤子爱胜蚓(Eisenia foetida) 的毒性效应[J]. 生态毒理学报, 2011, 6(2): 200-206. HU Chang-wei, CUI Yi-bin, LI Ding-sheng, et al. Ecotoxicological effect of ZnO and TiO2 nanoparticles on earthworm(Eisenia foetida)[J]. Asian Journal of Ecotoxicology, 2011, 6(2): 200-206. |
| [25] |
Zhang Y, Shen G, Yu Y, et al. The hormetic effect of cadmium on the activity of antioxidant enzymes in the earthworm(Eisenia fetida)[J]. Environmental Pollution, 2009, 157(11): 3064-3068. DOI:10.1016/j.envpol.2009.05.039 |
| [26] |
Ma J, Cheng C, Du Z, et al. Toxicological effects of pyraclostrobin on the antioxidant defense system and DNA damage in earthworms(Eisenia fetida)[J]. Ecological Indicators, 2019, 101: 111-116. DOI:10.1016/j.ecolind.2019.01.015 |
| [27] |
Liu T, Zhu L, Han Y, et al. The cytotoxic and genotoxic effects of metalaxy-M on earthworms(Eisenia fetida)[J]. Environmental Toxicology & Chemistry, 2015, 33(10): 2344-2350. |
| [28] |
曹圣来. 典型纳米金属氧化物对不同类型土壤中蚯蚓、小麦的毒性效应[D]. 南京: 南京大学, 2015. CAO Sheng-lai. Toxicology of metal oxide nanoparticles on earthworm and wheat in different types of soils[D]. Nanjing: Nanjing University, 2015. |
| [29] |
Jiang J, Pi J, Cai J. The advancing of zinc oxide nanoparticles for biomedical applications[J]. Bioinorganic Chemistry and Applications, 2018, 2018: 1-18. |
| [30] |
Venkatachalam P, Priyanka N, Manikandan K, et al. Enhanced plant growth promoting role of phycomolecules coated zinc oxide nanoparticles with P supplementation in cotton(Gossypium hirsutum L.)[J]. Plant Physiology and Biochemistry, 2017, 110: 118-127. DOI:10.1016/j.plaphy.2016.09.004 |
| [31] |
García-Gómez C, Fernández M D, Babin M, et al. Ecotoxicological evaluation of sewage sludge contaminated with zinc oxide nanoparticles[J]. Archives of Environmental Contamination & Toxicology, 2014, 67(4): 494-506. DOI:10.1007/s00244-014-0070-2 |
| [32] |
Świątek Z M, van Gestel C, Bednarska A J, et al. Toxicokinetics of zinc-oxide nanoparticles and zinc ions in the earthworm Eisenia andrei[J]. Ecotoxicology & Environmental Safety, 2017, 143: 151-158. |
| [33] |
Spurgeon D J, Hopkin S P. Comparisons of metal accumulation and excretion kinetics in earthworms(Eisenia fetida) exposed to contaminated field and laboratory soils[J]. Applied Soil Ecology, 1999, 11(2/3): 227-243. |
| [34] |
Bour A, Mouchet F, Silvestre J, et al. Environmentally relevant approaches to assess nanoparticles ecotoxicity: A review[J]. Journal of Hazardous Materials, 2015, 283: 764-777. DOI:10.1016/j.jhazmat.2014.10.021 |
| [35] |
Lapied E, Nahmani J Y, Moudilou E, et al. Ecotoxicological effects of an aged TiO2 nanocomposite measured as apoptosis in the anecic earthworm Lumbricus terrestris after exposure through water, food and soil[J]. Environment International, 2011, 37(6): 1105-1110. DOI:10.1016/j.envint.2011.01.009 |
| [36] |
Richardson J B, Görres J H, Sizmur T. Synthesis of earthworm trace metal uptake and bioaccumulation data: Role of soil concentration, earthworm ecophysiology, and experimental design[J]. Environmental Pollution, 2020, 262: 114126. DOI:10.1016/j.envpol.2020.114126 |
| [37] |
García-Gómez C, García-Gutierrez S, Obrador A, et al. Study of Zn availability, uptake, and effects on earthworms of zinc oxide nanoparticle versus bulk applied to two agricultural soils: Acidic and calcareous[J]. Chemosphere, 2019, 239: 124814. |
| [38] |
Amooaghaie R, Norouzi M, Saeri M, et al. Impact of zinc and zinc oxide nanoparticles on the physiological and biochemical processes in tomato and wheat[J]. Botany, 2017, 95(5): 441-455. DOI:10.1139/cjb-2016-0194 |
| [39] |
Liu X, Wang F, Shi Z, et al. Bioavailability of Zn in ZnO nanoparticle-spiked soil and the implications to maize plants[J]. Journal of Nanoparticle Research, 2015, 17(4): 175. DOI:10.1007/s11051-015-2989-2 |
| [40] |
Zhao L, Sun Y, Hernandez-Viezcas J A, et al. Influence of CeO2 and ZnO nanoparticles on cucumber physiological markers and bioaccumulation of Ce and Zn: A life cycle study[J]. Journal of Agricultural & Food Chemistry, 2013, 61(49): 11945-11951. |
| [41] |
Rajput V D, Minkina T M, Behal A, et al. Effects of zinc-oxide nanoparticles on soil, plants, animals and soil organisms: A review[J]. Environmental Nanotechnology Monitoring & Management, 2018, 9: 76-84. |
| [42] |
Fonte S J, Botero C, Quintero D C, et al. Earthworms regulate plant productivity and the efficacy of soil fertility amendments in acid soils of the Colombian Llanos[J]. Soil Biology and Biochemistry, 2019, 129: 136-143. DOI:10.1016/j.soilbio.2018.11.016 |
| [43] |
Sun Y, Zhao L, Li X, et al. Stimulation of earthworms(Eisenia fetida) on soil microbial communities to promote metolachlor degradation[J]. Environmental Pollution, 2019, 248: 219-228. DOI:10.1016/j.envpol.2019.01.058 |
| [44] |
Puga-Freitas R, Barot S, Taconnat L, et al. Signal molecules mediate the impact of the earthworm aporrectodea caliginosa on growth, development and defence of the plant Arabidopsis thaliana[J]. Public Library of Science, 2012, 7(12): e49504. |
| [45] |
Banerjee A, Biswas J K, Pant D, et al. Enteric bacteria from the earthworm(Metaphire posthuma) promote plant growth and remediate toxic trace elements[J]. Journal of Environmental Management, 2019, 250: 109530. DOI:10.1016/j.jenvman.2019.109530 |
| [46] |
Kim S, Lee S, Lee I. Alteration of phytotoxicity and oxidant stress potential by metal oxide nanoparticles in cucumis sativus[J]. Water Air and Soil Pollution, 2012, 223(5): 2799-2806. DOI:10.1007/s11270-011-1067-3 |
| [47] |
Liu T, Chen X, Gong X, et al. Earthworms coordinate soil biota to improve multiple ecosystem functions[J]. Current Biology, 2019, 29(20): 3420-3429e5. DOI:10.1016/j.cub.2019.08.045 |
 2021, Vol. 40
2021, Vol. 40






