2. 江西省科学院能源研究所, 南昌 330096;
3. 南京农业大学植物保护学院昆 虫系, 南京 210095
2. Institute of Energy, Jiangxi Academy of Science, Nanchang 330096, China;
3. Department of Entomology, College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China
除草剂是全球第一大农药类型[1]。随着单一作物及抗除草剂类作物的种植面积不断增加,除草剂因省力高效、适合机械化操作,其需求量依然在增加[2-3]。然而实际施用时并非全部施用量,甚至仅有40% 的施用量能够实现药效,其余随风、水形成低浓度除草剂扩散到农田周边非靶标区域[4]。农田周边的休耕地等半自然生境对农业生态系统中生物多样性保护和农业生产均具有十分重要的价值,如维持生物多样性、为农业传粉者和害虫天敌提供栖息地[5-6]。除草剂,包括低浓度除草剂对农业生态系统中非靶标区域的生物群落的影响已受到关注,但是其生态风险尚未得到充分评估。除草剂生态风险研究将科学地支撑农业生态系统中生物多样性保护和管理决策[7]。
植物是食物网最重要的组成部分,具有生态系统更高营养级维持、水土保持等生态系统服务功能[8-9]。线虫是土壤动物区系中最丰富的无脊椎动物,能驱动和调控土壤养分循环和物质转化,其群落组成和功能群结构可以反映土壤质量及自然和人为扰动状况,被视为环境指示生物[10-13]。针对除草剂包括低浓度除草剂对农业生态系统中非靶标区域(如田埂、休耕地)中植物群落的影响开展了少量研究,不同类型的半自然生境表现出不同的响应特征[14-16]。除草剂对土壤线虫的影响包括直接毒性作用,以及除草剂抑制地表植被生长而造成土壤线虫营养缺乏的间接影响[17]。研究低浓度除草剂对农业生态系统半自然生境中植物和土壤线虫群落的影响,将从地上和地下生物的响应更加全面地揭示低浓度除草剂的生态风险。
近年来,随着我国农村劳动力不断向城市转移,农田转变成休耕地的现象时有发生。因此,本研究选取我国北方一处休耕地为研究对象,基于大田控制试验喷施低于大田推荐剂量的除草剂,对比分析不同低浓度除草剂对植物及土壤线虫群落的影响,以期为评估低剂量除草剂的生态风险提供参考。
1 材料与方法 1.1 样地概况与实验设计本实验为大田控制实验,位于中国环境科学研究院北京顺义实验基地。该基地位于北京市(39.4~41.6°N、115.7~117.4°E)顺义区赵全营镇,属于典型北温带半湿润大陆性季风气候,夏季高温多雨,冬季寒冷干燥,全年80% 降水集中在6—8月,年均降水量655 mm,年均温13.4 ℃,全年无霜期180~200 d。实验田占地约1 500 m2,于2011—2013年种植玉米和油菜,未施用农药,2014年3月机械匀地使土壤处于匀质状态,未开展农业种植。样地植物群落主要物种为马唐(Digitaria sanguinalis)、反枝苋(Amaranthus retroflexus)、苘麻(Abutilon theophrasti)、藜(Chenopodium album)等。样地土壤为潮土,pH为7.5,土壤有机质含量为6.93 g·kg-1。
选取我国北方旱地农田广泛使用且除草机理不同的两种除草剂,即莠去津(山东胜邦绿野化学有限公司生产)和苯磺隆(山东侨昌化学有限公司生产)。莠去津是一种用于土壤和叶片处理的三嗪类除草剂,除草机理是与光合作用电子传递系统中的质体醌结合位点结合,抑制光合作用,在环境中具有持久性[18-19]。苯磺隆能快速被植物的叶片吸收,抑制乙酰内酯合酶,该酶是生物合成支链氨基酸的关键酶[20]。两种除草剂浓度设定均依据产品推荐大田施用剂量设定。
2014年4月采用随机区组设计开展大田实验,共设4个小区(即4次重复),每个小区内分别设置7个处理,分别为未施用除草剂而施用等量清水的空白样地(CK)、大田推荐剂量莠去津(1 200 g·hm-2,以有效成分计)处理样地(A1)、大田推荐剂量50%的莠去津(600 g·hm-2,以有效成分计)处理样地(A2)、大田推荐剂量25% 的莠去津(300 g·hm-2,以有效成分计)处理样地(A3)、大田推荐剂量苯磺隆(22.5 g·hm-2,以有效成分计)处理样地(T1)、大田推荐剂量50%的苯磺隆(11.25 g·hm-2,以有效成分计)处理样地(T2)、大田推荐剂量25%的苯磺隆(5.63 g·hm-2,以有效成分计)处理样地(T3),每个小区内不同处理样地随机分布,共计28块处理样地。每个样地为3 m×5 m,样地间距离2~3 m。2014年6月20日进行除草剂的喷施处理,与华北地区夏玉米施用除草剂时间一致。在喷施除草剂时,各处理样地四周搭建高度1.5 m塑料薄膜隔离带,72 h后拆除,防止除草剂扩散导致各实验处理间产生相互影响。采用手动农药喷雾器进行喷施(NS-5,Worth生产,上海),喷头压力为2×105 Pa。
1.2 样品采集与物种鉴定实验在除草剂处理30 d后进行植物样方调查和土壤样品采集[21-22]。每个处理样地内分别随机选取3个50 cm×50 cm植物样方,样方距离样地边缘 > 1 m,记录物种种类、数量,依据《中国植物志》(http://www.iplant.cn/frps)鉴定物种。每个处理样地内用五点取样法取土样,除去地表凋落物层取0~10 cm表层土壤,除去植物残体、石块等杂物,土样充分混合后四分法取土。称取100 g鲜土样,采用改进的Baermann浅盘法分离提取线虫[23]。在体视显微镜下对线虫计数,并转换为100 g土样中线虫数量[23]。在不同处理样地提取的线虫中随机取100条(< 100条取全部个体),依据《中国土壤动物检索图鉴》 [24]鉴定。
1.3 数据处理Shannon-Wiener多样性指数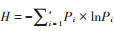
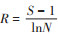
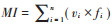
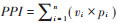
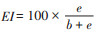
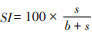
采用双因素方差分析(Two-way ANOVA)分析除草剂种类、除草剂浓度,以及二者间相互作用对植物群落和土壤线虫群落各指数的影响。对差异显著的主要影响因素再采用单因素方差分析(ANOVA),并采用Fisher’ s Protected LSD进行多重比较,采用SPSS 20.0软件进行数据分析,Origin8.5软件作图。用基于Bray-Curtis距离的非度量多维尺度(Non-metric multidimensional scaling,NMDS)分析植物群落多样性与线虫群落组成的相似性。用Mantel test方法检测植物物种多样性与线虫群落多样性的相关关系及显著性。用R软件vegan包完成NMDS和Mental test分析,并用ggplot2包进行NMDS出图。
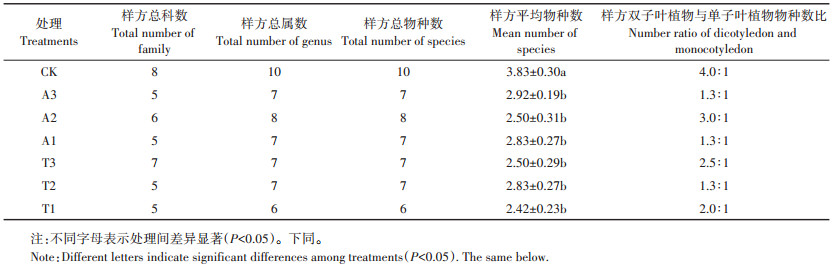
2 结果与分析 2.1 对植物群落组成的影响与空白对照相比,莠去津和苯磺隆均减少了样方总科属数、总物种数、样方平均物种数,而不同除草剂及不同浓度处理对样方平均物种的数量影响差异不显著(P≥0.05)(表 1)。所有处理样地中样方共记录14属15种植物,隶属于菊科(Compositae)(3属3种)、禾本科(Gramineae)(3属3种)、旋花科(Convolvulaceae)(1属2种)等共10个科。不同处理样地中观测个体数量最多的植物均为马唐(Digitaria sanguinalis),而个体数量位于第二位的植物在不同处理样地中不相同,空白样地(CK)中为狗尾草属(Setaria spp.),大田推荐剂量莠去津(A1)、大田推荐剂量25% 的莠去津(A3)处理样地及3个浓度苯磺隆(T1、T2、T3)处理样地中均为反枝苋(Amaranthus retroflexus),大田推荐剂量50% 的莠去津(A2)处理样地为苘麻(Abutilon theophrasti)。
|
|
表 1 不同处理样地植物物种数量 Table 1 Plant species number of different treatment |
2种除草剂及其不同浓度的处理样地中植物群落的物种组成均存在差异。与CK样地相比,莠去津和苯磺隆处理样地中双子叶与单子叶植物物种数量比例降低;莠去津不同浓度处理样地中该比例排序为A2 > A3=A1,苯磺隆不同处理样地中该比例是T3 > T1 > T2(见表 1)。马唐、反枝苋和苘麻是所有处理样地中均有分布的种,马齿苋(Portulaca oleracea)、野大豆(Glycine soja)、丝瓜(Luffa aegyptiaca)和苍耳(Xanthium sibiricum)仅发现于CK样地,而豚草(Ambrosia artemisiifolia)、萝藦(Metaplexis japonica)、裂叶牵牛(Pharbitis nil)、牵牛花(Pharbitis purpurea)、稗子(Echinochloa crusgalli)均没有出现在CK样地。
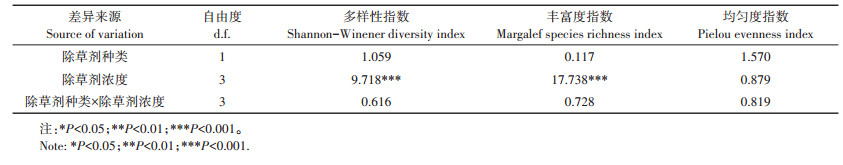
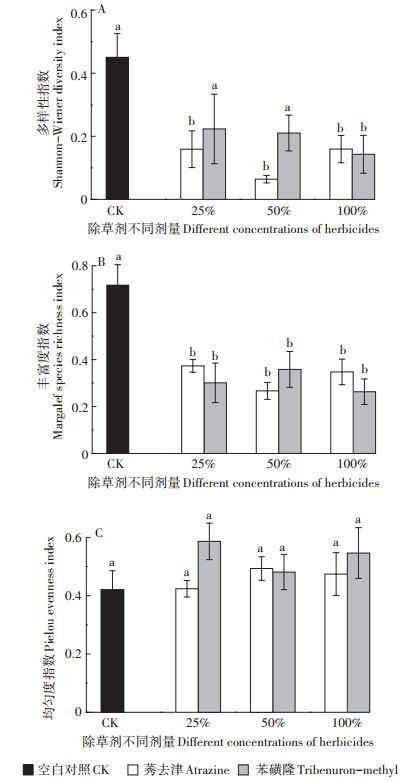
2.2 对植物群落多样性的影响除草剂种类对野生植物群落多样性指数、丰富度指数和均匀度指数的影响差异均不显著(P≥0.05),除草剂浓度对野生植物群落多样性指数和丰富度指数影响差异显著,而对均匀度指数的影响差异均不显著,且除草剂种类与浓度间对植物群落多样性指数不存在交互作用(表 2)。两种除草剂施用大田推荐量25%、50% 和100% 处理样地中的植物群落多样性指数和丰富度指数均差异较小(图 1)。
|
|
表 2 双因素方差分析(F值)除草剂种类、除草剂浓度及其二者交互作用对植物群落多样性指数的影响 Table 2 Two-way ANOVA results(F values)for testing for herbicide type, dose and their interactions on the diversity indexes of the plant communities |
|
不同字母表示处理间差异显著(P < 0.05) Different letters indicate significant differences among treatments (P < 0.05) 图 1 不同处理下的野生植物群落多样性指数 Figure 1 Diversity indexes of plant communities in different treatments |
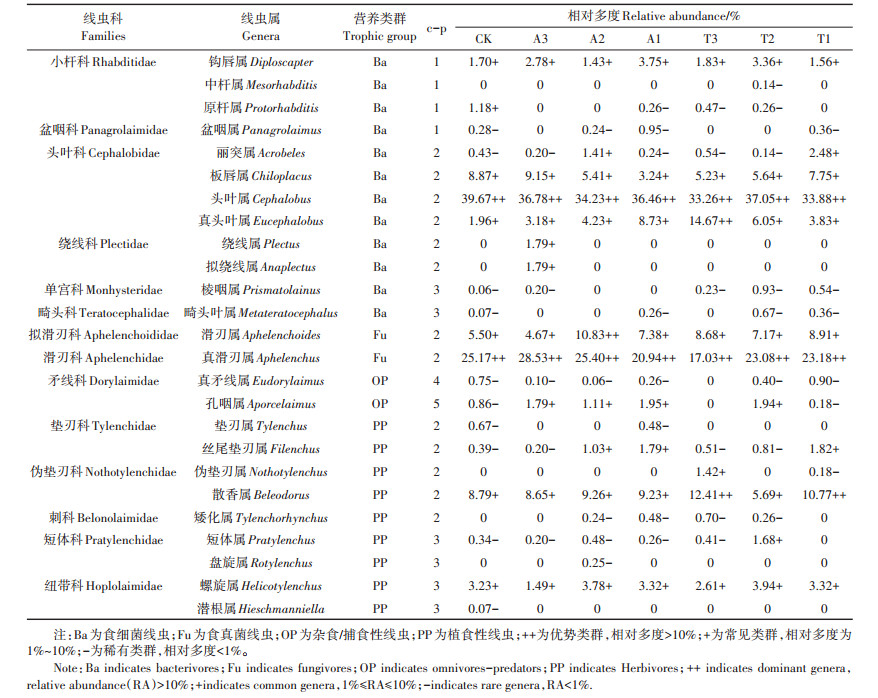
所有处理样地的样方共鉴定出25属线虫,CK样地鉴定出19属线虫,A3、A2、A1样地分别鉴定出16、16属和18属线虫,T3、T2、T1样地分别鉴定出15、18属和16属线虫。个体数量占线虫总个体数量 > 10% 的为优势类群,1%~10% 为常见类群,< 1% 为稀有类群[32]。头叶属(Cephalobus)和真滑刃属(Aphelenchus)是所有处理样地的优势属;不同处理样地中线虫的稀有属存在差异,CK样地中有10个稀有属,而其他处理样地中稀有属数量减少且组成也不同(表 3)。结果表明施用不同剂量的莠去津或苯磺隆均改变了土壤线虫群落组成,改变了土壤线虫群落中稀有属。
|
|
表 3 不同处理土壤线虫群落组成 Table 3 Community composition of soil nematode of different treatments |
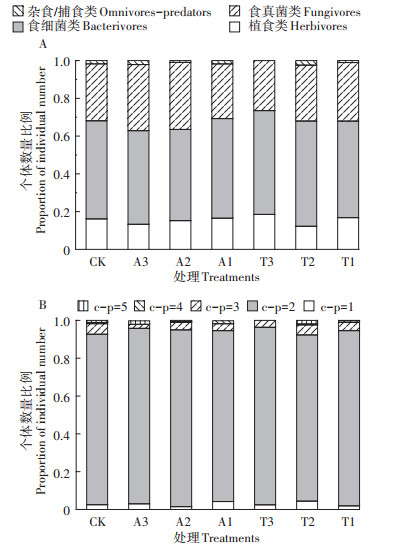
根据线虫的形态特征可分为植食、食细菌、食真菌和捕食/杂食共4个营养类群[10],CK与除草剂处理样地中的各营养类型土壤线虫个体数量比例相似,均是以食细菌类土壤线虫个体数量比例最高,杂食/捕食类最低(图 2A)。c-p值为2的土壤线虫数量在不同处理样地中均最大,除T3样地外,相对于CK样地,施用除草剂的样地均减少了c-p值为3~5的线虫数量,表明施用除草剂使土壤承受了更大的环境胁迫压力(图 2B)。
|
图 2 不同处理样地中不同类型土壤线虫组成 Figure 2 Different types composition of soil nematodes of different treatments |
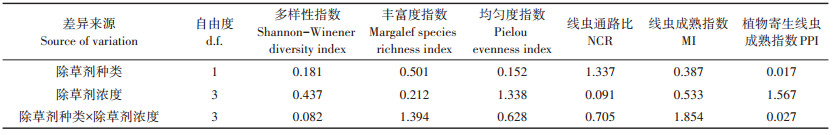
所有样地土壤线虫的NCR处于0.51~0.65,表明不同处理样地的土壤有机质分解过程均以细菌通道为主,但是与CK相比,A3和A2样地中有机质分解过程中细菌通道有所抑制,向真菌分解方向变化(表 4)。不同处理样地中土壤线虫MI均在2~3(T3除外),属于产卵量大且世代时间短的耐环境压力类群(表 4),表明不同处理样地中土壤环境均受外界干扰较大;PPI为2.15~2.47,表明不同处理样地中植物寄生线虫受植物根系影响较小。MI和PPI表明不同处理样地中土壤线虫生活史多样性相似[25]。根据土壤线虫EI和SI分析,所有处理样地的土壤环境条件均较差,且均处于高干扰环境中(图 3)。双因素方差分析表明,除草剂不同种类、不同浓度处理对样地的土壤线虫群落丰富度、均匀度和多样性指数,及土壤线虫群落丰富度、均匀度和多样性指数,及土壤线虫NCR、MI和PPI的影响均不显著,且除草剂种类与浓度间对土壤线虫群落特征指数影响不存在交互作用(表 5)。
|
|
表 4 不同处理样地中土壤线虫群落特征指数 Table 4 Indexes of soil nematode community of different treatments |

|
1、2、3、4分别代表空白对照、大田推荐剂量的25%、大田推荐剂量的50%、大田推荐剂量 1, 2, 3, 4 indicate the blank control, 25%, 50% and 100% of the recommended field application concentration, respectively 图 3 不同处理样地中土壤线虫EI与SI Figure 3 EI and SI of soil nematode in different treatments |
|
|
表 5 双因素方差分析(F值)除草剂种类、除草剂浓度及二者交互作用对土壤线虫群落特征指数的影响 Table 5 Two-way ANOVA results(F values)for testing for herbicide type, dose and their interactions on the indexes of the soil nematode community |
为进一步分析植物多样性对土壤线虫群落的影响,基于Bray-Curtis相似性矩阵的非度量多维尺度排序,分析土壤线虫群落在植物多样性梯度下的分布特征。结果发现,土壤线虫群落在排序图中没有呈现出明显的分异情况,说明植物多样性对不同处理的土壤线虫群落没有表现出很强的影响(图 4)。Mantel test分析表明,植物多样性与土壤线虫多样性无显著相关关系(r=-0.006,P=0.41)。
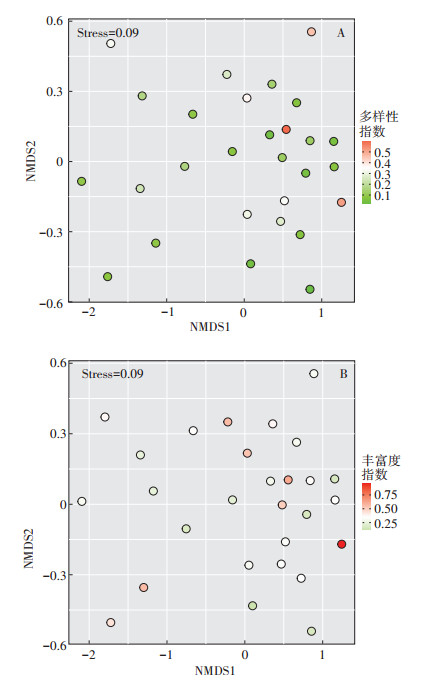
|
图 4 基于Bray-Curtis距离的非度量多维尺度图 Figure 4 Non-metric multidimensional scaling diagram based on Bray-Curtis distance |
短时间内野生植物群落和土壤线虫群落对除草剂的响应不同。本研究中,在施用除草剂30 d后,休耕地中植物群落多样性和物种数量显著降低。这或许与除草剂化学性质有关,尽管选取的两种除草剂的化学性质和除草剂机理不同[33],但是两种除草剂均能杀死植物群落中敏感个体或抑制其生长,从而影响植物群落组成和多样性。然而,土壤线虫群落各特征指数在处理30 d后没有发生显著变化,或许与施用除草剂浓度有关。有研究表明2 000、1 000 g·hm-2(以有效成分计)莠去津降低了土壤线虫群落多样性,而250 g·hm-2(以有效成分计)莠去津没有改变土壤线虫群落多样性[34];也有研究表明低浓度除草剂施用促使土壤线虫群落多样性增加[35-37]。土壤线虫群落特征指数没有显著变化的原因也可能与土壤环境有关。有研究表明未开垦草地在施用除草剂后土壤养分下降,土壤线虫主要类群也转变为干扰类群[38],而本研究中农田转变成休耕地第一年,土壤依然处于高干扰高胁迫状态(图 3),土壤线虫类群属于耐环境压力类群(表 4),施用除草剂增加了土壤环境压力,无法改变属于耐环境压力类群的土壤线虫群落(图 2B)。
除草剂对野生植物群落和线虫群落的影响均存在潜在生态风险。除草剂可以通过杀死植物或抑制植物繁殖[39-41]改变土壤种子库组成和植物群落演替,从而间接改变以植物群落为食物基础或栖息环境的其他生物群落,包括传粉昆虫和农业害虫天敌等[16, 42]。尽管本研究中植物群落多样性在短期内降低没有显著影响土壤线虫群落,但是在实际生产中,农田施用除草剂多常年在春夏季,正值植物生长季,植物群落变化的潜在生态风险和农业生产风险依然值得关注。线虫占据着土壤食物网的中心位置,其物种多样性、食性多样性、生活史策略多样性、功能群多样性奠定了其作为土壤食物网结构和功能指示生物的生态学基础[43]。低浓度除草剂能显著地抑制土壤线虫的运动和繁殖[44],直接毒害或许是本研究中不同处理样地间线虫稀有属和线虫群落组成均存在差异的原因之一。土壤线虫组成改变和个体数量降低表明土壤食物网发生了变化[12],若土壤质量降低则其恢复难度将远大于植物群落的恢复。
低剂量除草剂的生态风险值得关注。本研究中,低于大田推荐剂量的除草剂对于野生植物群落的影响高于大田推荐剂量的除草剂的影响。很多研究表明,低剂量或亚致死剂量的除草剂能够抑制植物个体的生长、繁殖甚至子代的生长[45-46]。因此,实际生产中需要重视从农田中扩散到农田周边区域的低剂量除草剂的生态风险。
农田休耕指在可耕、可种的季节不耕田、不种植作物的一种方式,是成本低且见效快的耕地质量改善途径,可提高生物多样性[47]。休耕地对于农业生态系统中生物多样性保护具有重要意义,因此在实际生产中应加强除草剂生态风险管控,以减少农业生产中飘散地除草剂对休耕地中植物群落的威胁,而除草剂对土壤线虫群落及土壤质量变化的影响依然值得关注。
4 结论(1)短时间内野生植物群落和土壤线虫群落对除草剂的响应不同。施用莠去津或苯磺隆30 d后,休耕地中植物群落物种组成改变,野生植物群落多样性指数和丰富度指数显著降低,均匀度指数无显著变化;土壤线虫群落组成和稀有属改变,土壤线虫群落多样性指数、生活史多样性指数和营养类群多样性指数均无显著变化;植物群落多样性降低在短期内没有显著影响土壤线虫群落。
(2)低浓度除草剂的生态风险值得关注。低于大田推荐剂量莠去津(600、300 g·hm-2以有效成分计)或苯磺隆(11.25、5.63 g·hm-2以有效成分计)对于休耕地植物群落的影响大于大田推荐剂量的莠去津(1 200 g·hm-2以有效成分计)或苯磺隆(22.5 g·hm-2以有效成分计)影响;除11.25 g·hm-2(以有效成分计)的苯磺隆处理样地外,其他浓度的除草剂处理样地均减少了c-p值为3~5的线虫数量,表明施用低于大田推荐剂量的除草剂同样会增加土壤的环境胁迫压力。需防控低浓度除草剂对农业生态系统中半自然生境中生物多样性的影响。
| [1] |
全球农药市场进入下一个发展上升期 亚太地区销量增加明显[J]. 农药市场信息, 2019(3): 30-32. The global pesticide market will enter the next stage of development and the sales volume in the asia: Pacific region has increased significantly[J]. Pesticide Market News, 2019 (3): 30-32. |
| [2] |
束放, 李永平, 魏启文. 2018年种植业农药使用情况及2019年需求分析[J]. 中国植保导刊, 2019, 39(4): 73-76. SHU Fang, LI Yongping, WEI Qi-wen. Pesticide use in planting industry in 2018 and demand analysis in 2019[J]. China Plant Protection, 2019, 39(4): 73-76. |
| [3] |
Gianessi L P. The increasing importance of herbicides in worldwide crop production[J]. Pest Management Science, 2013, 69(10): 1099-1105. DOI:10.1002/ps.3598 |
| [4] |
Jensen P K, Olesen M H. Spray mass balance in pesticide application: A review[J]. Crop Protection, 2014, 61: 23-31. DOI:10.1016/j.cropro.2014.03.006 |
| [5] |
Robleno I, Storkey J, Sole-Senan X O, et al. Using the response-effect trait framework to quantify the value of fallow patches in agricultural landscapes to pollinators[J]. Applied Vegetation Science, 2018, 21(2): 267-277. DOI:10.1111/avsc.12359 |
| [6] |
Gaba S, Perronne R, Fried G, et al. Response and effect traits of arable weeds in agro-ecosystems: A review of current knowledge[J]. Weed Research, 2017, 57(3): 123-147. DOI:10.1111/wre.12245 |
| [7] |
Reeg J, Heine S, Mihan C, et al. Potential impact of effects on reproductive attributes induced by herbicides on a plant community[J]. Environmental Toxicology and Chemistry, 2018, 37(6): 1707-1722. DOI:10.1002/etc.4122 |
| [8] |
Balzan M V, Bocci G, Moonen A C. Utilisation of plant functional diversity in wildflower strips for the delivery of multiple agroecosystem services[J]. Entomologia Experimentalis et Applicata, 2016, 158: 304-319. DOI:10.1111/eea.12403 |
| [9] |
Dively G P, Leslie A W, Hooks C R R. Evaluating wildflowers for use in conservation grass buffers to augment natural enemies in neighboring cornfields[J]. Ecological Engineering, 2020, 144: 105703. DOI:10.1016/j.ecoleng.2019.105703 |
| [10] |
Yeates G W, Bongers T, Degoede R G M, et al. Feeding-habits in soil nematode families and genera-an outline for soil ecologists[J]. Journal of Nematology, 1993, 25(3): 315-331. |
| [11] |
李静, 蔡连贺, 刘瑞华, 等. 转双价基因棉SGK321不同秸秆还田量对土壤线虫群落的影响[J]. 农业环境科学学报, 2019, 38(4): 871-881. LI Jing, CAI Lian-he, LIU Rui-hua, et al. Effect of transgenic cotton SGK321 with different amounts of straw on soil nematode communities[J]. Journal of Agro-Environment Science, 2019, 38(4): 871-881. |
| [12] |
Juliane V C L S, Maria N C H, Juvenil E C, et al. Land use, soil properties and climate variables influence the nematode communities in the Caatinga dry forest[J]. Applied Soil Ecology, 2020, 150(6): 150. |
| [13] |
齐月, 李俊生, 关潇, 等. 人工林与其紧邻农田中野生植物与土壤线虫群落特征对比[J]. 环境科学研究, 2020, 33(6): 103-111. QI Yue, LI Jun-sheng, GUAN Xiao, et al. Comparison of wild plant community and soil nematode community in fast-growing poplar plantationand wheat maize rotation fields[J]. Research of Environmental Sciences, 2020, 33(6): 103-111. |
| [14] |
Alignier A, Baudry J. Is plant temporal beta diversity of field margins related to changes in management practices[J]. Acta Oecologica-International Journal of Ecology, 2016, 75: 1-7. DOI:10.1016/j.actao.2016.06.008 |
| [15] |
Schmitz J, Schafer K, Bruhl C A. Agrochemicals in field marginsField evaluation of plant reproduction effects[J]. Agriculture Ecosystems & Environment, 2014, 189: 82-91. |
| [16] |
Egan J F, Bohnenblust E, Goslee S, et al. Herbicide drift can affect plant and arthropod communities[J]. Agriculture, Ecosystems and Environment, 2014, 185: 77. DOI:10.1016/j.agee.2013.12.017 |
| [17] |
Rahman L, Whitelaw-Weckert M A, Hutton R J, et al. Impact of floor vegetation on the abundance of nematode trophic groups in vineyards[J]. Applied Soil Ecology, 2009, 42(2): 96-106. DOI:10.1016/j.apsoil.2009.02.006 |
| [18] |
Arntz A M, Delucia E H, Jordan N. Contribution of photosynthetic rate to growth and reproduction in Amaranthus hybridus[J]. Oecologia, 1998, 117: 323-330. DOI:10.1007/s004420050665 |
| [19] |
Li X Y, Wu T, Huang H L, et al. Atrazine accumulation and toxic responses in maize Zea mays[J]. Journal of Environmental Sciences, 2012, 24: 203-208. DOI:10.1016/S1001-0742(11)60718-3 |
| [20] |
王恒智, 白霜, 吴小虎, 等. 小麦田麦家公对苯磺隆的抗性机理[J]. 植物保护学报, 2019, 46(1): 216-223. WANG Heng-zhi, BAI Shuang, WU Xiao-hu, et al. Resistance mechanism of Lithospermum arvense L. to tribenuron-methyl in winter wheat field[J]. Journal of Plant Protection, 2019, 46(1): 216-223. |
| [21] |
王可洪. 三江平原湿地垦殖过程中农药对土壤线虫多样性的影响[D]. 哈尔滨: 中国科学院大学(东北地理与农业生态研究所), 2014. WANG Ke-hong. Effect of agrochemical application on soil nematode diversity in the reclamation progress of Sanjiang Plain[D]. Harbin: University of Chinese Academy of Sciences(Northeast Institute of Geography and Agroecology), 2014. |
| [22] |
贾国连, 李军, 鲁飞. 25%硝磺草酮莠去津油悬浮剂防除玉米田杂草药效研究[J]. 现代农业科技, 2013(13): 134, 140-134. JIA Guo-lian, LI Jun, LU Fei. Efficacy of 25% mesotrione·atrazine oil suspension agent for controlling weeds in maize fields[J]. Xiandai Nongye Keji, 2013(13): 134, 140-134. |
| [23] |
Liang W J, Lou Y L, Li Q, et al. Nematode faunal response to longterm application of nitrogen fertilizer and organic manure in Northeast China[J]. Soil Biology & Biochemistry, 2009, 41(5): 883-890. |
| [24] |
尹文英, 宋大祥, 唐觉. 中国土壤动物检索图鉴[M]. 北京: 科学出版社, 1998. YIN Wen-ying, SONG Da-xiang, TANG Jue. Pictorial keys to soil animals of China[M]. Beijing: Science Press, 1998. |
| [25] |
Shannon C E, Weaver W. The mathematical theory of communication[M]. Illinois: University of Illinois Press, 1949.
|
| [26] |
Yeates G W. Variation in soil nematode diversity under pasture with soil and year[J]. Soil Biology & Biochemistry, 1984, 16(2): 95-102. |
| [27] |
Yeats G W, Bongers T. Nematode diversity in agroecosystems[J]. Agriculture Ecosystems & Environment, 1999, 74(1): 113-135. |
| [28] |
Bongers T. The maturity index-an ecological measure of environmental disturbance based on nematode species compositon[J]. Oecologia, 1990, 83(1): 14-19. DOI:10.1007/BF00324627 |
| [29] |
Moore J C, Hunt H W. Resource compartmentation and the stability of real ecosystems[J]. Nature, 1988, 333(6170): 261-263. DOI:10.1038/333261a0 |
| [30] |
Ferris H, Bongers T, Goede R G M. A framework for soil food web diagnostics: Extension of the nematode faunal analysis concept[J]. Applied Soil Ecology, 2001, 18(1): 13-29. DOI:10.1016/S0929-1393(01)00152-4 |
| [31] |
Ferris H, Matute M M. Structural and functional succession in the nematode fauna of a soil food web[J]. Applied Soil Ecology, 2003, 23(2): 93-110. DOI:10.1016/S0929-1393(03)00044-1 |
| [32] |
张晓珂, 梁文举, 李琪, 等. 长白山森林土壤线虫-形态分类与分布格局[M]. 北京: 中国农业出版社, 2013. ZHANG Xiao-ke, LIANG Wenju, LI Qi, et al. Forest soil nematodes in Changbai Mountain-Morphology and distribution[M]. Beijing: China Agriculture Press, 2013. |
| [33] |
强胜. 杂草学[M]. 北京: 中国农业出版社, 2009. QIANG Sheng. Weed science[M]. Beijing: China Agriculture Press, 2009. |
| [34] |
Das T K, Sakhuja P K, Zelleke H. Herbicide efficacy and non-target toxicity in highland rainfed maize of Eastern Ethiopia[J]. International Journal of Pest Management, 2010, 56(4): 315-325. DOI:10.1080/09670874.2010.497872 |
| [35] |
Yeates G W, Bongers T. Nematode diversity in agroecosystems[J]. Agriculture Ecosystems & Environment, 1999, 74(1/2/3): 113-135. |
| [36] |
Salminen J, Eriksson I, Haimi J. Effects of terbuthylazine on soil fauna and decomposition processes[J]. Ecotoxicology and Environmental Safety, 1996, 34(2): 184-189. DOI:10.1006/eesa.1996.0062 |
| [37] |
Ishibashi N, Kondo E, Ito S. Effects of application of certain herbicides on soil nematodes and aquatic invertebrates in rice paddy fields in Japan[J]. Crop Protection, 1983, 2(3): 289-304. DOI:10.1016/0261-2194(83)90003-0 |
| [38] |
DuPont S T, Culman S W, Ferris H, et al. No-tillage conversion of harvested perennial grassland to annual cropland reduces root biomass, decreases active carbon stocks, and impacts soil biota[J]. Agriculture Ecosystems & Environment, 2010, 137(1-2): 25-32. |
| [39] |
Boutin C, Elmegaard N, Kjaer C. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment[J]. Ecotoxicology, 2004, 13: 349-369. DOI:10.1023/B:ECTX.0000033092.82507.f3 |
| [40] |
Boutin C, Aya K L, Carpenter D, et al. Phytotoxicity testing for herbicide regulation: Shortcomings in relation to biodiversity and ecosystem services in agrarian systems[J]. Science of the Total Environment, 2012, 415: 79-92. DOI:10.1016/j.scitotenv.2011.04.046 |
| [41] |
齐月, 关潇, 闫冰, 等. 除草剂对苘麻子代萌发和幼苗生长的延迟影响[J]. 中国环境科学, 2016, 36(8): 2480-2486. QI Yue, GUAN Xiao, YAN Bing, et al. Seed germination and seedling growth of seed from velvetleaf treated by herbicides[J]. China Environmental Science, 2016, 36(8): 2480-2486. DOI:10.3969/j.issn.1000-6923.2016.08.030 |
| [42] |
Dupont Y L, Strandberg B, Damgaard C. Effects of herbicide and nitrogen fertilizer on non-target plant reproduction and indirect effects on pollination in Tanacetum vulgare(Asteraceae)[J]. Agriculture Ecosystems & Environment, 2018, 262: 76-82. |
| [43] |
陈云峰, 韩雪梅, 李钰飞, 等. 线虫区系分析指示土壤食物网结构和功能研究进展[J]. 生态学报, 2014, 34(5): 1072-1084. CHEN Yun-feng, HAN Xue -mei, Li Yu-fei, et al. Approach of nematode fauna analysis indicate the structure and function of soil food web[J]. Acta Ecologica Sinica, 2014, 34(5): 1072-1084. |
| [44] |
Wang Y B, Anastasia N E, Li Z H, et al. Joint toxicity of arsenic, copper and glyphosate on behavior, reproduction and heat shock protein response in Caenorhabditis elegans[J]. Bulletin of Environmental Contamination and Toxicology, 2017, 98(4): 465-471. DOI:10.1007/s00128-017-2042-5 |
| [45] |
Rotches-Ribalta R, Boutin C, Blanco-Moreno J M, et al. Herbicide impact on the growth and reproduction of characteristic and rare arable weeds of winter cereal fields[J]. Ecotoxicology, 2015, 24(5): 991-1003. DOI:10.1007/s10646-015-1440-x |
| [46] |
Qi Y, Li J S, Fu G, et al. Effects of sublethal herbicides on offspring germination and seedling growth: Redroot pigweed(Amaranthus retroflexus)vs. velvetleaf(Abutilon theophrasti)[J]. Science of the Total Environment, 2018, 645: 543-549. DOI:10.1016/j.scitotenv.2018.07.171 |
| [47] |
吴芸紫, 刘章勇, 蒋哲, 等. 稻-麦连作和稻-休耕农田植物物种多样性的比较[J]. 草业科学, 2017, 34(5): 1090-1099. WU Yunzi, LIU Zhang-yong, JIANG Zhe, et al. Comparison of plant species diversity in continuous rice-wheat and rice-fallow systems[J]. Pratacultural Science, 2017, 34(5): 1090-1099. |
 2021, Vol. 40
2021, Vol. 40