近年来,随着工业的迅速发展和农药的过度使用,有毒重金属(如铅、镉、铜、锌等)不断被排放到水体和土壤环境中,导致水体污染和作物生长受限,继而影响农业生产和食品安全,故探索一种经济高效的重金属治理方法,对当前环境保护工作有重要的意义[1]。
生物炭是一种由生物质产生的具有良好吸附性能的固体材料,被广泛应用于去除重金属污染物[2]。生物炭与重金属之间的相互作用主要涉及矿物沉淀、阳离子交换、官能团络合、π电子配位等[3-4]。生物炭吸附重金属的机制表明,其物理化学性质是影响吸附性能的主要因素,这由生物炭的原料和热解条件共同决定[5]。不同原料生物炭的碳含量、表面积、含氧官能团、灰分、pH等理化性质差异较大。另外,热解条件尤其是热解温度对生物炭的物理化学结构也有着重要的影响,进而影响着不同机制在吸附中的贡献。此外,生物炭在环境中的应用潜力主要取决于其与重金属离子间的相互作用机制[6]。例如,重金属和生物炭之间的弱结合力(如:物理吸附和阳离子交换机制),有利于生物炭的解吸附和重金属的分离,而两者间的强结合力(如:沉淀和络合机制)更适合生物炭固化土壤中的重金属,保持重金属的长期稳定性。因此,研究生物炭和重金属间的相互作用机制对理解生物炭在环境中的应用潜力具有重要意义。
当前研究的生物炭大多数以农业废弃物(如秸秆)为原料,而菌糠作为食用菌栽培后的培养基质,产量巨大(2018年我国食用菌产量为3 789万t[7],产生约1 512万t菌糠),这些菌糠除少数被用作饲料和肥料外,大部分被堆放或以传统的露天焚烧方式处置[8-9],少有被制成菌糠生物炭用作环境吸附材料。
因此,本实验选用双孢菇菌糠为原料制备生物炭,研究不同热解温度下菌糠生物炭理化性质。以批量吸附实验进行吸附动力学、等温吸附实验;利用傅里叶变换红外光谱(FTIR)、X射线衍射光谱(XRD)等技术手段对吸附Pb2+前后的生物炭样品进行表征,并定性、定量地探究其吸附特性和机理;对吸附后生物炭进行萃取实验,探究生物炭的环境应用潜力,以期为菌糠废弃物用于废水中重金属的去除和土壤重金属污染的修复提供一定的参考。
1 材料与方法 1.1 菌糠生物炭的制备与表征双孢菇菌糠原料由山西农业大学食用菌中心提供,主要成分为麦秸、鸡粪、泥炭土等。菌糠经烘箱60 ℃烘干后,粉碎过35目孔径筛,并装至瓷坩埚中压实,再置于马弗炉中,采用慢速限氧法分别在350、550 ℃和750 ℃下热解3 h,待样品冷却至室温后取出,研磨过100目孔径筛后(0.154 mm)制成最终样品。根据生产温度分别将样品命名为MS350、MS550、MS750。
对生物炭样品进行表征。称取1 g样品于10 mL水中(固液比为1∶10)振荡30 min后使用pH计测定样品pH值;产率为生物炭制备前后的质量百分比;将样品在马弗炉中以800 ℃的条件加热2 h,根据加热前后质量比计算灰分含量;使用傅立叶变换红外光谱仪在4 000~400 cm-1测定样品的表面官能团;通过X射线衍射仪测定样品的矿物质组成;以磷钼蓝分光光度法测定溶液中PO43-含量。
1.2 批量吸附实验以Pb(NO3)2配制不同浓度的Pb2+溶液,0.01 mol· L-1 NaNO3为电解质,用0.1 mol·L-1的HNO3和0.1 mol· L-1的NaOH调节溶液pH。当pH>6.01时,Pb(OH)+与OH-更易形成氢氧复合物[10][如Pb(OH)2、Pb(OH)3-、Pb2(OH)3+、Pb3(OH)42+和Pb4(OH)4 4+],降低了溶液中游离Pb2+的浓度,因此选择溶液初始pH值为5.0±0.1。以1 g·L-1的固液比(30 mg生物炭与30 mL Pb2+溶液混合),将一定体积和浓度的Pb2+溶液添加到预称好生物炭的聚乙烯管中,在恒温振荡器(200 r·min-1,25 ℃)中振荡进行批量吸附实验。吸附动力学中,将100 mL质量浓度为250 mg·L-1的Pb2+溶液,分别添加至含有100 mg样品的三角瓶中,振荡10、20、40 min和1、2、4、10、24、36、48 h后取样。吸附等温线中,调节Pb2+浓度为50、100、150、200、250、300、400、500 mg·L-1。通过调节250 mg·L-1的Pb2+溶液的pH值为2.0~7.0,以获得不同溶液初始pH值对生物炭吸附Pb2+的影响。所有样品均设3次平行,吸附完成后,取上清液过0.22 μm滤膜,通过电感耦合等离子体发射光谱仪(ICP-OES)测定滤液中Pb2+浓度。
1.3 吸附机制分析实验生物炭吸附铅可主要归因于矿物沉淀、阳离子交换、含氧官能团络合和π电子配位4种作用。
根据Wang等[11]的计算方法,生物炭经酸洗脱矿后,绝大多数矿物质被去除而表面官能团未发生改变[12]。因此酸洗前后生物炭吸附的减少量可被认为是矿物质作用的吸附量(Qcm)。生物炭中的交换性阳离子(K+、Ca2+、Na+和Mg2+)参与吸附的交换作用,因此,阳离子交换的量(Qcme)可根据吸附前后溶液中阳离子浓度的变化量计算。矿物质作用的吸附量由阳离子交换和矿物沉淀共同作用,因此矿物沉淀量(Qcmp)可以由矿物质作用的吸附量(Qcm)与阳离子交换量(Qcme)的差值来计算。
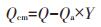
|
(1) |

|
(2) |
式中:Qcm、Qcmp、Qcme分别为矿物作用、沉淀、阳离子交换的吸附贡献量,mg·g-1;Q为酸洗前生物炭的吸附量,Qa为酸洗后生物炭的吸附量,mg·g-1;Y为酸洗生物炭的产率,%。
酸洗生物炭吸附过程中Pb2+与含氧官能团络合会释放H+至溶液中,使得吸附后溶液pH值降低,因此酸洗生物炭中官能团络合贡献量(Qco1)可根据酸洗生物炭吸附后溶液pH的下降值计算。π电子配位贡献量(Qcπ)可由酸洗生物炭的吸附量与其含氧官能团吸附贡献值的差值求得。
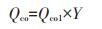
|
(3) |
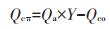
|
(4) |
式中:Qco为官能团络合贡献量;Qcπ为π电子配位贡献量。
1.4 顺序萃取实验根据Shi等[6]和Shen等[13]的研究,对吸附后的生物炭进行了简化的萃取实验,研究吸附后生物炭表面上铅的稳定性能。吸附在生物炭表面上的铅可分为可交换态、酸溶态和非生物利用态三部分。可交换态移动性强,有较高的风险;酸溶态移动性弱,风险较小;而非生物利用态稳定性强,风险很低。
简化的萃取实验如下:(1)称取0.1 g吸附后的样品于50 mL聚乙烯管中,加入8 mL 0.5 mol·L-1 MgCl2(使用NaOH或HCl调节至pH值7.0)振荡萃取20 min。(2)另称取吸附后的样品0.1 g于聚乙烯管中,加入8 mL 1 mol·L-1 NaOAc(用HOAc调节至pH值5.0)振荡萃取5 h。(3)收集振荡后溶液的上清液,通过0.22 μm滤膜过滤后,使用ICP-OES测定Pb2+的浓度,所有实验均设置3个平行。
根据(1)可得到可交换态的铅含量;(2)可得到可交换态铅和酸溶态铅含量之和;非生物利用态的铅可由样品吸附铅的总量减去可交换态铅和酸溶态铅之和得到。
1.5 数据处理及分析菌糠生物炭对Pb2+的吸附量Qe通过式(5)进行计算。
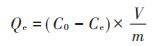
|
(5) |
式中:Qe为生物炭单位质量吸附量,mg·g-1;C0为初始溶液Pb2+浓度,mg·L-1;Ce为吸附Pb2+后浓度,mg·L-1;V为溶液体积,mL;m为生物炭质量,mg。
通过准一级动力学(6)、准二级动力学(7)方程对吸附结果进行拟合。方程如下:
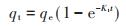
|
(6) |

|
(7) |
式中:qe为平衡吸附量,mg·g-1;qt为t时刻吸附量,mg· g-1;t为时间,min;K1为准一级反应速率常数,min;K2为准二级反应速率常数,g·mg-1·min-1。
通过Langmuir(8)和Freundlich(9)模型对等温吸附模型进行拟合,方程如下:

|
(8) |

|
(9) |
式中:qe为平衡吸附量;Qmax为最大吸附量,mg·g-1;KL为吸附亲和力,L·mg-1;Ce为吸附平衡浓度mg·L-1;Kf为吸附容量,mg·g-1;n为吸附强度。
吸附实验的结果表示为平均值。使用Origin 2016进行吸附动力学和吸附等温线的参数拟合。
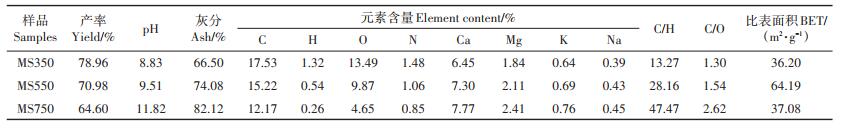
2 结果与讨论 2.1 双孢菇菌糠生物炭的基本性质双孢菇菌糠生物炭的性质如表 1所示。样品的产率随着生产温度的升高从78.96% 下降到64.60%,灰分含量从66.50% 增加到82.12%,产率和灰分均高于常见作物秸秆生物炭[14-15],这与菌糠生物炭原料在物理结构和材料组成上有关。高灰分含量说明生物炭样品中的无机成分占比高,无机成分在热解过程中挥发很少,使得灰分含量随着热解温度升高而升高。所有热解温度下的生物炭均呈碱性,相比MS350(pH值8.83)和MS550(pH值9.51),MS750的pH值达到了11.82,其较高的pH值更适合应用于修复酸性水体或土壤的重金属污染。这是因为在样品热解过程中伴随着酸性官能团的分解和碱性矿物的析出,造成生物炭的pH值不断升高[16]。另外,菌糠生物炭中含有较多的矿质成分,特别是碱土金属钙、镁,会在热解时转化为碳酸盐形式,同样导致生物炭的碱性增强[17-18]。在热解时许多含碳物质会转化为气态的烃化合物和焦油的芳烃[19],同时挥发性物质的逐渐损失会带走许多表面官能团元素(H、O和N),导致生物炭的C、H、N、O含量均呈现下降趋势。生物炭的C/H和C/O逐渐升高,表明生物炭的芳香性逐渐增强、极性逐渐变低[20-21],因此随着热解温度的升高,菌糠生物炭的芳香性逐渐增强,结构逐渐稳定。灰分含量会影响生物炭的比表面积,过多的灰分会堵塞生物炭的孔隙[22],使得比表面积降低。相比之下,生物炭在550 ℃热解温度下有着最高的比表面积(64.19 m2·g-1),当温度升高至750 ℃后生物炭中的孔隙结构发生坍塌或熔融,使得比表面积进一步下降至37.08 m2·g-1。
|
|
表 1 菌糠生物炭的基本性质 Table 1 Basic properties of spent mushroom substrate biochar |
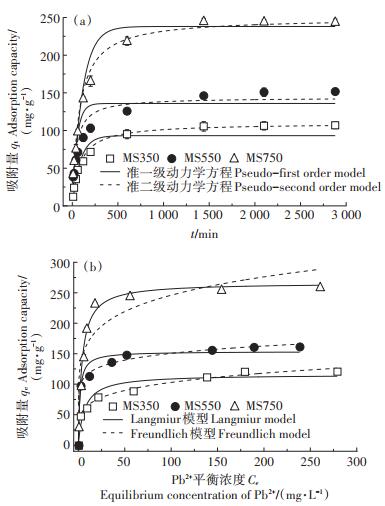
图 1(a)显示了菌糠生物炭对Pb2+的吸附量随时间变化结果及动力学拟合曲线。在最初的时间(0~4 h)内,3种样品均表现出较快的吸附速率,吸附4 h时均达到饱和吸附量的60% 以上。随着吸附时间的增加(4~24 h),吸附量增幅逐渐减小,吸附24 h时基本达到吸附平衡状态,吸附量几乎不再增加。在吸附前期,生物炭表面有较多的吸附位点,吸附驱动力较大,吸附速率较快。吸附后期,随着吸附时间的增加,溶液中Pb2+浓度减小,溶质浓度差减小,同时生物炭表面活性吸附位点逐渐达到饱和,因此吸附速率逐渐减小直至达到吸附平衡。生物炭对Pb2+的吸附量随溶液平衡浓度变化的关系如图 1(b)所示。由图 1(b)可知,随着平衡溶液浓度的升高,MS350、MS550、MS750对Pb2+的吸附量增长逐渐变缓,最终趋于稳定。
|
图 1 菌糠生物炭对Pb2+吸附动力学及等温线曲线 Figure 1 Adsorption kinetics and isotherm for Pb2+ by spent mushroom substrate biochar |
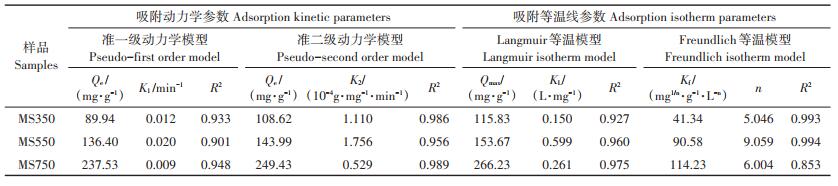
表 2显示了菌糠生物炭吸附Pb2+的动力学和等温线拟合结果。准一级动力学模型认为吸附由扩散控制,假设吸附质的扩散决定了吸附速度。准二级模型假定吸附是吸附剂和被吸附物之间的化学反应引起的。由表 2可知,准二级动力学模型能较好地描述3种生物炭的吸附过程,表明吸附速率主要受化学吸附机制控制。MS350、MS550对Pb2+的吸附等温线很好地符合Freundlich模型(R2 =0.993、0.994),这表明MS350和MS550吸附Pb2+主要是多分子层吸附。而MS750以Langmuir模型很好地拟合(R2 =0.975),表明MS750对Pb2+的吸附以单分子层吸附为主。由Langmuir模型计算出的最大吸附容量Qmax以MS750(266.23 mg · g-1) > MS550(153.67 mg · g-1) > MS350(115.83 mg·g-1)的顺序降低。
|
|
表 2 菌糠生物炭吸附Pb2+动力学及等温线参数 Table 2 Kinetic and isotherm parameters of Pb2+ adsorption by spent mushroom substrate biochar |
溶液pH值影响生物炭的表面电荷、金属离子的存在形态,进而影响生物炭吸附重金属的能力[23]。为评估溶液pH值对生物炭吸附Pb2+能力的影响,选取了pH值为2.0~7.0的范围进行实验。图 2描述了不同初始pH值对菌糠生物炭吸附Pb2+的影响。可以看出,随着溶液pH值的升高,3种生物炭的吸附量均逐渐升高,这与不同pH值下生物炭的表面电荷有关。生物炭在pH为2.0~7.0时的Zeta电位如图 3所示。3种生物炭的Zeta电位随着溶液pH值的增加而逐渐降低,这意味着生物炭上负电荷数量的增加[24]。负电荷数量的增加有利于生物炭通过静电作用吸附Pb2+。然而,MS750对Pb2+的吸附量明显大于MS350和MS550,这说明静电引力作用并不是生物炭吸附Pb2+的主要机制。pH值为2.0时溶液中存在大量的H+,生物炭表面被质子化,对带正电的Pb2+产生较大的静电排斥,吸附量很小[25-26]。同时,较低的pH值下,生物炭释放出大量阳离子(如Ca2+、Mg2+)与Pb2+竞争吸附位点,使得生物炭对Pb2+的吸附能力受到限制。当pH值升至3.0时,生物炭发生去质子化作用,3种样品的吸附量迅速增加,分别达到了61.11、79.26、179.22 mg·g-1。pH值大于5.0时,由于溶液中OH-逐渐增多,促进了Pb2+的沉淀,使得吸附量又呈明显增长趋势。
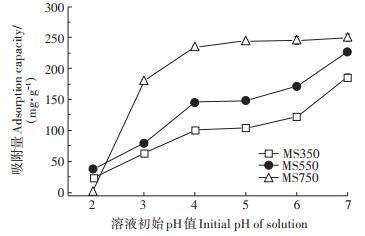
|
图 2 pH对Pb2+吸附量的影响 Figure 2 Effects of the initial solution pH on Pb2+ adsorption capacities |

|
图 3 不同溶液pH下Zeta电位的变化 Figure 3 Change of Zeta potential at different solution pH |
吸附后溶液pH值的变化如图 4所示。与初始pH值相比,空白溶液(不含Pb2+)的pH值均升高,这是因为生物炭中碱性矿物的释放[4]。然而,与空白溶液相比,吸附Pb2+后溶液的pH值却呈下降趋势。这是由于生物炭中含氧官能团(如-COOH和-OH)与Pb2+络合时会释放H+[27-28],降低了溶液pH。同时溶液中的Pb2+与碱性离子(如PO43-、CO32-)生成沉淀,也会使溶液的pH值降低[29]。
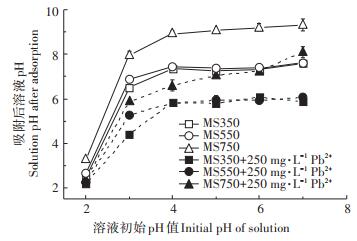
|
图 4 吸附后溶液pH的变化 Figure 4 Changes in solution pH after adsorption |
表 3对比了不同来源生物炭的性质及其对Pb2+的吸附性能。在相近热解温度下,菌糠生物炭有着较低的碳含量,说明菌糠生物炭的有机成分占比小,这与制备生物炭原料的差异有关。与其他原材料比较,菌糠的生物炭产率较高,且表现出更高的Pb2+吸附能力,说明菌糠能够产出更多量的生物炭,是一种经济、高吸附力的吸附剂。
|
|
表 3 不同原料生物炭性质比较 Table 3 Comparison of biochar properties of different feedstocks |
FTIR能较直观地表征生物炭表面官能团种类和数量变化[33],图 5显示了生物炭吸附前和吸附后的FTIR图。3 424 cm-1处羟基—OH宽伸缩振动峰和1 620 cm-1处羧基C=O振动峰,随着温度的升高振动逐渐减弱。1 600~1 400 cm-1处芳环C=C的骨架振动随温度的升高而越发明显,这说明高温热解下的生物炭芳香性更强。880~680 cm-1处为芳环C—H弯曲振动,1 040、460 cm-1处是对应于Si—O—Si的吸收峰[34-35]。此外,1 095 cm-1处为硫酸根(SO42-)的反对称伸缩振动,874 cm-1处对应于碳酸盐矿物(CO32-)的峰。随着热解温度的升高,硫酸根(1 095 cm-1)伸缩振动逐渐减弱,而碳酸盐(874 cm-1)的吸收峰逐渐增强。吸附Pb2+后,对应硫酸根(1 095 cm-1)和碳酸盐(874 cm-1)振动消失,这可能和Pb2+与SO42-、CO32-生成了沉淀有关。例如,MS350中Pb2+与SO42-结合生成沉淀,MS550中Pb2+与SO42-、CO32-生成沉淀,MS750中Pb2+与CO32-生成沉淀(见图 6)。对应芳环C=C(1 600~1 400 cm-1)在吸附后波数减小、振幅变宽,MS750变化最明显,说明吸附过程有π电子参与,且π电子作用随热解温度升高而增强。

|
图 5 吸附Pb2+前后FTIR Figure 5 FTIR diagrams before and after Pb2+ adsorption |
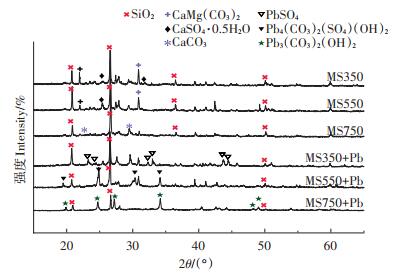
|
图 6 吸附前后XRD图谱的变化 Figure 6 XRD images before and after adsorption |
生物炭吸附Pb2+前后的XRD结果如图 6,由图可知,3种样品均有强烈的SiO2峰,推测菌糠生物炭中含有较多的SiO2。在MS350和MS550上检测到烧石膏(CaSO4·0.5H2O)和白云石[CaMg(CO3)2],当热解温度上升至750 ℃时,检测到CaCO3的峰。与吸附前相比,吸附后的样品均产生了新峰,说明在吸附后有新的物质生成。吸附后,在MS350、MS550和MS750上分别出现了PbSO4、Pb4(CO3)2(SO4)(OH)2和Pb3(CO3)2(OH)2新峰。在MS350吸附过程中,溶液中的Pb2+与SO42-结合生成沉淀,而随着热解温度升高,CaSO4·0.5H2O开始逐渐分解,溶液中的部分Pb2+开始与CO32-结合生成沉淀,因此,在MS550上生成Pb4(CO3)2(SO4)(OH)2;对于MS750,高温使CaSO4·0.5H2O彻底分解,最终生成了Pb3(CO3)2(OH)2沉淀物。磷酸铅沉淀未在XRD中检出,可能是因为含量较低。通过对比吸附前后生物炭释放到溶液中的PO43-,发现随着初始浓度的增加,MS350和MS550释放到溶液中PO43-分别由1.35、0.59 mg·g-1逐渐降低,而在MS750中并无PO43-的释放,这意味着PO43-参与了MS350和MS550的吸附过程。以上结果说明,沉淀作用均发生在3种样品的吸附过程中,低温下以SO42-沉淀为主,高温下以CO32-沉淀为主,这与FTIR分析结果一致。
2.6 吸附机理定量分析生物炭吸附重金属过程中涉及多种机理,通常有:(1)与阳离子进行离子交换;(2)与无机物质形成沉淀;(3)与含氧官能团的络合;(4)与π电子进行配位。由图 7可知,对于3种生物炭样品,矿物沉淀在4种吸附机理中的贡献百分比最高,是吸附过程中主要的贡献机制,在MS750中矿物沉淀的贡献比率达到了85.81%。阳离子交换作用的贡献量先下降后上升,贡献率持续降低,依次为24.92%、11.96%、9.23%,当热解温度从350 ℃升至550 ℃时,矿物质的结晶程度增强、溶解性降低[36-37],导致阳离子与Pb2+的交换能力减弱,而在750 ℃时,可能因为高温下矿质结晶状态发生变化,阳离子交换作用又增强。对于MS350,官能团络合有着较高的贡献(贡献量为20.65 mg·g-1,占比为19.89%),当热解温度逐渐升高,官能团络合的贡献率减小,高温生物炭MS750的贡献量仅为4.98 mg·g-1,贡献占比为2.16%。这是由于高温热解下含氧官能团(如COOH,—R—OH)会逐渐分解[12],导致在吸附过程中的贡献作用逐渐减小。相对于阳离子交换和官能团络合,π键的平均贡献率最低。总体上,热解温度影响吸附中各种机理的贡献,沉淀作用是吸附的主要贡献机制,且随着热解温度的升高,有机成分(Qco+Qcπ)的贡献率降低,无机成分(Qcmp+Qcme)的贡献率增加。
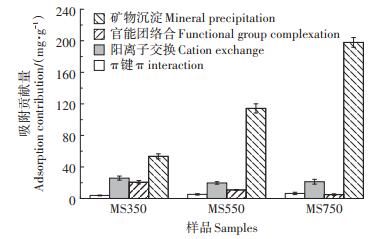
|
图 7 生物炭吸附Pb2+中各吸附机制贡献量及贡献率 Figure 7 Contribution and contribution rate of each adsorption mechanism in the adsorption of Pb2+ by biochar |
生物炭在环境修复中的应用不仅取决于其物理化学性质,还取决于其与环境的相互作用。生物炭修复水体重金属污染是通过生物炭吸附,减少溶液中重金属离子的浓度,降低重金属对水体环境的危害,如果吸附后的生物炭还可再回收利用,在一定程度上可节约生产成本。而生物炭修复重金属污染土壤是将生物炭施入土壤中,使土壤中的重金属稳定固化,降低其生物有效性,从而减少重金属在动植物中的富集和毒性危害[38],并且在施入土壤后不再回收。生物炭吸附、固定重金属的过程涉及到多种机理,在实际的环境修复中,每种机理都有其各自的稳定性能和潜在的环境风险。
在本研究中,根据图 8的萃取实验结果可知,绝大部分固定在菌糠生物炭上的铅是稳定的酸溶性铅和非生物利用铅,两种形态的铅占总吸附量的大小顺序为:MS750(98.65%) > MS550(95.91%) > MS350(86.51%)。较高的酸溶性铅和非生物利用铅占比说明吸附后的铅具有较好稳定性,在环境中的风险较低。MS350吸附后表面上的可交换铅为14.84 mg· g-1,而MS550和MS750的可交换铅仅为6.14 mg·g-1和3.24 mg·g-1,这部分铅很不稳定,易从生物炭中解析出来,如果应用到土壤可能会浸出到土壤环境中。可交换铅量高,说明吸附后的铅能更多被解吸并收集。随着热解温度的升高,MS550和MS750可交换铅含量逐渐降低,说明菌糠生物炭固定酸溶性铅和非生物利用铅的能力提高。XRD结果表明,在MS350上的主要沉淀物是PbSO4,而在MS750上主要是Pb3(CO3)2(OH)2,由于PbSO4的溶度积Ksp(1.6×10-8)远高于Pb3(CO3)2(OH)2的Ksp(~10-47)[6],进一步说明MS750吸附后的铅更加稳定,不易浸出到环境中。
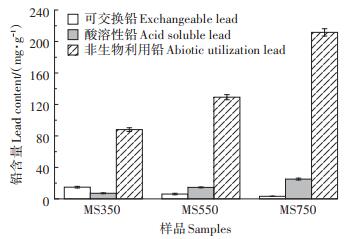
|
图 8 吸附后生物炭上铅的占比及含量 Figure 8 Proportion and content of lead on biochars after adsorption |
总体上,MS350有较高的可交换铅量,具有回收利用的潜力,较适合用于水体铅污染的修复。与低温热解菌糠生物炭相比,高温热解下的MS550和MS750则更适合应用于土壤铅污染的修复。同时高温热解生物炭有着较高的pH值,施入土壤后可使土壤pH值升高,降低重金属的移动性和生物有效性,对土壤重金属固化有促进作用。
3 结论(1)热解温度是影响生物炭理化性质的重要因素。随着热解温度的升高,生物炭的产率和碳含量降低,pH值、灰分含量上升,芳香性增强。准二级动力学模型能更好描述3种生物炭对Pb2+的吸附过程。MS350和MS550的等温吸附符合Freundlich模型,而MS750更符合Langmuir模型,经Langmuir模型拟合,3种样品的Qmax分别为115.83、153.67、266.23 mg·g-1。
(2)生物炭吸附Pb2+过程涉及到矿物沉淀、阳离子交换、含氧官能团络合以及π电子配位多种机理共同作用,其中矿物沉淀占主导地位。随着热解温度的升高,矿物沉淀、π电子配位对吸附的贡献量逐渐上升,阳离子交换贡献量先下降后上升,官能团络合贡献量逐渐下降。
(3)环境应用潜力分析表明,吸附在生物炭的铅以稳定的酸溶性铅和非生物利用态铅为主,环境应用风险低。相比之下,低温热解生物炭适合用于水体铅污染修复,而高温热解生物炭则更适合用于土壤铅污染的修复,且在酸性土壤的修复上有更大潜力。
| [1] |
黄益宗, 郝晓伟, 雷鸣, 等. 重金属污染土壤修复技术及其修复实践[J]. 农业环境科学学报, 2013, 32(3): 409-417. HUANG Yi-zong, HAO Xiao-wei, LEI Ming, et al. The remediation technology and remediation practice of heavy metals contaminated soil[J]. Journal of AgroEnvironment Science, 2013, 32(3): 409-417. |
| [2] |
Zhou Z, Xu Z, Feng Q, et al. Effect of pyrolysis condition on the adsorption mechanism of lead, cadmium and copper on tobacco stem biochar[J]. Journal of Cleaner Production, 2018, 187: 996-1005. DOI:10.1016/j.jclepro.2018.03.268 |
| [3] |
Zhang W, Du W, Wang F, et al. Comparative study on Pb2+ removal from aqueous solutions using biochars derived from cow manure and its vermicompost[J]. Science of the Total Environment, 2020, 716: 137108. DOI:10.1016/j.scitotenv.2020.137108 |
| [4] |
Cui X, Fang S, Yao Y, et al. Potential mechanisms of cadmium removal from aqueous solution by Canna indica derived biochar[J]. Science of the Total Environment, 2016, 562: 517-525. DOI:10.1016/j.scitotenv.2016.03.248 |
| [5] |
Wang J, Wang S. Preparation, modification and environmental application of biochar: A review[J]. Journal of Cleaner Production, 2019, 227: 1002-1022. DOI:10.1016/j.jclepro.2019.04.282 |
| [6] |
Shi J, Fan X, Tsang D C W, et al. Removal of lead by rice husk biochars produced at different temperatures and implications for their environmental utilizations[J]. Chemosphere, 2019, 235: 825-831. DOI:10.1016/j.chemosphere.2019.06.237 |
| [7] |
中国食用菌协会. 中国食用菌协会2018年度全国食用菌统计调查结果分析[EB/OL]. (2020-03-19)[2020-08-15] http://hz.cefa.com.cn/2020/03/19/10704.html. China Edible Fungi Association. Analysis on the results of national edible fungi statistical survey of China Edible Fungi Association in 2018[EB/OL].(2020-03-19)[2020-08-15] http://hz.cefa.com.cn/2020/03/19/10704.html. |
| [8] |
张勇, 陈骥, 张锋. 中国菌糠露天焚烧污染物排放时空分布特征[J]. 中国环境科学, 2020, 40(1): 100-108. ZHANG Yong, CHEN Ji, ZHANG Feng. The spatiotemporal distribution of pollutant emissions from open burning of spent mushroom substrate in China[J]. China Environmental Science, 2020, 40(1): 100-108. DOI:10.3969/j.issn.1000-6923.2020.01.011 |
| [9] |
杨和川, 谭一罗, 苏文英, 等. 食用菌菌糠资源化利用研究进展[J]. 农业工程, 2018, 8(10): 54-58. YANG He-chuan, TAN Yi-luo, SU Wen-ying, et al. Research progress on resource utilization of spent mushroom substrate[J]. Agricultural Engineering, 2018, 8(10): 54-58. |
| [10] |
Cao Y, Shen G, Zhang Y, et al. Impacts of carbonization temperature on the Pb(Ⅱ) adsorption by wheat straw-derived biochar and related mechanism[J]. Science of the Total Environment, 2019, 692: 479-489. DOI:10.1016/j.scitotenv.2019.07.102 |
| [11] |
Wang X H, Li X, Liu G Q, et al. Mixed heavy metal removal from wastewater by using discarded mushroom-stick biochar: Adsorption properties and mechanisms[J]. Environmental Science-Processes & Impacts, 2019, 21(3): 584-592. |
| [12] |
曹健华, 刘凌沁, 黄亚继, 等. 原料种类和热解温度对生物炭吸附Cd2+的影响[J]. 化工进展, 2019, 38(9): 4183-4190. CAO Jianhua, LIU Ling-qin, HUANG Ya-ji, et al. Effects of feedstock type and pyrolysis temperature on Cd2+ adsorption by biochar[J]. Chemical Industry and Engineering Progress, 2019, 38(9): 4183-4190. |
| [13] |
Shen Z, Hou D, Jin F, et al. Effect of production temperature on lead removal mechanisms by rice straw biochars[J]. Science of the Total Environment, 2019, 655: 751-758. DOI:10.1016/j.scitotenv.2018.11.282 |
| [14] |
常帅帅, 张学杨, 王洪波, 等. 秸秆生物炭对Pb2+的吸附性能及影响因素研究[J]. 环境科技, 2019, 32(6): 23-28. CHANG Shuaishuai, ZHANG Xue-yang, WANG Hong-bo, et al. Research on the adsorption property and effect factors of Pb2+ on straw biochar[J]. Environmental Science and Technology, 2019, 32(6): 23-28. |
| [15] |
吴愉萍, 李雅颖, 周萍, 等. 不同原料及热解条件下农业废弃物生物炭的特性[J]. 江苏农业科学, 2019, 47(8): 230-233. WU Yuping, LI Ya-ying, ZHOU Ping, et al. Characteristics of agricultural waste biochar under different raw materials and pyrolysis conditions[J]. Jiangsu Agricultural Sciences, 2019, 47(8): 230-233. |
| [16] |
Park J H, Wang J J, Kim S H, et al. Cadmium adsorption characteristics of biochars derived using various pine tree residues and pyrolysis temperatures[J]. Journal of Colloid and Interface Science, 2019, 553: 298-307. DOI:10.1016/j.jcis.2019.06.032 |
| [17] |
Chen T, Zhang Y, Wang H, et al. Influence of pyrolysis temperature on characteristics and heavy metal adsorptive performance of biochar derived from municipal sewage sludge[J]. Bioresource Technology, 2014, 164: 47-54. DOI:10.1016/j.biortech.2014.04.048 |
| [18] |
黄菲, 闫梦, 常建宁, 等. 不同菌糠生物炭对水体中Cu2+、Cd2+的吸附性能[J]. 环境化学, 2020, 39(4): 1116-1128. HUANG Fei, YAN Meng, CHANG Jian-ning, et al. Adsorption performance of Cu2+ and Cd2+ in water by different biochars derived from spent mushroom substrate[J]. Environmental Chemistry, 2020, 39(4): 1116-1128. |
| [19] |
Shen T, Tang Y, Lu X Y, et al. Mechanisms of copper stabilization by mineral constituents in sewage sludge biochar[J]. Journal of Cleaner Production, 2018, 193: 185-193. DOI:10.1016/j.jclepro.2018.05.071 |
| [20] |
马洁晨, 汪新亮, 张学胜, 等. 不同热解温度龙虾壳生物炭特征及对Zn2+的吸附机制[J]. 生态与农村环境学报, 2019, 35(7): 900-908. MA Jie-chen, WANG Xin-liang, ZHANG Xue-sheng, et al. Influence of pyrolysis temperature on characteristics and Zn2+ adsorptive mechanism of crayfish shell biochars[J]. Journal of Ecology and Rural Environment, 2019, 35(7): 900-908. |
| [21] |
Ahmad M, Rajapaksha A U, Lim J E, et al. Biochar as a sorbent for contaminant management in soil and water: A review[J]. Chemosphere, 2014, 99: 19-33. DOI:10.1016/j.chemosphere.2013.10.071 |
| [22] |
Agrafioti E, Bouras G, Kalderis D, et al. Biochar production by sewage sludge pyrolysis[J]. Journal of Analytical and Applied Pyrolysis, 2013, 101: 72-78. DOI:10.1016/j.jaap.2013.02.010 |
| [23] |
肖琴, 刘有才, 曹占芳, 等. 生物炭吸附废水中重金属离子的研究进展[J]. 环境科技, 2019, 32(1): 68-73. XIAO Qin, LIU You-cai, CAO Zhan-fang, et al. Research progress on the absorption of heavy metals from wastewater by biochar[J]. Environmental Science and Technology, 2019, 32(1): 68-73. |
| [24] |
Chang J, Zhang H, Cheng H, et al. Spent Ganoderma lucidum substrate derived biochar as a new bio-adsorbent for Pb2+/Cd2+ removal in water[J]. Chemosphere, 2020, 241: 125121. DOI:10.1016/j.chemosphere.2019.125121 |
| [25] |
嵇梦圆, 胡逸文, 梁程, 等. 农林废弃物基生物炭对重金属铅和镉的吸附特性[J]. 生态与农村环境学报, 2020, 36(1): 106-114. JI Meng-yuan, HU Yi-wen, LIANG Cheng, et al. Adsorption of lead and cadmium on biochars produced from agroforestry wastes[J]. Journal of Ecology and Rural Environment, 2020, 36(1): 106-114. |
| [26] |
张海波, 闫洋洋, 程红艳, 等. 平菇菌糠生物炭对水体中Pb2+的吸附特性与机制[J]. 环境工程学报, 2020, 14(11): 3170-3181. ZHANG Hai-bo, YAN Yang-yang, CHENG Hong-yan, et al. Adsorption characteristics and mechanisms of Pb2+ in water on biochar derived from spent Pleurotus ostreatus substrate[J]. Journal of Environmental Engineering, 2020, 14(11): 3170-3181. DOI:10.12030/j.cjee.202001024 |
| [27] |
Liu L, Huang Y, Meng Y, et al. Investigating the adsorption behavior and quantitative contribution of Pb2+ adsorption mechanisms on biochars by different feedstocks from a fluidized bed pyrolysis system[J]. Environmental Research, 2020, 187: 109609. DOI:10.1016/j.envres.2020.109609 |
| [28] |
Wang Z, Liu G, Zheng H, et al. Investigating the mechanisms of biochar's removal of lead from solution[J]. Bioresource Technology, 2015, 177: 308-317. DOI:10.1016/j.biortech.2014.11.077 |
| [29] |
李旭, 季宏兵, 张言, 等. 不同制备温度下水生植物生物炭吸附Cd2+研究[J]. 水处理技术, 2019, 45(9): 68-73, 77. LI Xu, JI Hong-bing, ZHANG Yan, et al. Adsorption characteristics and mechanism of Cd2+ on biochar with different pyrolysis temperatures produced from hydrophyte[J]. Technology of Water Treatment, 2019, 45(9): 68-73, 77. |
| [30] |
唐登勇, 胡洁丽, 胥瑞晨, 等. 芦苇生物炭对水中铅的吸附特性[J]. 环境化学, 2017, 36(9): 1987-1996. TANG Deng-yong, HU Jieli, XU Rui-chen, et al. Adsorption of lead onto reed biochar in aqueous solution[J]. Environmental Chemistry, 2017, 36(9): 1987-1996. |
| [31] |
Liu L, Huang Y, Zhang S, et al. Adsorption characteristics and mechanism of Pb(Ⅱ) by agricultural waste-derived biochars produced from a pilot-scale pyrolysis system[J]. Waste Manag, 2019, 100: 287-295. DOI:10.1016/j.wasman.2019.08.021 |
| [32] |
杨婷婷, 孟莉蓉, 李晖, 等. 两种生物炭对Pb的吸附特性研究[J]. 农业环境科学学报, 2017, 36(8): 1627-1633. YANG Ting-ting, MENG Li-rong, LI Hui, et al. Adsorption of Pb by biochars derived from two types of biomass[J]. Journal of Agro-Environment Science, 2017, 36(8): 1627-1633. |
| [33] |
徐东昱, 周怀东, 高博. 生物炭吸附重金属污染物的研究进展[J]. 中国水利水电科学研究院学报, 2016, 14(1): 7-15. XU Dongyu, ZHOU Huai-dong, GAO Bo. Research progress on biochar adsorption of heavy metal contaminants[J]. Journal of China Institute of Water Resources and Hydropower Research, 2016, 14(1): 7-15. |
| [34] |
黄爽, 董彩琴, 黄介生, 等. 温度及过筛方式对猪粪和稻秆炭理化特性和镉吸附的影响[J]. 农业工程学报, 2018, 34(8): 235-243. HUANG Shuang, DONG Cai-qin, HUANG Jie-sheng, et al. Effects of temperature and sieving treatments on physicochemical characteristics and cadmium adsorption capacity for biochars derived from pig manure and rice straw[J]. Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(8): 235-243. |
| [35] |
邓金环, 郜礼阳, 周皖婉, 等. 不同温度制备香根草生物炭对Cd2+的吸附特性与机制[J]. 农业环境科学学报, 2018, 37(2): 340-349. DENG Jin-huan, GAO Li-yang, ZHOU Wan-wan, et al. Adsorption characteristics and mechanisms of Cd2+ in biochar derived from vetiver grass under different pyrolysis temperatures[J]. Journal of AgroEnvironment Science, 2018, 37(2): 340-349. |
| [36] |
Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3): 3488-3497. DOI:10.1016/j.biortech.2010.11.018 |
| [37] |
Xu X, Zhao Y, Sima J, et al. Indispensable role of biochar-inherent mineral constituents in its environmental applications: A review[J]. Bioresource Technology, 2017, 241: 887-899. DOI:10.1016/j.biortech.2017.06.023 |
| [38] |
李江遐, 吴林春, 张军, 等. 生物炭修复土壤重金属污染的研究进展[J]. 生态环境学报, 2015, 24(12): 2075-2081. LI Jiang-xia, WU Lin-chun, ZHANG Jun, et al. Research progresses in remediation of heavy metal contaminated soils by biochar[J]. Ecology and Environmental Sciences, 2015, 24(12): 2075-2081. |
 2021, Vol. 40
2021, Vol. 40