生物炭是由农业废弃物在完全或部分缺氧条件下热解炭化生成的一类高度芳香化难熔性高聚物[1]。生物炭对重金属镉(Cd)表现出较强的吸附作用[2-3],其主要吸附机理包括[4-8]:(1)沉淀作用,如Cd与生物炭表面含PO43-或CO32-的矿物形成磷酸盐或碳酸盐沉淀;(2)离子交换作用,生物炭表面含有大量阳离子,如K+、Na+、Mg2+、Ca2+等,重金属离子可通过与这些阳离子发生交换反应而吸附在生物炭表面;(3)配位作用,低温制备的生物炭表面含有丰富的含氧极性官能团,如—OH和—COOH等,这些极性官能团可与重金属离子发生络合反应;(4)Cd-Π作用,Cd可与生物炭表面富电子区域(如—C=C、苯环)形成共价键。但是文献中关于生物炭对Cd吸附机理的报道通常是定性分析,很少有研究能从定量的角度明确各吸附机理在生物炭吸附Cd过程中的贡献。生物炭对Cd的吸附能力及吸附机理与生物炭自身的理化性质密切相关,而生物炭的理化性质受原材料以及热解条件影响较大[9-12]。
秸秆和猪粪是我国产量较大的两类农业废弃物,由这两类农业废弃物所引发的环境问题已经引起了人们的广泛关注。以秸秆和猪粪为原料热解成生物炭,既可以缓解废弃物堆积和燃烧带来的不利影响,又可以吸附固定重金属[13-16]。因此,本研究以猪粪和秸秆在不同温度下制备的生物炭作为研究对象进行Cd吸附试验,定量分析各吸附机理在生物炭吸附Cd过程中的贡献率,有利于清楚认识生物炭的不同性质在吸附重金属过程中的作用,以期为制备生物炭提供理论基础。
1 材料与方法 1.1 生物炭的制备与表征本研究选用灰分含量差异较大的两种生物质材料小麦秸秆和猪粪制备生物炭。小麦秸秆和猪粪分别取自山西省运城市芮城县某农田和养猪场,将收集得到的样品风干,去除碎石等异物,粉碎备用。利用管式炉分别对两种生物质进行热解制备生物炭,升温速率为5 ℃·min-1,分别升温至300 ℃和700 ℃,并保持2 h,期间通氮气。将制备得到的生物炭研磨过筛,粒径为0.038 5~0.450 0 mm(40目和200目之间)的生物炭即为研究所用生物炭[17]。根据来源和热解温度,将制备得到的生物炭分别标记为PBC300、PBC700、WBC300和WBC700,其中PBC和WBC分别为猪粪和小麦秸秆制备的生物炭,300和700分别为热解温度。
利用灼烧质量损失法测定生物炭有机质和无机灰分含量[18-21]。准确称取50.0 g生物炭于坩埚中,置于马弗炉内,于750 ℃下灼烧4 h,冷却后称取剩余部分含量,即为生物炭无机灰分含量,损失部分为生物炭有机质含量。利用元素分析仪(Elementar Vario EL,德国)表征生物炭元素C、H、N的组成,元素O含量通过样品有机质质量减去C、H、N元素含量得到。
1.2 等温吸附试验取一定质量生物炭加入到40 mL样品瓶中,再加入40 mL初始浓度分别为10~50 mg·L-1Cd溶液,以0.01 mg·L-1的NaNO3溶液作为支持电解质,用稀HNO3和NaOH溶液调节pH为5.0,旋紧盖子,置于摇床中,于20 ℃和120 r·min-1条件下,连续恒温振荡48 h,之后取上清液,过0.45 µm滤膜,利用原子吸收光谱仪(Analytik jena,ZEEnit 700P)测定溶液中Cd含量[22]。通过质量平衡法计算吸附于生物炭上的Cd含量。
1.3 吸附机理分析生物炭内无机和有机组分为吸附Cd的主要结构,为了定性及定量计算各组分对Cd在生物炭上吸附的贡献,将生物炭进行除灰处理,并利用除灰生物炭和原生物炭分别进行单点吸附试验,同时对吸附平衡后Cd在生物炭上赋存形态及吸附溶液中阴阳离子组分及含量进行测定[20]。
1.3.1 除灰生物炭的制备利用1 mol·L-1 HCl溶液去除生物炭内无机组分[17, 20-21]。称取15 g生物炭于含有100 mL 1 mol·L-1 HCl的锥形瓶中,置于恒温振荡箱中25 ℃、200 r· min-1振荡2 h。为保证生物炭灰分去除彻底,该过程重复3次,再用蒸馏水冲洗至pH恒定,然后将生物炭进行冷冻干燥,备用。除灰后生物炭分别标记为APBC和AWBC。
1.3.2 吸附试验分别准确称取原生物炭和除灰生物炭各1.00 g于250 mL锥形瓶中,加入100 mL 200 mg·L-1的Cd溶液(超纯水配制,pH 5.0),以不含Cd的超纯水(pH 5.0)作为空白对照,按照等温吸附试验方法进行吸附。利用pH计(PHS-3C,雷磁,上海精密科学仪器有限公司)分别测定平衡前后吸附溶液的pH值。
1.3.3 Cd在生物炭上赋存形态表征吸附平衡后将生物炭分离并冷冻干燥,利用傅里叶红外光谱(FTIR,Nexus 870,Nicolet,美国)表征吸附前后生物炭表面官能团的变化,利用X射线光电子能谱仪(XPS,Axis Ultra DLD,Kratos Analytical Ltd,美国)及X射线光谱仪(XRD,BRUKER D8 ADVANCE,德国)对Cd在生物炭上的存在形态进行表征。
1.3.4 吸附溶液中阴阳离子含量测定利用原子吸收光谱仪分别测定吸附平衡前后溶液中K+、Na+、Ca2+、Mg2+和Cd含量。利用钼酸盐-抗坏血酸法测定溶液中PO43-含量,酸碱指示剂滴定法测定溶液中CO32-含量。
1.4 不同吸附机理对Cd在生物炭上吸附的贡献生物炭吸附Cd的主要成分为生物炭有机组分和无机组分,无机组分主要通过离子交换作用和沉淀作用吸附Cd,有机组分主要通过络合作用吸附Cd[18-21]。离子交换作用主要指Cd通过静电吸引作用吸附在生物炭上,置换下等量的阳离子,如Ca2+、K+、Na+和Mg2+等,因此可通过测定吸附前后溶液中Ca2+、K+、Na+和Mg2+的量计算生物炭通过离子交换作用吸附Cd的量。沉淀作用主要指Cd与生物炭表面阴离子,如PO43-、CO32-发生沉淀反应而吸附在生物炭上。络合作用指Cd通过与生物炭含氧官能团配位而吸附在生物炭上。配位过程中释放出的H+会导致溶液pH值变化,因此可通过pH值的改变计算络合吸附Cd的量。
离子交换作用(Qcme)、矿物沉淀作用(Qcmp)、络合作用(Qco)在吸附过程中的吸附量按以下公式计算:
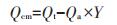
|
(1) |
式中:Qcm为Cd与矿物质反应的吸附量,mg·g-1;Qa和Qt分别为除灰生物炭和原生物炭对Cd的吸附量,mg·g-1;Y为除灰生物炭产率,%。
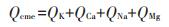
|
(2) |
式中:QK、QCa、QNa和QMg为原生物炭释放到吸附溶液中可交换态K+、Ca2+、Na+和Mg2+的含量,mg·g-1。
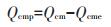
|
(3) |
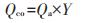
|
(4) |
Qco/Qt、Qcme /Qt、Qcmp/Qt的比值分别为络合作用、离子交换作用和沉淀作用在Cd吸附过程中的贡献率。
1.5 数据分析利用Freundlich[式(5)]和Langmuir[式(6)]模型对吸附等温线数据进行拟合。
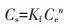
|
(5) |

|
(6) |
式中:Cs为平衡时生物炭吸附Cd的量,mg·g-1;Ce为平衡时溶液中Cd的浓度,mg·L-1;Kf为Freundlich吸附系数(mg·g-1)(mg·L-1)-n;n为吸附等温线非线性指数,无量纲;qmax为最大吸附量,mg·g-1;KL为平衡吸附常数,L·g-1。
吸附试验中每个浓度设置3个平行,使用Microsoft 2010 Excel软件计算平均值和标准差。利用Origin 2018拟合吸附等温线。
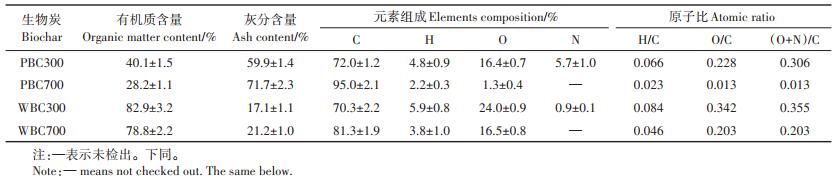
2 结果与讨论 2.1 生物炭的性质本研究所制备的4种生物炭的元素组成和各原子比见表 1。生物炭性质与原材料及其制备温度密切相关。与WBC相比,PBC有机质含量较低,但灰分含量较高。这主要是因为猪粪生物质中含有较多的无机组分,如碳酸盐和硅酸盐等,在热解过程中有机组分逐渐分解降低,而无机组分残留在生物炭中导致的[23-25]。随着热解温度的升高,PBC和WBC中元素C含量逐渐增加,而元素H、O、N含量逐渐降低,导致原子比H / C和O / C降低,表明高温制备的生物炭(BC700)含有较多芳香碳结构(原子比H/C较低),而低温制备的生物炭(BC300)含有较多含氧基团(原子比O/C较大)。
|
|
表 1 生物炭的元素组成与原子比 Table 1 The elemental composition and atomic ratio of biochar |
生物炭内丰富的无机或有机组分为其吸附重金属提供了吸附位点,但不同原材料在不同温度下制备的生物炭性质差异显著,这可能是导致不同生物炭对重金属吸附存在差异的主要原因。
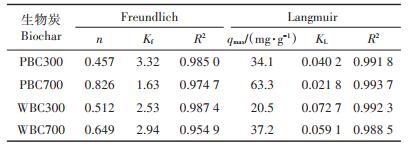
2.2 Cd在生物炭上的吸附等温线Cd在生物炭上的吸附等温线及其拟合参数如图 1和表 2所示。Freundlich和Langmuir模型均能较好拟合Cd在PBC和WBC上的吸附等温线,R2均大于0.9,其中Langmuir模型拟合更好的效果,WBC700的R2为0.988 5,其他3种BC的R2大于0.99。从图 1和表 2可以看出,Cd在生物炭上的吸附等温线非线性较强(n < 1),说明Cd在生物炭上的吸附是表面吸附,而且生物炭对Cd的吸附点位具有异质性特点。根据Langmuir拟合结果可以推测,Cd在生物炭上的吸附点位有限,吸附机制属于单分子层吸附,其中化学吸附起主导作用。热解温度越高,KL值越低,说明高温制备的生物炭有利于与Cd的结合。PBC300、PBC700、WBC300和WBC700对Cd的最大吸附量分别为34.1、63.3、20.5、37.2 mg·g-1,相同温度下猪粪制备的生物炭(PBC)对Cd的吸附能力强于秸秆制备的生物炭(WBC),结合生物炭的性质(表 1),推测灰分在生物炭吸附Cd的过程中起到了重要作用。
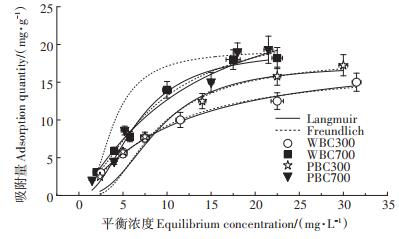
|
图 1 Cd在生物炭上的等温吸附 Figure 1 Sorption isotherm of Cd on biochar |
|
|
表 2 Cd在生物炭上的吸附等温线拟合参数 Table 2 The regression parameters of Cd on biochar fitted by Freundlich and Langmuir equation |
为了解生物炭灰分在生物炭吸附Cd过程中的作用,对4种生物炭进行了除灰处理,除灰后生物炭的pH为中性,灰分含量显著降低(< 5%),说明酸洗处理可将大部分灰分去除。除灰前后生物炭对Cd吸附能力的变化如图 2所示。在相同初始浓度下,与原生物炭(BC)相比,除灰后生物炭(ABC)对Cd的吸附量显著下降。PBC700和WBC700对Cd的吸附量分别为15.9 mg·g-1和15.7 mg·g-1,PBC300和WBC300对Cd的吸附量分别为11.5 mg·g-1和9.57 mg·g-1。而除灰后,APBC700和AWBC700对Cd的吸附量分别为2.70 mg·g-1和3.11 mg·g-1,与BC相比分别下降了83.0%和80.3%。APBC300和AWBC300对Cd的吸附量分别为6.13 mg · g-1和5.84 mg · g-1,与BC相比分别下降了46.6% 和38.5%。可以看出,除灰处理对BC700吸附Cd的影响明显强于BC300;而且除灰对PBC吸附Cd的影响强于WBC,这表明无机灰分为高温生物炭吸附Cd的主要成分,有机质和无机灰分为低温下制备的生物炭(BC300)吸附Cd的主要成分。
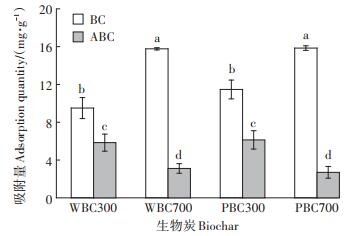
|
不同字母表示处理间差异显著(P < 0.05) Different letters indicate significant difference among treatments(P < 0.05) 图 2 原生物炭与除灰生物炭对Cd的吸附量 Figure 2 Adsorption of Cd by original biochar and ash-removing biochar |
生物炭内无机灰分成分主要为硅酸盐、碳酸盐和磷酸盐等[26],因此在生物炭对Cd的吸附过程中,灰分可通过离子交换作用以及沉淀作用促进生物炭对Cd的吸附。
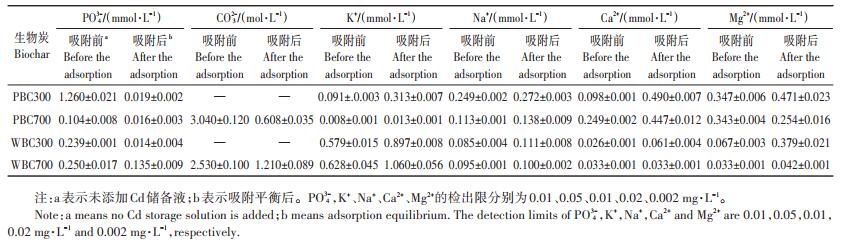
2.3.1 沉淀作用大量文献表明,吸附过程中Cd可与生物炭释放到水溶液中的部分阴离子(如CO32-、PO32-和OH-)形成沉淀[27-29]。为定量分析沉淀作用在生物炭吸附Cd过程中的作用,测定了吸附前后吸附背景液中部分离子含量的变化,如表 3所示。PBC和WBC溶液中含有一定量的CO32-和PO32-,其中BC700溶液中CO32-含量高于BC300,PBC300溶液中PO43-含量高于PBC700,而WBC300溶液中PO43-含量低于WBC700,这与生物炭本身性质有关[29]。除灰处理后,APBC和AWBC溶液中CO32-和PO43-含量显著降低。添加与未添加Cd储备液的处理相比,吸附达到平衡后,溶液中CO32-和PO43-含量显著降低,表明吸附过程中Cd可能与CO32-和PO43-结合形成沉淀,导致溶液中CO32-和PO43-含量降低。图 3为生物炭吸附Cd前后的XRD图谱,可以看出吸附后生物炭表面出现了C2CdO4·H2O和CdCO3两种沉淀,尤其是PBC700。可能由于PO43-含量较低,导致吸附后生物炭表面未检出Cd3(PO4)2峰。吸附后生物炭表面出现明显的Cd3d峰,其中404.4 eV被认为是CdCO3沉淀(图 4),这表明吸附过程中在生物炭表面出现了CdCO3。结合吸附前后溶液中CO32-和PO43-含量变化和吸附前后生物炭表面XRD及XPS图谱,表明沉淀作用为生物炭吸附Cd的机理之一。
|
|
表 3 生物炭吸附Cd前后溶液中的部分离子含量(平均值±标准差) Table 3 Partial ion content in solution before and after Cd adsorption by biochar |

|
图 3 生物炭吸附Cd前后的XRD图谱 Figure 3 XRD of biochar before and after Cd adsorption. |

|
图 4 不同生物炭吸附Cd前后的XPS图谱 Figure 4 XPS spectra of different biochars before and after Cd adsorption |
金属离子(如K+、Na+、Ca2+、Mg2+)可通过静电吸引以及与生物炭上的羧基和羟基形成表面络合物(如—COOM和—R—O—M)的方式负载在生物炭表面。离子交换作用被认为是一种生物炭吸附重金属的常见吸附机理[30]。为证明生物炭灰分对吸附Cd的作用,测定了生物炭吸附Cd前后溶液中部分金属离子的含量(表 3)。与吸附前溶液中金属离子含量相比,吸附平衡后溶液中Ca2+、Mg2+、Na+、K+含量均显著增加。整体来说,PBC300和WBC300吸附过程中释放的金属阳离子的含量高于PBC700和WBC700释放的量,而且吸附过程中生物炭释放的二价阳离子的量(Ca2+和Mg2+)高于一价阳离子(Na+和K+)的量。PBC300的吸附使溶液中K+、Na+、Ca2+和Mg2+含量分别增加了264%、9%、400%和36%;WBC300的吸附使溶液中K+、Na+、Ca2+和Mg2+含量分别增加了55%、31%、135% 和466%。BC300含有较高的O/C,即具有丰富的含氧官能团,因此离子交换作用在低温生物炭(BC300)吸附Cd的过程中较高温生物炭(BC700)更显著,而且起最主要作用的是与生物炭含氧官能团络合的二价无机阳离子(如Ca2+和Mg2+)。
2.4 有机质在生物炭吸附Cd过程中的作用由图 2可知,生物炭除灰后仍对Cd具有较强的吸附能力,这说明生物炭有机组分对吸附Cd起到了重要作用,尤其是低温制备的生物炭。有机质是生物炭的重要组成成分,主要是由C、H、O、N和S等元素组成的富含多羧基或多羟基官能团的芳香烃及脂肪烃类高聚物。生物炭表面的羧基、羟基等结构可通过共价键的形式结合金属离子,这被认为是生物炭吸附重金属的一项重要机理。为探究生物炭有机质对Cd的吸附机理,本研究借助FTIR和XPS光谱分析了生物炭吸附Cd关键结合位点及Cd在生物炭表面的赋存形态。对比生物炭吸附Cd前后的FTIR光谱图(图 5)可以发现,吸附前后生物炭表面部分有机官能团位移发生变化,当Cd吸附在生物炭上后,4种不同生物炭在3 620、1 680、1 100 cm−1和600 cm−1附近峰(分别对应的官能团为—OH、C=O、—C—O和芳烃)的位移均发生不同程度的变化,表明吸附过程中Cd主要结合点位为生物炭表面的含氧官能团。
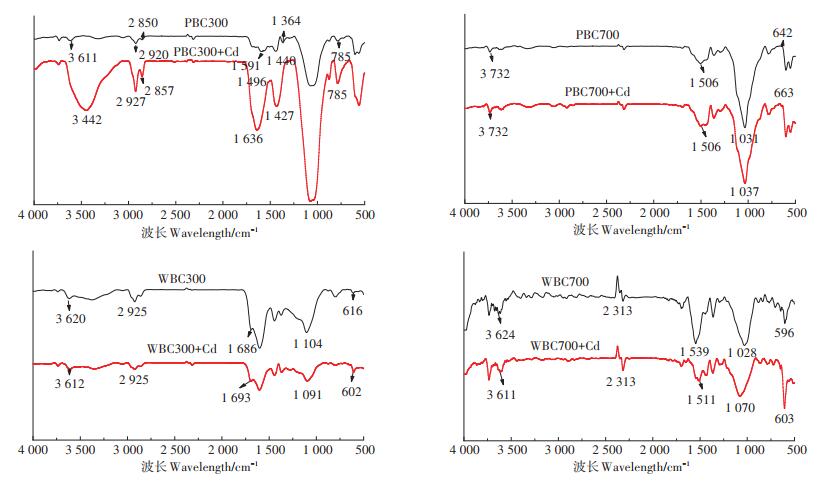
|
图 5 不同生物炭吸附Cd前后的FTIR谱图 Figure 5 FTIR spectra before and after Cd adsorption by different biochar |
生物炭吸附前后表面XPS光谱分析结果如图 4所示。生物炭吸附Cd后,其表面出现了Cd3d峰,对该峰分析可知Cd主要以Cd—O、—OCdOH或CdCO3形态存在于生物炭表面。与吸附前相比,除灰生物炭吸附Cd后溶液的pH值有所降低。APBC300、APBC700、AWBC300和AWBC700吸附Cd后溶液pH值分别下降了0.67、-0.13、0.43、0.12。有研究表明[31],含氧官能团与Cd络合过程中H+的释放导致溶液pH值下降。综上,结合吸附前后生物炭表面FTIR和XPS谱图,以及溶液pH值的变化,可推测生物炭内含氧官能团为吸附Cd的主要吸附点位。
2.5 定量分析生物炭对Cd的吸附作用2.3和2.4的结果表明,Cd在生物炭上的吸附机理包括沉淀作用、离子交换作用和络合作用。生物炭通过各吸附作用吸附Cd的量如图 6a所示,在本试验条件下,各吸附机理在生物炭吸附Cd过程中的贡献率如图 6b所示。
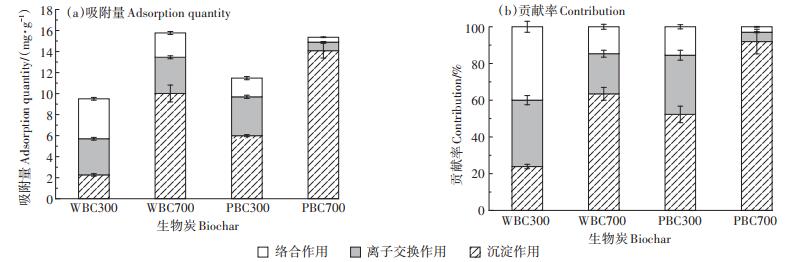
|
图 6 不同生物炭通过沉淀作用、离子交换作用和络合作用对Cd的吸附 Figure 6 Different biochars adsorbed Cd by precipitation, ion exchange and complexation |
由图 6可以看出,生物炭吸附Cd过程中,灰分起到了重要作用。对于灰分含量比较高的生物炭,如PBC300和PBC700,在本试验条件下,灰分在生物炭吸附Cd过程中的贡献率(沉淀作用和离子交换作用)接近90%,而且主要通过沉淀作用吸附Cd。随着生物炭热解温度的升高,沉淀作用在生物炭吸附Cd过程中的贡献率升高,如PBC300为52.1%,PBC700为91.9%;而离子交换作用的贡献率逐渐下降,这可能由于高温制备的生物炭中金属阳离子向矿物晶体转变,抑制了与Cd的交换作用;但灰分(沉淀作用和离子交换作用)对生物炭吸附Cd的贡献率升高。由于低温制备的生物炭有机质含量较高,且含有丰富的含氧官能团(原子比O/C较高),如PBC300和WBC300,因此络合作用在生物炭吸附Cd过程中的贡献率较高温制备生物炭的高,WBC300中络合作用贡献率为39.9%,而WBC700为14.7%。
3 结论(1)无机组分和有机质是生物炭吸附Cd的主要组分,其中无机组分主要通过沉淀作用和离子交换作用吸附溶液中的Cd,有机质通过表面含氧官能团的络合作用吸附溶液中的Cd。
(2)随着生物炭热解温度的升高,沉淀作用在生物炭吸附Cd过程中的贡献率升高,而离子交换作用和络合作用贡献率下降。
(3)灰分含量较高以及高温制备的生物炭,无机沉淀作用和离子交换作用为生物炭吸附Cd的主要机理;低温制备的有机质含量较高的生物炭有机质对Cd的吸附贡献率较高。
| [1] |
Xiao X, Chen B L, Chen Z M, et al. Insight into multiple and multilevel structures of biochars and their potential environmental applications: A critical review[J]. Environmental Science and Technology, 2018, 52(9): 5027-5047. DOI:10.1021/acs.est.7b06487 |
| [2] |
Liu Y Y, Wang L, Wang X Y, et al. Oxidative ageing of biochar and hydrochar alleviating competitive sorption of Cd(Ⅱ) and Cu(Ⅱ)[J]. Science of the Total Environment, 2020, 725: 138419. DOI:10.1016/j.scitotenv.2020.138419 |
| [3] |
Fan S S, Li H, Wang Y, et al. Cadmium removal from aqueous solution by biochar obtained by co-pyrolysis of sewage sludge with tea waste[J]. Research on Chemical Intermediates, 2017, 44(1): 135-154. DOI:10.1007/s11164-017-3094-1 |
| [4] |
Goswami R, Shim J, Deka S, et al. Characterization of cadmium removal from aqueous solution by biochar produced from Ipomoea fistulosa at different pyrolytic temperatures[J]. Ecological Engineering, 2016, 97: 444-451. DOI:10.1016/j.ecoleng.2016.10.007 |
| [5] |
Guo Z Z, Zhang X D, Kang Y, et al. Biomass-derived carbon sorbents for Cd(Ⅱ) removal: Activation and adsorption mechanism[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(5): 4103-4109. |
| [6] |
Bashir S, Zhu J, Fu Q L, et al. Comparing the adsorption mechanism of Cd by rice straw pristine and KOH-modified biochar[J]. Springer Nature Journal, 2018, 25: 11875-11883. |
| [7] |
Trakal L, Veselská V, Šafařík I, et al. Lead and cadmium sorption mechanisms on magnetically modified biochars[J]. Bioresource Technology, 2016, 203: 318-324. DOI:10.1016/j.biortech.2015.12.056 |
| [8] |
Wang Z H, Shen D K, Shen F, et al. Equilibrium, kinetics and thermodynamics of cadmium ions(Cd) removal from aqueous solution using earthworm manure-derived carbon materials[J]. Journal of Molecular Liquids, 2017, 241: 612-621. DOI:10.1016/j.molliq.2017.05.097 |
| [9] |
Chen Z, Liu T, Tang J J, et al. Characteristics and mechanisms of cadmium adsorption from aqueous solution using lotus seedpod-derived biochar at two pyrolytic temperatures[J]. Environmental Science and Pollution Research, 2018, 25: 11854-11866. DOI:10.1007/s11356-018-1460-1 |
| [10] |
Han L F, Sun H R, Ro Kyoung S, et al. Removal of antimony(Ⅲ) and cadmium(Ⅱ) from aqueous solution using animal manure-derived hydrochars and pyrochars[J]. Bioresource Technology, 2017, 234: 77-85. DOI:10.1016/j.biortech.2017.02.130 |
| [11] |
Higashikawa F S, Conz R F, Colzato M, et al. Effects of feedstock type and slow pyrolysis temperature in the production of biochars on the removal of cadmium and nickel from water[J]. Journal of Cleaner Production, 2016, 137: 965-972. DOI:10.1016/j.jclepro.2016.07.205 |
| [12] |
Bian R J, Joseph S, Cui L Q, et al. A three-year experiment confirms continuous immobilization of cadmium and lead in contaminated paddy field with biochar amendment[J]. Journal of Hazardous Materials, 2014, 272: 121-128. DOI:10.1016/j.jhazmat.2014.03.017 |
| [13] |
C ui, L Q, Pan G X, Li L Q, et al. Continuous immobilization of cadmium and lead in biochar amended contaminated paddy soil: A fiveyear field experiment[J]. Ecological Engineering, 2016, 93: 1-8. DOI:10.1016/j.ecoleng.2016.05.007 |
| [14] |
Ahmad M, Rajapaksha A U, Lim J E, et al. Biochar as a sorbent for contaminant management in soil and water: A review[J]. Chemosphere, 2014, 99: 19-33. DOI:10.1016/j.chemosphere.2013.10.071 |
| [15] |
Meng Z W, Huang S, Xu T, et al. Transport and transformation of Cd between biochar and soil under combined dry-wet and freeze-thaw aging[J]. Environmental Pollution, 2020, 263: 112-118. |
| [16] |
Fan J P, Li Y, Yu H Y, et al. Using sewage sludge with high ash content for biochar production and Cu(Ⅱ) sorption[J]. Science of the Total Environment, 2020, 713: 548-557. |
| [17] |
Wang Z Y, Liu G C, Zheng H, et al. Investigating the mechanisms of biochar's removal of lead from solution[J]. Bioresource Technology, 2015, 177: 308-317. DOI:10.1016/j.biortech.2014.11.077 |
| [18] |
Cui X Q, Fang S Y, Yao Y Q, et al. Potential mechanisms of cadmium remov al from aqueous solution by Canna indica derived biochar[J]. Science of the Total Environment, 2016, 562: 517-525. DOI:10.1016/j.scitotenv.2016.03.248 |
| [19] |
Xia Y, Yang T X, Zhu N M, et al. Enhanced adsorption of Pb(Ⅱ) onto modified hydrochar: Modeling and mechanism analysis[J]. Bioresource Technology, 2019, 288: 121593. DOI:10.1016/j.biortech.2019.121593 |
| [20] |
Liu L, Fan S S. Removal of cadmium in aqueous solution using wheat straw biochar: Effect of minerals and mechanism[J]. Environmental Science and Pollution Research International, 2018, 25(9): 8688-8700. DOI:10.1007/s11356-017-1189-2 |
| [21] |
Sun J K, Lian F, Liu Z Q, et al. Biochars derived from various crop straws: Characterization and Cd(Ⅱ) removal potential[J]. Ecotoxicology and Environmental Safety, 2014, 106: 226-231. DOI:10.1016/j.ecoenv.2014.04.042 |
| [22] |
Jennifer C, Isabel G, Bernard L, et al. Effect of biochar and compost on soil properties and organic matter in aggregate size fractions under field conditions[J]. Agriculture, Ecosystems and Environment, 2020, 295: 106882. DOI:10.1016/j.agee.2020.106882 |
| [23] |
田俊俊. 生物炭对镉污染土壤的钝化修复效应研究[D]. 成都: 四川农业大学, 2018. TIAN Jun-jun. Passivation and remediation effects of biochar on cadmium contaminated soil[D]. Chengdu: Sichuan Agricultural University, 2018. |
| [24] |
Lu H L, Zhang W H, Yang Y X, et al. Relative distribution of Pb2+ sorption mechanisms by sludge-derived biochar[J]. Water Research, 2012, 46(3): 854-862. DOI:10.1016/j.watres.2011.11.058 |
| [25] |
Liang J, Li X M, Yu Z G, et al. Amorphous MnO2 modified biochar derived from aerobically composted swine manure for adsorption of Pb(Ⅱ) and Cd(Ⅱ)[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(6): 5049-5058. |
| [26] |
Wan S L, Ma Z Z, Xue Y, et al. Sorption of lead(Ⅱ), cadmium(Ⅱ), and copper(Ⅱ) ions from aqueous solutions using tea waste[J]. Industrial & Engineering Chemistry Research, 2014, 53(9): 3629-3635. |
| [27] |
Chi T, Zuo J, Liu F L. Performance and mechanism for cadmium and lead adsorption from water and soil by corn straw biochar[J]. Frontiers of Environmental Science & Engineering, 2017, 11: 157-164. |
| [28] |
Shen Z T, Zhang Y H, McMillan O, et al. Characteristics and mechanisms of nickel adsorption on biochars produced from wheat straw pellets and rice husk[J]. Environmental Science and Pollution Research International, 2017, 24(14): 12809-12819. DOI:10.1007/s11356-017-8847-2 |
| [29] |
Deng Y Y, Huang S, Laird D A, et al. Quantitative mechanisms of cadmium adsorption on rice straw and swine manure-derived biochars[J]. Environmental Science and Pollution Research, 2018, 25: 32418-32432. DOI:10.1007/s11356-018-2991-1 |
| [30] |
Zhang F, Wang X, Yin D X, et al. Efficiency and mechanisms of Cd removal from aqueous solution by biochar derived from water hyacinth (Eichornia crassipes)[J]. Journal of Environmental Management, 2015, 153: 68-73. |
| [31] |
Li B, Yang L, Wang C Q, et al. Adsorption of Cd(Ⅱ) from aqueous solutions by rape straw biochar derived from different modification processes[J]. Chemosphere, 2017, 175: 332-340. DOI:10.1016/j.chemosphere.2017.02.061 |
 2021, Vol. 40
2021, Vol. 40