由于铅锌矿不合理开采以及工农业生产等原因,Cd通过地表径流和地下渗透等途径进入农田土壤。《全国污染土壤调查公报》指出,Cd的点位超标率为7.0%,为重金属之首[1]。我国人多地少,即使是Cd污染的农田仍广泛种植农作物,因此作物对Cd的吸收与累积引起广泛关注[2]。
玉米是我国重要的粮食作物,具有生长期短、易种易管和品种丰富等优点[3]。陈建军等[4]、鄢小龙等[5]和郭晓方等[6]均发现,玉米对Cd有一定吸收能力,且不同品种的富集转运能力存在明显差异,但造成品种差异性的机理目前尚不明确。
根系是植物吸收养分和水分的主要器官,受环境中有益元素和有毒元素影响[7]。在受到Cd离子胁迫时,根系会通过调整形态结构和代谢来应对胁迫,如耐Cd玉米感受Cd信号后会通过改变体内代谢过程来适应胁迫环境[8]。沈天尔等[9]发现,玉米可启动相关响应机制阻滞Cd的运输以缓解Cd离子毒害。陈伟等[10]研究表明,黑麦草根长、根表面积和根尖数均随着重金属离子浓度升高而不断降低。根系形态的改变又会影响根系对水分、矿物元素和Cd的吸收。因此,植物根系形态与Cd的吸收累积存在密切关系。
重金属胁迫影响根系的同时也会影响根鞘形成。根鞘是根系、土壤、微生物的互作产物,是土壤颗粒与根表及根毛相互黏附、缠绕形成的土壤连续体[11]。根鞘结构的形成有利于植物根土界面的信息交流及水分和养分的交换,也可以作为一个联合固氮微生物储存库[11],可以表征农作物在土壤中开发和获取资源的能力[12],在应对非生物胁迫方面也具有潜在重要性[13]。Delhaize等[14]发现,不同品种小麦在酸性土壤中根鞘有显著差异,并认为这种差异是根毛对Al耐性而造成的。Bailey等[15]发现不同物种间根鞘结合强度不同,表明根鞘性状存在差异。根鞘作为耐非生物胁迫的重要器官,在养分吸收方面具有潜在重要性,James等[16]的试验表明,同一植物不同品种的根鞘性状以及根鞘吸收磷的效率均有显著差异。当前,对根鞘的研究多集中在干旱条件下根鞘提高植物抗旱性和对根系的保护方面,但在Cd污染土壤中根系和根鞘的相互关系以及根鞘与植株Cd累积方面尚缺乏系统研究[17]。
鉴此,本研究选取兰坪某铅锌矿区周边Cd污染农田土壤种植玉米,研究12个玉米品种根系形态、根鞘与Cd累积特征三者间的相互关系,进而从根系和根鞘的角度研究重金属转运、吸收和累积的差异性。
1 材料与方法 1.1 供试土壤与玉米品种供试土壤为山原红壤,取自云南兰坪县某铅锌矿区重金属污染农田,土壤风干后过2 mm孔径筛备用。其基本化学性质如下:pH值为6.22,有机质含量40.1 g·kg-1,全氮、全磷和全钾含量分别为2.30、12.1、12.4 g·kg-1,碱解氮、速效磷和速效钾含量分别为132、44.2、165 mg·kg-1,土壤Cd含量9.59 mg·kg-1。
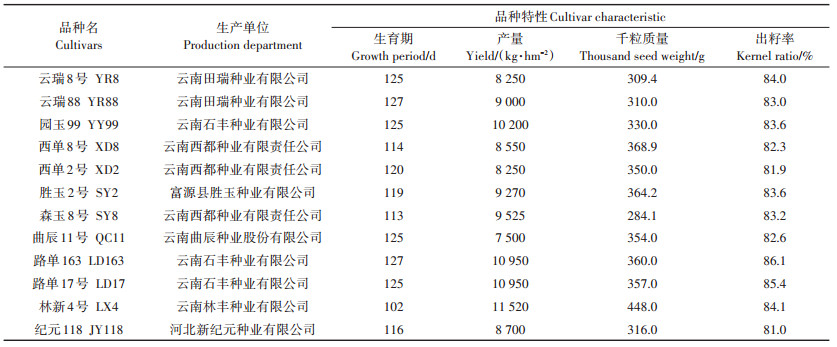
本试验选用的12个供试玉米品种,购买于云南省昆明市小板桥种子批发市场,均为云南高原主栽玉米品种。选取籽粒饱满的种子消毒后置于28 ℃下恒温培养3 d,待种子露白后播种。供试玉米名称及其生产单位见表 1。
|
|
表 1 供试玉米品种、生产单位及品种特性 Table 1 Tested cultivars of maize, production department and cultivar characteristics |
盆栽试验于2019年9月25日在云南农业大学东校区温室大棚播种,出苗35 d后收样,每个玉米品种4个重复。试验采用育苗袋尺寸为28 cm×25 cm,装入2.0 kg土壤。每个育苗袋播种3粒出芽程度一致的种子,出苗5 d后间苗,每袋留下1株生长良好的幼苗。浇水根据天气情况来定,选择晴天傍晚浇灌,保持含水量55% 左右,按常规方法进行管理。为减少环境梯度影响,同一处理的4个重复每隔一日随机调换一次位置。
1.3 指标测量方法收获时用小刀从两侧轻轻划开育苗袋,取出玉米后将地上和地下部分离,摇动地下部使大块土壤脱落,根鞘土则会保留在根部。用玻璃棒轻轻地按压根系,使根鞘从根系上脱离下来,将根鞘在烘箱中(75 ℃,72 h)烘至恒质量后称量质量。用蒸馏水清洗玉米根系,尽量减少对根毛的损害,晾干后用吸水纸吸干根系表面水分,均匀铺开,经Epson Perfection V700扫描仪(Seiko Epson,日本)扫描后,用Win RHIZO PRO STD4800型(Regent,加拿大)根系图像处理软件分析得出根体积、根长、根尖数、根表面积、分枝数、平均根系直径等参数。将地上部和地下部分别用自来水和去离子水冲洗3遍,于105 ℃烘箱杀青0.5 h,然后于75 ℃烘箱烘至恒质量,称量质量,碾碎备用。土壤样品风干、磨碎,过筛后备用。
称取0.2 g玉米植株样,采用硝酸-高氯酸消解[18],过滤并定容到50 mL容量瓶内;称取5.0 g土壤样品,采用王水-高氯酸消解,过滤并定容到50 mL容量瓶内;火焰原子吸收分光光度法测定Cd含量。用100 mL 0.01 mL·L-1氯化钙提取根鞘土壤中的有效态Cd[19],并用石墨炉测定。
根鞘发育指数由根鞘土壤与根的干质量比表示[20],Cd累积量=Cd含量(mg·kg-1)×植株生物量(g·plant-1)。
1.4 数据统计与分析采用Duncan氏新复极差法对数据进行差异显著性分析,采用Microsoft Excel软件进行常规分析,利用Origin 9.0作图软件绘图,并采用SPSS软件进行相关性分析。
2 结果与分析 2.1 玉米生物量由图 1可知,不同品种玉米地上部和地下部生物量存在差异,12个品种地上部的平均生物量为1.29 g,最高是森玉8号(达2.05 g),其次是园玉99,且两者之间无显著差异;最低是林新4号,仅为0.78 g。12个品种地下部的平均生物量为0.53 g,最高是园玉99(达1.05 g),森玉8号次之,两者间差异显著;最低是林新4号,仅为0.30 g。总的来看,地上部生物量最大值为最小值的2.6倍,地下部生物量最大值为最小值的3.5倍。

|
数据为4次重复的平均值±标准差,不同小写字母表示不同玉米品种间差异显著(P<0.05)。下同 The data in the table is the mean ± standard deviation of 4 replicates, the different lowercase letters indicate significant differences among different cultivars (P < 0.05). The same below 图 1 12个玉米品种地上部和地下部生物量 Figure 1 Biomass of shoot and root of 12 maize cultivars |
由图 2可知,根长、根表面积和根体积以园玉99最高,平均根系直径以路单17号最高,根尖数和分枝数以西单8号最高;根长、根表面积和分枝数以林新4号最低,平均根系直径以云瑞88最低,根体积和根尖数以胜玉2号最低。12个品种根长和根表面积最大值均为最小值的2.9倍,根体积最大值是最小值的3.2倍,根尖数最大值为最小值的5.5倍,分枝数最大值为最小值的6.1倍。
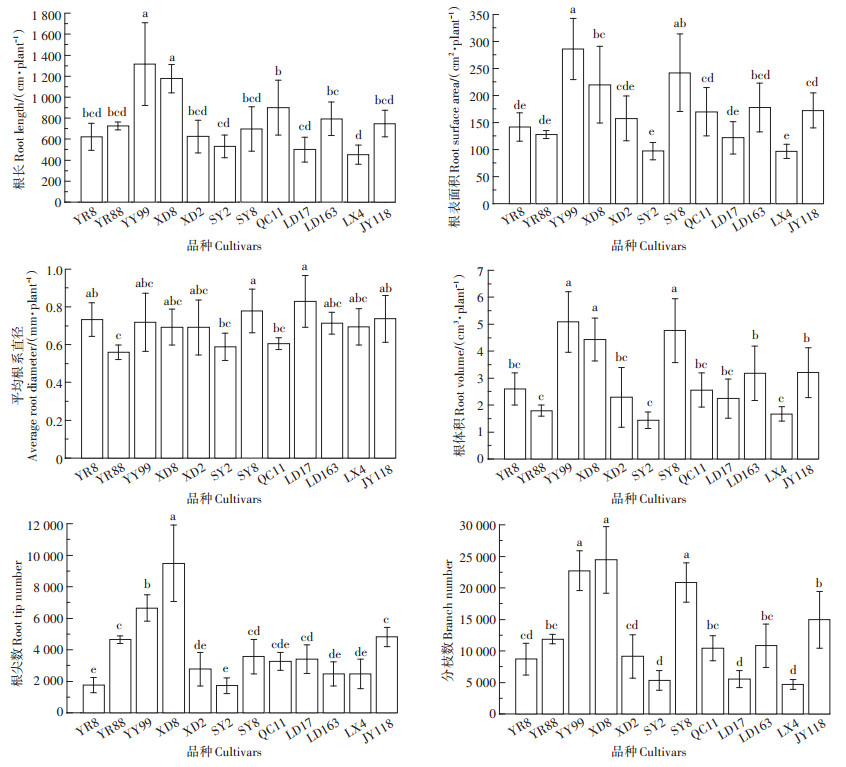
|
图 2 12个玉米品种根系形态特征 Figure 2 Morphological characteristics of roots of 12 cultivars of maize |
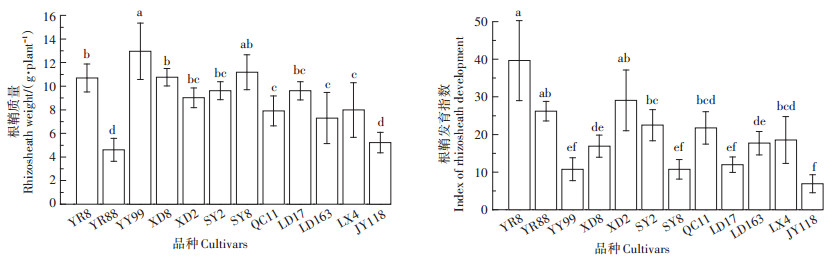
由图 3可知,根鞘质量范围为4.61~13.00 g,平均质量为8.91 g,最高是园玉99,其次是森玉8号,且两者无显著差异,最低是云瑞88。12个品种的根鞘质量最大值为最小值的3.1倍。同时,根鞘发育指数范围为6.9~39.7,平均值为19.4,最高为云瑞8号,其次是西单2号,且两者之间无显著差异,最低是纪元118;12个品种的根鞘发育指数的最大值为最小值的5.8倍。结果表明,不同品种玉米产生根鞘的能力差异较大。
|
图 3 12个玉米品种根鞘特征 Figure 3 Rhizosheath characteristics of 12 cultivars of maize |
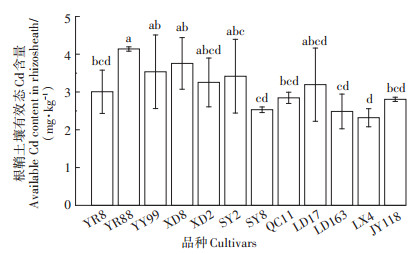
由图 4可知,根鞘土壤有效态Cd含量以云瑞88最高,林新4号最低,12个品种的平均值为3.11 mg·kg-1。
|
图 4 12个玉米品种根鞘土壤有效态Cd含量 Figure 4 Content of available Cd rhizosheath of 12 maize cultivars |
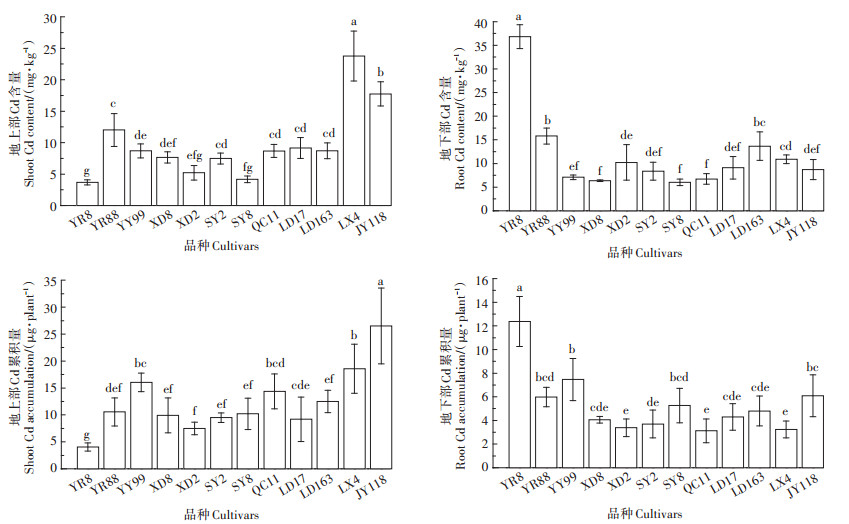
由图 5可知,不同品种玉米对Cd的富集和转运能力存在差异,12个玉米品种平均地上部Cd含量为10.0 mg·kg-1,最高是林新4号(达23.8 mg·kg-1),其次是纪元118,两者差异显著,最低是云瑞8号(3.7 mg·kg-1)。平均地下部Cd含量为11.7 mg·kg-1,最高是云瑞8号(达36.8 mg·kg-1),云瑞88次之,两者差异显著,最低是森玉8号(为6.0 mg·kg-1)。整体来看,地上部Cd含量最大值为最小值的6.4倍,地下部Cd含量最大值为最小值的6.1倍。
|
图 5 12个玉米品种Cd含量和Cd累积量 Figure 5 Cd content and Cd accumulation of 12 maize cultivars |
平均地上部Cd累积量为12.4 μg·plant-1,最高是纪元118(达26.5 μg·plant-1),其次是林新4号,且两者差异显著;最低是云瑞8号(为4.1 μg·plant-1)。平均地下部Cd累积量为5.3 μg·plant-1,最高是云瑞8号(达12.4 μg·plant-1),其次是园玉99,且两者之间差异显著,最低是曲辰11号(为3.1 μg·plant-1)。综合而言,地上部Cd累积量最大值为最小值的6.5倍,地下部最大值为最小值的4.0倍。
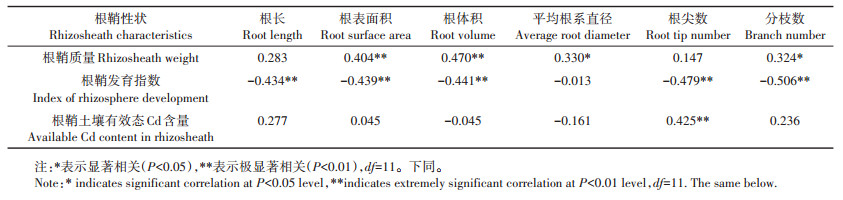
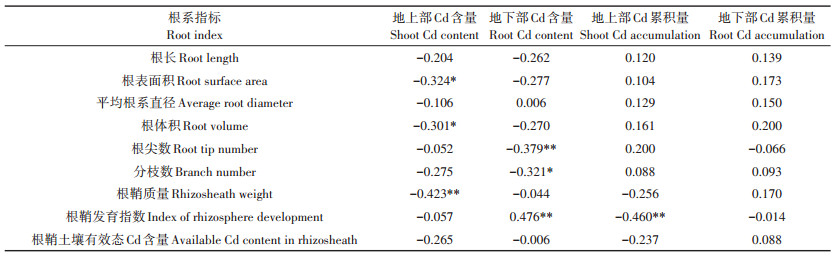
2.5 相关性分析如表 2所示,根鞘质量与根表面积、根体积呈极显著正相关(P < 0.01,下同),与平均根系直径、分枝数呈显著正相关(P < 0.05,下同)。根鞘发育指数与根长、根表面积、根体积、根尖数、分枝数呈极显著负相关,根鞘土壤有效态Cd含量与根尖数呈极显著正相关。又如表 3所示,根鞘质量与地上部Cd含量呈极显著负相关,根鞘发育指数与地下部Cd含量呈极显著正相关。地上部Cd含量与根表面积和根体积呈显著负相关;地下部Cd含量与根尖数呈极显著负相关,与分枝数呈显著负相关。
|
|
表 2 12个品种玉米根系形态与根鞘性状的相关性 Table 2 Correlation between root morphology and rhizosheath characteristics in 12 maize cultivars |
|
|
表 3 12个品种玉米根系形态、根鞘性状与Cd累积特征的相关性 Table 3 Correlation between root morphology, rhizosheath characteristics and Cd a cumulative characteristic of 12 maize cultivars |
植物对重金属的吸收与自身的遗传因素和外界环境条件有关[21]。Cd对植物的影响与浓度有关,低浓度有积极的刺激作用,当浓度超过一定量时就会抑制其生长发育,且随着浓度升高抑制作用显著提高[22]。根系是植物最先感知Cd等有毒物质的器官,土壤中Cd对植物的危害也首先表现在根系变化上。研究表明,高浓度Cd会对植物根系初生根的生长有明显抑制作用[23],减小根表面积和根体积,并抑制主根和侧根的生长[24]。本研究发现,在Cd污染土壤中,玉米地上部Cd含量与根表面积和根体积呈显著负相关,玉米地下部Cd含量与根尖数呈极显著负相关、与分枝数呈显著负相关。这可能是高浓度的Cd抑制根系细胞分裂和伸长,导致根系生长缓慢而造成的[25],表明植物根系形态与其Cd吸收能力关系密切,在响应环境Cd污染胁迫方面表现出高度的形态可塑性。但也有研究表明,玉米地上部Cd含量与根表面积、根体积呈显著正相关[26]。其原因可能与不同作物及品种对重金属胁迫的根系响应差异有关,这是不同作物及其品种的遗传特性差异导致的。
玉米的Cd累积量存在显著差异,这与陈建军等[4]研究结果一致,可能是玉米在少数基因控制下对Cd积累具有基因型差异造成的[8],也可能是不同品种对Cd胁迫的耐性存在显著差异造成的[27]。Cd胁迫下,根细胞内活性氧自由基的产生速率增大,致使细胞膜的结构和功能遭到破坏,根系活力下降,逐渐失去吸收水分和营养素的能力。因此在本试验中,根尖数与地下部Cd含量呈显著负相关,与前人关于玉米等植物地下部Cd含量与根尖数呈显著正相关的研究结论[28]相似,说明根系形态与Cd累积量的关系较为紧密,但与前人关于蕹菜等植物的研究结论[29]相反,这可能是植物不同种类其根系类型的差异而导致的[30]。有研究发现,紫花香薷的根长、根表面积和体积越大,越有利于吸收Pb[31],这与试验中发现的地上部Cd含量与根表面积和根体积呈显著负相关的结论相反,这可能是不同作物对重金属的响应存在差异,以及试验周期长短不同[32]造成的。此外,土壤pH和金属离子间的相互作用也会影响植物对Cd的吸收和累积[32]。试验中还发现,12个品种玉米地上部Cd累积量均大于地下部,与多数研究者的结论相反[4],这可能是因为盆栽与大田试验相比,水肥供应、根系生长空间、气候等环境因素差异大,导致大田植株重金属含量与盆栽试验存在明显的差异性[2]。所以,盆栽试验得到的重金属累积方面的结果,还需要进一步开展大田试验进行验证。
3.2 玉米根鞘性状与重金属累积品种差异的关系自根鞘发现以来,有关研究多集中于根鞘形成机理和根鞘耐干旱、保持土壤肥力以及根鞘微生物方面[12, 16-17],很少关注根鞘与重金属胁迫的关系。本试验研究了根鞘的3个特征,即根鞘质量、根鞘土壤有效态Cd含量以及根鞘发育指数,发现不同品种之间根鞘特征有显著的差异性。在前人的研究中,用于描述根鞘的指标各不相同,比如根鞘厚度、附着在根上的潮湿土壤质量和每单位根长度的根新鲜质量[33],植物物种之间的差异可能会因所使用的指标不同而有很大差异[34]。本试验用根鞘发育指数表征玉米根系产生根鞘的能力,结果表明根鞘发育指数与地下部Cd含量呈极显著正相关,这可能是因为在Cd胁迫下根系分泌物大量分泌,促进了根鞘的形成[35]。此外,根鞘发育指数与根长、根表面积、根体积、根尖数、分枝数呈显著负相关,即随着根系的生长发育,根系产生根鞘的能力递减,这与Ma等[20]试验结论相符合。在唐子钦等[36]对牧草根鞘的研究中发现,根平均连接长度、根体积、根平均直径是影响根鞘质量的3个根系形态指标,本试验也有类似的结论。本试验中根鞘土壤有效态Cd含量差异较大,可归因于植物吸收、局部氧化还原条件、质子释放或其他分泌物的影响[37]。本试验还发现,根尖数和分枝数会影响根鞘土壤有效态Cd含量。
需要指出的是,目前在根鞘研究方面争议较大,特别是根鞘的获取方法急需统一标准化。本试验为盆栽试验,局限于生长周期与生长容器的限制,仅仅是一次玉米幼苗时期根鞘性状与重金属Cd累积特征以及根系形态之间相互关系的初步探索,为根鞘的研究和玉米在重金属胁迫下的生长状况研究提供理论基础。今后需要将大田和室内盆栽试验相结合,开展长期系统的研究,着重解决同一物种在不同时期根鞘的动态形成过程,在大田试验丰富的土壤环境下采集大量的根鞘,细致地研究根鞘内的微生物、酶以及根系分泌物与植物耐重金属胁迫之间的关系,为进一步对根鞘的研究提供科学依据。
4 结论(1)供试12个品种玉米的生物量、根系形态和根鞘存在明显品种差异,其中不同玉米品种的根鞘指标差异更为明显。
(2)植株Cd含量与根系形态指标(根表面积、根体积和根尖数)呈负相关,地下部Cd含量与根鞘发育指数呈极显著正相关,表明玉米植株Cd吸收与根系形态、根鞘性状关系密切,根系形态和根鞘性状是导致玉米Cd吸收品种差异的原因之一。
| [1] |
陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析[J]. 农业环境科学学报, 2017, 36(9): 1689-1692. CHEN Nengchang, ZHENG Yu-ji, HE Xiao-feng, et al. Analysis of the Report on the national general survey of soil contamination[J]. Journal of AgroEnvironment Science, 2017, 36(9): 1689-1692. |
| [2] |
杨志新, 钟伟, 秦丽, 等. 9个油菜品种根系形态与镉铅累积关系及机理初步分析[J]. 云南农业大学学报(自然科学), 2018, 33(5): 916-924. YANG Zhi-xin, ZHONG Wei, QIN Li, et al. Relationship between root morphology and Cd/Pb accumulation characteristics of nine rape varieties and its mechanism[J]. Journal of Yunnan Agricultural University (Natural Science), 2018, 33(5): 916-924. |
| [3] |
Fässler E, Robinson B H, Gupta S K, et al. Uptake and allocation of plant nutrients and Cd in maize, sunflower and tobacco growing on contaminated soil and the effect of soil conditioners under field conditions[J]. Nutrient Cycling in Agroecosystems, 2010, 87(3): 339-352. DOI:10.1007/s10705-009-9342-z |
| [4] |
陈建军, 于蔚, 祖艳群, 等. 玉米(Zea mays)对镉积累与转运的品种差异研究[J]. 生态环境学报, 2014, 23(10): 1671-1676. CHEN Jian-jun, YU Wei, ZU Yan-qun, et al. Variety difference of Cd accumulation and translocation in Zea mays[J]. Ecology and Environmental Sciences, 2014, 23(10): 1671-1676. DOI:10.3969/j.issn.1674-5906.2014.10.016 |
| [5] |
鄢小龙, 马宏朕, 李元, 等. 铅锌矿区周边农田Cd、Pb低累积玉米品种筛选[J]. 云南农业大学学报(自然科学), 2019, 34(6): 1076-1083. YAN Xiao-long, MA Hong-zhen, LI Yuan, et al. Screening Zea mays cultivars based upon accumulation of Cd and Pb in the farmland around the lead-zinc mine area[J]. Journal of Yunnan Agricultural University (Natural Science), 2019, 34(6): 1076-1083. |
| [6] |
郭晓方, 卫泽斌, 丘锦荣, 等. 玉米对重金属累积与转运的品种间差异[J]. 生态与农村环境学报, 2010, 26(4): 367-371. GUO Xiaofang, WEI Ze-bin, QIU Jin-rong, et al. Differences between corn cultivars in accumulation and translocation of heavy metals[J]. Journal of Ecology and Rural Environment, 2010, 26(4): 367-371. DOI:10.3969/j.issn.1673-4831.2010.04.015 |
| [7] |
马献发, 宋凤斌, 张继舟. 根系对土壤环境胁迫响应的研究进展[J]. 中国农学通报, 2011, 27(5): 44-48. MA Xian-fa, SONG Feng-bin, ZHANG Ji-zhou. Advances of research of roots responses to environmental stress on soil[J]. Chinese Agricultural Science Bulletin, 2011, 27(5): 44-48. DOI:10.3969/j.issn.1007-7774.2011.05.010 |
| [8] |
樊金娟, 刘宇, 曹樱迪, 等. 玉米对镉胁迫的响应及其耐镉机制研究进展[J]. 沈阳农业大学学报, 2018, 49(5): 633-640. FAN Jin-juan, LIU Yu, CAO Ying-di, et al. Responses of maize to cadmium stress and mechanisms of cadmium tolerance[J]. Journal of Shenyang Agricultural University, 2018, 49(5): 633-640. |
| [9] |
沈天尔, 施洁, 胡盈盈, 等. 玉米对镉的转运、积累机制及其生理响应[J]. 中国粮油学报, 2019, 34(9): 139-146. SHEN Tian-er, SHI Jie, HU Ying-ying, et al. Mechanism of cadmium transport and accumulation in maize and its physiological response against Cd toxicity[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(9): 139-146. |
| [10] |
陈伟, 张苗苗, 宋阳阳, 等. 重金属离子对2种草坪草荧光特性及根系形态的影响[J]. 草业学报, 2014, 23(3): 333-342. CHEN Wei, ZHANG Miao-miao, SONG Yang-yang, et al. Impacts of heavy metals on the fluorescence characteristics and root morphology of 2 turfgrass species[J]. Acta Prataculturae Sinica, 2014, 23(3): 333-342. |
| [11] |
罗丽朦, 王瑾, 王丽学, 等. 扁穗冰草根鞘与其环境土壤理化性质和微生物数量的比较[J]. 草地学报, 2013, 21(6): 1109-1112. LUO Li-meng, WANG Jin, WANG Li-xue, et al. Comparison of physicochemical properties and microbe population between the surrounding soil and rhizosheath of Agropyron cristatum L.[J]. Acta Agrestia Sinica, 2013, 21(6): 1109-1112. |
| [12] |
Adu M O, Asare P A, Yawson D O, et al. Quantifying variations in rhizosheath and root system phenotypes of landraces and improved varieties of juvenile maize[J]. Rhizosphere, 2017, 336(3): 29-39. |
| [13] |
Lynch J P, Chimungu J G, Brown K M. Root anatomical phenes associated with water acquisition from drying soil: Targets for crop improvement[J]. Journal of Experimental Botany, 2014, 65(21): 6155-6166. DOI:10.1093/jxb/eru162 |
| [14] |
Delhaize E, James R A, Ryan P R. Aluminium tolerance of root hairs underlies genotypic differences in rhizosheath size of wheat(Triticum aestivum)grown on acid soil[J]. The New Phytologist, 2012, 195(3): 609-619. DOI:10.1111/j.1469-8137.2012.04183.x |
| [15] |
Bailey C, Scholes M. Rhizosheath occurrence in South African grasses[J]. South African Journal of Botany, 1997, 63(6): 484-490. DOI:10.1016/S0254-6299(15)30803-6 |
| [16] |
James R A, Weligama C, Verbyla K, et al. Rhizosheaths on wheat grown in acid soils: Phosphorus acquisition efficiency and genetic control[J]. Journal of Experimental Botany, 2016, 67(12): 3709-3718. DOI:10.1093/jxb/erw035 |
| [17] |
Brown L K, George T S, Neugebauer K, et al. The rhizosheath-a potential trait for future agricultural sustainability occurs in orders throughout the angiosperms[J]. Plant and Soil, 2017, 41(8): 115-128. DOI:10.1007/s11104-017-3220-2 |
| [18] |
谭建波, 湛方栋, 刘宁宁, 等. 续断菊与蚕豆间作下土壤部分化学特征与Cd形态分布状况研究[J]. 农业环境科学学报, 2016, 35(1): 53-60. TAN Jian-bo, ZHAN Fang-dong, LIU Ning-ning, et al. Soil chemical properties and Cd form distribution in Vicia faba and Sonchus asper intercropping system[J]. Journal of Agro-Environment Science, 2016, 35(1): 53-60. |
| [19] |
Rao C R M, Sahuquillo A, Sanchez J F L. A review of the different methods applied in environmental geochemistry for single and sequential extraction of trace elements in soils and related materials[J]. Water, Air, and Soil Pollution, 2008, 189(1/2/3/4): 291-333. |
| [20] |
Ma W, Li X, Li C. Modulation of soil particle size and nutrient availability in the maize rhizosheath[J]. Pedosphere, 2011, 21(4): 483-490. DOI:10.1016/S1002-0160(11)60150-1 |
| [21] |
段桂兰, 张红梅, 刘云霞, 等. 水稻基因类型与生长环境对精米中砷积累的影响[J]. 生态毒理学报, 2013, 8(2): 156-162. DUAN Gui-lan, ZHANG Hong-mei, LIU Yun-xia, et al. Impact of rice genotype and growing environment on arsenic accumulation in rice polished grains[J]. Asian Journal of Ecotoxicology, 2013, 8(2): 156-162. |
| [22] |
邹文桐. 铅镉复合胁迫对芥菜种子萌发、幼苗生长及光合色素含量的影响[J]. 种子, 2013, 32(3): 41-45. ZOU Wen-tong. Effects of combined lead and cadmium on seed germination, seedling growth and leaf photosynthetic pigment contents of Brassica juncea[J]. Seed, 2013, 32(3): 41-45. |
| [23] |
Gruber B D, Giehl R F H, Friedel S, et al. Plasticity of the arabidopsis root system under nutrient deficiencies[J]. Plant Physiology, 2013, 163(1): 161-179. DOI:10.1104/pp.113.218453 |
| [24] |
Huang B F, Xin J L, Dai H W, et al. Root morphological responses of three hot pepper cultivars to Cd exposure and their correlations with Cd accumulation[J]. Environmental Science and Pollution Research International, 2015, 22(2): 1151-1159. DOI:10.1007/s11356-014-3405-7 |
| [25] |
何俊瑜, 任艳芳, 朱诚, 等. Cd对水稻根尖细胞的遗传损伤效应[J]. 农业环境科学学报, 2008, 27(6): 2303-2307. HE Jun-yu, REN Yan-fang, ZHU Cheng, et al. Cytogenetic damage induced by cadmium in rice(Oryza sativa L.)root tips[J]. Journal of Agro-environment Science, 2008, 27(6): 2303-2307. DOI:10.3321/j.issn:1672-2043.2008.06.031 |
| [26] |
刘建新. 镉胁迫下玉米幼苗生理生态的变化[J]. 生态学杂志, 2005(3): 265-268. LIU Jian-xin. Physiological and ecological responses of maize seedlings to cadmium stress[J]. Chinese Journal of Ecology, 2005(3): 265-268. |
| [27] |
邵小杰, 杨洪强. 氯化镉胁迫下葡萄根系生理反应的品种差异[J]. 中国农业科学, 2010, 43(12): 2485-2490. SHAO Xiao-jie, YANG Hong-qiang. Cultivar difference in the physiological responses of grape roots under CdCl2 stress[J]. Scientia Agricultura Sinica, 2010, 43(12): 2485-2490. |
| [28] |
李胜宝, 曹力, 秦丽, 等. 丛枝菌根真菌对砂培玉米幼苗根系特征、光合生理与镉累积的影响[J]. 微生物学通报, 2020, 47(11): 3822-3833. LI Sheng-bao, CAO Li, QIN Li, et al. Effects of arbuscular mycorrhizal fungi on root traits, photosynthetic physiology and cadmium accumulation of sand-cultured maize seedlings[J]. Microbiology China, 2020, 47(11): 3822-3833. |
| [29] |
龚玉莲, 杨中艺. 蕹菜典型品种的根系形态学特征及与Cd吸收积累的关系[J]. 华南师范大学学报(自然科学版), 2012, 44(3): 100-106. GONG Yu-lian, YANG Zhong-yi. Root morphology of typical cultivars of water spinach involved in Cd absorption and accumulation[J]. Journal of South China Normal University, 2012, 44(3): 100-106. |
| [30] |
陈伟立, 李娟, 朱红惠, 等. 根际微生物调控植物根系构型研究进展[J]. 生态学报, 2016, 36(17): 5285-5297. CHEN Wei-li, LI Juan, ZHU Hong-hui, et al. A review of the regulation of plant root system architecture by rhizosphere microorganisms[J]. Acta Ecologica Sinica, 2016, 36(17): 5285-5297. |
| [31] |
Peng H Y, Tian S Y, Yang X E. Changes of root morphology and Pb uptake by two species of Elsholtzia under Pb toxicity[J]. Journal of Zhejiang University Science, 2005, 6B(6): 546-552. |
| [32] |
胡华群. 磷对辣椒根系生长发育及生理代谢的影响[D]. 贵阳: 贵州大学, 2009: 10-12. HU Hua-qun. Effects of phosphorus on growth and physiological metabolism of pepper roots[D]. Guiyang: Guizhou University, 2009: 10-12. |
| [33] |
Bose S, Bhattacharyya A K. Heavy metal accumulation in wheat plant grown in soil amended with industrial sludge[J]. Chemosphere, 2008, 70(7): 1264-1272. |
| [34] |
Kidd D R, Ryan M H, Haling R E, et al. Rhizosphere carboxylates and morphological root traits in pasture legumes and grasses[J]. Plant and Soil, 2016, 402(1/2): 77-89. DOI:10.1007/s11104-015-2770-4 |
| [35] |
Pinto A P, Sim I, Mota A M. Cadmium impact on root exudates of sorghum and maize plants: A speciation study[J]. Journal of Plant Nutrition, 2008, 31(10): 1746-1755. |
| [36] |
唐子钦, 陈有军, 胡健, 等. 川西北沙化草地7种牧草根系构型及根鞘特征分析[J]. 中国草地学报, 2020, 42(2): 22-31. TANG Ziqin, CHEN You-jun, HU Jian, et al. Analysis of root architecture and rhizosheath characteristics of seven forage species in desertified grassland of northwest Sichuan[J]. Chinese Journal of Grassland, 2020, 42(2): 22-31. |
| [37] |
Myrold D. The rhizosphere: Biochemistry and organic substances at the soil-plant interface. Second Edition[J]. Soil Science Society of America Journal, 2008, 72(6): 339-353. |
 2021, Vol. 40
2021, Vol. 40