2. 浙江大学环境与资源学院污染环境修复与生态健康教育部重点实验室, 杭州 310013
2. Key Laboratory of Environmental Remediation and Ecosystem Health, Ministry of Education(MOE), College of Environmental and Resources Sciences, Zhejiang University, Hangzhou 310013, China
近年来,随着我国采矿业和工农业的快速发展,工业废气及汽车尾气的排放、污水的灌溉、农药化肥的滥施等活动将大量的重金属(比如镉)带入土壤环境。据2014年环境保护部和国土资源部公布的《全国土壤污染状况调查公报》显示,我国镉污染耕地面积达20万hm2,镉的点位超标率达7%[1],我国土壤镉污染总体情况不容乐观。小麦在我国是第二大粮食作物[2],具有广泛的种植面积。作为镉中积累型作物,小麦对于土壤中的重金属有着较强的积累能力,对人体健康存在着较大的威胁。因此,采取安全高效的植物修复措施来保证受污染耕地上小麦的安全利用刻不容缓。基于此,筛选镉低积累的小麦品种,从而减少土壤中的镉通过食物链向人体的转移,是保证镉轻度污染耕地安全利用、保障人体健康行之有效的重要措施[3]。
研究表明,植物对镉的吸收和积累存在着较大的品种差异,不同品种对镉的吸收和器官分布不同。近年来,研究人员已经对不同作物的不同品种在重金属吸收、转运以及积累上的差异进行了很多研究,并开展了重金属低积累品种筛选的相关工作[3-5]。Zeng等[6]以138份水稻品种为供试材料,分析了它们种植在不同污染程度土壤中植株和籽粒的镉含量,筛选出一批镉低积累水稻品种。Wang等[7]通过大田试验,研究了19个玉米品种对重金属镉富集与转运的品种差异,并筛选出籽粒重金属镉低积累的玉米品种。Liu等[8]通过水培试验研究了30种小麦苗期对镉吸收与转运的品种差异,筛选出部分小麦镉低积累品种,将其应用于生产并取得了理想效果。
小麦籽粒的灌浆期是小麦产量形成的关键时期。叶片中合成的光合产物通过韧皮部运输到籽粒,并伴随着养分元素以及重金属元素的迁移转化,从而在籽粒中进行积累。Harris等[9]通过测定镉高/低积累的小麦在整个灌浆期各部位的镉积累量,研究了镉在整个植株和各部位的分配对籽粒中镉积累的影响。与前人的研究结果不同,Harris等[9]得出在籽粒灌浆期,叶片中镉的韧皮部再转运并不是影响籽粒中镉积累的运输途径,相反,镉由根部经地上部到达籽粒的木质部运输是最直接途径。此外,在灌浆期,水稻根部会继续吸收营养液中的镉并将其转运至地上部[10]。有研究表明,通过比较开花前供应镉处理下与开花后供应镉处理下的水稻各部位的镉含量得出,籽粒镉含量的40% 可归因于灌浆过程中水稻对镉的吸收[11]。因此,研究灌浆期小麦的重金属分布特性对于了解重金属在小麦各部位的分布以及对于籽粒中重金属积累量的预测有着重要意义。
本研究采取大田试验,选用全国范围内广泛种植的30个小麦品种,研究灌浆期小麦各部位镉的分布及其迁移转化规律,旨在了解不同小麦品种在灌浆期镉的分布特征,初步确定一批镉低积累小麦品种,从而为低积累小麦品种的选育提供一定的基础。
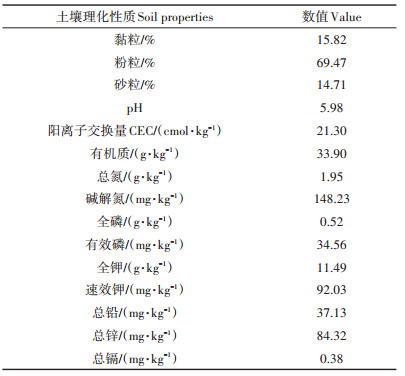
1 材料与方法 1.1 供试材料试验地位于浙北地区某镉污染农田,该地土壤类型为青紫泥,前茬作物为水稻。采用不锈钢土壤采集器,按照五点采样法,采集耕层(0~20 cm)土壤样品并测定其土壤理化性质。土壤样品经风干、磨细并分别过1 mm和0.125 mm筛。根据土壤农化分析常规方法[12],分析土壤的基本理化性质。用比重计法测定土壤质地。用pH计在1∶2.5的土壤/水悬浮液中测定pH值。CEC的测定采用1 mol·L-1 NH4OAc(pH=7.0)交换-滴定法。采用Walkley法测定土壤有机质含量。采用元素分析仪(Vario-MAX,德国)直接测定全氮的含量。采用碱解扩散法测定土壤碱解氮的含量。土壤全磷采用NaOH熔融,钼锑抗比色法测定。有效磷含量采用抗坏血酸-钼酸铵法测定。土壤全钾采用NaOH熔融,火焰光度法测定。用中性1 mol·L-1 NH4OAc提取土壤速效钾,振荡30 min,火焰分光光度法测定。供试土壤的基本理化性质见表 1。
|
|
表 1 土壤基本理化性质 Table 1 Basic properties of the tested soil |
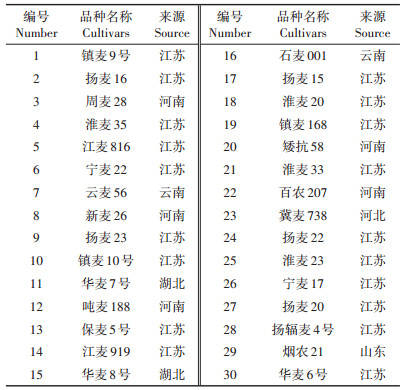
供试小麦品种30个,其中20个为在长江中下游平原广泛种植的小麦品种,10个为在华北平原广泛种植的小麦品种,购自浙江省、江苏省、山东省以及河南省的种子销售点。供试小麦品种的具体信息见表 2。
|
|
表 2 供试小麦品种 Table 2 Tested wheat cultivars |
根据当地农民的生产习惯,于2016年11月20日对小麦种子进行撒播。每个小麦品种3次重复,随机区组排列,共90个小区,小区之间间隔0.5 m,小区面积23.37 m2(5.7 m×4.1 m)。同时在试验地的周围设置保护行(0.5 m)以消除边际效应。播种前施用复合肥(N∶P∶K=16∶16∶16)作为基肥,施用量为525 kg·hm-2;然后在第8片叶长出时,撒施尿素进行追肥,施用量为300 kg·hm-2。
1.3 样品采集与分析土壤中全量重金属镉、锌和铅的分析采用HNO3∶HF∶HClO4(V∶V∶V=5∶1∶1)消解法(GB / T 17141—1997),消解液采用ICP-MS(7500a,Agilent,美国)进行测定[13]。
在籽粒灌浆期(2017年4月中旬),选择1 m×1 m的范围,采用五点采样法采集小麦植株。从每个品种中选出10株代表性植株,并分为地上部和根部。同样,在籽粒成熟期,采集小麦植株,并将其分为籽粒、地上部和根部。用自来水将植株表面清洗干净,然后用去离子水小心洗涤3次。将根浸泡在10 mmol·L-1 EDTA-Na2中15 min以从根表面除去吸附的重金属,然后使用超纯水冲洗3次。将新鲜的地上部和根部在65 ℃下烘干至恒质量。最后,将这些干燥的样品称质量以确定产量和生物量,用粉碎机磨细,过100目筛备用,随后进行化学分析。植株中重金属镉的分析采用HNO3∶H2O2(V∶V=5∶1)消解法(GB/T 17141—1997),消解液采用ICP-MS(7500a,Agilent,美国)进行测定。
1.4 数据处理所有数据的平均值以及标准误差均采用Excel 2013、SPSS 19.0和Origin 8.0软件进行处理。采用Duncan新复极差法检验不同品种之间数据差异的显著性(P < 0.05)。采用相关性分析计算各指标之间的相关系数。
2 结果与分析 2.1 灌浆期植物生长与生物量差异 2.1.1 灌浆期株高由图 1可以看出,不同品种之间小麦灌浆期的株高存在着显著差异,但重复之间变异较小。不同品种之间小麦株高变化范围为48.87~77.47 cm,周麦28株高最小,为48.87 cm,淮麦33株高最大,达77.47 cm,平均值为58.73 cm。品种之间最大值为最小值的1.59倍。

|
图 1 不同小麦品种灌浆期的株高 Figure 1 Height of different wheat cultivars in grain filling stage |
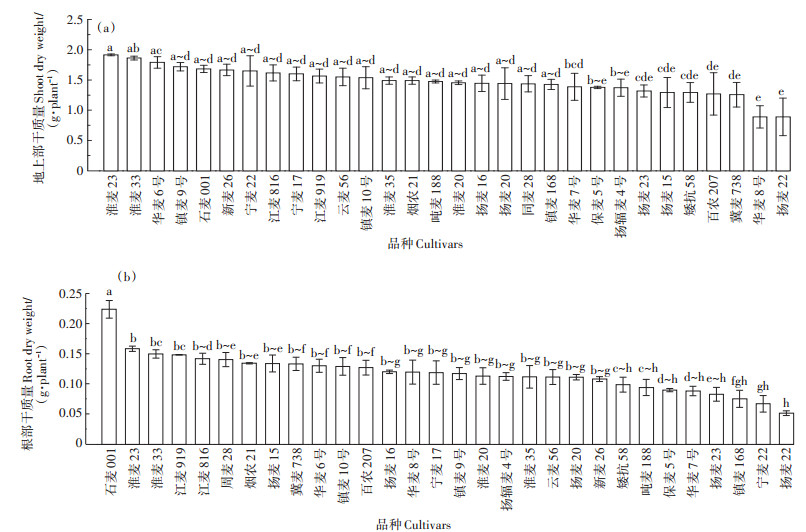
由图 2可以看出,不同品种之间小麦灌浆期的地上部和根部的干质量均存在着显著性差异。不同品种之间小麦灌浆期根部干质量的变化范围为0.05~0.22 g·plant-1,平均值为0.12 g·plant-1。扬麦22根部干质量最小,为0.05 g·plant-1,石麦001根部干质量最大,达0.22 g·plant-1。品种之间最大差4.4倍。相同品种小麦不同部位的干质量有着明显差异(P < 0.05)。总体而言,地上部>根。地上部干质量的变化范围为0.89~1.92 g·plant-1,平均值为1.47 g·plant-1。扬麦22地上部干质量最小,为0.89 g·plant-1,淮麦23地上部干质量最大,达1.92 g·plant-1,品种之间最大值为最小值的2.08倍。
|
图 2 不同小麦品种灌浆期的不同部位的干质量 Figure 2 Dry weight of different wheat cultivars in grain filling stage |
根冠比是反映小麦干物质协调积累状况的重要指标之一,受小麦本身遗传特性和环境因素的影响,小麦能够通过调节根冠比来实现对逆境的适应。由图 3可以看出,不同品种之间小麦灌浆期的根冠比存在着显著性差异,但重复之间变异较小。不同品种之间小麦灌浆期根冠比变化范围为0.04~0.15,宁麦22根冠比最小,为0.04,华麦8号根冠比最大,为0.15,平均值为0.08,最大值为最小值的3.75倍。

|
图 3 不同小麦品种灌浆期的根冠比 Figure 3 Root-shoot ratio of different wheat cultivars in grain filling stage |
如图 4所示,同一品种的小麦不同部位中的镉浓度有着明显差异(P < 0.05)。总体而言,根>地上部。从图中可以看出,在30个小麦品种中根部镉浓度差异显着(P < 0.05)。根系的镉浓度范围从周麦28的0.37 mg·kg-1 DW到烟农21的1.57 mg·kg-1 DW,平均值为0.84 mg·kg-1 DW。品种之间最大值为最小值的4.24倍。同样,30个小麦品种中,地上部镉的浓度也存在显著差异(P < 0.05),从新麦26的0.07 mg·kg-1 DW到扬麦20的0.26 mg·kg-1 DW,平均值为0.16 mg·kg-1 DW。品种之间最大值为最小值的3.71倍。
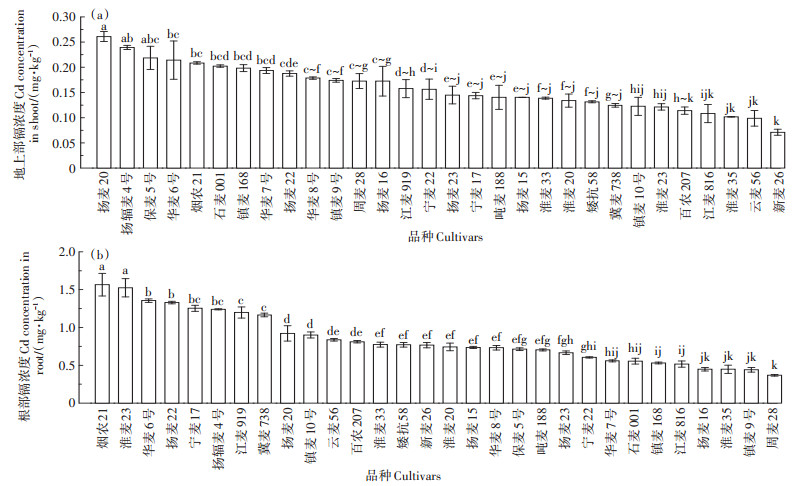
|
图 4 不同小麦品种灌浆期不同部位的镉浓度 Figure 4 Cd concentration in different tissues of different wheat cultivars in grain filling stage |
一般来说,不同组织中镉的积累是评价植物修复镉污染土壤能力的重要指标,镉积累可以更好地反映镉的植物提取潜力。根据干质量和镉浓度计算根部和地上部的镉积累量。由于各部位镉浓度和干质量存在差异,从图 5中可以看出30个小麦品种的根部和地上部也存在显著差异。如图所示,由于地上部干质量较高,地上部镉的积累量高于根部。根部积累量为0.04(镇麦168)~0.24 μg·plant-1(淮麦23),品种之间的最大值为最小值的6倍,平均值为0.10 μg·plant-1。地上部镉的积累量变异范围为0.12(新麦26)~0.38 μg·plant-1(扬麦20),平均值为0.23 μg·plant-1,品种之间的最大值为最小值的3.17倍。
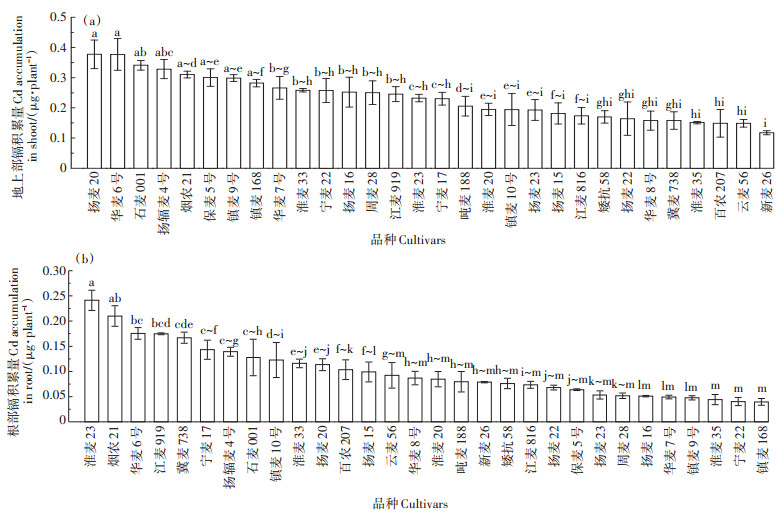
|
图 5 不同小麦品种灌浆期不同部位的镉积累量 Figure 5 Cd accumulation in different tissues of different wheat varieties in grain filling stage |
AF通常可用于评估植物积累重金属的能力。计算公式如下:AFrs =根部的[Cd]/土壤中的[Cd],AFss =地上部的[Cd]/土壤中的[Cd],式中:[Cd]为镉浓度,mg·kg-1。30个小麦基因型不同部位镉的AF如图 6所示。AF在不同部位差异显著(P < 0.05),表现为AFrs >AFss,与30个小麦品种的各部位镉浓度趋势一致。AFrs为0.97(周麦28)~4.12(烟农21),AFss为0.19(新麦26)~ 0.69(扬麦20)。最高AFrs和AFss值分别为最低值的4.25、3.63倍。这些结果表明,小麦植株中的镉主要富集在根部。
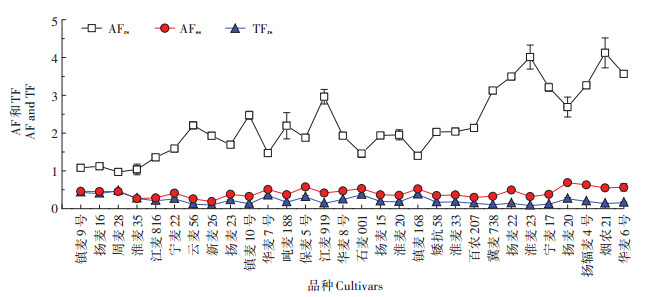
|
图 6 不同小麦品种灌浆期不同部位的富集系数(AF)和转移系数(TF) Figure 6 Translocation factor (TF)and bioaccumulation factor (AF)of Cd in different tissues among different wheat cultivars in grain filling stage |
依据不同组织中的镉浓度,根据下式计算植物将重金属从根部转移到秸秆能力的转移系数(TFrs):TFrs =地上部[Cd]/根部[Cd],[Cd]代表镉浓度,mg·kg-1。30个小麦品种中的TFrs见图 6。30个小麦品种的TFrs差异显著(P < 0.05),变异范围为0.08(淮麦23)~0.47(周麦28)。
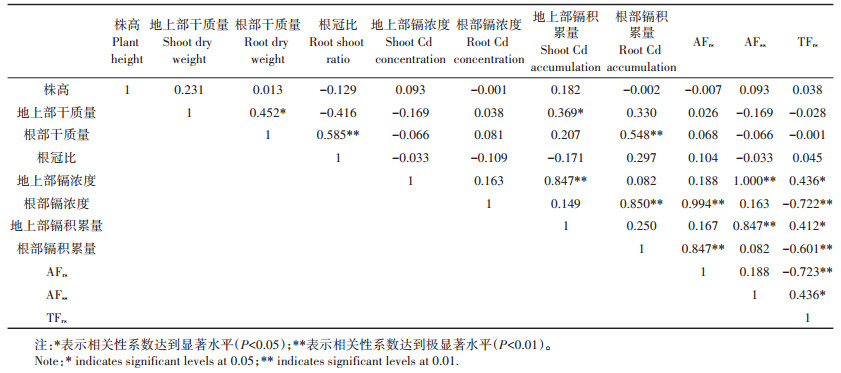
2.4 灌浆期生长指标与镉吸收转移的相关性分析表 3显示了灌浆期植物各生长指标与各部位重金属含量及富集系数和转移系数之间的相关性系数。相关性分析表明,不同小麦品种灌浆期的根-地上部转移系数(TFrs)分别与地上部镉浓度(r=0.436*)、根部镉浓度(r=-0.722**)、地上部镉积累量(r=0.412*)、根部镉积累量(r=- 0.601**)、地上部富集系数(r= 0.436*)和根部富集系数(r=-0.723**)均呈显著性相关。说明镉在小麦各部位的分布与镉在小麦体内的迁移转运有关。
|
|
表 3 不同小麦品种灌浆期各生长指标与镉吸收转移相关指标的相关性系数 Table 3 Correlation coefficients between growth indexes and Cd uptake and transport related indexes among different wheat cultivars during filling period |
图 7列出了成熟期30个小麦品种各个部位的镉浓度以及根-地上部转移系数和地上部-籽粒转移系数。从图中可以看出,成熟期30个小麦品种各个部位的镉浓度以及根-地上部转移系数(TFrs)和地上部-籽粒转移系数(TFsg)均存在显著差异。淮麦23、冀麦738、宁麦17三个品种地上部和根部的镉浓度同样存在一定的差异,但地上部镉浓度之间的差异未达到显著水平,这与灌浆期的数据是一致的。同样,根-地上部转移系数均低于1。3个品种籽粒中镉的浓度分别为0.052、0.045、0.044 mg·kg-1 DW,均远低于我国国家食品限量标准0.1 mg·kg-1 DW。
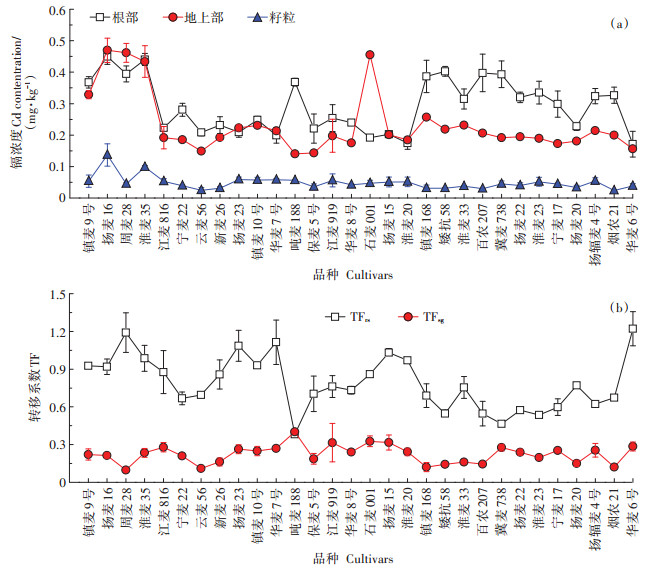
|
图 7 不同小麦品种成熟期不同部位的镉浓度和转移系数 Figure 7 Cd concentrations and translocation factors(TF)in different tissues among different wheat varieties in maturity stage |
镉是毒性最强的重金属元素之一,过量的镉进入植物体内,会对植物产生极大的危害,其主要表现为:植株矮小、生长受阻、产量和品质降低,甚至是死亡。王慧慧等[14]研究了10种砧用南瓜幼苗在不同镉浓度下的生长状况,其中有5个品种的生物量在所有镉处理下均显著高于对照;4个品种的生物量在所有镉处理下与对照无差异,说明同一物种不同品种间的镉耐性存在显著差异。类似地,本研究发现不同品种之间小麦灌浆期的株高以及地上部干质量均存在着显著性的差异,且品种之间最大值分别为最小值的1.59、2.08倍,其中,淮麦23和扬麦22分别表现出最高和最低的地上部干质量。这表明镉处理下不同小麦品种的生长状况存在显著差异,对重金属镉的耐性也存在显著差异。
同一物种不同品种对镉的吸收特性也存在较大差异。李德明等[15]通过大田试验对87个白菜品种的镉积累特性进行比较,发现春夏季白菜镉积累高于其他两季,且不同基因型间镉积累差异很大。同样,在本研究中,在籽粒灌浆期不同小麦品种各部位的镉浓度以及镉积累量均存在显著差异(图 4和图 5)。其中,扬麦20、华麦6号、石麦001、扬辐麦4号、烟农21、保麦5号的地上部均表现出较高镉浓度以及镉积累量。淮麦35、云麦56和新麦26的地上部则均表现出较低的镉浓度及镉积累量,其中地上部镉浓度均低于小麦镉的临界含量标准(0.1 mg·kg-1)。植物从根部吸收的重金属离子经过木质部运输到茎、叶、果实等器官,在同一植物体的不同组织、器官之间,镉的分布一般存在显著差异,镉优先积累到薄壁组织和芽胞胚中[16-17]。根部的镉积累一般大于茎叶等其他组织,多数植物大约65%~90%的镉存在于根部[18]。与前人研究结果一致,本试验中的30个小麦品种的AFrs均大于AFss,这表明小麦植株中的镉主要富集在根部。其中烟农21、华麦6号和扬辐麦4号均表现出较高的AFrs和AFss。同时,在上文也提到这3个品种的地上部也表现出较高镉浓度以及镉积累量。这些结果说明这3个品种具有一定的富集品种的特征。转移系数是用来评价植物从根部向地上部运输重金属的能力,转移系数越大,植物从地下部向地上部转运重金属的能力越强。本研究中的周麦28、镇麦9号、扬麦16、镇麦168、石麦001、华麦7号根部镉浓度较低但地上部镉浓度较高,具有较大的转移系数,这可能是由于这些品种根系所受生理毒害大,其细胞壁固持或液泡区隔的镉含量已达饱和,因而镉进入可溶性组分并迁移到地上。淮麦23、冀麦738、宁麦17根部镉浓度较高但地上部镉浓度较低,表现出较低的转运系数,说明在镉胁迫下这些品种的根部会阻止镉向地上部分转移,避免产生更严重的毒害。小麦镉积累量低或镉运转效率低,且能够将其固定在根部的品种是人们所希望的小麦品种。
本文研究了灌浆期30个小麦品种在镉胁迫下的生长状况及其对镉的吸收和转运能力,初步确定了一些品种具有将重金属镉固定在根部并且较少向地上部进行转运的特性,说明这些品种可以作为低积累小麦品种的候选者。近年来,众多研究者也已对不同作物品种的重金属镉富集转运特性进行差异性相关研究,从中筛选镉低积累品种。袁林等[19]研究了9个玉米品种对重金属镉累积与转运的品种差异,筛选出适合西南地区种植的重金属镉低积累玉米品种。刘昭兵等[20]对不同基因型甘薯吸收累积特性研究,在湘潭地区筛选出8个镉低积累甘薯品种。一般情况下,在筛选植物作为重金属修复材料时,应综合考虑其重金属生物富集、转运及耐性能力。目前还没有统一、完整的指标评价体系使评定结果与实际结果更为接近。因此,应综合各指标来评价植物对镉的吸收转移能力和耐性,避免单个指标带来的片面影响。Baker等[21]推荐将可食部位镉含量低于国家限量标准和转移系数 < 1作为镉低积累作物筛选的重要标准。刘维涛等[22]综合前人研究经验制定了新的镉低积累作物的筛选标准:一是可食部位镉含量低于国家标准;二是富集系数 < 1;三是转运系数 < 1;四是对镉具有较高的耐受性。转移系数 < 1这个筛选标准被广泛应用于各个生育时期进行的低积累作物的筛选工作中,因此可以将其作为低积累作物早期筛选的一个重要考虑因素。在本研究中,30个小麦品种各器官转运镉的能力存在明显差异,其中淮麦23、冀麦738、宁麦17这3个品种具有较低的根-地上部转移系数(TFrs),均 < 1。成熟期这3个品种籽粒镉浓度远低于我国国家食品限量标准(0.1 mg·kg-1 DW)并具有较低的根-地上部转移系数(均 < 1),符合镉低积累品种的标准。以上能够看出,成熟期的结果与灌浆期的结果是一致的。由此可以最终得出,淮麦23、冀麦738以及宁麦17被鉴定为镉低积累小麦品种的候选者。同时,分析灌浆期小麦镉吸收转运的特征时,可以在小麦生长的早期缩小品种的范围,为最终镉低积累小麦的鉴定提供重要的参考价值。
不同品种之间对镉积累的差异可能是品种之间形态和生理特性的差异(例如根系形态和转运能力的差异)造成的。相关研究表明[23],小麦对镉吸收和分配是由根部特征决定的。根尖分生区的顶端区域、根毛以及侧根,是重金属吸收的主要场所。Wu等[24]研究表明,超积累植物东南景天的根尖、根毛和侧根是重金属镉吸收的3个主要部位,同时研究指出根毛以及侧根发育的越多,根系对镉的吸收能力越强。然而位于根尖细胞质膜上大量的重金属转运蛋白或通道在不同品种之间也会表现出不同的镉转运能力。TaTM20是一种小麦体内编码跨膜蛋白的基因。当它在酵母细胞中表达时表现出一定的镉耐受性,其特点是在GSH浓度不足的情况下,可以促进镉离子外流,降低酵母细胞中镉的浓度[25]。然而,根据Uraguchi等[26]的报道,木质部运输是决定镉由根到地上部转运从而影响地上部和籽粒中镉积累水平的主要生理过程。P1B-ATPases,又称重金属离子泵(HMAs),是植物体内重金属跨膜转运的关键酶。研究人员称TaHMA2使转基因酵母细胞表现出更高的镉耐受性。Tan等[27]报道了在转基因水稻体内,TaHMA2参与了锌/镉的长距离运输。此外,TaHMA2在水稻中的过表达也促进了镉从根系向地上部的运输,并且在低镉处理下,转基因水稻表现出较好的镉耐受性。在本研究中,灌浆期30个小麦品种的根-地上部转移系数(TFrs)存在着显著的差异,这与前人的研究是一致的。其中,淮麦23、冀麦738、宁麦17的根-地上部转移系数(TFrs)均 < 1。同样地,成熟期淮麦23、冀麦738、宁麦17籽粒中的镉浓度均远低于国家食品限量标准,并表现出较低的根-地上部转运能力。
4 结论(1)镉污染条件下,灌浆期30个小麦品种的株高以及各部位的生物量均存在着显著差异。
(2)不同小麦品种各部位吸收、积累镉的能力存在明显差异。灌浆期镉在小麦体内的分配规律总体上为根>地上部。
(3)不同小麦品种各器官转运镉的能力存在明显差异,所有品种根-地上部转运系数 < 1,其中淮麦23、冀麦738、宁麦17具有较低的根-地上部转运系数(TFrs)。
(4)淮麦23、冀麦738、宁麦17在成熟期籽粒的镉含量均远低于国家食品限量标准值(0.1 mg · kg-1 DW),并表现出较低的根-地上部转运系数(均 < 1),符合镉低积累品种的标准。
根据以上研究结果,本文初步确定淮麦23、冀麦738、宁麦17作为低积累小麦品种的候选者,为低积累小麦品种的最终确定提供更加具体的种质资源及数据支撑。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[R]. 北京: 环境保护部, 国土资源部, 2014. Ministry of Environmental Protection, Ministry of Land and Resources. Bulletin of the national survey of soil pollution[R]. Beijing: Ministry of Environmental Protection, Ministry of Land and Resources, 2014. |
| [2] |
He Z H, Rajaram S, Xin Z Y, et al. A history of wheat breeding in China[J]. Journal of Comparative Neurology, 2001, 523: 805-813. |
| [3] |
Perrier F, Yan B, Candaudap F, et al. Variability in grain cadmium concentration among durum wheat cultivars: Impact of aboveground biomass partitioning[J]. Plant and Soil, 2016, 404(1/2): 307-320. DOI:10.1007/s11104-016-2847-8 |
| [4] |
Yan Y F, Choi D H, Kim D S, et al. Genotypic variation of cadmium accumulation and distribution in rice[J]. Journal of Crop Science & Biotechnology, 2010, 13(2): 69-73. |
| [5] |
Zhang Z, Jin F, Wang C, et al. Difference between Pb and Cd accumulation in 19 elite maize inbred lines and application prospects[J]. Journal of Biomedicine and Biotechnology, 2012, 1: 271485. |
| [6] |
Zeng F, Mao Y, Cheng W, et al. Genotypic and environmental variation in chromium, cadmium and lead concentrations in rice[J]. Environmental Pollution, 2008, 153(2): 309-314. DOI:10.1016/j.envpol.2007.08.022 |
| [7] |
Wang A Y, Wang M Y, Liao Q, et al. Characterization of Cd translocation and accumulation in 19 maize cultivars grown on Cd-contaminated soil: Implication of maize cultivar selection for minimal risk to human health and for phytoremediation[J]. Environmental Science and Pollution Research, 2016, 23(6): 5410-5419. DOI:10.1007/s11356-015-5781-z |
| [8] |
Liu W T, Liang L, Zhang X, et al. Cultivar variations in cadmium and lead accumulation and distribution among 30 wheat(Triticum aestivum L.)cultivars[J]. Environmental Science and Pollution Research, 2015, 22(11): 8432-8441. DOI:10.1007/s11356-014-4017-y |
| [9] |
Harris N S, Taylor G J. Cadmium uptake and partitioning in durum wheat during grain filling[J]. BMC Plant Biology, 2013, 13: 103. DOI:10.1186/1471-2229-13-103 |
| [10] |
Rodda M S, Li G, Reid R J. The timing of grain Cd accumulation in rice plants: The relative importance of remobilization within the plant and root Cd uptake post-flowering[J]. Plant Soil, 2011, 347: 105-114. DOI:10.1007/s11104-011-0829-4 |
| [11] |
Chan D Y, Hale B A. Differential accumulation of Cd in durum wheat cultivars: Uptake and retranslocation as sources of variation[J]. Journal of Experimental Botany, 2004, 55: 2571-2579. DOI:10.1093/jxb/erh255 |
| [12] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2008: 264-268. BAO Shi-dan. Soil agricultural chemistry analysis method[M]. 3rd Edition. Beijing: China Agriculture Press, 2008: 264-268. |
| [13] |
Tang L, Yasir H, Afsheen Z, et al. Characterization of fava bean(Vicia faba L.)genotypes for phytoremediation of cadmium and lead co-contaminated soils coupled with agro-production[J]. Ecotoxicology and Environmental Safety, 2019, 171: 190-198. DOI:10.1016/j.ecoenv.2018.12.083 |
| [14] |
王慧慧, 王晨, 张明华, 等. 砧用南瓜幼苗对镉的耐性和积累能力研究[J]. 西北植物学报, 2018, 38(12): 109-118. WANG Hui-hui, WANG Chen, ZHANG Ming-hua, et al. Study on tolerance and accumulation ability of cadmium in pumpkin seedlings for rootstocks[J]. Acta Botanica Boreali-Occidentalia Sinica, 2018, 38(12): 109-118. |
| [15] |
李德明, 朱祝军, 钱琼秋. 白菜镉积累基因型差异研究[J]. 园艺学报, 2004, 31(1): 97-98. LI De-ming, ZHU Zhu-jun, QIAN Qiongqiu. Investigation of genotypic difference of cadmium contents in shoots of Brassica campestris ssp. chinensis[J]. Acta Horticulturae Sinica, 2004, 31(1): 97-98. |
| [16] |
Florijn P J, Beusichem M L. Uptake and distribution of cadmium in maize inbred lines[J]. Plant and Soil, 1993, 150(1): 25-32. DOI:10.1007/BF00779172 |
| [17] |
Carginale V, Sorbo S, Capasso C, et al. Accumulation, localization, and toxic effects of cadmium in the liverwort Lunularia cruciata[J]. Protoplasma, 2004, 223(1): 53-61. DOI:10.1007/s00709-003-0028-0 |
| [18] |
Ramos I, Esteban E, Lucena J J, et al. Cadmium uptake and subcellular distribution in plants of Lactuca sp. Cd-Mn interaction[J]. Plant Science, 2002, 162(5): 761-767. DOI:10.1016/S0168-9452(02)00017-1 |
| [19] |
袁林, 刘颖, 兰玉书, 等. 不同玉米品种对镉吸收累积特性研究[J]. 四川农业大学学报, 2018, 36(1): 21-27. YUAN Lin, LIU Ying, LAN Yu-shu, et al. Variations of cadmium absorption and accumulation among corn cultivars of metal pollution in soil from lead-zinc mining area[J]. Journal of Sichuan Agricultural University, 2018, 36(1): 21-27. |
| [20] |
刘昭兵, 纪雄辉, 田发祥, 等. 不同基因型甘薯(Ipomoea batatas Lam.)吸收累积Cd的特征差异性研究[J]. 农业环境科学学报, 2010, 29(9): 1653-1658. LIU Zhao-bing, JI Xiong-hui, TIAN Faxiang, et al. Absorption and accumulation of Cd in different sweet potato(Ipomoea batatas Lam.)genotypes[J]. Journal of Agro-Environment Science, 2010, 29(9): 1653-1658. |
| [21] |
Baker A J M, Whiting S N. In search of the holy grail: A further step in understanding metal hyperaccumulation?[J]. New Phytologisit, 2002, 155: 1-7. DOI:10.1046/j.1469-8137.2002.00449_1.x |
| [22] |
刘维涛, 周启星. 重金属污染预防品种的筛选与培育[J]. 生态环境学报, 2010, 19(6): 1452-1458. LIU Wei-tao, ZHOU Qi-xing. Screening and breeding of heavy metal pollution prevention cultivars[J]. Ecology and Environmental Sciences, 2010, 19(6): 1452-1458. DOI:10.3969/j.issn.1674-5906.2010.06.035 |
| [23] |
蔡保松, 曹林奎. 镉对小麦生长发育的影响及其基因型间差异[J]. 西北农林科技大学学报(自然科学版), 2003, 31(1): 62-66. CAI Bao-song, CAO Lin-kui. Effects of cadmium on the growth and development in different wheat genotypes[J]. Journal of Northwest A & F University (Nat Sci Ed), 2003, 31(1): 62-66. |
| [24] |
Wu Y J, Ma L Y, Liu Q Z, et al. The plant-growth promoting bacteria promote cadmium uptake by inducing a hormonal crosstalk and lateral root formation in a hyperaccumulator plant Sedum alfredii[J]. Journal of Hazardous Materials, 2020, 395: 122661. DOI:10.1016/j.jhazmat.2020.122661 |
| [25] |
Kim Y Y, Kim D Y, Shim D, et al. Expression of the novel wheat gene TM20 confers enhanced cadmium tolerance to bakers'yeast[J]. Journal of Biological Chemistry, 2008, 283: 15893-15902. |
| [26] |
Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 2009, 60: 2677-2688. |
| [27] |
Tan J, Wang J, Chai T, et al. Functional analyses of TaHMA2, a P (1B)-type ATPase in wheat[J]. Plant Biotechnology Journal, 2013, 11: 420-431. |
 2021, Vol. 40
2021, Vol. 40