近年来,随着工业化进程的推进、各种化肥、农药的大量使用、工业污泥及废水在农业上的利用和日益严重的重金属大气沉降,农田土壤中重金属污染状况日趋严重[1]。据农业部门调查,国内经污水灌溉的农用土地面积为140万hm2,而重金属污染占总量的64.8%,其中又以镉(Cd)污染最为突出。我国Cd污染农田面积约27.86万hm2,每年约有146万t的大田作物产品Cd含量超标[2]。因此,亟须针对Cd污染农田土壤开展修复技术研究。
一些物理化学方法,如化学沉淀、离子交换、膜过滤和蒸发等可用于从污染物中去除Cd[3-4]。然而这些方法通常成本高昂,且当Cd2+浓度较低时(1~100 mg· L-1)几乎没有效果[5]。近年来,微生物(包括酵母,真菌和细菌)由于其所具备的吸附金属能力,及其作为修复载体的低成本和环境友好性特征,越来越受到人们的关注[6-7]。
但是,从种类繁多的微生物群体中鉴定出有价值的Cd生物修复候选者具有一定挑战性。植物生长促进微生物(Plant growth promoting microorganism,PGPM)通常被认为是潜在的候选者,因为它们可以在吸附Cd的同时刺激植物的生长,从而实现与植物的协同修复或抑制谷物作物对Cd的吸收[8]。然而,当利用外来菌株进行修复时,其与土著微生物群落之间可能存在的负竞争会导致相关环境如土壤或水体的各种生态风险[9]。而利用土著PGPM进行污染土壤的原位修复则可以很好地避免这一点。一般采用高耐性微生物以外源添加的方式修复污染场所的重金属[10-11]。因此,筛选去除效率高的耐Cd微生物对污染环境中Cd的修复具有重要意义。在本团队之前的研究中,从Cd超积累植物龙葵(Solanum nigrum L.)的根际土壤筛选了一批PGPM,发现菌株AXY1表现出较优异的植物生长促进作用,包括吲哚-3-乙酸(IAA)的分泌、产铁载体和解磷功能[12]。菌株可能对Cd具有抗性、并能够帮助植物应对Cd胁迫。例如细菌可能会吸收可溶性Cd2+,从而降低Cd的生物可利用性,进而缓解其对植物的毒性。Xu等[13]将从重金属污染土壤中筛选获得的耐Cd细菌Raoultella sp. strain X13接种于小白菜,发现其在促进小白菜生长的同时还能通过对Cd2+的吸附降低小白菜对Cd2+的生物可利用性。而Jin等[7]将从污染土壤筛选获得的Simplicillium chinense QD10接种于芦苇时,发现其可能通过对Cd、Pb的吸附使Cd、Pb在根部富集而提高植物的修复作用。然而,菌株AXY1对Cd的抗性、吸附能力和吸附方式并不清晰,这限制了其在原位修复上的实际应用。
本研究以前期筛选获得的龙葵根际促生菌AXY1为研究对象,通过形态特征和系统发育学分析对该菌株进行鉴定,并研究了其生长特性,考察了其对重金属Cd的吸附和活化特性,以期为生物修复Cd污染农田土壤提供优异的菌种资源。
1 材料与方法 1.1 材料 1.1.1 菌株来源菌株AXY1由Cd超积累植物龙葵(Solanum nigrum L.)根际土壤筛选分离获得。首先称取5 g土样,加入盛有玻璃珠和95 mL无菌水的锥形瓶中,充分混匀后,再取10 mL转移至含有90 mL LB培养基的锥形瓶中,28 ℃振荡培养7 d,稀释涂布平板,并划线分离。
1.1.2 培养基及主要试剂Luria-Bertani(LB)液体培养基:酵母粉5 g·L-1,蛋白胨10 g·L-1,氯化钠10 g·L-1。
主要试剂:氯化镉(CdCl2·2.5H2O,分析纯,国药集团化学试剂有限公司)、碳酸镉(CdCO3,分析纯,上海麦克林生化科技有限公司)。
1.2 菌株鉴定 1.2.1 菌株形态特征观察对菌株的菌落形态、颜色、大小和边缘等进行观察,并用革兰氏染色法在光学显微镜(Axio Examiner,德国)下观察其形貌。
1.2.2 系统发育学分析菌株于LB液体培养基活化,35 ℃、180 r·min-1下培养24 h后转接于LB固体培养基划线,35 ℃恒温培养24 h后,送上海派森诺生物科技股份有限公司进行16S rRNA基因测序。
1.3 菌株的生长特性研究 1.3.1 温度对菌株生长的影响从LB固体培养基上挑选菌株的单菌落于LB液体培养基中,35 ℃、180 r·min-1下振荡培养12 h,取1 mL菌液接种于50 mL LB液体培养基中,在不同温度(15、20、25、30、35、40 ℃)、180 r·min-1下振荡培养24 h后用多功能酶标仪(M200PRO,德国/瑞士)测定OD600,每个处理3个重复。
1.3.2 pH对菌株生长的影响配制不同pH(4.0、5.0、6.0、7.0、8.0、9.0,用0.1 mol·L-1的HCl和NaOH溶液进行调节)的LB液体培养基,其他条件同1.3.1,35 ℃摇床培养后测定OD600,每个处理3个重复。
1.3.3 菌株的生长曲线挑取单菌落培养后,取1 mL菌液分别接种于不含Cd2+及浓度为10 mg·L-1 Cd2+的50 mL LB液体培养基中,35 ℃、180 r·min-1下振荡培养,每4 h测定一次OD600,培养36 h,每个处理3个重复。
1.4 菌株的Cd耐性和活化性测定Cd耐受性测定:采用最小抑菌浓度(Minimal inhibitory concentration,MIC)来评估菌株对Cd的耐受能力。将菌株接种于Cd2+浓度不断升高的LB液体培养基中(0~140 mg·L-1),并在摇床中以35 ℃和180 r· min-1的转速孵育24 h。通过检测OD600来测定细菌的生长状况。
碳酸镉活化性测定:在配制LB液体培养基的基础上加入碳酸镉粉末(0.06 g·L-1;Cd浓度:39.12 mg· L-1),取1 mL菌液接种于50 mL培养基中(以不加菌液为对照),35 ℃、180 r·min-1下振荡培养2 d,离心取上清液过0.22 μm滤膜,滤液用电感耦合等离子体发射光谱仪(ICP-OES,Optima 800,美国)进行Cd2+浓度分析。每个处理3个重复。菌株对碳酸镉的活化率按公式(1)计算:
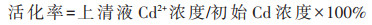
|
(1) |
实验在50 mL离心管中进行,离心管中含有20 mL Cd2+溶液,每组3个重复,固定条件为35 ℃和180 r·min-1摇床反应。在1.0 g·L-1生物量(湿质量)和10 mg·L-1 Cd2+条件下测定pH值对吸附的影响,初始pH值为3.0~8.0,反应时间为4 h;在pH 7.0和10 mg·L-1 Cd2+下,测定生物量对吸附的影响,生物量(湿质量)为1.0~11.0 g·L-1,反应时间为4 h;在pH 7.0和1.0 g· L-1生物量(湿质量)下,测定不同初始Cd2+浓度对吸附的影响,反应时间为4 h。同样,在1.0 g·L-1生物量(湿质量)、10 mg·L-1 Cd2+和pH 7.0下,测定吸附时间(0~4 h)对吸附的影响[9]。生物吸附后,离心(9 000 r· min-1、10 min),收集上清液,采用ICP-OES进行Cd2+浓度分析。吸附率按公式(2)计算:
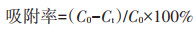
|
(2) |
式中:C0和Ct分别为上清液中初始时刻和t时刻的Cd2+浓度,mg·L-1。
1.5.2 等温线模型拟合Langmuir等温线模型(3)适用于均质力作用下的单层生物吸附[14]。
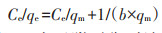
|
(3) |
式中:Ce为吸附平衡时溶液中Cd2+浓度,mg·L-1;qe为吸附平衡时吸附量,mg·g-1;qm为单分子层饱和吸附量,mg·g-1;b为与吸附相关的Langmuir常数,L·mg-1。

|
(4) |
式中:RL为Langmuir模型平衡参数,C0为溶液不同Cd2+初始浓度,mg·L-1;RL < 1,可利用吸附剂进行吸附;RL =0,吸附反应不可逆;RL =1,为线性;RL >1,不利于吸附。
Freundlich等温线模型用于模拟金属离子对非均质表面的生物吸附[15]。其线性方程(5)如下所示:
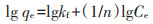
|
(5) |
式中:Ce吸附平衡时溶液中Cd2+浓度,mg·L-1;qe为吸附平衡时吸附量,mg·g-1;kf为吸附或分配系数;n为Freundlich常数,代表生物吸附的有利度。
1.5.3 解吸实验在35 ℃和180 r·min-1(pH值7.0、10 mg·L-1 Cd2+和1.0 g·L-1生物量)下吸附4 h后,反应液离心,收集上层清液进行进一步分析。沉淀物用3种不同的解吸剂解吸[16]:Milli-Q H2O、1.0 mol·L-1 NH4NO3和0.1 mol·L-1EDTA-Na2。反应液在180 r·min-1、35 ℃反应4 h。离心后,采用ICP-OES法测定上清液中Cd2+的浓度。
1.6 SEM-EDS和FTIR分析 1.6.1 SEM-EDS分析采用扫描电子显微镜(SEM,NOVA NanoSEM 230,美国)和X射线能谱仪(Oxford X-max 80,英国)对菌株吸附前后进行形貌观察和元素分析。将培养后的细菌离心收集菌体,经2.5% 戊二醛固定、PB缓冲液清洗、乙醇逐级梯度脱水和干燥等操作后,上机检测。
1.6.2 FTIR分析使用傅里叶变换红外光谱仪(FTIR,Nicolet 6700)对各吸附剂吸附前后表面官能团变化进行分析。用真空冷冻机(BTP-3ES00X Bench Toop Pro,美国)对吸附剂进行冻干,在4 000~400 cm-1范围内以4 cm-1的分辨率记录了所有红外光谱。观察所用样品由2 mg吸附剂封装在200 mg KBr中制备而成。
1.7 数据分析使用Excel 2010、Origin 2018和SPSS 22.0软件对数据进行分析处理。使用单因素方差分析(ANOVA)和Duncan多重比较分析(P < 0.05)对数据进行评估。
2 结果与讨论 2.1 菌株鉴定 2.1.1 菌株形态特征在LB固体培养基上AXY1菌落呈圆形,乳白色,黏液状,表面光滑(图 1)。在光学显微镜下观察呈细小的短棒状,革兰氏阴性。

|
图 1 AXY1菌株的革兰氏染色图(400倍) Figure 1 Gram stain of strain AXY1(400 times) |
将测序所得序列在美国国家生物技术信息中心(NCBI)中进行比对,发现其与Rhizobium pusense NRCPB10的序列相似度最高,达99.71%。目前研究者普遍认为当16S rRNA基因序列同源性高于97% 时,可认为是属内同种。进一步通过MEGA 7.0软件,采用Neighbour-Joining方法构建了菌株AXY1的系统发育进化树(图 2)。结果显示,AXY1菌株与Rhizobium pusense NRCPB10亲缘关系最近,结合菌株形态特征,进一步确认该菌株属于Rhizobium pusense。菌株的测序序列已提交至NCBI GeneBank数据库,登录号为MT774560。

|
图 2 AXY1菌株16S rRNA基因序列构建的系统发育树 Figure 2 Phylogenetic tree constructed by 16S rRNA gene sequence of strain AXY1 |
研究了不同温度下AXY1菌株的生长状况,结果如图 3(a)所示。在较低温度下,菌株生长受到严重抑制。随着温度的升高,菌株OD600值迅速上升,并在35 ℃时达到最高值1.51,但随着温度的继续升高,OD600值又显著下降(P < 0.05),表明AXY1菌株生长的最适生长温度在35 ℃左右。
|
图 3 温度和pH对AXY1菌株生长的影响 Figure 3 Effects of temperature and pH on the growth of strain AXY1 |
研究了不同pH条件下AXY1菌株的生长状况,结果如图 3(b)所示。随着培养基pH的升高,菌株生长呈现先上升后下降的趋势。在酸性条件下,菌株生长受到严重抑制,在pH为4.0时,几乎无法生长;而当pH为9.0时,培养基呈碱性,菌株生长同样受到一定程度抑制,OD600值显著下降(P < 0.05)。结果表明,AXY1菌株的最适生长pH在7.0左右,过酸或过碱均不适合其生长。
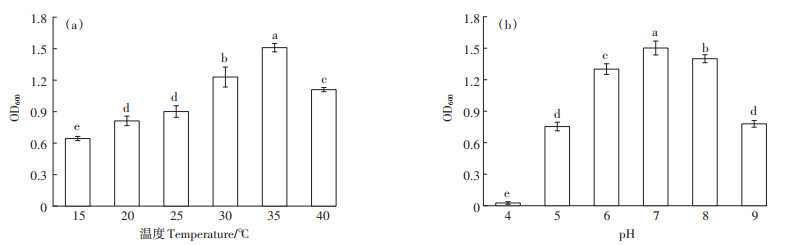
2.2.2 菌株的生长曲线研究研究了AXY1菌株的生长曲线,结果如图 4所示。在正常情况下,AXY1菌株的迟缓期较长,8 h后才进入指数生长期,并在20 h时OD600达到最高值。培养超过28 h后,菌株生长进入衰亡期。在10 mg·L-1 Cd2+胁迫下,菌株的生长显得更为迟缓,在28 h时OD600才达到最高值。
|
图 4 AXY1菌株的生长曲线 Figure 4 Growth curve of strain AXY1 |
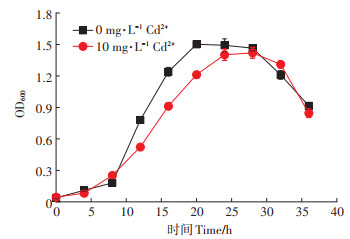
研究了AXY1菌株对Cd的耐受能力,结果如图 5(a)所示。菌株对Cd的MIC值为120 mg·L-1,与前人报道的耐Cd菌株Pseudomonas alcaliphila Cd-t1(100 mg·L-1)[17]和Cedecea sp. SC19(120 mg·L-1)[18]相近,而略低于Bacillus sp. GZ-22(250 mg·L-1)[19]。在低Cd浓度下(< 0 mg·L-1),菌株能正常生长,表明其具备低Cd浓度Cd污染修复的先决条件。当Cd浓度超过20 mg·L-1时,菌株的生长受到大幅度抑制。
|
图 5 AXY1菌株对Cd的耐受性及活化性 Figure 5 Tolerance and activation of strain AXY1 to cadmium |
研究了AXY1菌株对碳酸镉的活化特性,结果如图 5(b)所示。培养结束后,菌液中Cd2+浓度为3.60 mg·L-1,活化率为9.21%。Tessier等[20]将土壤中重金属形态分为可交换态、碳酸盐结合态、铁锰氧化物结合态、有机物结合态和残渣态5种。其中碳酸盐结合态指金属离子与碳酸盐沉淀相结合的部分,该形态易受环境变化,尤其是pH变化的影响。促生菌在生长的过程中可能会通过分泌各类有机酸溶解碳酸镉,提高土壤Cd的生物有效性,进而提高植物对Cd的萃取效率。
2.4 菌株对Cd2+的吸附性评估 2.4.1 吸附条件研究研究了不同pH对AXY1菌株吸附Cd2+的影响,结果如图 6(a)所示。溶液的pH是影响吸附过程的最重要因素之一,它会影响金属离子的溶解度和菌株表面功能基团的活性。菌株AXY1在pH值为7.0时,对Cd2+的吸附率达到最大值41.52%。在pH < 6.0时,菌株的生物吸附率显著降低(P < 0.05),这是因为在酸性溶液中,存在大量的H+与Cd2+竞争结合位点[21]。另一方面,当水溶液的pH > 8.0时,菌株的吸附率同样显著降低(P < 0.05),这是由于金属氢氧化物沉淀会在碱性条件下产生,导致Cd2+吸附量降低。
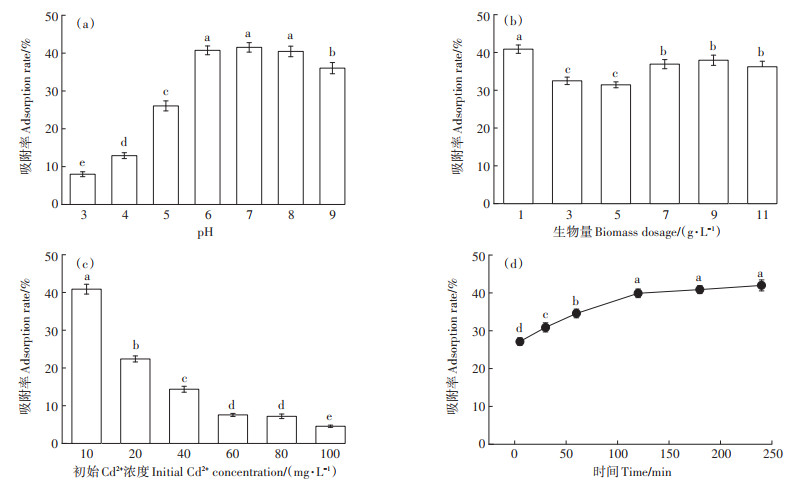
|
图 6 pH、生物量、初始Cd2+浓度和吸附时间对AXY1菌株吸附Cd2+的影响 Figure 6 Effect of pH, biomass dosage, initial Cd2+ concentration and adsorption time on Cd2+ adsorption by strain AXY1 |
研究了不同生物量对AXY1菌株吸附Cd2+的影响,结果如图 6(b)所示。生物量是一个重要的因素,它决定了给定初始浓度下的菌株的生物吸附率。当生物量为1.0 g·L-1时,菌株的吸附率显著高于其余组(P < 0.05)。在较低的生物量浓度下,有着较高的吸附率可能是较高的金属离子浓度与生物量比率所致。在生物量为5.0 g·L-1时,AXY1对Cd2+的吸附率达到最低点(31.44%)。这可能是由于部分细胞聚集导致暴露的生物吸附表面积有所减少,缺乏吸附位点,从而降低了菌株的吸附率[9]。进一步提高生物量,生物吸附率恢复增加趋势。这与生物吸附剂数量的增加有关,表面积的增多为吸附提供了更多的活性位点[22]。
研究了溶液不同初始Cd2+浓度对AXY1菌株吸附Cd2+的影响,结果如图 6(c)所示。随着Cd2+浓度的增加,菌株的吸附率明显降低,在10 mg·L-1时有着最高的吸附率40.88%。Cd2+浓度的增加可能导致细胞表面缺乏足够的游离位点和竞争性吸附[23]。另一个重要原因是高浓度的Cd对细胞有毒害性并影响细胞活力[19]。
研究了不同吸附时间对AXY1菌株吸附Cd2+的影响,结果如图 6(d)所示。菌株在开始的5 min内迅速达到了27.14%的高吸附率,之后,菌株的吸附率在5~60 min内继续快速增加。随后,吸附率缓慢增加并在120 min后逐渐稳定(P>0.05),并达到最大值41.98%。菌株对Cd2+的快速吸附可能归因于细胞壁的表面吸附机理:吸附初始,菌株的所有结合位点都是游离的,并且可供吸附的Cd2+浓度很高[5]。
2.4.2 吸附等温线模型拟合对吸附数据进行等温线模型拟合,结果如图 7和表 1所示。Langmuir和Freundlich线性化模型描绘了吸附剂Cd2+吸收量(qe)和溶液中Cd2+残留浓度(Ce)之间的关系。从R2值可以看出,AXY1菌株的吸附数据符合Langmuir模型(R2=0.957),但并不符合Freundlich模型(R2=0.091),表明其表面主要为单层生物吸附。高浓度的Cd对细胞造成了相当大的损害,甚至导致某些细胞的死亡,这时Freundlich模型并不特别合适[24]。
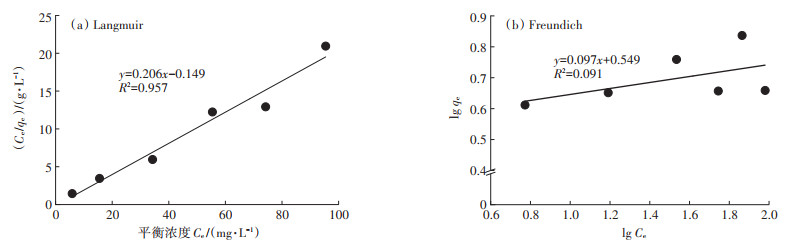
|
图 7 Langmuir和Freundlich等温线模型拟合 Figure 7 Langmuir and Freundlich isotherms fitting plots |
|
|
表 1 等温线模型拟合相关参数 Table 1 Parameters of isotherms model fitting |
AXY1菌株基于Langmuir模型获得的预测qm值为4.85 mg·g-1;代表菌株对Cd2+的结合力强弱的Langmuir亲和系数(b)为-1.38 L·mg-1,表明被菌株吸附的Cd2+可能较易被解吸剂洗脱[25]。Langmuir模型平衡参数(RL) < 1,表明可利用菌株对Cd2+进行吸附。此外,发现菌株的Freundlich常数(n)>1,表明AXY1菌株对Cd2+的生物吸附即使在较高的Cd2+浓度下也是可以进行的。
2.5 解吸实验为了进一步研究AXY1菌株对Cd2+的吸附方式,分别用Milli-Q水、1.0 mol·L-1 NH4NO3和0.1 mol·L-1 EDTA-Na2解吸液,对AXY1菌株吸附的Cd2+进行解吸。上述3种洗脱液分别可以解吸由吸附剂吸附的不同部分的金属离子:(1)物理包裹,其结合力弱并且容易被水解吸;(2)与细胞壁上的Na+、Mg2+、K+和Ca2+进行离子交换,可被NH4NO3溶液解吸;(3)与细胞壁上官能团进行络合,可以被EDTA-Na2溶液解吸。剩余部分被认为是在胞内积累。
实验结果如图 8所示。Milli-Q水、1.0 mol·L-1 NH4NO3和0.1 mol·L-1 EDTA-Na2解吸液分别解吸了9.00%、55.94% 和68.82% 由AXY1菌株吸附的Cd2+。因此,AXY1菌株吸附的Cd2+中物理吸附部分为9.00%,离子交换部分为46.94%,官能团络合部分为12.88%,细胞内积累部分为31.18%。这表明在对Cd2+的生物吸附过程中,AXY1菌株的离子交换部分最多,且有部分Cd2+被转运进入胞内。

|
图 8 不同解吸剂对菌株AXY1吸附的Cd2+的解吸率 Figure 8 Desorption of the absorbed Cd2+ by strain AXY1 using different desorption solutions |
利用SEM-EDS对AXY1菌株Cd2+吸附前后的形貌和表面元素进行观察,结果如图 9所示。未经Cd2+处理的AXY1细胞呈棒状,表面较为光滑,边界清晰,而经Cd2+处理后,细胞受到胁迫,形态改变、模糊、不规则,出现聚集现象。这种变化可能是由于Cd2+在细胞表面与活性官能团的相互作用破坏了细胞表面的机械张力[6]。X射线能谱仪(EDS)是一种应用广泛的生物吸附剂材料化学元素分析工具。未经Cd处理的AXY1菌株细胞表面没有检测到Cd2+信号,而经Cd处理后,菌株表面检测到了Cd2+的信号,证明了Cd2+在菌株表面的存在。
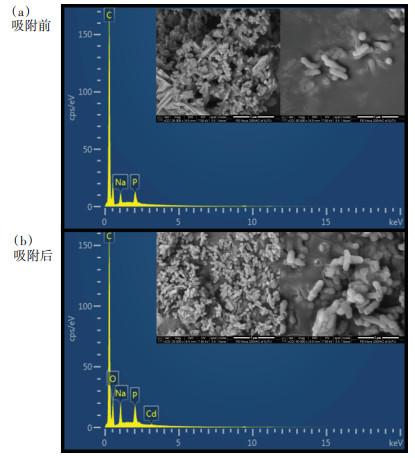
|
图 9 AXY1菌株吸附Cd2+前后扫描电镜和能谱图 Figure 9 SEM-EDS spectrum of strain AXY1 before and after Cd2+ adsorption |
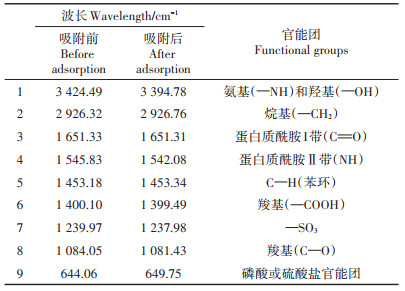
利用傅里叶变换红外光谱仪(FTIR)分析获得AXY1菌株Cd2+吸附过程中所涉及到的官能团信息。吸附前后结果如图 10所示,根据文献结果确定了相应的特征峰[24, 26-27],列于表 2。AXY1菌株在吸附过程中,位于3 424.49、2 926.32、1 651.33、1 545.83、1 453.18、1 400.10、1 239.97、1 084.05 cm-1和644.06 cm-1处的峰发生偏移,其对应的官能团分别为氨基(—NH)和羟基(—OH)、烷基(—CH2)、蛋白质酰胺Ⅰ带(C=O)、蛋白质酰胺Ⅱ带(NH)、C—H(苯环)、羧基(—COOH)、—SO3、羧基(C—O)、磷酸或硫酸盐官能团,表明上述官能团可能参与了AXY1菌株对Cd2+的生物吸附。此外,氨基(—NH)和羟基(—OH)、蛋白质酰胺Ⅱ带(NH)、C—O(羧基)和磷酸或硫酸盐官能团所在峰发生较大偏移,表明它们在AXY1菌株对Cd2+的生物吸附过程中可能发挥了更为重要的作用。
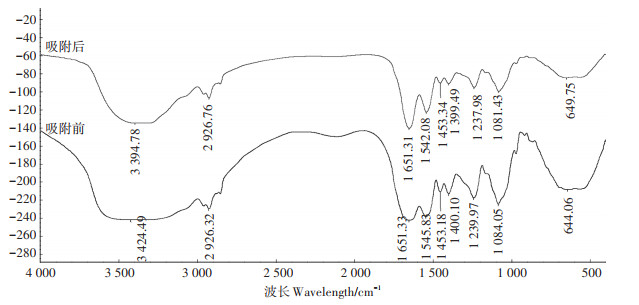
|
图 10 AXY1菌株吸附Cd2+前后红外光谱图 Figure 10 FTIR spectra of strain AXY1 before and after Cd2+ adsorption |
|
|
表 2 FTIR图谱中的主要官能团 Table 2 Main functional groups observed from FTIR spectra |
(1)菌株AXY1经过鉴定为根瘤菌(Rhizobium pusense),其最适生长温度在35 ℃左右,最适生长pH在7.0左右。
(2)菌株AXY1对Cd的耐受性达120 mg·L-1,对碳酸镉的活化率为9.21%。
(3)菌株AXY1对Cd2+的吸附以单层生物吸附为主,吸附过程符合Langmuir模型。
(4)菌株AXY1吸附的Cd2+中,离子交换部分最多,且有部分Cd2+被转运进入胞内。此外,—OH、—NH、—COOH等官能团可能参与了菌株对Cd2+的吸附。
| [1] |
李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21: 104-107. LI Jing, ZHOU Yanwen, CHEN Sen, et al. Actualities, damage and management of soil cadmium pollution in China[J]. Anhui Agricultural Science Bulletin, 2015, 21: 104-107. |
| [2] |
曹仁林, 贾晓葵, 张建顺. 镉污染水稻土防治研究[J]. 天津农林科技, 1999(6): 12-17. CAO Ren-lin, JIA Xiao-kui, ZHANG Jianshun. Study on the control of cadmium polluted paddy soil[J]. Tianjin Agriculture and Forestry Science and Technology, 1999(6): 12-17. |
| [3] |
Vijayaraghavan K, Yun Y S. Bacterial biosorbents and biosorption[J]. Biotechnology Advances, 2008, 26: 266-291. DOI:10.1016/j.biotechadv.2008.02.002 |
| [4] |
Özdemir S, Kilinc E, Poli A, et al. Biosorption of Cd, Cu, Ni, Mn and Zn from aqueous solutions by thermophilic bacteria, Geobacillus toebii sub. sp. decanicus and Geobacillus thermoleovorans sub. sp. stromboliensis: Equilibrium, kinetic and thermodynamic studies[J]. Chemical Engineering Journal, 2009, 152: 195-206. DOI:10.1016/j.cej.2009.04.041 |
| [5] |
Mohapatra R K, Parhi P K, Pandey S, et al. Active and passive biosorption of Pb(Ⅱ) using live and dead biomass of marine bacterium Bacillus xiamenensis PbRPSD202:Kinetics and isotherm studies[J]. Journal of Environmental Management, 2019, 247: 121-134. |
| [6] |
Ren G, Jin Y, Zhang C, et al. Characteristics of Bacillus sp. PZ-1 and its biosorption to Pb(Ⅱ)[J]. Ecotoxicology and Environmental Safety, 2015, 117: 141-148. DOI:10.1016/j.ecoenv.2015.03.033 |
| [7] |
Jin Z M, Deng S Q, Wen Y C, et al. Application of Simplicillium chinense for Cd and Pb biosorption and enhancing heavy metal phytoremediation of soils[J]. Science of the Total Environment, 2019, 697: 134148. DOI:10.1016/j.scitotenv.2019.134148 |
| [8] |
Chi Y W, Huang Y Y, Wang J C, et al. Two plant growth promoting bacterial Bacillus strains possess different mechanisms in adsorption and resistance to cadmium[J]. Science of the Total Environment, 2020, 741: 140422. DOI:10.1016/j.scitotenv.2020.140422 |
| [9] |
Wang T Q, Yao J, Yuan Z M, et al. Isolation of lead-resistant Arthrobactor strain GQ-9 and its biosorption mechanism[J]. Environmental Science and Pollution Research, 2018, 25: 3527-3538. DOI:10.1007/s11356-017-0694-7 |
| [10] |
Peng W H, Li X M, Song J X, et al. Bioremediation of cadmium-and zinc-contaminated soil using Rhodobacter sphaeroides[J]. Chemosphere, 2018, 197: 33-41. DOI:10.1016/j.chemosphere.2018.01.017 |
| [11] |
Li J, Liu Y R, Zhang L M, et al. Sorption mechanism and distribution of cadmium by different microbial species[J]. Journal of Environmental Management, 2019, 237: 552-559. |
| [12] |
蒋淼, 张丹, 支月娥, 等. 强化龙葵富集镉根际促生菌的分离、筛选与鉴定[J]. 微生物学通报, 2019, 46: 2231-2240. JIANG Miao, ZHANG Dan, ZHI Yue -e, et al. Isolation, screening and identification of plant growth promoting rhizobacteria to enrich cadmium accumulation in Solanum nigrum L[J]. Microbiology China, 2019, 46: 2231-2240. |
| [13] |
Xu S Z, Xing Y H, Liu S, et al. Role of novel bacterial Raoultella sp. strain X13 in plant growth promotion and cadmium bioremediation in soil[J]. Applied Microbiology and Biotechnology, 2019, 103: 3887-3897. DOI:10.1007/s00253-019-09700-7 |
| [14] |
Behera S S, Das S, Parhi P K, et al. Kinetics, thermodynamics and isotherm studies on adsorption of methyl orange from aqueous solution using ion exchange resin Amberlite IRA-400[J]. Desalination and Water Treatment, 2017, 60: 249-260. DOI:10.5004/dwt.2017.0171 |
| [15] |
Bulgariu D, Bulgariu L. Equilibrium and kinetics studies of heavy metal ions biosorption on green algae waste biomass[J]. Bioresource Technology, 2012, 103: 489-493. DOI:10.1016/j.biortech.2011.10.016 |
| [16] |
Bai J, Yang X H, Du R Y, et al. Biosorption mechanisms involved in immobilization of soil Pb by Bacillus subtilis DBM in a multi-metalcontaminated soil[J]. Journal of Environmental Sciences, 2014, 26: 2056-2064. DOI:10.1016/j.jes.2014.07.015 |
| [17] |
陈雪姣, 郭雪玲, 南昊, 等. 一株耐镉假单胞杆菌的分离鉴定及其对镉的吸附研究[J]. 湖北农业科学, 2016, 55: 2765-2768, 2773. CHEN Xue-jiao, GUO Xue-ling, NAN Hao, et al. Separation, identification of a cadmium -tolerant Pseudomonas and the study of its adsorption characters of Cd2+[J]. Hubei Agricultural Sciences, 2016, 55: 2765-2768, 2773. |
| [18] |
王建才, 刘兴华, 王怀中, 等. 耐铅镉菌株的分离鉴定及其吸附能力[J]. 生物工程学报, 2020, 36: 1600-1609. WANG Jian-cai, LIU Xing-hua, WANG Huai-zhong, et al. Isolation, identification and heavy metals biosorption of a lead and cadmium-tolerant strain[J]. Chinese Journal of Biotechnology, 2020, 36: 1600-1609. |
| [19] |
Zhao Y, Yao J, Yuan Z M, et al. Bioremediation of Cd by strain GZ-22 isolated from mine soil based on biosorption and microbially induced carbonate precipitation[J]. Environmental Science and Pollution Research, 2017, 24: 372-380. DOI:10.1007/s11356-016-7810-y |
| [20] |
Tessier A P, Campbell P G C, Bisson M X. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017 |
| [21] |
Khadivinia E, Sharafi H, Hadi F, et al. Cadmium biosorption by a glyphosate-degrading bacterium, a novel biosorbent isolated from pesticide-contaminated agricultural soils[J]. Journal of Industrial and Engineering Chemistry, 2014, 20: 4304-4310. DOI:10.1016/j.jiec.2014.01.037 |
| [22] |
Mittal A, Kaur D, Malviya A, et al. Adsorption studies on the removal of coloring agent phenol red from wastewater using waste materials as adsorbents[J]. Journal of Colloid and Interface Science, 2009, 337: 345-354. DOI:10.1016/j.jcis.2009.05.016 |
| [23] |
Ma X M, Cui W G, Yang L, et al. Efficient biosorption of lead(Ⅱ) and cadmium(Ⅱ) ions from aqueous solutions by functionalized cell with intracellular CaCO3 mineral scaffolds[J]. Bioresource Technology, 2015, 185: 70-78. DOI:10.1016/j.biortech.2015.02.074 |
| [24] |
Xu S Z, Xing Y H, Liu S, et al. Characterization of Cd2+ biosorption by Pseudomonas sp. strain 375, a novel biosorbent isolated from soil polluted with heavy metals in Southern China[J]. Chemosphere, 2020, 240: 124893. DOI:10.1016/j.chemosphere.2019.124893 |
| [25] |
Tunali S, Çabuk A, Akar T. Removal of lead and copper ions from aqueous solutions by bacterial strain isolated from soil[J]. Chemical Engineering Journal, 2006, 115: 203-211. DOI:10.1016/j.cej.2005.09.023 |
| [26] |
Masoudzadeh N, Zakeri F, Lotfabad T, et al. Biosorption of cadmium by Brevundimonas sp. ZF12 strain, a novel biosorbent isolated from hot-spring waters in high background radiation areas[J]. Journal of Hazardous Materials, 2011, 197: 190-198. DOI:10.1016/j.jhazmat.2011.09.075 |
| [27] |
Li X J, Li D B, Yan Z N, et al. Biosorption and bioaccumulation characteristics of cadmium by plant growth-promoting rhizobacteria[J]. RSC Advances, 2018, 8: 30902-30911. DOI:10.1039/C8RA06270F |
 2021, Vol. 40
2021, Vol. 40