2. 中国科学院大学资源与环境学院, 北京 101408;
3. 葫芦岛市生态环境保护服务中心, 辽宁 葫芦岛 125000
2. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 101408, China;
3. Ecological Environmental Protection Service Center of Huludao City, Huludao 125000, China
土壤中铝(Al)元素主要以硅铝酸盐、铝氧化物和铝氢氧化物的形式存在于固相中[1]。含水氧化铝(Al2O3·3H2O)和氢氧化铝(Al2O3·nH2O)在土壤中含量较高,其中氧化铝是最丰富和最活泼的矿物质之一[1]。氧化铝可以影响许多微量元素和污染物的环境行为,例如重金属形态转化等[2]。氧化铝具有很好的材料性能,比如热稳定性、耐腐蚀性和吸附性等[3-4]。氧化铝的吸附行为主要与其有较大比表面积和密度有关[2]。其中γ-氧化铝具有独特的化学稳定性和机械稳定性,是一种应用非常广泛的吸附材料[5]。针对土壤中氧化铝的研究,目前主要集中在α-氧化铝和γ-氧化铝[6]。
铬(Cr)是工业生产中应用较多的重金属之一,其主要用于冶金和皮革制造等行业。环境中铬有+2到+6价等多种价态,其中Cr(Ⅵ)和Cr(Ⅲ)是土壤中铬主要存在形态[7]。土壤中铬的迁移和转化等过程与其在土壤界面上吸附和解吸附等过程紧密相关[8]。由于土壤中氧化铝等矿物具有较强吸附能力,其能对土壤中Cr(Ⅵ)和Cr(Ⅲ)的迁移和转化产生重要影响。
土壤环境中存在一些土著微生物,能把毒性较高的Cr(Ⅵ)还原成毒性较低的Cr(Ⅲ),被称为Cr(Ⅵ) 还原菌。已经报道从土壤中分离的Cr(Ⅵ)还原菌有Oceanobacillus oncorhynchi[9]、Leucobacter chromiireducens[10]和Bacillus dabaoshanensis[11]等。在土壤环境中,土壤矿物和土壤微生物之间存在紧密关系,例如土壤矿物可以吸附微生物,而土壤微生物也可以利用矿质元素促进生长[12]。研究表明土壤中存在的Cr(Ⅵ)还原菌能够对土壤中典型铁氧化物(针铁矿和赤铁矿) 吸附铬产生影响[13],但其对土壤中不同种类铝氧化物吸附铬的影响尚缺乏系统了解。
本研究内容主要包括:(1)α-氧化铝和γ-氧化铝对Cr(Ⅵ)吸附能力的比较;(2)当Cr(Ⅵ)、Cr(Ⅵ)还原菌与α-氧化铝或γ-氧化铝共存时,培养前后两种氧化铝的变化;(3)Cr (Ⅵ)还原菌对α-氧化铝和γ-氧化铝吸附铬的影响。
1 材料与方法 1.1 Cr (Ⅵ)还原菌的分离和鉴定本实验中使用的Cr(Ⅵ)还原菌为前期工作中筛选的菌株Microbacterium sp. QH-2,即微杆菌属菌株QH-2。该菌株分离于青海某铬渣堆放场地灰褐土样品[13]。菌株QH-2能耐受20 mmol·L-1 Cr (Ⅵ),且对Cr (Ⅵ)还原速率可以达到2.17 mg·L-1·h-1[13]。
1.2 铝氧化物的表征本实验中铝氧化物为α-氧化铝(α-Al2O3)和γ- 氧化铝(γ-Al2O3),其中α-氧化铝纯度为99.9%,颗粒大小约为30 nm。γ-氧化铝纯度为99.99%,颗粒大小约为10 nm,两种铝氧化物均购自上海麦克林生化科技有限公司。
1.3 铝氧化物对Cr (Ⅵ)吸附的研究0.5 g α-氧化铝和0.5 g γ-氧化铝各自与pH为4.0、体积为40 mL的使用重铬酸钾(K2Cr2O7)配制的5 mmol·L-1 Cr(Ⅵ)溶液混合,放入恒温摇床(25 ℃、160 r·min-1)中振荡48 h,经离心(4 000 r·min-1、10 min) 后,使用超纯水清洗。一部分经过冷冻干燥,利用微波消解仪(CEM Mars 6)消解后,使用电感耦合等离子体发射光谱仪(ICP-OES)(美国Perkin-Elmer公司)测定总铬含量[14],另一部分待用。吸附实验重复3次。
1.4 Cr (Ⅵ)在铝氧化物上解吸附和还原将上述吸附饱和Cr(Ⅵ)的0.5 g α-氧化铝和0.5 g γ-氧化铝各自加入到40 mL在LB(Luria-Bertani)培养基中培养的QH-2菌液(OD600=2.0),后置于30 ℃、160 r·min-1恒温摇床中培养。实验过程中,在12、24、48、72 h和96 h分别取样,样品过0.22 μm的滤膜,待测液相培养基中总铬和Cr(Ⅵ)。待测样品经微波消解后,使用ICP-OES测定总铬,Cr (Ⅵ)测定则参考《水质六价铬的测定二苯碳酰二肼分光光度法》(GB/T 7467—1987)。解吸附和还原实验重复3次。
混合液培养96 h测定pH后,使用60%(m:V)蔗糖溶液离心(8 000 r·min-1,10 min),将菌株与铝氧化物分离[15]。一部分培养液用于扫描电镜观察,另一部分经冷冻干燥后,待测X射线衍射(XRD)和固相中总铬。以仅添加吸附饱和Cr (Ⅵ)α-氧化铝和γ-氧化铝的LB培养基(pH=8.2)作为对照。
1.5 扫描电镜观察混合液加入体积分数为2.5%戊二醛固定。测定前移除戊二醛溶液,用超纯水清洗3次后,使用50%、70%、85%、95% 和100%(V:V)乙醇溶液逐级脱水,每级脱水过程保持10 min。用临界点干燥法进行干燥,喷金待测(Hitachi SU8010,Japan)[16]。
1.6 XRD表征XRD仪器购自日本SmartLab公司,扫描角度为10°~80°,目标电压为45 kV,电流为200 mA。
2 结果与讨论 2.1 α-氧化铝和γ-氧化铝的扫描电镜表征培养前后,α-氧化铝和γ-氧化铝扫描电镜观察结果如图 1所示。

|
图 1 α-氧化铝和γ-氧化铝的扫描电镜图 Figure 1 Scanning electron microscope of α-alumina and γ-alumina |
在含有Cr(Ⅵ)的培养基培养后,菌株QH-2在α-氧化铝和γ-氧化铝表面上不规则吸附,并且菌株QH-2表面出现突起物,这种突起物可能是由于Cr (Ⅵ)被还原成Cr (Ⅲ)后,Cr (Ⅲ)被吸附或固定在细胞表面[17-18]。也有研究者认为Cr(Ⅵ)还原菌在含有Cr (Ⅵ)的培养基中培养后,细胞表面产生的形态变化可能是细胞本身对Cr(Ⅵ)的耐受性适应所引起[19]。此外,已有研究表明铬酸盐通常是通过静电作用吸附在氧化铝的表面[2],本实验中,α-氧化铝和γ-氧化铝与Cr (Ⅵ)的吸附行为可能也与静电作用有关。
2.2 α-氧化铝和γ-氧化铝的XRD表征培养后α-氧化铝和γ-氧化铝的XRD表征见图 2。由图 2可以看出,培养前后α-氧化铝和γ-氧化铝的XRD图谱没有明显变化,而且特征峰位置没有发现明显偏移,表明α-氧化铝和γ-氧化铝的晶体结构未受到Cr(Ⅵ)还原菌生长的影响。与之不同的是,Muehe等[20]报道了希瓦氏菌属Shewanella oneidensis MR-1与吸附着As(Ⅲ)和As(Ⅴ)的针铁矿混合培养,针铁矿上发现蓝铁矿和磁铁矿两种次生矿物。Qian等[21]研究表明一些Cr(Ⅵ)还原菌可以先将Fe(Ⅲ)还原成Fe(Ⅱ),而Fe(Ⅱ)能将Cr(Ⅵ)还原成Cr(Ⅲ)。而在本次共培养实验中,α-氧化铝和γ-氧化铝中均未发现次生矿物的形成。
|
图 2 培养前后α-氧化铝和γ-氧化铝XRD图谱 Figure 2 XRD analysis of α-alumina and γ-alumina before and after incubation |
使用ICP-OES测得,培养前Cr(Ⅵ)在α-氧化铝和γ-氧化铝上吸附量分别为1 236.0 mg·kg-1和5 682.0 mg·kg-1(表 1)。在pH为4吸附条件下,γ-氧化铝对Cr (Ⅵ)吸附能力明显强于α-氧化铝。α-氧化铝是一种稳定相氧化铝,γ-氧化铝属于活性氧化铝的一种,γ-氧化铝比α-氧化铝的比表面积更大、表面能更高,这也是本实验中α-氧化铝对Cr(Ⅵ)吸附能力弱于γ-氧化铝的原因[22]。
|
|
表 1 α-氧化铝和γ-氧化铝对铬的吸附量(mg·kg-1) Table 1 The adsorption capacity of chromium by α-alumina and γ-alumina(mg·kg-1) |
共培养实验中α-氧化铝和γ-氧化铝对铬的吸附量变化见表 1。培养后,未接种的对照中α-氧化铝和γ-氧化铝上总铬量分别为62.2 mg·kg-1和1 720.0 mg· kg-1,而与菌株QH-2培养后,α-氧化铝和γ-氧化铝上的总铬量分别为75.2 mg·kg-1和2 331.8 mg·kg-1。因而菌株QH-2的存在增加了α-氧化铝和γ-氧化铝对铬的吸附量。这可能是由于吸附在氧化铝的菌株QH-2在生长繁殖和分泌有机物质,如细胞释放胞外酶和生物多聚物等促进了氧化铝对铬的吸附[23]。此外,在本培养实验pH条件(碱性)下,Cr(Ⅵ)以CrO42-存在,Cr(Ⅲ)会以Cr(OH)4-存在,由于α-氧化铝和γ- 氧化铝含有较多羟基(OH),因此二者更容易结合和吸附Cr(Ⅲ),形成Cr(OH)-4,因而当溶液中Cr(Ⅵ) 被Cr (Ⅵ)还原菌株QH-2还原成Cr (Ⅲ)后,α-氧化铝和γ-氧化铝对铬吸附量增加。
2.4 培养过程中液相培养基中铬的形态和分布在96 h的培养过程中,液相培养基中Cr(Ⅵ)和Cr(Ⅲ)变化见图 3。由图 3可以看出,随着培养的进行,α-氧化铝和γ-氧化铝上吸附的Cr (Ⅵ)逐渐解吸附到液相培养基中。而在液相培养基中,菌株QH-2又将解吸附的Cr(Ⅵ)还原成Cr(Ⅲ)。由图 3(a)和图 3(b)看出,当培养到72 h后,液相培养基中Cr(Ⅵ)几乎被完全还原。但培养到96 h后,液相培养基中Cr(Ⅲ) 依然在减少,可能是由于还原生成的Cr(Ⅲ)逐渐被α-氧化铝和γ-氧化铝吸附。
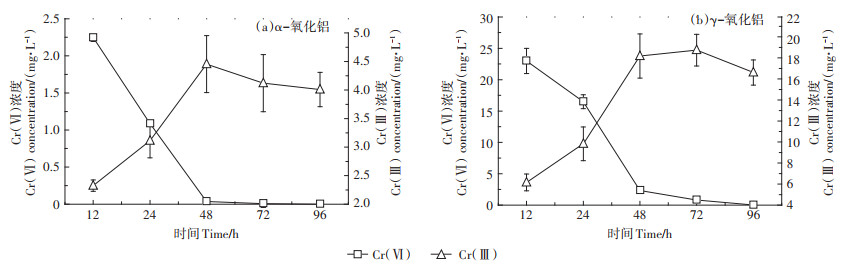
|
图 3 液相培养基中Cr(Ⅵ)和Cr(Ⅲ)的变化 Figure 3 Changes of Cr (Ⅵ)and Cr (Ⅲ)in liquid phase |
pH是影响氧化铝对Cr(Ⅵ)吸附的重要因素,通常pH能影响氧化铝表面的电荷变化[24-25]。pH越低,α-氧化铝表面的正电荷越多,从而其吸附量越大,当pH升高后,其吸附量会减少[25]。培养实验结束后,测定α-氧化铝和γ-氧化铝混合液pH都为8.2±0.1,这是由于菌株的生长和代谢导致了混合液pH升高[13],而吸附饱和Cr (Ⅵ)的α-氧化铝和γ-氧化铝会随着pH的进一步升高从固相上释放Cr(Ⅵ)到液相培养基中,液相培养基中Cr (Ⅵ)被菌株QH-2还原成Cr(Ⅲ)。pH的升高会导致OH-离子浓度的增加,而OH-离子浓度增加会与Cr2O72-产生竞争吸附,也进一步促进了Cr (Ⅵ)在α-氧化铝和γ-氧化铝表面的解吸附[24-27]。
3 结论(1) pH为4时,α-氧化铝对Cr (Ⅵ)吸附能力弱于γ-氧化铝。
(2) 接种Cr(Ⅵ)还原菌QH-2不会影响α-氧化铝和γ-氧化铝的矿物结构。
(3) 菌株QH-2与α-氧化铝和γ-氧化铝共培养后,能增加α-氧化铝和γ-氧化铝对铬的吸附量。
| [1] |
应小芳, 刘鹏, 徐根娣. 土壤中的铝及其植物效应的研究进展[J]. 生态环境, 2003(2): 237-239. YING Xiao-fang, LIU Peng, XU Gendi. The advance in the research of aluminum in soil and its influence on plant[J]. Ecology and Environment, 2003(2): 237-239. |
| [2] |
Elzinga E J, Tang Y, McDonald J, et al. Macroscopic and spectroscopic characterization of selenate, selenite, and chromate adsorption at the solid-water interface of γ-Al2O3[J]. Journal of Colloid and Interface Science, 2009, 340(2): 153-159. DOI:10.1016/j.jcis.2009.08.033 |
| [3] |
Genz A, Kornmüller A, Jekel M. Advanced phosphorus removal from membrane filtrates by adsorption on activated aluminium oxide and granulated ferric hydroxide[J]. Water Research, 2004, 38(16): 3523-3530. DOI:10.1016/j.watres.2004.06.006 |
| [4] |
Alvarez-Ayuso E, Garcia-Sanchez A, Querol X. Adsorption of Cr(Ⅵ) from synthetic solutions and electroplating wastewaters on amorphous aluminium oxide[J]. Journal of Hazardous Materials, 2007, 142(1/2): 191-198. |
| [5] |
Ge J, Deng K, Cai W, et al. Effect of structure-directing agents on facile hydrothermal preparation of hierarchical γ-Al2O3 and their adsorption performance toward Cr(Ⅵ) and CO2[J]. Journal of Colloid and Interface Science, 2013, 401: 34-39. DOI:10.1016/j.jcis.2013.03.028 |
| [6] |
McHale J M, Navrotsky A, Perrotta A J. Effects of increased surface area and chemisorbed H2O on the relative stability of nanocrystalline γ-Al2O3 and α-Al2O3[J]. The Journal of Physical Chemistry B, 1997, 101(4): 603-613. DOI:10.1021/jp9627584 |
| [7] |
陈英旭, 何增耀, 吴建平. 土壤中铬的形态及其转化[J]. 环境科学, 1994(3): 53-56. CHEN Ying-xu, HE Zeng-yao, WU Jian-ping. The form and transformation of chromium in soil[J]. Environmental Science, 1994(3): 53-56. |
| [8] |
刘晓娟. 土壤中铬的迁移转化规律及硒铬互作研究[D]. 太原: 山西大学, 2019. LIU Xiao-juan. Migration and transformation of chromium in soil and the interaction between chromium and seleniumits[D]. Taiyuan: Shanxi University, 2019. |
| [9] |
Zeng Q, Hu Y, Yang Y, et al. Cell envelop is the key site for Cr(Ⅵ) reduction by Oceanobacillus oncorhynchi W4. a newly isolated Cr(Ⅵ) reducing bacterium[J]. Journal of Hazardous Materials, 2019, 368: 149-155. DOI:10.1016/j.jhazmat.2019.01.031 |
| [10] |
Joutey N T, Bahafid W, Sayel H, et al. Leucobacter chromiireducens CRB2. a new strain with high Cr(Ⅵ) reduction potential isolated from tannery-contaminated soil(Fez. Morocco)[J]. Annals of Microbiology, 2016, 66(1): 425-436. DOI:10.1007/s13213-015-1125-y |
| [11] |
Cui X, Wang Y, Liu J, et al. Bacillus dabaoshanensis sp. nov. a Cr (Ⅵ) -tolerant bacterium isolated from heavy-metal-contaminated soil[J]. Archives of Microbiology, 2015, 197(4): 513-520. DOI:10.1007/s00203-015-1082-7 |
| [12] |
Lower S K, Hochella M F, Beveridge T J. Bacterial recognition of mineral surfaces: Nanoscale interactions between Shewanella and α-FeOOH[J]. Science, 2001, 292: 1360-1363. DOI:10.1126/science.1059567 |
| [13] |
Wang C, Cui Y. Recognition of a new Cr(Ⅵ) -reducing strain and study of the potential capacity for reduction of Cr(Ⅵ) of the strain[J]. BioMed Research International, 2019, 5135017. |
| [14] |
王春勇, 夏龙, 王鹏飞, 等. 农田、退耕还湿地、天然草本沼泽土壤重金属和农药的分布及潜在生态风险评价——以抚远市乌苏镇东兴村为例[J]. 湿地科学, 2019, 17(2): 222-227. WANG Chunyong, XIA Long, WANG Peng-fei, et al. Distribution of heavy metals and pesticides in soils of farmland, land of reverting farmland to wetland, and natural marsh and their potential ecological risk assessment: A case study of Dongxing Village of Wusu Town, Fuyuan City[J]. Wetland Science, 2019, 17(2): 222-227. |
| [15] |
Yee N, Fein J B, Daughney C J. Experimental study of the pH, ionic strength, and reversibility behavior of bacteria-mineral adsorption[J]. Geochimica et Cosmochimica Acta, 2000, 64(4): 609-617. DOI:10.1016/S0016-7037(99)00342-7 |
| [16] |
Zhang Z, Yin N, Du H, et al. The fate of arsenic adsorbed on iron oxides in the presence of arsenite-oxidizing bacteria[J]. Chemosphere, 2016, 151: 108-115. DOI:10.1016/j.chemosphere.2016.02.065 |
| [17] |
Chai L Y, Huang S H, Yang Z H, et al. Hexavalent chromium reduction by Pannonibacter phragmitetus BB isolated from soil under chromium-containing slag heap[J]. Journal of Environmental Science and Health Part A, 2009, 44(6): 615-622. DOI:10.1080/10934520902784690 |
| [18] |
Zhu W, Yang Z, Ma Z, et al. Reduction of high concentrations of chromate by Leucobacter sp. CRB1 isolated from Changsha, China[J]. World Journal of Microbiology and Biotechnology, 2008, 24(7): 991-996. DOI:10.1007/s11274-007-9564-7 |
| [19] |
杨锦霞. 利用游离和固定化铬(Ⅵ) 还原菌除铬的研究[D]. 武汉: 华中农业大学, 2009. YANG Jin-xia. Removal of toxic chromate using free and immobilized Cr(Ⅵ) -reducing bacteria[D]. Wuhan: Huazhong Agricultural University, 2009. |
| [20] |
Muehe E M, Scheer L, Daus B, et al. Fate of arsenic during microbial reduction of biogenic versus abiogenic As-Fe (Ⅲ) -mineral coprecipitates[J]. Environmental Science & Technology, 2013, 47(15): 8297-8307. |
| [21] |
Qian J, Wei L, Liu R, et al. An exploratory study on the pathways of Cr(Ⅵ) reduction in sulfate-reducing up-flow anaerobic sludge bed (UASB) reactor[J]. Scientific Reports, 2016, 6: 23694. DOI:10.1038/srep23694 |
| [22] |
郑刘斌. 氧化铝颗粒增强铝基复合材料研究[D]. 北京: 北方工业大学, 2013. ZHENG LIU-bin. Study on the Al2O3 particles reinforced aluminum matrix composites[D]. Beijing: North China University of Technology, 2013. |
| [23] |
荣兴民, 黄巧云, 陈雯莉, 等. 土壤矿物与微生物相互作用的机理及其环境效应[J]. 生态学报, 2006, 28(1): 376-387. RONG Xingmin, HUANG Qiao-yun, CHEN Wen-li, et al. Interaction mechanisms of soil minerals with microorganisms and their environmental significance[J]. Acta Ecologica Sinica, 2006, 28(1): 376-387. |
| [24] |
Bhattacharya A K, Naiya T K, Mandal S N, et al. Adsorption, kinetics and equilibrium studies on removal of Cr(Ⅵ) from aqueous solutions using different low-cost adsorbents[J]. Chemical Engineering Journal, 2008, 137(3): 529-541. |
| [25] |
孙志勇, 成文, 方战强. 纳米氧化铝吸附溶液中Cr(Ⅵ) 的研究[J]. 华南师范大学学报(自然科学版), 2014, 46(2): 79-85. SUN Zhiyong, CHENG Wen, FANG Zhan-qiang. Adsorption of hexavalent chromium by nano-alumina particles[J]. Journal of South China Normal University (Natural Science Edition), 2014, 46(2): 79-85. |
| [26] |
李丽, 汤勇铮, 蒋园园, 等. 烟酰胺腺嘌呤二核苷酸在纳米α-氧化铝上的吸附作用[J]. 应用化学, 2012, 29(5): 551-556. LI Li, TANG Yong-zheng, JIANG Yuan-yuan, et al. Adsorption behavior of nicotinamide adenine dinucleotide on α-aluminum oxide nanoparticles[J]. Chinese Journal of Applied Chemistry, 2012, 29(5): 551-556. |
| [27] |
Sharma Y C, Srivastava V. Comparative studies of removal of Cr(Ⅵ) and Ni(Ⅱ) from aqueous solutions by magnetic nanoparticles[J]. Journal of Chemical & Engineering Data, 2010, 56(4): 819-825. |
 2021, Vol. 40
2021, Vol. 40



