2. 天津市农业资源与环境研究所, 天津 300384
2. Tianjin Institute of Agriculture Resource and Environment, Tianjin 300384, China
生物炭是由动植物残体在完全或部分缺氧的条件下经热解炭化产生的一类高度芳香化难溶性高聚产物[1]。近年来,生物炭作为一种多功能土壤添加剂迅速成为研究焦点,论文数量呈指数型上升[2]。已有研究表明,生物炭的生产不仅为生物质资源化提供了一条新途径,还有利于碳的增汇减排,并减少其他温室气体的排放。生物炭还可以改善土壤肥力及农田微生态,促进农作物增产,极大提高农业生产的可持续性[3-5]。因此,生物炭作为可能对人类社会可持续发展路径产生深远影响的重大技术,迅速成为国际研究热点。
生物炭颗粒具有高芳香性、多孔性和高比表面积等特征,且其表面含有丰富的羟基、酚羟基和羰基等极性活性官能团,这决定着其对各类污染物都有着极强的吸附固定能力[6-8]。早先认为生物炭具有较强的稳定性,在自然环境中的半衰期大约为102~107 a[9]。但是,最近越来越多的研究表明,生物炭在一定程度上能被生物或非生物过程氧化或降解[10-11],这不但影响生物炭的表面极性,还造成其比表面积的变化,而这样的过程无疑对生物炭的环境功效产生影响。另外,生物炭与土壤组分及环境过程之间还会发生相互作用,土壤有机质、矿物、微生物、根系分泌物以及氧化、冻融、紫外线照射等都会使生物炭发生一系列物理化学反应,包括吸附和氧化还原反应,从而改变生物炭颗粒的理化性质,如表面含氧官能团增多、孔堵塞等[12-14]。例如,冻融交替一段时间后,生物炭的碳含量逐渐增加,比表面积受到破碎发生粒径变小或者孔结构破碎现象;不同制备温度生物炭在土壤中灭菌培养1 a,高温生物炭的表面极性增加,内部吸附点位可及性降低;而低温生物炭的阳离子交换量增加[15]。本课题组研究发现,植物根系分泌的有机小分子可通过孔堵塞作用降低高温生物炭的孔体积,而提高低温生物炭的表面极性[16]。以上这些变化势必引起生物炭对有机污染物吸附能力与吸附机理的变化,从而影响生物炭对土壤体系中无机或有机污染物的固定作用。Zhang等[17]研究了生物炭改良土壤对邻苯二甲酸二乙酯(Diethyl phthalate,DEP)的吸附,发现对于低有机质含量土壤,添加生物炭使土壤体系对目标物的吸附增加,而且生物炭在土壤中老化后吸附能力并没有降低;但对于高有机质含量的土壤,生物炭老化后,对目标物的吸附能力明显降低,作者将其归因于高有机质含量土壤中溶解性有机物对生物炭微孔的堵塞作用。然而,由于土壤系统复杂多变,土壤对生物炭的老化作用过程复杂,是土壤中多组分多因素多过程综合作用的结果。但目前,对于生物炭老化进程中不同土壤环境过程的作用及差异尚缺乏研究,更无法正确理解不同土壤环境下老化生物炭与污染物之间的相互作用。
邻苯二甲酸酯(Phthalic acid esters,PAEs)是一类被广泛用来生产聚氯乙烯薄膜、包装材料和医疗用品的增塑剂。随着含PAEs塑料制品的大量使用,大气、水体以及土壤不同程度地受到污染,尤其是农业土壤系统。由于PAEs的生殖毒性和致癌性,我国已将邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)、邻苯二甲酸二丁酯(Dibutyl phthalate,DBP)以及邻苯二甲酸二正辛酯(Dioctyl phthalate,DOP)列为环境优先污染物[18]。进入21世纪后,随着我国土壤中PAEs污染问题日益严重,关于PAEs污染问题的研究引起了广泛的关注,也获得了大量关于生物炭纯品吸附PAEs的研究成果。但是,生物炭加入受污染土壤后,作为一个新的界面,在与土壤接触过程中受物理、化学、生物作用而发生多种老化过程,这些过程交错纵横,其对生物炭的结构和理化性质及对PAEs吸附能力的影响尚待研究。
为明确长时间自然环境条件作用(降雨、灌溉、酸雨、氧化、作物生长等)对生物炭的老化及吸附性能的影响,本研究选取不同温度(300、500 ℃和700 ℃)制备的水稻秸秆初级生物炭和经水洗、强酸、H2O2和植物根系分泌物等老化处理的生物炭,并以DEP和DBP两种典型PAEs作为目标污染物来模拟农田常见土壤环境过程对生物炭理化性质和吸附PAEs的影响,探讨生物炭应用的长期环境效应,以期为生物炭技术治理农田PAEs土壤污染提供科学依据。
1 材料与方法 1.1 PAEs和初级生物炭的制备PAEs:分别准确称取50 mg DEP和DBP标准品于100 mL容量瓶中,用甲醇定容至100 mL,配制成5 g·L-1的储备液,于4 ℃冰箱中保存备用。
初级生物炭的制备:将水稻秸秆自然晾干后粉碎至0.5 cm以下,放入坩埚中压实,加盖后置于马弗炉(SX2-2.5-12,天津市中环实验电炉有限公司,中国)中,以5 ℃ · min-1的升温速率升至目标温度(300、500 ℃和700 ℃),并保持4 h。加热结束后自然冷却至室温,取出并研磨粉碎后过80目筛,获得初级生物炭。将300、500 ℃和700 ℃下制备的初级生物炭分别标记为B300、B500和B700。
1.2 老化生物炭的制备 1.2.1 强酸和水洗老化生物炭取2 g初级生物炭,加入40 mL 1 mol·L-1 HCl∶HF(V∶V=1∶1)酸溶液中,充分混合后放置在摇床(180 r· min-1、25 ℃)中振荡,24 h后取出,离心(4 000 r·min-1)5 min,去上清液,将剩余生物炭重复以上步骤4次(剩余生物炭质量基本维持不变)。以上处理后获得的生物炭用去离子水多次清洗,以去除残余的酸和盐,直至pH值接近中性。获得的生物炭冷冻干燥后,放入广口瓶,置于干燥器中避光保存,并将其分别标记为AB300、AB500、AB700。以去离子水代替酸溶液,获得水洗老化样品分别标记为WB300、WB500、WB700。
1.2.2 H2O2氧化生物炭取2 g初级生物炭,加入40 mL 5 mol·L-1 H2O2溶液,充分混合后,放置在摇床(180 r·min-1、25 ℃)中振荡,24 h后取出,离心(4 000 r·min-1)5 min,去上清液,将剩余生物炭重复以上步骤4次。以上处理后获得的生物炭用去离子水多次清洗,以去除残余的H2O2。获得的生物炭冷冻干燥后,放入广口瓶,置于干燥器中避光保存,并将其分别标记为HB300、HB500、HB700。
1.2.3 小麦根系分泌物老化生物炭本研究中小麦根系分泌物的收集方法参照本课题组前期开发的方法进行[19]。具体步骤为:将Hoagland营养液中培养30 d后的小麦幼苗置于蒸馏水中开始收集根系分泌物。收集根系分泌物的时间为晚上19:00至次日早上9:00,温度为20 ℃,避光收集,其余时间将小麦重新置于Hoagland营养液中继续培养。将收集的小麦根系分泌物溶液利用NaN3灭菌沉淀,过0.45 µm滤膜,置于4 ℃冰箱中备用。取2 g初级生物炭,加入40 mL 5 mg C·L-1小麦根系分泌物的溶液,充分混合后,放置在摇床中(180 r·min-1、25 ℃)振荡,24 h后取出,离心(4 000 r·min-1)5 min,去上清液,将剩余生物炭重复上述步骤4次。获得的生物炭冷冻干燥后,放入广口瓶,置于干燥器中避光保存,并分别标记为RB300、RB500、RB700。
1.3 生物炭的表征初级及老化生物炭样品采用全自动元素分析仪(EA3000,利曼,意大利)测定其碳、氮、硫和氢等元素的相对比例。通过灼烧质量损失法测定生物炭有机组分和无机组分的比例。氧元素的相对比例通过样品总质量减去元素碳、氢、氮比例和无机组分比例计算得到。采用傅里叶变换红外光谱仪(Perkin Elmer 1725 X,美国)分析样品的官能团组成。采用多站扩展式比表面积快速分析仪(ASAP2460,麦克仪器,美国)测定样品的比表面积及孔结构。
1.4 吸附实验吸附实验采用批处理恒温振荡法。准确称取5~ 50 mg生物炭样品置于40 mL棕色玻璃平底瓶中,加入40 mL 5 mmol·L-1的CaCl2背景溶液,充分混合后,放入摇床(180 r·min-1、25±1 ℃)中避光振荡6 h。取出样品,加入适量1 mol·L-1盐酸或1 mol·L-1 NaOH溶液,调节pH值至7.0。加入1~20 mg·kg-1的DEP或DBP储备液,控制甲醇的含量在0.15% 以下,避免共溶剂效应。充分混合后,放入摇床(180 r·min-1、25± 1 ℃)中避光振荡24 h。取1.5 mL上清液经高速离心(15 000 r·min-1)5 min后,待液相色谱法分析。目标物在整个实验过程中因瓶壁吸附、水解、光解等损失小于10%。
1.5 样品分析与数据处理液相中DEP和DBP浓度通过高效液相色谱仪(Agilent 1200,美国)进行测定,测定方法为:色谱柱为venusil XBP C18(A)(4.6 mm ×150 mm×5 μm,120 Å),流动相为乙腈∶水=60∶40(V∶V),流速为1 mL·min-1,检测器为紫外检测器(检测波长225 nm)。使用目标物的标准储备液,配制系列浓度的标样,外标法定量。固相中PAEs的含量通过初始含量与水相中含量差计算。
采用Freundlich模型对PAEs的等温吸附数据进行拟合:Qe=Kf∙Cen,PAEs的吸附分配系数Kd值计算公式如下:

|
式中:Qe为PAEs在固相中达到吸附平衡时的浓度,mg·kg-1;Ce为PAEs在水相中达到吸附平衡时的浓度,mg·L-1;Kf为吸附系数,表示生物炭对PAEs吸附能力的强弱,mg·kg-1·(mg·L-1)-n;n为吸附等温线非线性指数,n值越接近1,表示吸附等温线线性程度越强;Kd为吸附分配系数,利用Ce分别为0.5 mg·L-1时的Kd值比较不同生物炭的吸附能力。数据的差异显著性采用单因素方差分析法进行。
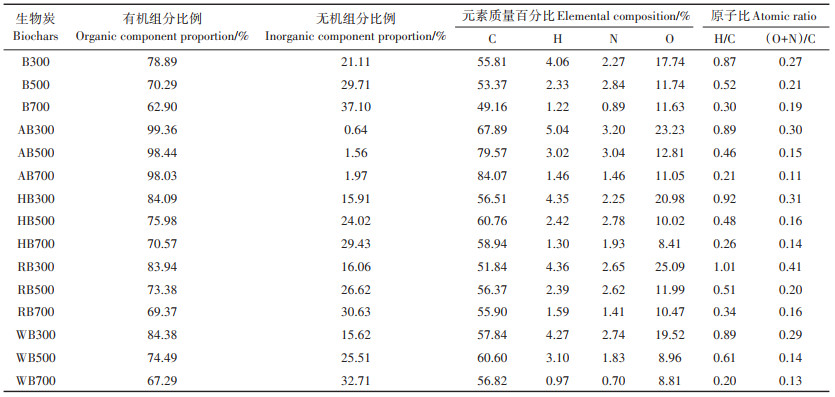
2 结果与讨论 2.1 表征分析 2.1.1 元素分析通过元素分析发现(表 1),随着热解温度升高,初级生物炭的无机组分比例升高,碳、氢、氮和有机组分比例均下降,极性[(O+N)/C]下降,非极性(H/C)上升。这可能是由于随着热解温度的升高,原生物质水稻秸秆中的氮、氧和氢等元素随着小分子物质的挥发而被消耗掉,无定形碳逐步转化为芳香碳,芳香性(H/ C)逐步提高,极性[(O+N)/C]逐渐下降,而有机组分、氧和氢等元素比例均降低,无机矿物质和无机氧化物等不挥发性物质残留在生物炭表面,导致生物炭的无机组分比例增加[7]。
|
|
表 1 初级及老化生物炭的元素组成 Table 1 Elemental composition of original and aged biochars |
经强酸、H2O2、植物根系分泌物以及水等老化处理的生物炭中无机组分比例下降,有机组分比例提高,且老化处理所引起的生物炭性质变化的程度为强酸>H2O2≈植物根系分泌物≈水洗。尤其,经强酸老化处理后的AB300、AB500和AB700中的无机组分比例分别从21.11%、29.71% 和37.10% 减小至0.64%、1.56% 和1.97%,使有机组分及碳在强酸老化生物炭中占主要成分。生物炭的元素组成也因不同的老化处理方式而发生变化。不同老化处理后均显著提高了高温生物炭(700 ℃)的碳元素比例,但对低温生物炭(300 ℃)却产生了不同影响:H2O2和去离子水处理未显著提高碳元素比例,而植物根系分泌物反而降低了碳元素比例。这主要是高低温生物炭中可溶性无机组分和有机组分含量差异造成的[20-21]。在不同老化处理组中,生物炭中氧元素比例的差异显著,这主要受生物炭有机组分、无机组分以及植物根系分泌物中氧元素比例的影响。例如,植物根系分泌物老化处理生物炭过程中,部分无机组分和有机组分脱离生物炭溶于水,暴露出生物炭表面的部分吸附位点以及被无机组分和溶解性有机组分堵塞的孔道,植物根系分泌物被生物炭表面吸附,造成生物炭元素组成的变化。相比于水洗处理,植物根系分泌物包含低分子量有机酸(如乙酸、丁酸、苹果酸等)、糖类和氨基酸等物质,含氧比例高、含氧官能团丰富,显著提高了老化生物炭中的氧元素比例[22-24]。而且,老化处理对不同温度制备生物炭的芳香化程度和极性影响不同。强酸、H2O2、植物根系分泌物以及水等老化处理均提高了低温生物炭(300 ℃)的极性,却降低了中高温生物炭(500 ℃和700 ℃)的极性,而生物炭芳香性呈现出相反的结果。
已有研究表明,生物炭在自然或人为的生物和非生物老化过程中碳元素比例均表现出下降的趋势,而氧元素比例呈现出增加的趋势[25-27]。然而,本研究中的酸洗、H2O2氧化和水流作用等非生物老化过程均降低了无机组分比例,导致了氧元素比例提高,但碳元素比例均未表现出下降的趋势。这可能是由于生物炭中的一些溶解性成分通过水流及酸和氧化作用被去除掉[28]。此外,生物炭含有较多的无机组分,在一定程度上掩盖了生物炭元素组成的变化程度[7]。
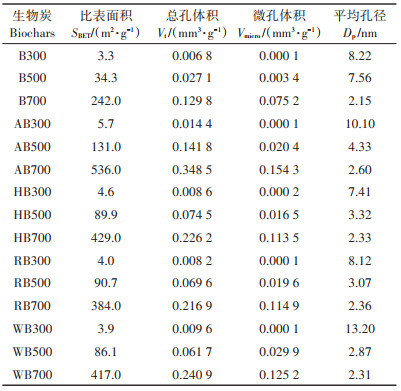
2.1.2 比表面积初级和老化生物炭的比表面积和孔结构如表 2所示。随着热解温度的升高,比表面积、总孔体积和介孔(2 nm < d < 5 nm)体积均显著增大,而平均孔径减小。这是由于随着热解温度的升高,生物质内生物高聚物开始发生解聚和脱氢反应,不稳定易挥发组分逐渐消失,不稳定碳结构逐渐向片状晶体结构转变,形成介孔和微孔,增大了生物炭的比表面积[21, 29]。这也是B700比表面积远大于B300的主要原因。经过不同老化方式处理后,不同热解温度所制备生物炭的比表面积、孔体积和介孔体积均显著提高,且酸老化效果更显著。这与本课题组前期关于除灰生物炭的研究结果是一致的[7, 30]。老化处理后,溶于水的无机和有机组分从生物炭表面被剥离,生物炭表面被阻塞的孔重新暴露出来,微孔和介孔的增加造成了比表面积的增加,而强酸、H2O2以及植物根系分泌物中的小分子酸能够强化无机组分的剥离,进一步提高比表面积。以上结果揭示了新鲜生物炭的比表面积在酸性、氧化态和根系分泌物存在的土壤环境条件下的变化规律,同时,也暗示着生物炭在农田土壤生态系统中会与土壤各环境过程发生充分的相互作用,如:表面发生氧化反应、在水流作用下释放可溶性无机和有机组分、吸附土壤溶解性有机质等,这些均能造成生物炭性质的改变。这也合理解释了本课题组之前的研究发现,生物炭与水稻土、红土之间的老化作用强度显著高于东北黑土和生物炭间的老化作用强度[31]。
|
|
表 2 初级和老化生物炭的比表面积及孔结构 Table 2 Special surface area and porosity of original and aged biochars |
初级和老化生物炭的红外光谱信息如图 1所示。生物炭上基团的伸缩振动与其他碳类物质的类似,一般以3 300~3 800 cm-1为O—H的伸缩振动,烷基C— H的伸缩振动为2 855~2 960 cm-1,N—H的伸缩振动为3 200~3 400 cm-1,C=O(酯、醛、酮、酸等)和C=C(芳香烃等)的伸缩振动为1 630~1 760 cm-1,1 410 cm-1处的峰与羧基有关[32]。热解温度不同,所制得的生物炭(B300、B500和B700)红外谱不同。随着温度升高,脂肪烃(2 855~2 960 cm-1处)、N—H(3 200~ 3 400 cm-1处)和O—H(3 300~3 800 cm-1处)峰强度均减弱。这是因为在热解过程中,随着热解温度的升高,原材料生物质中的烷基碳逐渐被芳香化,而氧、氮等元素以H2O、CH4、CO、CO2、NO等挥发性有机物形式脱离体系,当温度达到500 ℃以上时,无定形碳逐步转化为片状晶体结构碳[33]。

|
图 1 初级和老化生物炭样品的红外光谱图 Figure 1 FTIR spectra of original and aged biochars |
经过不同老化方式处理后,不同热解温度所制备生物炭的特征峰强度发生不同变化,其中,强酸、H2O2、植物根系分泌物等老化处理后的生物炭特征峰变化更为显著。生物炭由不稳定碳、稳定碳和无机组分组成,且三者的主要成分受热解温度和原材料的影响较大。不稳定碳和无机组分易被水或酸溶液从生物炭中淋溶出来,从而改变生物炭的理化性质和吸附性能[22]。在本研究中,经强酸老化处理后,低、高温生物炭(300 ℃和700 ℃)的O—H峰强度增加,而低、中温生物炭的C—O—C和—COO-的峰强度减弱或消失,高温生物炭的—COO-的峰强度增强。这是由于低、中温生物炭表面吸附有大量的酚类、羧酸类小分子有机物[34],而高温生物炭表面则由高比例的无机组分组成,当经强酸老化处理后,生物炭中部分极不稳定的有机和无机组分被酸去除,稳定碳组分及其表面的含氧官能团被暴露出来。而不同温度所形成稳定碳组分的差异成为影响强酸老化结果的主要因素。H2O2老化处理显著提高了3类生物炭C=O和O—H等峰的强度,这表明H2O2对生物炭表面起到了氧化作用。而植物根系分泌物老化处理显著提高了3类生物炭O—H、C=O、C—O—C等峰的强度,尤其是高温生物炭变化最为显著。植物根系分泌物的成分以小分子酸为主,在与生物炭共老化过程中,不仅可以去除生物炭中的无机组分,还能与生物炭发生吸附作用,进而改变生物炭表面的物质组成和官能团性质。
2.2 不同老化方式生物炭对PAEs的吸附初级和老化生物炭对DEP和DBP的吸附结果见表 3。初级生物炭对DEP和DBP的吸附等温线均符合Freundlich方程(R2>0.970),且随着热解温度的升高,吸附的非线性程度增强,吸附量逐渐增大。Chen等[35]认为生物炭对芳香性有机污染物的吸附机制随着生物炭的热解温度而发生变化,芳香性有机污染物在低温制备的生物炭上主要表现为分配作用,而在中高温制备的生物炭上主要表现为吸附作用。本研究中,DEP和DBP在B300上的吸附等温线n值分别为0.680和0.630,非线性较弱,说明PAEs在B300上分配作用为主要吸附机理;而PAEs在中高温生物炭上的吸附等温线较在B300上非线性强,表明PAEs在B700上的吸附是分配作用和表面吸附综合作用的结果。这是由于高温生物炭芳香度高、极性低,比低温生物炭具有更大的比表面积与更为丰富的孔结构,增强了其对PAEs的吸附能力。
|
|
表 3 初级和老化生物炭对DEP和DBP吸附的Freundlich模型拟合参数 Table 3 Freundlich isotherm parameters for the sorption of DEP and DBP by original and aged biochars |
经过强酸和H2O2老化处理后,生物炭对DEP和DBP吸附能力显著增强,lgKf值增加(表 3)。这是因为生物炭表面部分无机和溶解性有机组分被去除,有机表面和更多的孔暴露出来,增加生物炭对DEP和DBP的吸附位点。根系分泌物老化处理显著提高了低温生物炭对DEP和DBP的吸附,但对高温生物炭吸附DEP却无显著影响。除根系分泌物溶液对生物炭表面无机组分的去除作用外,根系分泌物会占据生物炭表面的吸附位点,进而影响DEP和DBP的吸附,这两者贡献度的大小直接决定着老化生物炭对污染物的最终吸附结果。在本研究中,由于高温生物炭对DEP的吸附能力相对较弱,进而未表现出去除无机组分后吸附增强的现象。
为了衡量生物炭有机部分的吸附容量,本研究对单点吸附分配系数(KOC=Kd/有机组分含量)进行有机组分标化。在0.5 mg·L-1的浓度水平下,低、中、高温生物炭的KOC均表现为DBP>DEP,这说明3种生物炭含有的有机组分对DBP的吸附能力更强。经强酸、H2O2以及植物根系分泌物老化后,低、中、高温生物炭的KOC表现出不同程度的增加,低温生物炭的KOC表现为植物根系分泌物≈水洗>H2O2>强酸,而高温生物炭的KOC表现为强酸>H2O2>植物根系分泌物≈水洗。老化处理后的KOC增加,表明生物炭表面溶解有机或无机组分的去除释放了一部分有机吸附位点,增加了吸附位点的可及性。但不同老化方式对KOC造成的差异可能是低、中、高温生物炭中无机和溶解性有机组分比例以及对PAEs相对吸附能力的差异引起的[27]。
疏水性分配作用在疏水性有机物吸附过程中发挥着重要作用,而对于PAEs等亲水性有机物,静电作用、氢键、孔填充作用和π-π电子供体-受体作用等特殊作用力都有可能发挥重要作用。已有研究表明,生物炭对PAEs的吸附机理主要包括:疏水性分配作用、孔填充作用、氢键和π-π电子供体-受体作用等[36]。在本研究中,对于同种生物炭,DBP的lgKf值比DEP的大,这是由于DBP具有更强的疏水性(lgKOW,DEP= 2.54;lgKOW,DBP=4.27)。lgKOC/lgOWK值也能够反映出疏水性分配作用和其他作用力的相对贡献[36]。较高的lgKOC/lgKOW值代表着其他作用力的高贡献率[37]。在本研究中,随着生物炭热解温度的升高,DBP和DEP的lgKOC/lgKOW值呈上升趋势,这表明其他特殊作用力在高温生物炭的吸附中所占比例更高[36, 38]。PAEs与B300上极性官能团之间形成的氢键作用等特殊作用力是PAEs在B300上吸附等温线呈现出较弱非线性的原因;由于B700具有较高的芳香性和丰富的孔隙结构[39],孔填充作用和π-π电子受体和供体作用成为了PAEs在高温生物炭上的主要吸附作用力。强酸、H2O2以及植物根系分泌物处理会引起KOC值的改变,并且lgKOC/lgKOW值表现出了与KOC值相同的变化规律,这进一步证明了生物炭中的无机和溶解性有机组分的存在对其吸附PAEs具有重要影响,且影响程度与PAEs在生物炭上的吸附机理有关。如上文所讨论,PAEs在高温生物炭上的吸附是分配作用和表面吸附及孔填充综合作用的结果。由于高温生物炭具有较高的芳香性和丰富的孔隙结构,孔填充作用、π- π电子受体和供体以及氢键作用成为了PAEs在高温生物炭上的主要吸附作用力。高温生物炭在老化过程中其表面吸附位点和孔隙结构被暴露出来,导致高温生物炭对PAEs的吸附能力增强。但对于强酸、H2O2、植物根系分泌物等不同老化方式,强酸老化对高温生物炭的无机组分去除更彻底,比表面积和活性位点相对增加量更高,因此强酸老化生物炭表现出对PAEs更高的吸附能力。而对于主要依靠分配作用和氢键吸附PAEs的低温生物炭来说,无机和溶解性有机组分对PAEs相似的吸附机制和吸附能力,是老化后低温生物炭对PAEs吸附能力上升或下降主要原因。
3 结论(1)热解温度的升高促进生物炭孔结构的发育,提高其比表面积,但与此同时,也会引起无机组分的比例增加,导致部分孔隙被阻塞,进而使得老化处理后生物炭比表面积的变化程度不同。
(2)经强酸、H2O2、植物根系分泌物以及水洗等老化处理的生物炭中无机组分比例下降,有机组分比例上升,比表面积、微孔和介孔体积均增大,且老化处理所引起的生物炭性质变化的程度为强酸>H2O2≈植物根系分泌物>水洗。
(3)初级和老化生物炭对DEP和DBP的等温吸附线均符合Freundlich模型,且对DBP的吸附能力均强于DEP。
(4)老化处理显著提高了中高温生物炭对PAEs的吸附,且强酸的老化效果强于H2O2、植物根系分泌物及水洗等处理,这是由于中高温生物炭中高比例无机组分的去除释放了一部分有机吸附位点和被堵塞的孔道,增加了PAEs吸附位点的可及性。
| [1] |
Marris E. Putting the carbon back: Black is the new green[J]. Nature, 2006, 442: 624-626. DOI:10.1038/442624a |
| [2] |
Premarathna K S D, Rajapaksha A U, Sarkar B, et al. Biochar-based engineered composites for sorptive decontamination of water: A review[J]. Chemical Engineering Journal, 2019, 372: 536-550. DOI:10.1016/j.cej.2019.04.097 |
| [3] |
Homagain K, Shahi C, Luckai N, et al. Biochar-based bioenergy and its environmental impact in Northwestern Ontario Canada: A review[J]. Journal of Forest Research, 2014, 25(4): 737-748. DOI:10.1007/s11676-014-0522-6 |
| [4] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota: A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [5] |
Marc B A M, Christoph F. Biochar: Bring on the sewage[J]. Nature, 2015, 518(7540): 483. |
| [6] |
Yavari S, Malakahmad A, Sapari N B. Biochar efficiency in pesticides sorption as a function of production variables: A review[J]. Environmental Science and Pollution Research International, 2015, 22(18): 13824-13841. DOI:10.1007/s11356-015-5114-2 |
| [7] |
Zhang P, Sun H, Ren C, et al. Sorption mechanisms of neonicotinoids on biochars and the impact of deashing treatments on biochar structure and neonicotinoids sorption[J]. Environmental Pollution, 2018, 234: 812-820. DOI:10.1016/j.envpol.2017.12.013 |
| [8] |
Xiang Y, Xu Z, Wei Y, et al. Carbon-based materials as adsorbent for antibiotics removal: Mechanisms and influencing factors[J]. Journal of Environmental Management, 2019, 237: 128-138. |
| [9] |
Zimmerman A R. Abiotic and microbial oxidation of laboratory-produced black carbon(biochar)[J]. Environmental Science and Technology, 2010, 44: 1295-1301. DOI:10.1021/es903140c |
| [10] |
Singh B P, Cowie A L, Smernik R J. Biochar carbon stability in a clayey soil as a function of feedstock and pyrolysis temperature[J]. Environmental Science and Technology, 2012, 46(21): 11770-11778. DOI:10.1021/es302545b |
| [11] |
Santos F, Torn M S, Bird J A. Biological degradation of pyrogenic organic matter in temperate forest soils[J]. Soil Biology and Biochemistry, 2012, 51: 115-124. DOI:10.1016/j.soilbio.2012.04.005 |
| [12] |
Qiu Y, Xiao X, Cheng H, et al. Influence of environmental factors on pesticide adsorption by black carbon pH and model dissolved organic matter[J]. Environmental Science and Technology, 2009, 43: 4973-4978. DOI:10.1021/es900573d |
| [13] |
Li J, Li S, Dong H, et al. Role of alumina and montmorillonite in changing the sorption of herbicides to biochars[J]. Journal of Agricultural and Food Chemistry, 2015, 63(24): 5740-5746. DOI:10.1021/acs.jafc.5b01654 |
| [14] |
Xu N, Zhang B, Tan G, et al. Influence of biochar on sorption, leaching and dissipation of bisphenol A and 17alpha-ethynylestradiol in soil[J]. Environmental Science: Processes & Impacts, 2015, 17(10): 1722-1730. |
| [15] |
Shi K, Xie Y, Qiu Y. Natural oxidation of a temperature series of biochars: Opposite effect on the sorption of aromatic cationic herbicides[J]. Ecotoxicology and Environmental Safety, 2015, 114: 102-108. DOI:10.1016/j.ecoenv.2015.01.015 |
| [16] |
Ren X, Sun H, Wang F, et al. The changes in biochar properties and sorption capacities after being cultured with wheat for 3 months[J]. Chemosphere, 2016, 144: 2257-2263. DOI:10.1016/j.chemosphere.2015.10.132 |
| [17] |
Zhang X, Sarmah A K, Bolan N S, et al. Effect of aging process on adsorption of diethyl phthalate in soils amended with bamboo biochar[J]. Chemosphere, 2016, 142: 28-34. DOI:10.1016/j.chemosphere.2015.05.037 |
| [18] |
Silva M J, Barr D B, Reidy J A, et al. Urinary levels of seven phthalate metabolites in the US population from the National Health and Nutrition Examination Survey(NHANES) 1999-2000[J]. Environmental Health Perspectives, 2004, 112(3): 331-338. DOI:10.1289/ehp.6723 |
| [19] |
Ren X H, Wang F, Cao F X, et al. Desorption of atrazine in biocharamended soils: Effects of root exudates and the aging interactions between biochar and soil[J]. Chemosphere, 2018, 212: 687-693. DOI:10.1016/j.chemosphere.2018.08.124 |
| [20] |
Ren X H, Wang F, Zhang P, et al. Aging effect of minerals on biochar properties and sorption capacities for atrazine and phenanthrene[J]. Chemosphere, 2018, 206: 51-58. DOI:10.1016/j.chemosphere.2018.04.125 |
| [21] |
Xiao X, Chen B, Zhu L. Transformation, morphology, and dissolution of silicon and carbon in rice straw-derived biochars under different pyrolytic temperatures[J]. Environmental Science & Technology, 2014, 48: 3411-3419. |
| [22] |
Ling W T, Ren L L, Gao Y Z, et al. Impact of low-molecular-weight organic acids on the availability of phenanthrene and pyrene in soil[J]. Soil Biology and Biochemistry, 2009, 41(10): 2187-2195. DOI:10.1016/j.soilbio.2009.08.003 |
| [23] |
Toyama T, Furukawa T, Maeda N, et al. Accelerated biodegradation of pyrene and benzo[J]. Water Research, 2011, 45(4): 1629-1638. DOI:10.1016/j.watres.2010.11.044 |
| [24] |
Lefevre G H, Hozalski R M, Novak P J. Root exudate enhanced contaminant desorption: An abiotic contribution to the rhizosphere effect[J]. Environmental Science & Technology, 2013, 47(20): 11545-11553. |
| [25] |
Hale S E, Hanley K, Lehmann J, et al. Effects of chemical, biological, and physical aging as well as soil addition on the sorption of pyrene to activated carbon and biochar[J]. Environmental Science & Technology, 2011, 45(24): 10445-10453. |
| [26] |
Keith A, Singh B, Singh B P. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil[J]. Environmental Science & Technology, 2011, 45(22): 9611-9618. |
| [27] |
Santos F, Torn M S, Bird J A. Biological degradation of pyrogenic organic matter in temperate forest soils[J]. Soil Biology and Biochemistry, 2012, 51: 115-124. DOI:10.1016/j.soilbio.2012.04.005 |
| [28] |
Zhang P, Huang P, Xu X, et al. Spectroscopic and molecular characterization of biochar-derived dissolved organic matter and the associations with soil microbial responses[J]. Science of the Total Environment, 2020, 708: 134619. DOI:10.1016/j.scitotenv.2019.134619 |
| [29] |
Lattao C, Cao X, Mao J, et al. Influence of molecular structure and adsorbent properties on sorption of organic compounds to a temperature series of wood chars[J]. Environmental Science & Technology, 2014, 48: 4790-4798. |
| [30] |
Zhang P, Sun H, Yu L, et al. Adsorption and catalytic hydrolysis of carbaryl and atrazine on pig manure-derived biochars: Impact of structural properties of biochars[J]. Journal of Hazardous Materials, 2013, 244-245: 217-224. DOI:10.1016/j.jhazmat.2012.11.046 |
| [31] |
Zhang P, Min L J, Tang J C, et al. Sorption and degradation of imidacloprid and clothianidin in Chinese paddy soil and red soil amended with biochars[J]. Biochar, 2020, 2: 329-341. DOI:10.1007/s42773-020-00060-4 |
| [32] |
Qu X, Fu H, Mao J, et al. Chemical and structural properties of dissolved black carbon released from biochars[J]. Carbon, 2016, 96: 759-767. DOI:10.1016/j.carbon.2015.09.106 |
| [33] |
Kim K H, Kim J Y, Cho T S, et al. Influence of pyrolysis temperature on physicochemical properties of biochar obtained from the fast pyrolysis of pitch pine(Pinus rigida)[J]. Bioresource Technology, 2012, 118: 158-162. DOI:10.1016/j.biortech.2012.04.094 |
| [34] |
Zhang P, Liu A J, Huang P, et al. Sorption and molecular fractionation of biochar-derived dissolved organic matter on ferrihydrite[J]. Journal of Hazardous Materials, 2020, 392: 122260. DOI:10.1016/j.jhazmat.2020.122260 |
| [35] |
Chen B L, Yuan M X. Enhanced sorption of polycyclic aromatic hydrocarbons by soil amended with biochar[J]. Journal of Soils and Sediments, 2011, 11(1): 62-71. DOI:10.1007/s11368-010-0266-7 |
| [36] |
Sun K, Jin J, Keiluweit M, et al. Polar and aliphatic domains regulate sorption of phthalic acid esters(PAEs) to biochars[J]. Bioresource Technology, 2012, 118: 120-127. DOI:10.1016/j.biortech.2012.05.008 |
| [37] |
Xiao F, Pignatello J J. π+-π interactions between(hetero) aromatic amine cations and the graphitic surfaces of pyrogenic carbonaceous materials[J]. Environmental Science & Technology, 2015, 49(2): 906-914. |
| [38] |
Wand X, Guo X, Yand Y, et al. Sorption mechanisms of phenanthrene, lindane, and atrazine with various humic acid fractions from a single soil sample[J]. Environmental Science & Technology, 2011, 45: 2124-2130. |
| [39] |
Kah M, Sigmund G, Xiao F, et al. Sorption of ionizable and ionic organic compounds to biochar, activated carbon and other carbonaceous materials[J]. Water Research, 2017, 124: 673-692. DOI:10.1016/j.watres.2017.07.070 |
 2021, Vol. 40
2021, Vol. 40