2. 南京信息工程大学应用气象学院, 南京 210044
2. School of Applied Meteorology, Nanjing University of Information Science & Technology, Nanjing 210044, China
土壤氮素转化过程控制着土壤中可利用氮数量的多少[1],对于植物生长、微生物活性、土壤养分的生物地球化学循环以及氮素的损失具有重要影响[2-3]。因此,研究土壤氮转化过程对于农田土壤养分管理、提高氮肥利用率以及生态环境保护具有多重意义。对土壤氮素转化规律的研究包括净氮转化速率和氮初级转化速率[4],净氮转化速率是控制其转化的各个氮初级转化速率的综合结果[5-6]。因此,研究土壤氮初级转化速率可以从过程水平上深入认识控制土壤中无机氮含量和形态的各个氮转化过程的初始速率[7]。
参与土壤氮循环过程的微生物活性受很多因素影响,其中温度是一个重要的影响因子。温度变化可能对土壤酶活性、微生物的群体结构、活性和数量产生影响,进而影响土壤中的氮素转化过程[8-10]。但氮初级转化过程对温度变化的响应非常复杂,很难用特定的数学方程来描述两者变化的关系[11],因为温度对氮初级转化速率的影响取决于土壤类型、气候条件等多重因素[11-12]。一般来说,土壤微生物的存活存在最适温度,低于或者高于最适温度,微生物的活性会受到明显抑制。前人研究表明[13],在5~45 ℃范围内温带草地土壤的氮初级矿化速率随温度增加显著增加。但也有研究指出,温度增加对亚热带和温带地区的林地土壤和草地土壤氮初级矿化速率没有影响(10~ 15 ℃)[14]或仅有小幅度增加(25~35 ℃)[12]。氮固定过程对温度变化的响应比矿化过程敏感,Andersen等[15]报道,在3~15 ℃范围内温带草地土壤氮初级固定速率随温度增加而增加,但氮初级矿化速率对温度变化不敏感。Lang等[14]也发现,温带林地土壤氮初级固定速率对温度增加(10~15 ℃)的响应比氮初级矿化速率更敏感。相对于氮矿化,硝化对温度变化也较为敏感,因为参与氮素矿化的微生物种类很多,适应的温度范围较宽[16],而硝化作用是在特定的微生物种群——氨氧化细菌的作用下进行的[17],所以对温度变化的响应较大[18]。但是不同研究结果间也存在很大差异,在5~45 ℃范围内,土壤硝化速率随温度增加而增加、降低或者不变的情况均有报道[13, 19-21]。前人不同研究结果间的显著差异可能与各研究使用的土壤类型及其性质不同有关。目前有关土壤氮初级转化过程对温度变化的响应研究大多针对亚热带和温带地区的林地土壤和草地土壤开展,鲜有温度变化影响农田黑土氮初级转化速率的报道。
黑龙江省属寒温带与温带大陆性季风气候,四季分明,温度差异较大,冬季气温最低可至-40 ℃,夏季气温最高可达36 ℃。季节变化以及极端天气导致的温度差异可能会显著影响土壤中的氮素转化过程,进而影响土壤中氮的释放、固持和损失,但目前尚不清楚寒温带农田土壤氮初级转化过程对温度变化的响应规律。因此,本研究以黑龙江省齐齐哈尔市的典型农田黑土为对象,采用室内培养试验,通过15N同位素成对标记技术和FLUAZ数值优化模型研究不同温度对土壤氮初级矿化速率、初级固定速率和初级硝化速率的影响,以期明确不同温度下土壤的氮素供应、保持和周转能力,研究结果对于农田黑土合理施用氮肥、提高氮肥利用率具有理论和现实意义。
1 材料与方法 1.1 供试土壤供试土壤采自黑龙江省齐齐哈尔市龙江县。齐齐哈尔市位于黑龙江省西部,地处45°53′~48°56′N、122°24′~126°41′E,海拔高度在200~500 m。该地区属半干旱大陆性季风气候,四季特点明显,春季干旱多风,夏季炎热多雨,秋季短暂霜早,冬季干冷漫长。年平均气温2.3 ℃,年平均降水量454 mm,降雨多集中在6—9月,占全年降水量的85%以上。
采样地点常年种植玉米,年均施肥量约为120 kg N·hm-2。于2019年秋季玉米收获后取样。采用S形多点采样法采集0~20 cm耕层土壤,将新鲜土样去除植物残体并混匀后过2 mm筛,于4 ℃下保存用于培养试验,另将一部分土壤风干后磨细过筛用于基本理化性质分析。土壤理化性质为:pH值5.53,田间最大持水量(WHC)为55.5%,有机碳和全氮含量分别为21.4 g·kg-1和2.07 g·kg-1,碳氮比为10.3,水溶性有机碳和水溶性有机氮含量分别为258 mg·kg-1和28.9 mg N·kg-1,铵态氮和硝态氮含量分别为5.14 mg N· kg-1和14.8 mg N·kg-1,砂粒、粉粒和黏粒含量分别为23.4%、60.3%和16.3%。
1.2 培养试验本研究采用15N同位素成对标记培养试验。试验设置3个培养温度:15、25、35 ℃,两个15N标记处理:15NH4NO3、NH415NO3(15N标记丰度为5 atom%),每个15N标记处理设置3次重复。称取相当于30 g烘干土质量的新鲜土样于90个250 mL三角瓶中,将三角瓶分为两组,用移液管向其中一组均匀加入2 mL 15NH4NO3溶液,向另外一组加入2 mL NH415NO3溶液,使添加的铵态氮和硝态氮浓度分别达到30 mg N· kg-1,添加氮溶液的同时调节水分含量至60% WHC。用锡箔封住三角瓶的瓶口,并扎4~5个洞以利于通气。将两组15N标记处理的三角瓶分别放入15、25、35 ℃的恒温培养箱中培养7 d。培养期间,每日去除锡箔通气30 min以保持好氧状态,每隔1 d采用称重法用滴管补充蒸发损失的水分。分别在添加标记氮溶液的0、1、3、5、7 d随机选取每个培养温度下每个15N标记土样3个,加入75 mL 2 mol·L-1的KCl溶液,振荡提取1 h,过滤,测定滤液中NH4+-N、NO3--N浓度及其15N丰度。过滤后的残留土壤用去离子水冲洗3次(每次150 mL),然后于60 ℃下烘干、磨细,用于测定土壤有机氮的浓度及其15N丰度。
1.3 测定项目与方法土壤pH用电位法测定(液土比为2.5∶1);土壤有机碳用重铬酸钾外加热容量法测定;土壤全氮采用开氏法测定;土壤砂粒、粉粒、黏粒含量采用比重计法测定;土壤铵态氮、硝态氮含量采用MgO-定氮合金蒸馏法测定;土壤用水浸提后利用有机碳氮分析仪测定水溶性有机碳和水溶性有机氮含量[22];土壤最大持水量参照Fierer等[23]的方法测定;土壤无机氮和有机氮的15N丰度采用同位素质谱仪测定。
1.4 数据处理与统计分析土壤氮初级转化速率采用FLUAZ模型计算得出[24]。该模型使用15N同位素成对标记技术(向土壤中添加15NH4NO3和NH415NO3)分别标记铵态氮和硝态氮库,测定不同培养时间各形态氮库的氮浓度及其15N丰度,通过数值优化拟合可以同时计算出有机氮初级矿化速率、初级硝化速率、初级反硝化速率、铵态氮固定速率、硝态氮固定速率和氨挥发速率。FLUAZ模型以最小平均加权误差(Mean weighed error,MWE)为标准拟合数据,相对于最小平方和而言更加标准化,能够更加准确反映速率之间的变异,估算的土壤氮转化速率与实测值之间具有很好的一致性,而且运用简便、迅速。通过计算培养期间各个时间段的氮初级转化速率,可以很好地表征土壤氮循环的动态变化。培养期间土壤平均氮初级转化速率是以各个时间段的氮初级转化速率根据培养时间的长短加权平均计算而得的。文中数据均为3次重复的平均值,采用Origin软件作图,采用SPSS软件进行不同处理间的差异显著性检验。
2 结果与分析 2.1 土壤中无机氮含量的动态变化不同培养温度下土壤中无机氮含量的动态变化如图 1所示。随着培养的进行,各温度处理土壤中铵态氮含量逐渐下降,硝态氮含量逐渐上升,15 ℃处理土壤无机氮含量变化缓慢。不同培养时间土壤铵态氮含量随着培养温度升高显著降低,至培养结束,15、25、35 ℃处理土壤铵态氮含量分别为25.6、8.07、1.86 mg N·kg-1(图 1a)。与15 ℃处理相比,培养温度增加至25 ℃硝态氮含量显著增加,温度继续增加至35 ℃时,硝态氮含量有所下降,但仍显著高于15 ℃处理。至培养结束,15、25、35 ℃处理的硝态氮含量分别为52.9、87.3、75.6 mg N·kg-1(图 1b)。

|
图 1 不同温度下土壤无机氮含量的动态变化 Figure 1 Dynamic changes of inorganic N contents in soils at different temperatures |
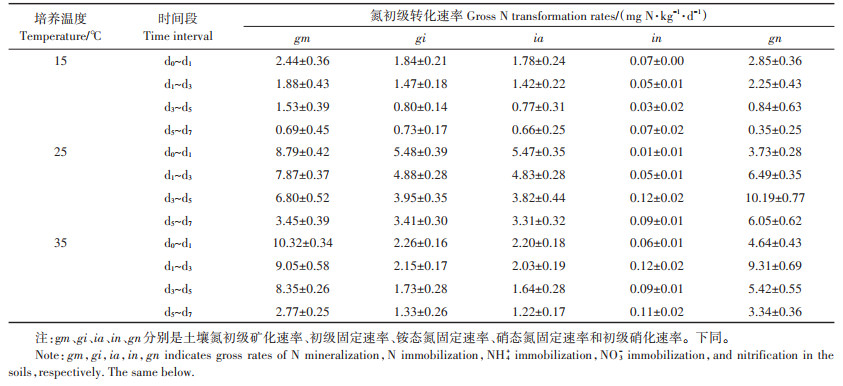
不同培养温度下土壤无机氮15N丰度的动态变化如图 2所示。在15N标记的铵态氮土壤样品中,各温度处理土壤铵态氮15N丰度逐渐下降,说明土壤中发生了有机氮的矿化作用,产生了自然丰度的铵态氮稀释了标记的铵态氮库的15N丰度(图 2a)。铵态氮的15N丰度随温度的升高而降低,与铵态氮浓度的变化趋势相同,表明有机氮的矿化速率随着温度升高而加快(图 2a)。在15N标记的铵态氮土壤样品中,各处理的硝态氮的15N丰度逐渐上升,说明发生了硝化作用,导致标记的铵态氮转化为了硝态氮,富集了土壤本底硝态氮库的15N丰度(图 2b)。硝态氮15N丰度随温度的变化趋势与硝态氮含量的变化趋势相同,表现为25 ℃>35 ℃>15 ℃(图 2b)。在15N标记的硝态氮土壤样品中,硝态氮15N丰度逐渐下降,不同温度处理间的大小顺序为25 ℃ < 35 ℃ < 15 ℃,进一步证实土壤中发生了硝化作用,自然丰度的铵态氮转化为硝态氮稀释了所标记的硝态氮库的15N丰度,且25 ℃时硝化速率最快(图 2d)。在15N标记的硝态氮土壤样品中,铵态氮的15N丰度接近于自然丰度,不同温度下没有显著差异(图 2c),说明土壤中没有发生有机氮的再矿化或者硝态氮的异化还原过程。
|
图 2 不同温度下土壤中无机氮15N丰度的动态变化 Figure 2 Dynamic changes of 15N isotopic excess of NH+4 and NO-3 in soils at different temperatures |
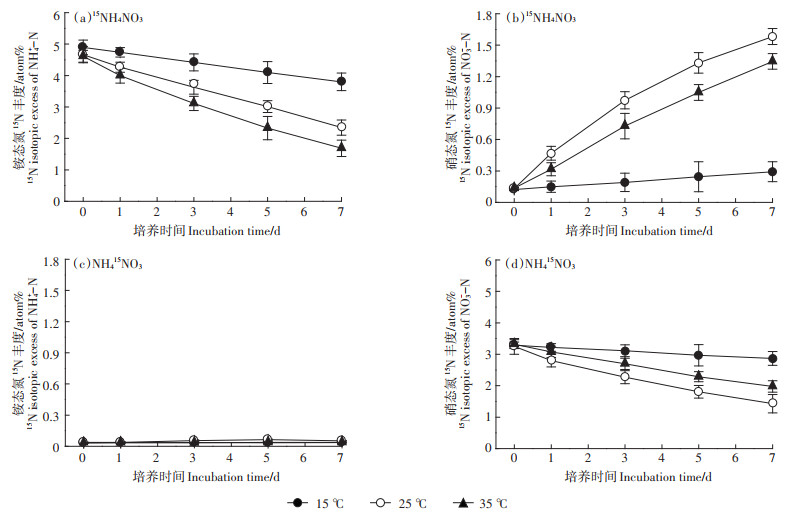
不同培养温度下土壤氮初级矿化速率和初级固定速率都随着培养时间的推进而逐渐下降(表 1)。各培养时间段,氮初级矿化速率随着温度增加而增加(表 1)。培养7 d内,15、25、35 ℃ 3个处理的平均氮初级矿化速率分别为1.52、6.43、7.23 mg N·kg-1·d-1,处理间差异显著(P < 0.05)(图 3)。各培养时间段,3个处理间土壤氮初级固定速率大小表现为15 ℃ < 35 ℃ < 25 ℃(表 1)。培养7 d内,15、25、35 ℃ 3个处理的平均氮初级固定速率分别为1.12、4.28、1.81 mg N· kg-1·d-1,处理间差异显著(P < 0.05)(图 3)。由表 1可知,微生物固定的无机氮以铵态氮为主,对硝态氮的固定速率可以忽略不计。培养温度为15 ℃时,土壤初级硝化速率随培养的进行而降低,而在25 ℃和35 ℃培养条件下,初级硝化速率随培养的进行先增加后下降,分别在培养后的3~5 d和1~3 d达到峰值(表 1)。15、25、35 ℃ 3个处理的平均初级硝化速率分别为1.39、7.03、5.83 mg N·kg-1·d-1,处理间差异显著(P < 0.05)(图 3)。
|
|
表 1 不同温度下土壤氮初级转化速率的动态变化(平均值±标准差) Table 1 Dynamic changes of gross N transformation rates in soils at different temperatures(Mean±standard deviation) |
|
图中不同小写字母表示各处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant difference among the three treatments(P < 0.05). The same below 图 3 不同温度下土壤平均氮初级转化速率 Figure 3 Average gross N transformation rates in soils at different temperatures |
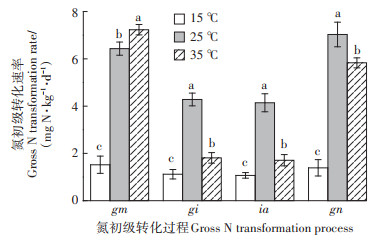
15 ℃和25 ℃处理的gn/ia值分别为1.30和1.70,两者之间无显著差异,而35 ℃处理的gn/ia值为3.41,显著高于15 ℃和25 ℃处理(图 4)。15 ℃和25 ℃处理的gm/gi值分别为1.36和1.50,两者之间无显著差异,但35 ℃处理的gm/gi值为3.99,显著高于15 ℃和25 ℃处理(图 4)。
|
图 4 不同温度下土壤氮初级转化速率间的比值 Figure 4 Ratio of gross N transformation rates in soils at different temperatures |
3个培养温度下,土壤氮初级矿化速率和初级固定速率都随培养时间的推进逐渐降低(表 1),说明土壤中易分解有效碳的数量在逐渐减少。温度是影响土壤微生物活性的重要因素[8],在一定温度范围内,微生物活性随着温度增加而增加,从而加快土壤中的氮素转化过程[25-26]。本研究结果表明,在15~35 ℃范围内,土壤氮初级矿化速率随着温度增加显著增加,培养温度由15 ℃增加至25 ℃时增幅很大,而温度进一步增加至35 ℃后增幅放缓,这与前人关于温带林地土壤和草地土壤氮初级矿化速率大小及随温度变化趋势的研究结果相似。Wang等[12]基于温带酸性高山草甸土的研究发现,土壤氮初级矿化速率在15~ 25 ℃范围内随温度的增加显著增加,25~35 ℃范围内增幅减小。Sun等[27]的研究表明,培养温度从15 ℃增加至25 ℃后,温带酸性森林土O、A层土壤氮初级矿化速率分别增加了4.5倍和0.8倍。Zaman等[13]也报道,在5~40 ℃范围内,温带酸性草地土壤氮初级矿化速率呈现随温度增加显著增加的变化趋势。高温条件下土壤具有较高的氮初级矿化速率可能与土壤中难矿化有机质的分解加速有关[28-29],因为催化有机物第一阶段分解的纤维素酶和蛋白酶活性随温度增加显著增加[30],促进了复杂有机物解聚为可溶性糖和氨基酸等简单有机物[31]。此外,高温下微生物分解有机物的速率也显著加快[32],从而导致土壤氮初级矿化速率显著增加。另一方面,高温处理下一些对温度敏感的土壤微生物死亡后会释放出大量水溶性有机碳[8, 33],有助于矿化作用的进行。
培养温度从15 ℃增加至25 ℃后,土壤氮初级固定速率显著增加,说明温度升高提高了土壤微生物的活性,促进了微生物对铵态氮的同化。Sun等[27]在研究温带酸性森林土壤氮初级转化过程对温度变化的响应时也发现,在15~25 ℃范围内土壤无机氮的初级固定速率随温度的增加显著增加。本研究结果显示,当培养温度从25 ℃进一步增加至35 ℃时,土壤氮初级固定速率反而显著下降,这与Wang等[12]基于亚热带酸性森林土和青藏高原酸性高山草甸土的研究结果相似。研究指出[25],参与氮固定过程的微生物种类要比参与氮矿化过程的微生物种类少,而且参与氮固定过程的微生物只能利用简单的易分解有效碳,而参与氮矿化过程的微生物可以利用复杂的有机化合物,不受底物分解难易程度的影响。因此,土壤中氮固定过程相比氮矿化过程对温度的变化更为敏感[15]。35 ℃高温条件下,一些不耐高温的土壤微生物大量死亡[8, 33],可能减少了参与氮固定过程的微生物数量,从而抑制固定过程的进行。死亡微生物释放出来的有效碳为一些耐高温的氮矿化微生物提供了底物和能量,从而显著增加了氮初级矿化速率[13],这可能是培养温度从25 ℃增加到35 ℃后土壤氮初级矿化速率对温度变化的响应与初级固定速率相反的原因。
15 ℃培养条件下,土壤初级硝化速率随培养的进行逐渐降低,说明底物铵态氮的添加可能对硝化微生物活性产生了刺激作用,使得初级硝化速率在培养后的第1 d就达到了峰值,然后随着底物的消耗,初级硝化速率逐渐降低。而在25 ℃和35 ℃培养条件下,初级硝化速率随培养时间的推进先增加后降低,这可能是25 ℃和35 ℃培养条件下土壤有机氮的矿化速率较高同时叠加外源氮添加的综合效应所致。硝化作用是在特定微生物种类——硝化细菌的作用下进行的,因此硝化作用对温度的变化比较敏感[34-35]。Breuer等[36]基于3个热带酸性森林土壤的研究发现,在一定温度范围内土壤初级硝化速率与土壤温度显著正相关,土壤温度每升高1 ℃,初级硝化速率平均增加NH4+-N 1.17 mg·m-2·h-1。本研究结果表明,培养温度从15 ℃增加至25 ℃后,土壤初级硝化速率显著增加,但当培养温度进一步增加至35 ℃时,初级硝化速率反而显著下降,这可能是因为高温降低了氧气的溶解度并增加了异养微生物对氧气的需求,导致土壤氧气浓度下降,进而抑制了硝化微生物的活性[34]。Liu等[37]在70%WFPS(孔隙含水量)条件下针对亚热带酸性农田土壤的培养试验发现,在15~25 ℃范围内土壤初级硝化速率随温度增加显著增加,当温度进一步增加到35 ℃时,初级硝化速率小幅度下降。Wang等[12]也报道,在15~35 ℃、60%WHC条件下亚热带和温带酸性森林土和草甸土的初级硝化速率也呈现随温度增加先增加后降低的变化趋势,这与本研究的结果相似。然而,也有研究发现中低温条件下培养温度升高对土壤初级硝化速率没有影响[38],甚至显著降低了土壤初级硝化速率[15],这可能是土壤有效碳含量或自养硝化速率比较低所致。在有效碳和铵态氮不是限制因子的前提下,自养硝化的最佳温度在25~ 35 ℃[13, 33],本研究结果与其一致。
在没有种植作物的实验室培养条件下,酸性农田土壤中的铵态氮主要有经硝化作用转变为硝态氮和被微生物固定为有机氮两个去向。因此,初级硝化速率与初级铵态氮固定速率的比值(gn/ia)可以用来衡量土壤中铵态氮的主要消耗过程,并可用于指示硝态氮产生潜势和淋溶风险[39]。如果gn/ia值大于1,说明硝化作用是消耗铵态氮的主要过程,如果gn/ia值小于1,说明土壤中的铵态氮主要被微生物固定,发生硝化作用和硝态氮淋溶的风险较小[25]。有机氮初级矿化速率与初级固定速率比值(gm/gi)反映了土壤无机氮的周转能力,可以用来评价矿化与固定过程的耦合程度。如果gm/gi值接近1,说明矿化与固定过程紧密耦连,有机氮矿化过程产生的铵态氮几乎全部可以被微生物固定为有机氮,氮素的内部周转循环能力很强;反之如果gm/gi值远大于1,说明矿化和固定过程的耦合程度不好,矿化产生的盈余氮会为硝化作用的发生提供大量底物,进而导致土壤氮素的损失[40]。本研究中15 ℃和25 ℃处理土壤中的gn/ia值和gm/gi值均稍大于1,而35 ℃高温处理土壤的gn/ia值和gm/ gi值均远大于1,说明在35 ℃高温条件下,土壤中有机氮的矿化速率大于微生物对无机氮的生物固定速率。虽然35 ℃高温下铵态氮的生物固定速率和硝化速率都比25 ℃条件下要低,但是硝化细菌对铵态氮的利用数量仍然显著高于微生物对铵态氮的固定,导致硝化作用成为铵态氮的主要消耗过程,从而可能产生大量硝态氮,如遇降雨可能会发生硝态氮的淋溶。而温度在15~25 ℃范围内土壤中有机氮的矿化作用和无机氮的生物固定过程耦合相对紧密,土壤中铵态氮发生硝化的比率仅仅稍大于铵态氮的固定,硝态氮累积的程度及发生淋溶和反硝化的几率相比35 ℃高温条件下要低。
本研究结果对于黑土区农田施肥具有一定的指导意义。本研究区域常年种植玉米,春季玉米播种时温度要恒定在15 ℃以上,此温度下土壤有机氮矿化作用较弱,土壤供应铵态氮的能力较弱,需要施用一定量的氮肥作基肥以保证玉米苗期的营养需求。在玉米生长旺期,平均气温在25 ℃以上,土壤有机氮的矿化作用增强,但同时固持和硝化能力也增强,此阶段应分次追施氮肥,同时要做好多雨条件下的田块排水工作以降低硝态氮的累积和淋溶风险。值得注意的是,本试验是在室内培养条件下进行的,今后还需进行原位试验加以深入研究和佐证。
4 结论(1)培养温度在15~35 ℃范围内,土壤氮初级矿化速率随温度的增加显著增加,初级固定速率和初级硝化速率则呈现先显著增加后显著降低的变化趋势。
(2)培养温度由15 ℃增加至25 ℃对氮初级矿化速率与初级固定速率比值(gm/gi)以及初级硝化速率与初级铵态氮固定速率比值(gn/ia)没有影响,且两个比值均稍大于1。但温度增加至35 ℃后显著增加了gm/gi值和gn/ia值,两个比值均远大于1。
(3)在15~25 ℃范围内,土壤氮素供应和固持能力基本持平,不易导致硝态氮的累积和淋溶。而在35 ℃高温条件下,土壤有机氮的矿化和固定过程耦连程度较弱,土壤铵态氮主要发生硝化作用,可能会增加硝态氮的累积和淋溶风险。
| [1] |
Booth M S, Stark J M, Rastetter E. Controls on nitrogen cycling in terrestrial ecosystems: A synthetic analysis of literature data[J]. Ecological Monographs, 2005, 75: 139-157. DOI:10.1890/04-0988 |
| [2] |
Zhang J B, Zhu T B, Cai Z C, et al. Effects of long term repeated mineral and organic fertilizer applications on soil nitrogen transformations[J]. European Journal of Soil Science, 2012, 63: 75-85. DOI:10.1111/j.1365-2389.2011.01410.x |
| [3] |
Zheng J, Guo R, Li D, et al. Nitrogen addition, drought and mixture effects on litter decomposition and nitrogen immobilization in a temperate forest[J]. Plant and Soil, 2017, 416: 165-179. DOI:10.1007/s11104-017-3202-4 |
| [4] |
Rennenberg H, Dannenmann M, Gessler A, et al. Nitrogen balance in forest soils: Nutritional limitation of plants under climate change stresses[J]. Plant Biology, 2009, 11: 4-23. DOI:10.1111/j.1438-8677.2009.00241.x |
| [5] |
Davidson E A, Hart S C, Shanks C A, et al. Measuring gross nitrogen mineralization, immobilization and nitrification by 15N isotopic pool dilution in intact soil cores[J]. Journal of Soil Science, 1991, 42: 335-349. DOI:10.1111/j.1365-2389.1991.tb00413.x |
| [6] |
Hart S C, Nason G E, Myrold D D, et al. Dynamics of gross nitrogen transformations in an old-growth forest: The carbon connection[J]. Ecology, 1994, 75(4): 880-891. DOI:10.2307/1939413 |
| [7] |
Müller C, Rütting T, Kattge J, et al. Estimation of parameters in complex 15N tracing models via Monte Carlo sampling[J]. Soil Biology and Biochemistry, 2007, 39: 715-726. DOI:10.1016/j.soilbio.2006.09.021 |
| [8] |
Joergensen R G, Brookes P C, Jenkinson D S. Survival of the soil microbial biomass at elevated temperatures[J]. Soil Biology and Biochemistry, 1990, 22: 1129-1136. DOI:10.1016/0038-0717(90)90039-3 |
| [9] |
王连峰, 蔡祖聪. 水分和温度对旱地红壤硝化活力和反硝化活力的影响[J]. 土壤, 2004, 36(5): 543-546. WANG Lian-feng, CAI Zucong. Assessment of temperature and water regime on nitrification an denitrification activity of upland red soils[J]. Soils, 2004, 36(5): 543-546. |
| [10] |
Braker G, Schwarz J, Conrad R. Influence of temperature on the composition and activity of denitrifying soil communities[J]. FEMS Microbiology Ecology, 2010, 73: 134-148. |
| [11] |
Murphy D V, Recous S, Stockdale E A, et al. Gross nitrogen fluxes in soil: Theory, measurement and application of 15N pool dilution techniques[J]. Advances in Agronomy, 2003, 79: 69-118. |
| [12] |
Wang J, Zhang J, Mueller C, et al. Temperature sensitivity of gross N transformation rates in an alpine meadow on the Qinghai-Tibetan Plateau[J]. Journal of Soils and Sediments, 2017, 17(2): 423-431. DOI:10.1007/s11368-016-1530-2 |
| [13] |
Zaman M, Chang S X. Substrate type, temperature, and moisture content affect gross and net N mineralization and nitrification rates in agroforestry systems[J]. Biology and Fertility of Soils, 2004, 39: 269-279. DOI:10.1007/s00374-003-0716-0 |
| [14] |
Lang M, Cai Z C, Mary B, et al. Land-use type and temperature affect gross nitrogen transformation rates in Chinese and Canadian soils[J]. Plant and Soil, 2010, 334: 377-389. DOI:10.1007/s11104-010-0389-z |
| [15] |
Andersen M K, Jensen L S. Low soil temperature effects on shortterm gross N mineralization-immobilization turnover after incorporation of a green manure[J]. Soil Biology and Biochemistry, 2001, 33: 511-521. DOI:10.1016/S0038-0717(00)00192-9 |
| [16] |
Benbi D, Richter J. A critical review of some approaches to modelling nitrogen mineralization[J]. Biology and Fertility of Soils, 2002, 35: 168-183. DOI:10.1007/s00374-002-0456-6 |
| [17] |
Baggs E M. Soil microbial sources of nitrous oxide: Recent advances in knowledge, emerging challenges and future direction[J]. Current Opinion in Environmental Sustainability, 2011, 3: 321-327. DOI:10.1016/j.cosust.2011.08.011 |
| [18] |
Gleeson D B, Müller C, Banerjee S, et al. Response of ammonia oxidizing archaea and bacteria to changing water filled pore space[J]. Soil Biology and Biochemistry, 2010, 42: 1888-1891. DOI:10.1016/j.soilbio.2010.06.020 |
| [19] |
Stottlemyer R, Toczydlowski D. Nitrogen mineralization in a mature boreal forest, Isle Royale, Michigan[J]. Journal of Environmental Quality, 1999, 28: 709-720. |
| [20] |
Schütt M, Borken W, Spott O, et al. Temperature sensitivity of C and N mineralization in temperate forest soils at low temperatures[J]. Soil Biology and Biochemistry, 2014, 69: 320-327. DOI:10.1016/j.soilbio.2013.11.014 |
| [21] |
Durán J, Morse J L, Rodríguez A, et al. Differential sensitivity to climate change of C and N cycling processes across soil horizons in a northern hardwood forest[J]. Soil Biology and Biochemistry, 2017, 107: 77-84. DOI:10.1016/j.soilbio.2016.12.028 |
| [22] |
Burford J R, Bremner J M. Relationships between the denitrification capacities of soils and total water soluble and readily decomposable soil organic matter[J]. Soil Biology and Biochemistry, 1975, 7(6): 389-394. DOI:10.1016/0038-0717(75)90055-3 |
| [23] |
Fierer N, Schimel J P. Effects of drying-rewetting frequency on soil carbon and nitrogen transformations[J]. Soil Biology and Biochemistry, 2002, 34(6): 777-787. DOI:10.1016/S0038-0717(02)00007-X |
| [24] |
Mary B, Recous S, Robin D. A model for calculating nitrogen fluxes in soil using 15N tracing[J]. Soil Biology and Biochemistry, 1998, 30: 1963-1979. DOI:10.1016/S0038-0717(98)00068-6 |
| [25] |
Hoyle F C, Murphy D V, Fillery I R P. Temperature and stubble management influence microbial CO2-C evolution and gross N transformation rates[J]. Soil Biology and Biochemistry, 2006, 38: 71-80. DOI:10.1016/j.soilbio.2005.04.020 |
| [26] |
Guntiñas M E, Leirós M C, Trasar-Cepeda C, et al. Effects of moisture and temperature on net soil nitrogen mineralization: A laboratory study[J]. European Journal of Soil Biology, 2012, 48: 73-80. DOI:10.1016/j.ejsobi.2011.07.015 |
| [27] |
Sun L F, Xia Z W, Sang C P, et al. Soil resource status affects the responses of nitrogen processes to changes in temperature and moisture[J]. Biology and Fertility of Soils, 2019, 55: 629-641. DOI:10.1007/s00374-019-01379-2 |
| [28] |
王帘里, 孙波. 温度和土壤类型对氮素矿化的影响[J]. 植物营养与肥料学报, 2011, 3: 583-591. WANG Lian-li, SUN Bo. Effects of temperature and soil type on nitrogen mineralization[J]. Journal of Plant Nutrition and Fertilizers, 2011, 3: 583-591. DOI:10.11674/zwyf.2011.0445 |
| [29] |
Heumann S, Böttcher J. Temperature functions of the rate coefficients of net N mineralization in sandy arable soils. Part Ⅰ: Derivation from laboratory incubations[J]. Journal of Plant Nutrition and Soil Science, 2004, 167: 381-389. DOI:10.1002/jpln.200421343 |
| [30] |
Trasar-Cepeda C, Gil-Sotres F, Leirós M C. Thermodynamic parameters of enzymes in grassland soils from Galicia, NW Spain[J]. Soil Biology and Biochemistry, 2007, 39: 311-319. DOI:10.1016/j.soilbio.2006.08.002 |
| [31] |
Schimel J P, Bennett J. Nitrogen mineralization: Challenges of a changing paradigm[J]. Ecology, 2004, 85: 591-602. DOI:10.1890/03-8002 |
| [32] |
Kemmitt S J, Lanyon C V, Waite I S, et al. Mineralization of native soil organic matter is not regulated by the size, activity or composition of the soil microbial biomass: A new perspective[J]. Soil Biology and Biochemistry, 2008, 40(1): 61-73. DOI:10.1016/j.soilbio.2007.06.021 |
| [33] |
Sierra J, Marban L. Nitrogen mineralization pattern of an Oxisol of Guadeloupe, French West Indies[J]. Soil Science Society of America Journal, 2000, 64: 2002-2010. DOI:10.2136/sssaj2000.6462002x |
| [34] |
张树兰, 杨学云, 吕殿青, 等. 温度、水分及不同氮源对土壤硝化作用的影响[J]. 生态学报, 2002, 22(12): 2147-2153. ZHANG Shulan, YANG Xue-yun, LÜ Dian-qing, et al. Effect of soil moisture, temperature and different nitrogen fertilizers on nitrification[J]. Acta Ecologica Sinica, 2002, 22(12): 2147-2153. DOI:10.3321/j.issn:1000-0933.2002.12.019 |
| [35] |
Chen Z, Ding W, Xu Y, et al. Importance of heterotrophic nitrification and dissimilatory nitrate reduction to ammonium in a cropland soil: Evidences from a 15N tracing study to literature synthesis[J]. Soil Biology and Biochemistry, 2015, 91: 65-75. DOI:10.1016/j.soilbio.2015.08.026 |
| [36] |
Breuer L, Kiese R, Butterbach-Bahl K. Temperature and moisture effects on nitrification rates in tropical rain forest soils[J]. Soil Science Society of America Journal, 2002, 66: 834-844. DOI:10.2136/sssaj2002.8340 |
| [37] |
Liu R, Hayden H L, Suter H, et al. The effect of temperature and moisture on the source of N2O and contributions from ammonia oxidizers in an agricultural soil[J]. Biology and Fertility of Soils, 2017(53): 141-152. |
| [38] |
Osborne B B, Baron J S, Wallenstein M D. Moisture and temperature controls on nitrification differ among ammonia oxidizer communities from three alpine soil habitats[J]. Frontiers of Earth Science, 2015, 10(1): 1-12. DOI:10.1007/s11707-015-0556-x |
| [39] |
Stockdale E A, Hatch D J, Murphy D V, et al. Verifying the nitrification to immobilisation ratio(N/I) as a key determinant of potential nitrate loss in grassland and arable soils[J]. Agronomie, 2002, 22: 831-838. DOI:10.1051/agro:2002060 |
| [40] |
Johnson D W. Nitrogen retention in forest soils[J]. Journal of Environmental Quality, 1992, 21: 1-12. |
 2021, Vol. 40
2021, Vol. 40