2. 西北农林科技大学资源环境学院, 陕西 杨凌 712100
2. College of Resources and Environmental Science, Northwest A & F University, Yangling 712100, China
纳米氧化锌(ZnO NPs)作为一种金属氧化物纳米颗粒,因颗粒尺寸的细微化而产生其本体块状材料所不具备的表面效应、小尺寸效应、量子效应和久保效应等特殊的物理性质[1],从而越来越多的应用于工业、农业等多领域的研究[2-3]。纳米材料的广泛应用会增加其进入环境中的风险,已有研究证实,大多数纳米材料会流入污水处理厂的污泥中,这些污泥作为土壤肥料施用时无疑会给农业生态系统带来一定的风险[4-5]。
种子萌发是植物生命周期的关键阶段,也是对外界环境因子最敏感的时期之一。有研究表明,纳米颗粒对种子发芽的影响与其作用浓度密切相关[6]。Mahajan等[7]研究表明,在培养基中添加20 mg·L-1的ZnO NPs会利于绿豆种子的萌发,1 mg·L-1的ZnO NPs会利于鹰嘴豆种子的萌发,高于该浓度会抑制其萌发和生长。Sedghi等[8]研究也表明较低浓度ZnO NPs对大豆种子发芽具有促进作用,而较高剂量ZnO NPs会抑制大豆种子发芽。Prasad等[9]在花生以及Rashar等[10]在洋葱中也发现了类似的结果。萌发后期,植物对水分和养分的吸收取决于根系的生长状况及根系形态。ZnO NPs对植物根系形态的研究也报道不一。Xiang等[11]研究结果表明80 mg·L-1的ZnO NPs对白菜发芽率没有影响,但显著抑制了白菜根和芽的生长。锌是唯一参与六大酶促反应的金属元素,在许多影响植物生长代谢的过程中发挥重要作用[12]。ZnO NPs显著降低了芥菜的生物量,并且对植物的根、茎和叶产生了一定的氧化损伤[13]。
已有大量研究阐明Zn2+对植物种子萌发及幼苗生长的影响[14-15]。关于ZnO NPs对水稻[16]、小麦[17]、玉米[18]等粮食作物种子萌发的影响研究也已展开,而其对豆科植物的影响研究大多集中在大豆[8]、绿豆[7]、豇豆[19]等植物,较少研究ZnO NPs对豆科牧草类植物萌发及幼苗生长的影响。因此,本研究通过种子发芽试验,探究ZnO NPs对不同豆科植物种子萌发和幼苗生理生化指标的差异影响,及锌在不同豆科植物中的累积,以期评价不同豆科植物对ZnO NPs的敏感性,为揭示纳米颗粒对同一科属不同品种植物的生长影响提供依据。
1 材料与方法 1.1 试验材料供试种子:豌豆、绿豆、紫花苜蓿、白三叶草种子,于山东寿禾种业购买。ZnO NPs粒径(20±5)nm,纯度>99.6%。分别称取1、5、10、20、40、80 mg ZnO NPs粉末分散于盛有100 mL超纯水的烧杯中,在超声振动仪中(100 W,40 kHz)振荡30 min,制得浓度为10 mg·L-1(N10)、50 mg·L-1(N50)、100 mg·L-1(N100)、200 mg·L-1(N200)、400 mg·L-1(N400)、800 mg·L-1(N800)的悬浮液,无添加ZnO NPs的超纯水作为对照(CK)。
1.2 试验方法培养皿灭菌:将直径为10 cm的玻璃培养皿在121 ℃高压蒸汽灭菌锅中灭菌30 min。种子表面消毒:分别随机选取一定数量的饱满、大小均匀的豌豆、绿豆、苜蓿、白三叶草种子,用10% 的过氧化氢浸泡10 min消毒,再用超纯水冲洗3遍。种子萌发试验:将消毒的种子平铺于放有定性滤纸的培养皿上,每个培养皿内的种子数量分别为豌豆10粒、绿豆15粒、苜蓿100粒、三叶草100粒,每个培养皿取液量均为5 mL,每个浓度处理设置6个重复,置于恒温培养箱(25±1)℃避光培养7 d,每日补充适量超纯水。
1.3 测定方法将ZnO NPs粉末在水体中充分稳定分散,采用透射电子显微镜(TEM,JEOL 100CX,日本)观测ZnO NPs颗粒微观结构。使用马尔文激光粒度仪(Mastersizer 2000,英国)测定ZnO NPs颗粒水动力学尺寸。本试验种皮中出现胚根或子叶即视为发芽,收取培养7 d的幼苗,用蒸馏水洗净,将根和茎分开,使用软尺测量幼苗的茎长,使用Espon scanner数字化扫描仪对根系进行扫描,扫描后运用细根分析软件(Win-RhIZO,2008a,Regent Instruments Inc)计算总根长、总表面积、比表面积等根系形态指标;采集幼苗的叶片,采用硫代巴比妥酸(TBA)法测定其丙二醛(MDA)含量。幼苗根系首先用0.1 mol·L-1 HNO3洗净,再用蒸馏水洗3遍,经105 ℃杀青30 min后,在65 ℃烘箱中烘至恒质量,称量每个培养皿中幼苗的干物质量,植物样品采用HNO3微波消解(Multiprep-41,FC2,意大利),石墨炉火焰原子吸收分光光度法测定消解液中的锌含量。
1.4 数据分析试验数据采用SPSS 19.0进行统计分析,采用LSD法进行多重比较,P < 0.05表示处理间差异显著,使用Origin 9.0进行图形绘制。
植物发芽率及根系比表面积(SRA)参数计算公式如下:
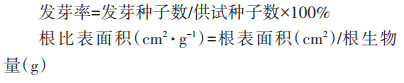
|
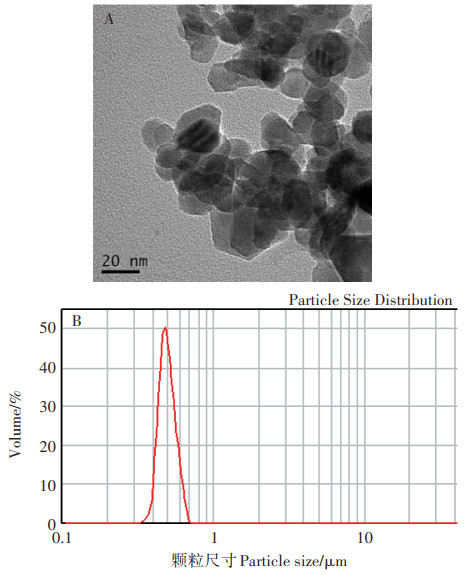
利用透射电子显微镜观察去离子水中ZnO NPs,如图 1所示,ZnO NPs颗粒呈球形,粒径约为20 nm。ZnO NPs溶解度为7.38 mg·L-1,水溶液中会产生团聚效应,形成较大尺寸的团聚体。
|
图 1 去离子水中ZnO NPs颗粒TEM扫描图(A)和水动力学尺寸图(B) Figure 1 TEM scan(A)and hydrodynamic dimension(B)of ZnO NPs particles in DI water |
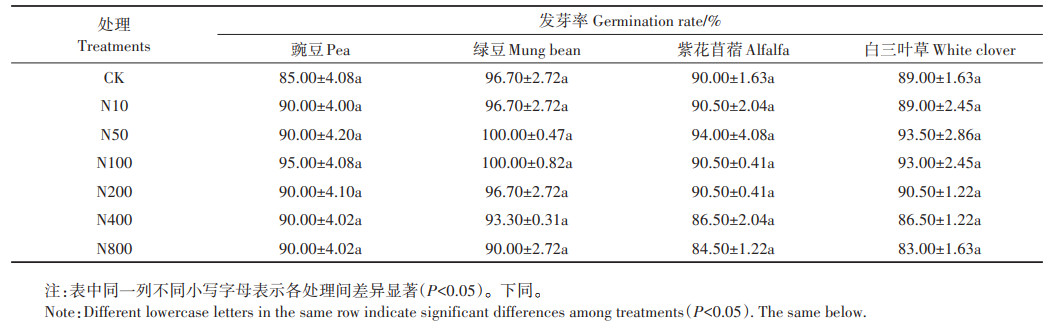
由表 1可知,不同浓度的ZnO NPs处理下4种豆科种子的发芽率与CK处理相比均无显著差异,除了N800处理的紫花苜蓿和白三叶草种子发芽率分别为84.50%和83.00%,其余浓度ZnO NPs处理下的4种豆科种子的发芽率均达到了发芽率标准GB 16715.2— 2010规定的种子质量标准(≥85%)。表明ZnO NPs对豌豆、绿豆种子的萌发无显著影响,在高浓度(400 mg·L-1和800 mg·L-1)ZnO NPs处理下会降低紫花苜蓿和白三叶草种子的发芽率。
|
|
表 1 不同浓度ZnO NPs处理对豆科幼苗发芽率的影响 Table 1 Effects of different concentrations of ZnO NPs on germination rate of leguminous seedlings |
由图 2中4种豆科幼苗的干质量及干质量相对百分率可知,随着ZnO NPs浓度的增加,豌豆和绿豆幼苗的干质量呈先增加后减少的趋势,分别在N100和N50处理时达到最大,较CK处理均显著增加了23%。紫花苜蓿和白三叶草幼苗的干质量随着ZnO NPs浓度的升高呈降低趋势,均在N10处理下达到最大,较CK处理分别增加了17% 和18%。与CK处理相比,N400和N800处理均显著降低了4种豆科植物幼苗的干质量,N800处理下豌豆、绿豆、紫花苜蓿、白三叶草的干质量比CK分别降低了13%、31%、25%、35%。总体来看,10~200 mg·L-1浓度范围的ZnO NPs利于豌豆幼苗干质量的累积,超过该浓度会显著降低豌豆幼苗干质量。除豌豆外的3种豆科植物,低浓度(10 mg· L-1和50 mg·L-1)ZnO NPs有利于幼苗干质量累积,因豆科植物品种的差异,产生的促进效果不同。而高浓度(≥100 mg·L-1)ZnO NPs会降低幼苗的干质量,呈现出一定的植物毒性。

|
图中同种柱子不同小写字母表示处理间差异显著(P&$60;0.05) Different lowercase letters within the same column indicate significant differences(P&$60;0.05)among treatments 图 2 不同浓度ZnO NPs处理对豆科幼苗干质量的影响 Figure 2 Effects of different concentrations of ZnO NPs on dry weights of leguminous seedlings |
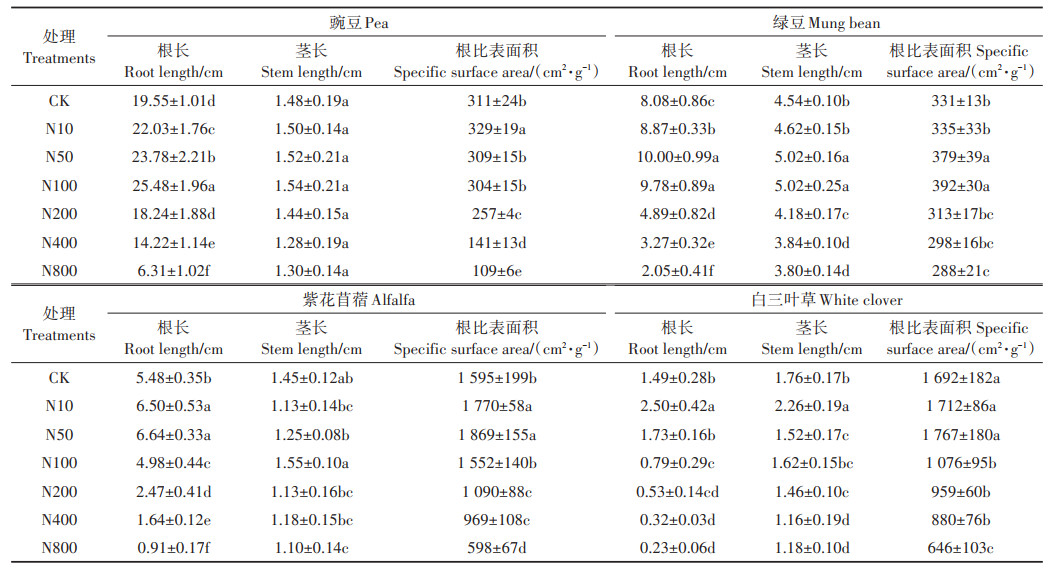
种子萌发后,ZnO NPs悬浮液与幼苗的根直接接触,进而对其产生影响。与CK处理相比,N10、N50、N100处理促进了豌豆幼苗侧根和根毛的生长(图 3)。根据表 2可得,N10、N50、N100处理均显著增加了豌豆和绿豆幼苗根长,高于100 mg·L-1浓度的ZnO NPs处理时,豌豆和绿豆幼苗的根长较CK降低。对于紫花苜蓿和白三叶草,只有N10和N50处理促进了幼苗根生长,大于50 mg·L-1浓度的ZnO NPs处理对紫花苜蓿和白三叶草的根伸长有显著的抑制作用。在最大浓度800 mg·L-1处理下,豌豆、绿豆、紫花苜蓿、白三叶草根长比CK处理分别减少了68%、75%、83%、85%,4种豆科幼苗的根伸长受到抑制,根的比表面积减小,但根生长变粗、直径增加。整体上,4种豆科幼苗根长度随ZnO NPs浓度的升高先增加后降低,但有助于根生长的浓度范围不同,表明植物不同,促进幼苗根生长的ZnO NPs最适浓度也不同。

|
图 3 不同浓度ZnO NPs处理对豆科幼苗根系形态的影响 Figure 3 Effects of different concentrations of ZnO NPs on root morphology of leguminous seedlings |
|
|
表 2 不同浓度ZnO NPs处理对豆科幼苗根长、茎长和比表面积的影响 Table 2 Effects of different concentrations of ZnO NPs on root length, stem length and specific surface area of leguminous seedlings |
由表 2可知,与CK处理相比,10~800 mg·L-1浓度的ZnO NPs处理对豌豆幼苗茎长无显著影响。绿豆幼苗的茎长随着ZnO NPs浓度的升高先增加后降低,低浓度(10、50、100 mg·L-1)ZnO NPs处理促进了绿豆幼苗的茎伸长,高浓度(200、400、800 mg·L-1)ZnO NPs处理则抑制了绿豆幼苗茎生长。只有N100处理对紫花苜蓿的茎生长有轻微的促进作用,其余处理均降低了紫花苜蓿幼苗的茎长。N10处理显著增加了白三叶草的茎长,相比CK茎长增加了28%,其余处理(N100除外)显著抑制了白三叶草幼苗茎的生长。
由表 2可知,与CK处理相比,低浓度ZnO NPs(≤100 mg·L-1)对4种豆科植物幼苗的根比表面积有促进作用,其中N10处理显著增加了豌豆、紫花苜蓿的根比表面积,N50处理显著增加了绿豆、紫花苜蓿的根比表面积,同时,N100处理也显著增加了绿豆的根比表面积。而高浓度(200、400、800 mg·L-1)ZnO NPs处理对4种豆科植物幼苗的根比表面积有不同程度的抑制。最大浓度800 mg·L-1处理对豌豆、绿豆、紫花苜蓿、白三叶草根的比表面积抑制率分别达到65%、13%、63%、62%。
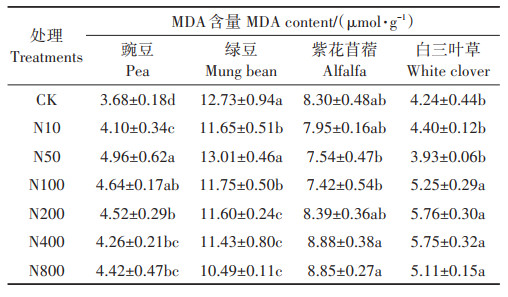
2.4 不同浓度ZnO NPs处理对4种豆科植物幼苗MDA含量的影响由表 3可以看出,与CK处理相比,不同浓度ZnO NPs处理均增加了豌豆幼苗的MDA含量,随着ZnO NPs浓度的升高,豌豆幼苗MDA含量呈先增加后减少的趋势,N50处理豌豆幼苗MDA含量最大。同时,N50处理也增加了绿豆幼苗的MDA含量,但未达到显著差异。各浓度ZnO NPs处理对紫花苜蓿幼苗MDA含量影响未达到显著差异,高浓度(≥100 mg·L-1)ZnO NPs处理显著增加了白三叶草幼苗的MDA含量。整体上,高浓度(100~800 mg·L-1)ZnO NPs处理对豌豆和白三叶草幼苗的胁迫作用显著,对绿豆和紫花苜蓿无显著胁迫作用。
|
|
表 3 不同浓度ZnO NPs处理对4种豆科幼苗MDA含量的影响 Table 3 MDA content of four legume seedlings treated with different concentrations of ZnO NPs |
由表 4可见,与CK处理相比,除了N10处理豌豆幼苗的锌含量与CK相比无显著差异外,4种豆科幼苗的锌含量均随着ZnO NPs浓度的升高呈上升趋势。豌豆、绿豆、紫花苜蓿、白三叶草的锌含量分别从CK的9.17、12.04、8.98、17.84 mg · kg-1升高到N800的83.96、82.96、212.48、263.21 mg·kg-1。N10处理的锌含量豌豆幼苗约是CK处理的1.6倍,绿豆约2.0倍,紫花苜蓿约4.6倍,白三叶草约3.8倍。在N50处理时,豌豆、绿豆、紫花苜蓿和白三叶草幼苗的锌含量分别约是其对应N10处理的1.7、1.7、2.6倍和2.0倍。随着ZnO NPs浓度的增加,4种豆科植物幼苗的锌含量增加缓慢,表明低浓度(10~50 mg·L-1)ZnO NPs处理有助于豆科植物幼苗锌含量的累积。整体看,4种豆科幼苗在各浓度ZnO NPs处理下,白三叶草幼苗的锌含量始终最高。
|
|
表 4 不同浓度ZnO NPs处理对豆科幼苗锌含量的影响 Table 4 Effects of different concentrations of ZnO NPs on Zn content in leguminous seedlings |
本试验中不同浓度的ZnO NPs处理对4种豆科种子发芽率无显著影响,对4种豆科幼苗生物量影响整体呈现“低促高抑”的效果。Lin等[20]通过发芽试验将萝卜、油菜、黑麦草、生菜、玉米、黄瓜等植物种子分别暴露于浓度为2 000 mg·L-1的5种纳米材料(MWCNT、Al NPs、Al2O3 NPs、Zn NPs、ZnO NPs)中,发现除Zn NPs和ZnO NPs显著降低了黑麦草和玉米种子的发芽率外,其余纳米材料处理对6种植物的发芽率均无显著影响。Khodakovskaya等[21]通过在含有碳纳米管(10~40 μg·L-1)的培养基中测试番茄种子的发芽和生长速率,发现碳纳米管能够穿透番茄种皮促进种子内部水分吸收,使番茄种子发芽率和生物量都显著增加。而本试验中各浓度ZnO NPs处理对豆科植物发芽均没有显著影响,可能原因是种皮表现出的选择渗透性,通过限制纳米颗粒的进入来保护胚胎不受ZnO NPs毒性,直至种子生长出胚根与培养基中的纳米颗粒直接接触[22]。随着ZnO NPs浓度的升高,豌豆和绿豆幼苗的干质量先增加后减少,紫花苜蓿和白三叶草的干质量呈降低趋势。相关研究报道的纳米颗粒对植物生物量的影响也不尽相同。Salehi等[23]在菜豆生长的琼脂培养基中添加25、50、100 mg·L-1的CeO2 NPs,结果最高浓度CeO2 NPs分别提高了菜豆茎和根37% 和19% 的生物量。但Wang等[24]发现200 mg·L-1和300 mg·L-1 ZnO NPs会抑制叶绿素的生物合成,降低光合效率,使拟南芥的生物量分别减少20% 和80%。综上,纳米颗粒对植物生物量的影响一方面因阻碍植物根际生长和营养吸收,另一方面因阻碍植物叶片光合作用影响能量合成。一般植物体内锌浓度达到100 μg·g-1时就表现过量,浓度为400 μg·g-1时就造成严重毒害[25]。本试验中ZnO NPs通过对豆科幼苗根和茎的生长产生促进或抑制作用进而对豆科幼苗的生物量产生直接影响。
本试验中,适宜浓度ZnO NPs处理能有效促进豆科幼苗根和茎的生长,但高浓度(400、800 mg·L-1)ZnO NPs处理均抑制了4种豆科幼苗根和茎的生长,同时降低了根的比表面积,在最大浓度处理下,4种豆科植物的根几乎都停止了伸长,表明高浓度ZnO NPs对4种豆科植物幼苗生长表现出植物毒性。研究表明低浓度ZnO NPs产生的Zn2+有助于水生植物花叶芦竹茎叶的生长,而高浓度ZnO NPs对其种子萌发后的茎叶生长产生明显抑制[26],这与本试验研究结果一致。种子萌发后幼根茎叶没有种皮的保护,高浓度ZnO NPs直接接触幼根茎叶,使其生长受到抑制[27]。有研究报道了ZnO NPs的毒性效应,Wan等[28]通过生理学和转录组学方法比较ZnO NPs和Zn2+对拟南芥的差异毒性,结果表明ZnO NPs和Zn2+都抑制了拟南芥初生根的生长,ZnO NPs对根伸长区域的生长有更强的抑制作用,而Zn2+对分生组织细胞有更强的毒性作用,但ZnO NPs处理的植物比Zn2+处理的植物能更快的从胁迫中恢复。ZnO NPs悬浮液中除了纳米颗粒自身,其溶解的Zn2+也会对植物生长产生影响,Zn2+含量随着ZnO NPs浓度的升高先上升后下降,200 mg·L-1的ZnO NPs悬浮液中Zn2+含量最高,高于此浓度的ZnO NPs悬浮液中Zn2+含量趋于稳定[18]。也有研究报道纳米颗粒通过进入植物细胞而抑制根生长,Kurepa等[29]研究表明超小型锐钛矿型TiO2 NPs能够进入拟南芥植物细胞,积聚在液泡和根细胞核这些亚细胞位置,并导致细胞微管重组和消除,从而抑制根伸长。Loepez-Moreno等[30]通过发芽试验研究ZnO NPs在大豆幼苗中的生物转化,结果表明ZnO NPs处理的大豆根长先增加后减小,使用同步加速器X吸收光谱在大豆根部未发现ZnO NPs,说明ZnO NPs对大豆根伸长的影响可能是由于纳米颗粒本身和ZnO NPs溶解出的Zn2+。本试验高浓度(400~800 mg · L-1)ZnO NPs处理对4种豆科幼苗根长的抑制作用与上述文献结果类似,ZnO NPs浓度越高,根长越小,表明除了ZnO NPs溶解的Zn2+,ZnO NPs自身的毒性也抑制了根的生长。
本试验中ZnO NPs对4种豆科幼苗根长的抑制作用要大于对茎长的抑制作用,这与林茂宏等[31]发现的不同浓度ZnO NPs与ZnSO4处理对樱桃萝卜和小白菜根伸长胁迫作用均高于对芽伸长胁迫作用的研究结果类似。与植物的全生命周期毒理试验不同,种子发芽试验在短时间内即呈现ZnO NPs的植物毒性,原因可能是胚根先伸出种皮与纳米颗粒接触。而在植物全生命周期中,有从根部向地上部营养运输的过程,在短时间内,幼苗根部吸收的纳米粒子或纳米粒子溶出的金属离子不能得到缓释,从而不能向茎、叶输送,因此基本表现为根部受到的植物毒性明显。根比表面积反映植物根系吸收水分和养分的能力,可作为描述根系形态功能的重要指标之一,其值越大,可得到的养分利用效率越高[32]。本试验中随着ZnO NPs浓度的升高,4种豆科植物幼苗的根比表面积先增大后减小,与幼苗的干质量变化趋势保持一致,根比表面积与植物利用养分的效率有关,这可能是导致豆科植物幼苗干质量降低的原因。
3.2 ZnO NPs对植物MDA及植株锌含量的影响植物在逆境胁迫下,细胞内活性氧产生和清除之间的平衡遭到破坏,导致氧自由基的大量积累,从而引发膜脂过氧化,其最终产物MDA含量的高低通常用来表示膜脂过氧化水平[33]。豆科植物受到ZnO NPs胁迫时会产生少量自由基,从而激发植物的多种生理功能,促进植物生长,但当ZnO NPs处理胁迫过强时,大量的自由基超过了抗氧化系统的清除能力,此时将会抑制植物生长。研究报道Fe3O4 NPs会引起黑麦草和南瓜植物的氧化应激,增加其体内的MDA含量[34]。本试验中高浓度(100~800 mg·L-1)ZnO NPs处理下,豌豆和白三叶草的MDA含量较CK显著提升,表明对其有一定的胁迫作用,对绿豆和紫花苜蓿的胁迫作用不显著,这可能是由于不同植物对锌的响应程度不同,由于锌是植物生长必需的营养元素,其氧化物的纳米颗粒对植物影响更为复杂。
不同浓度ZnO NPs处理不仅影响豆科植物幼苗的干质量、根长,而且影响幼苗体内的锌含量。与对豆科植物幼苗干质量和根长的影响趋势不同,本试验中4种豆科植物的锌含量随ZnO NPs浓度的升高而逐渐增加,同一处理,紫花苜蓿和白三叶草的锌含量大于豌豆和绿豆。植物的存在有利于ZnO NPs悬浮液中可溶性锌含量增加[35]。植物对金属元素的吸收取决于金属元素的可利用性、吸收量以及植物的储存能力[36],因此不同植物对锌的吸收利用效率存在差别。Loepz-Moreno等[30]通过发芽试验研究ZnO NPs和CeO2 NPs在大豆幼苗中的生物转化,结果表明在500 mg·L-1的ZnO NPs处理下大豆幼苗锌累积量最大,达到229 mg·kg-1,而1 000、2 000、4 000 mg·L-1的ZnO NPs处理锌累积量为135~150 mg·kg-1不等,分析原因可能是基质中纳米颗粒的聚集影响了植物对锌的吸收。Franklin等[37]研究表明ZnO NPs在100 mg· L-1时发生团聚,形成大小(纳米级至微米级)不同的絮状物,数据表明ZnO NPs在500 mg·L-1发生团聚低于4 000 mg·L-1,因此有更多的NPs和Zn2+可供植物吸收。本试验的研究结果与上述文献结果相似,本试验中N50处理较N10处理锌含量约增加2倍,在N400、N800处理时,4种豆科幼苗的锌含量较前一浓度处理增长缓慢,分析原因可能与较高浓度ZnO NPs的团聚以及释放的Zn2+含量密切相关。综上,较高浓度的ZnO NPs对植物造成不同程度的毒害效应,不同植物对纳米颗粒的吸收能力不同,导致不同植物对ZnO NPs响应存在一定差异。根据4种豆科植物的根伸长阈值,不同浓度的ZnO NPs处理对白三叶草的根长抑制率最大,再由高浓度ZnO NPs对白三叶草的胁迫作用较显著,白三叶草幼苗的锌含量最大,可得4种豆科植物对锌的敏感性高低依次为白三叶草、紫花苜蓿、绿豆、豌豆。
4 结论(1)不同浓度ZnO NPs处理不影响豆科植物的发芽率,适宜浓度的ZnO NPs处理有助于豆科幼苗干质量的累积。
(2)不同豆科植物对ZnO NPs的耐受性存在差异,豌豆、绿豆、紫花苜蓿、白三叶草幼苗根伸长阈值分别为200、100、50、50 mg · L-1 ZnO NPs。高浓度(100~800 mg·L-1)ZnO NPs处理对豌豆和白三叶草的胁迫作用强于绿豆和紫花苜蓿。
(3)在最大800 mg·L-1 ZnO NPs处理浓度范围内,4种豆科植物的锌含量随ZnO NPs浓度的升高而增加,不同豆科植物品种ZnO NPs敏感程度由大到小依次为白三叶草、紫花苜蓿、绿豆、豌豆。总体上,ZnO NPs对豆科幼苗生长产生促进或抑制的效果与处理浓度密切相关,ZnO NPs在农业生产中的应用应根据其剂量-影响效果合理施用。
| [1] |
马占营, 何仰清, 徐维霞. 纳米ZnO制备方法的研究进展[J]. 咸阳师范学院学报, 2007, 22(4): 36-39. MA Zhan-ying, HE Yang-qing, XU Wei-xia. Recent progress in preparation methods of nano-zinc oxide[J]. Journal of Xianyang Normal University, 2007, 22(4): 36-39. DOI:10.3969/j.issn.1672-2914.2007.04.013 |
| [2] |
Wang P, Lombi E, Zhao F J, et al. Nanotechnology: A new opportunity in plant sciences[J]. Trends in Plant Science, 2016, 21(8): 699-712. DOI:10.1016/j.tplants.2016.04.005 |
| [3] |
Milani N, Mclaughlin M J, Stacey S P, et al. Dissolution kinetics of macronutrient fertilizers coated with manufactured zinc oxide nanoparticles[J]. Journal of Agricultural & Food Chemistry, 2012, 60(16): 3991-3998. |
| [4] |
Dimkpa C O, Mclean J E, Britt D W, et al. Bioactivity and biomodification of Ag, ZnO, and CuO nanoparticles with relevance to plant performance in agriculture[J]. Industrial Biotechnology, 2012, 8(6): 344-357. DOI:10.1089/ind.2012.0028 |
| [5] |
Keller A A, Mcferran S, Lazareva A, et al. Global life cycle releases of engineered nanomaterials[J]. Journal of Nanoparticle Research, 2013, 15(6): 1692. DOI:10.1007/s11051-013-1692-4 |
| [6] |
Khodakovskaya M V, De S K, Biris A S, et al. Carbon nanotubes induce growth enhancement of tobacco cells[J]. Acs Nano, 2012, 6(3): 2128-2135. DOI:10.1021/nn204643g |
| [7] |
Mahajan P, Dhoke S K, Khanna A S, et al. Effect of nano-ZnO particle suspension on growth of mung(Vigna radiata) and gram(Cicer arietinum) seedlings using plant agar method[J]. Journal of Nanotechnology, 2011(3): 696535. |
| [8] |
Sedghi M, Hadi M, Toluie S G, et al. Effect of nano zinc oxioxide on the germination parameters of soybean seeds under drought stress[J]. Annals of West University of Timioara, 2013, 16(2): 73-78. |
| [9] |
Prasad T N V K V, Sudhakar P, Sreenivasulu Y, et al. Effect of nanoscale zinc oxide particlees on the germination, growth and yield of peanut[J]. Journal of Plant Nutrition, 2012, 35(6): 905-927. DOI:10.1080/01904167.2012.663443 |
| [10] |
Raskar S, Shankar V. Effect of zinc oxide nanoparticles on cytology and seed germination in onion[J]. International of Journal of Current Microbiology and Applied Sciences, 2014, 3(2): 467-473. |
| [11] |
Xiang L, Zhao H, Li Y, et al. Effects of the size and morphology of zinc oxide nanoparticles on the germination of Chinese cabbage seeds[J]. Environmental Science and Pollution Research, 2015, 22(14): 10452-10462. DOI:10.1007/s11356-015-4172-9 |
| [12] |
Auld D S. Zinc coordination sphere in biochemicial zinc sites[J]. Biometals, 2001, 14(3/4): 271-313. DOI:10.1023/A:1012976615056 |
| [13] |
Rao S, Shekhawat G S. Toxicity of ZnO engineered nanoparticles and evaluation of their effect on growth, metabolism and tissue specific accumulation in Brassica juncea[J]. Journal of Environmental Chemical Engineering, 2014, 2(1): 105-114. DOI:10.1016/j.jece.2013.11.029 |
| [14] |
El-Ghamery A A, El-Kholy M A, El-Yousser M A A, et al. Evaluation of cytological effects of Zn2+ in relation to germination and root growth of Nigella sativa L[J]. Toxicology and Environmental Mutagenesis, 2003, 537(1): 29-41. DOI:10.1016/S1383-5718(03)00052-4 |
| [15] |
Munzuroglu O, Geckil H. Effects of metals on seed germination, root elongation, and coleoptile and hypocotyl growth in Triticum aestivum and Cucumis sativus[J]. Archives of Environmental Contamination & Toxicology, 2002, 43(2): 203-213. |
| [16] |
Thuesombat P, Hannongbua S, Akasit S, et al. Effect of silver nanoparticles on rice(Oryza sativa L. cv. KDML 105) seed germination and seedling growth[J]. Ecotoxicology and Environmental Safety, 2014, 104: 302-309. DOI:10.1016/j.ecoenv.2014.03.022 |
| [17] |
Du W, Yang J, Peng Q, et al. Comparison study of zinc nanoparticles and zinc sulphate on wheat growth: From toxicity and zinc biofortification[J]. Chemosphere, 2019, 227: 109-116. DOI:10.1016/j.chemosphere.2019.03.168 |
| [18] |
孙露莹, 宋凤斌, 李向楠, 等. 纳米氧化锌对玉米种子萌发及根系碳代谢的影响[J]. 土壤与作物, 2020, 9(1): 40-49. SUN Lu-ying, SONG Feng-bin, LI Xiang-nan, et al. Effects of ZnO nanoparticles on seed germination and root carbon metabolism in maize(Zea mays L.)[J]. Soils and Crops, 2020, 9(1): 40-49. |
| [19] |
Wang P, Menzies N W, Lombi E, et al. Fate of ZnO nanoparticles in soils and cowpea(Vigna unguiculata)[J]. Environmental Science & Technology, 2013, 47(23): 13822-13830. |
| [20] |
Lin D H, Xing B S. Phytotoxicity of nanoparticles: Inhibition of seed germination and root growth[J]. Environmental Pollution, 2007, 150(2): 243-250. DOI:10.1016/j.envpol.2007.01.016 |
| [21] |
Khodakovskaya M, Dervishi E, Mahmood M, et al. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth[J]. Acs Nano, 2012, 6(8): 3221-3227. |
| [22] |
Costa M V J D, Sharma P K. Effects of copper oxide nanoparticles on growth, morphology, photosynthesis, and antioxidant response in Oryza sativa[J]. Photosynthetica, 2016, 54(1): 110-119. DOI:10.1007/s11099-015-0167-5 |
| [23] |
Salehi H, Begoña Miras-Moreno, Rad A C, et al. Relatively low dosages of CeO2 nanoparticles in the solid medium induce adjustments in secondary metabolism and ionomic balance of bean(Phaseolus vulgaris L.) roots and leaves[J]. Journal of Agricultural and Food Chemistry, 2020, 68: 67-76. DOI:10.1021/acs.jafc.9b05107 |
| [24] |
Wang X P, Yang X Y, Chen S Y, et al. Zinc oxide nanoparticles affect biomass accumulation and photosynthesis in arabidopsis[J]. Frontiers in Plant Science, 2015, 6: 1243. |
| [25] |
汪洪, 金继运. 植物对锌吸收运输及积累的生理与分子机制[J]. 植物营养与肥料学报, 2009, 15(1): 225-235. WANG Hong, JIN Jiyun. The physiological and molecular mechanisms of zinc uptake, transport, and hyperaccumulation in plants: A review[J]. Plant Nutrition and Fertilizer Science, 2009, 15(1): 225-235. |
| [26] |
曹冲, 黄娟, 王宁, 等. 纳米氧化锌对湿地植物种子萌发的影响[J]. 东南大学学报(自然科学版), 2017, 47(2): 416-420. CAO Chong, HUANG Juan, WANG Ning, et al. Impact of zinc oxide nanoparticles on seed germination of wetland plant[J]. Journal of Southeast University (Natural Science Edition), 2017, 47(2): 416-420. |
| [27] |
Ma Y H, Kuang L L, He X, et al. Effects of rare earth oxide nanoparticles on root elongation of plants[J]. Chemospher, 2010, 78(3): 273-279. DOI:10.1016/j.chemosphere.2009.10.050 |
| [28] |
Wan J P, Wang R T, Wang R L, et al. Conmparative physiological and transcriptomic analyses reveal the toxic effects of ZnO nanoparticles on plant growth[J]. Environmental Science & Technology, 2019, 53: 4235-4244. |
| [29] |
Kurepa J, Paunesku T, Vogt S, et al. Uptake and distribution of ultrasmall anatase TiO2 alizarin red S nanoconjugates in Arabidopsis thaliana[J]. Nano Letters, 2010, 10(7): 2296-2302. DOI:10.1021/nl903518f |
| [30] |
Loepez-Moreno M L, Rosa G D L, Hernandez-Viezcas J A, et al. Evidence of the differential biotransformation and genotoxicity of ZnO and CeO2 nanoparticles on soybean(Glycine max) plants[J]. Environmental Science & Technology, 2010, 44(19): 7315-7320. |
| [31] |
林茂宏, 沈玫玫, 吴佳妮, 等. 纳米氧化锌对两种蔬菜种子发芽及幼苗生长的影响[J]. 农业资源与环境学报, 2020, 38(1): 72-78. LIN Mao-hong, SHEN Mei-mei, WU Jia-ni, et al. Effects of zinc oxide nanoparticles on germination and seedling growth of two vegetables[J]. Journal of Agricultural Resources and Environment, 2020, 38(1): 72-78. |
| [32] |
Bauhus J, Khanna P K, Menden N. Aboveground and belowground interactions in mixed plantations of Eucalyptus globulus and Acacia mearnsii[J]. Revue Canadienne De Recherche Forestière, 2000, 30(12): 1886-1894. DOI:10.1139/x00-141 |
| [33] |
代惠萍, 赵桦, 李军超, 等. 锌对紫花苜蓿生理生化特性的影响及积累能力研究[J]. 北方园艺, 2014(10): 50-53. DAI Hui-ping, ZHAO Hua, LI Jun-chao, et al. Effects of Zn on the physiological and biochemical characteristics and accumulation abilities of Medikago sativa L[J]. Northern Horticulture, 2014(10): 50-53. |
| [34] |
Wang H, Kou X, Pei Z, et al. Physiological effects of magnetite (Fe3O4) nanoparticles on perennial ryegrass(Lolium perenne L.) and pumpkin(Cucurbita mixta) plants[J]. Nanotoxicology, 2011, 5(1): 30-42. DOI:10.3109/17435390.2010.489206 |
| [35] |
Lv J, Zhang S, Luo L, et al. Accumulation, speciation and uptake pathway of ZnO nanoparticles in maize[J]. Environmental Science Nano, 2015, 2(1): 68-77. DOI:10.1039/C4EN00064A |
| [36] |
Murakami M, Ae N, Ishikawa T, et al. Phytoextraction of cadmium by rice(Oryza sativa L), soybean(Glycine max(L.) Merr), and maize (Zea mays L.)[J]. Environmental Pollution, 2007, 67: 748-754. |
| [37] |
Franklin N J, Rogers S C, Apte G E, et al. Comparative toxicity of nanoparticulate ZnO, bulk ZnO, and ZnCl2 to a freshwater microalga (Pseudokirchneriella subcapitata): The importance of the particle solubility[J]. Environmental Science & Technology, 2007, 41: 8484-8490. |
 2021, Vol. 40
2021, Vol. 40