2. 中国水产科学研究院淡水渔业研究中心, 中国水产科学研究院长江中下游渔业生态环境评价和资源养护重点实验室, 江苏 无锡 214081
2. Key Laboratory of Fishery Ecological Environment Assessment and Research Conservation in Middle and Lower Reaches of the Yangtze River, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
铜(Cu)是生物体必需的微量元素之一,在维持机体正常代谢、生长发育和增强免疫力等方面有不可替代的作用[1]。然而,Cu也是目前我国淡水渔业生态环境中污染形势最为严峻的重金属[2]。《2018年中国渔业生态环境状况公报》指出,我国江河天然重要渔业水域中Cu超标面积占所监测面积的8.7%(约4.4万hm2),Cu平均浓度为0.000 5~0.045 mg·L-1;湖泊、水库重要渔业水域中Cu超标面积占所监测面积的14.9%(约21万hm2),Cu平均浓度为0.000 6~0.014 mg·L-1[2]。这势必会威胁我国淡水水生生物安全以及人类健康。值得注意的是,Cu虽然是贝类等无脊椎动物的多种酶及血蓝蛋白的重要成分[3-4],但是当Cu积累超过一定阈值时,便会对贝类等无脊椎动物产生严重的毒性效应[5],甚至会显著降低其子代对Cu的耐受性[6]。
背角无齿蚌(Anodonta woodiana)是我国特有物种,目前在亚洲、欧洲、北美洲和中美洲广泛分布[7-10]。因其具有营底栖生活(活动范围狭小)、对重金属的高积累性[对重金属的积累性较褶纹冠蚌(Cristaria plicata)、圆顶珠蚌(Unio douglasiae)、斑马贻贝(Dreissena polymorpha)、三角帆蚌(Hypriosis cumingii)等贝类更强]及低代谢性、体内积累的重金属含量与水环境中重金属含量呈简单相关关系等优势,被筛选为“淡水贝类观察”研究体系[8-10]中的专用指示生物,已成功应用于水污染监测及毒理学研究[8-12]。本实验室前期研究表明,背角无齿蚌幼蚌较成蚌对重金属(Cu、Cd)毒性更为敏感[12-13],如Cu对幼蚌和成蚌的96 h-EC50分别为3.4 mg·L-1和22.1 mg·L-1,后者约是前者的7倍[12]。因此,背角无齿蚌幼蚌可能更适宜用于水环境Cu污染的毒性效应研究。
组织切片在水生生物毒理学研究中应用十分广泛,是一种十分高效便捷的组织损伤研究技术。目前,有关Cu胁迫对背角无齿蚌抗氧化酶影响、细胞损伤和组织积累方面的研究较多[14-16],然而组织切片的相关研究较少。因此本研究拟开展Cu对背角无齿蚌幼蚌的毒性实验,进而利用组织切片技术探究Cu对幼蚌鳃、斧足、外套膜和消化腺的组织损伤效应,以期为淡水渔业生态环境Cu污染监测模式动物开发以及水域生态环境污染评价提供科学依据。
1 材料与方法 1.1 实验动物背角无齿蚌幼蚌(1龄),壳长(6.4±0.4)cm,采自中国水产科学研究院淡水渔业研究中心南泉实验基地,人工养殖以及水环境条件参考文献[17]。
1.2 暴露实验鉴于我国尚没有淡水贝类毒性实验研究的标准方法,本研究参照被广泛认可的美国“Standard guide for conducting laboratory toxicity tests with freshwater mussel”(ASTM E2455-06)[18]开展Cu对背角无齿蚌幼蚌的毒性暴露。
用刷子清洗幼蚌贝壳上的附着物,暂养2周以适应实验条件,每日投喂一次小球藻(Chlorella vulgaris),小球藻的投喂量为4×108个·L-1。实验开始前3 d停止投喂,排空幼蚌肠道内容物。根据本实验室前期研究结果,Cu对背角无齿蚌幼蚌的96 h半效应浓度(96 h-EC50)为3.4 mg·L-1[12],以及我国渔业水质标准(GB 11607—1989)中Cu限量(0.01 mg·L-1),用人工配制软水(pH值7.3~7.5、硬度40~48 mg·L-1、碱度30~35 mg·L-1)[18]配制5个浓度(2.0、1.0、0.1、0.01、0.005 mg· L-1)的暴露组和1个对照组(0 mg·L-1)溶液,每组设置3个平行。实验在贝类重金属暴露系统中进行,每个一次成型的玻璃缸中加入8 L溶液及16只幼蚌。实验期间不投喂饵料,水温控制在(20±1)℃,光照和黑暗比为16 h∶8 h,光强为1 000 lx,溶氧量>5.0 mg·L-1。为保持Cu浓度稳定,每24 h将溶液全部更换。在24、48、72、96 h分别从各浓度组取3只幼蚌用于组织切片,并根据陈修报等[13]建立的背角无齿蚌幼蚌死亡判断标准(幼蚌双壳张开,用玻璃棒刺激不闭壳定义为死亡)监测幼蚌存活情况,实验期间无幼蚌发生死亡。
1.3 组织切片与观察解剖出幼蚌的鳃、外套膜、斧足及消化腺,放于组织20倍体积的波恩氏液中固定3 h,之后将组织块置于自来水下,流水过夜冲洗以去除固定液。用梯度乙醇(70% 1 h、80% 1 h、90% 40 min、95% 40 min、100% Ⅰ 20 min、100%Ⅱ 20 min)浸泡使组织脱水,用分析纯二甲苯将组织依次透明两次(每次透明10 min),二甲苯∶石蜡(1∶1)浸泡1 h,石蜡(62 ℃)浸蜡3 h,用ES300-1型包埋机(金华市华速科技有限公司)将组织包埋在石蜡块中,并用HS-3345型全自动切片机(金华市华速科技有限公司)切片,切片厚度为6 μm,水浴锅摊片,烘箱烘片,H.E染色(苏木精染色5 min,1% 盐酸乙醇分色8 s,自来水返蓝10 min,伊红染色45 s),中性树胶封片,显微镜下观察并拍照。本文参照李阳等[19]和Otludil等[20]报道的方法,以损伤效应最为明显的暴露96 h的蚌组织切片图体现各类组织结构的变化。
1.4 Cu浓度的测定实验开始前取各浓度组水样30 mL用于测定Cu实际浓度。使用7500ce型ICP-MS(Agilent,美国)测定Cu浓度,通过元素标准添加回收法确定测定精度(Cu回收率为108.4%)。实际测得的Cu浓度为2.1、1.0、0.1、0.01、0.003 mg·L-1。由于实际浓度和理论浓度总体很接近,因此本研究应用理论浓度。
2 结果与分析 2.1 Cu胁迫对鳃组织结构的影响背角无齿蚌的鳃主要由排列紧密的鳃丝构成。对照组鳃丝结构完整,鳃丝之间由丝间隔相连,其表面覆盖有大量纤毛,鳃丝内部由结缔组织以及各种血细胞组成(图 1A )。经24 h暴露,各浓度组鳃组织均未出现明显组织损伤。经48 h暴露,0.1 mg·L-1暴露组开始出现色素细胞增多,且色素细胞数量随着Cu浓度增加而逐渐增多;2.0 mg·L-1暴露组开始出现部分纤毛脱落。经72 h暴露,0.01 mg·L-1暴露组开始出现色素细胞增多;1.0 mg·L-1暴露组开始出现少量细胞空泡化和部分纤毛脱落;2 mg·L-1暴露组开始出现细胞坏死。经96 h暴露,0.01 mg·L-1暴露组色素细胞显著增多且细胞出现空泡化(图 1C);0.1 mg·L-1暴露组开始出现部分纤毛脱落且巨噬细胞增多(图 1D);1.0 mg·L-1暴露组巨噬细胞持续增多,细胞空泡化和纤毛脱落加剧(图 1E);2.0 mg·L-1暴露组鳃丝结构出现萎缩,纤毛脱落和细胞空泡化严重,结缔组织发生糜烂坏死(图 1F)。

|
A:0 mg·L-1;B:0.005 mg·L-1;C:0.01 mg·L-1;D:0.1 mg·L-1;E:1.0 mg·L-1;F:2.0 mg·L-1 Ci:纤毛;Ma:巨噬细胞;Pc:色素细胞;Cv:细胞空泡化;Ct:结缔组织;Gf:鳃丝 Ci: cilia; Ma: macrophages; Pc: pigment cell; Cv: cell vacuolization; Ct: connective tissue; Gf: Gill filament 图 1 Cu暴露96 h对背角无齿蚌幼蚌鳃组织结构的影响 Figure 1 Effect of Cu exposure 96 h on gill tissue structure of Anodonta woodiana juveniles |
斧足是背角无齿蚌的运动器官,主要由肌细胞组成,还存在一些色素细胞、黏液细胞及上皮细胞。实验结果表明,对照组斧足组织结构完整,肌细胞排列密集、核染色清晰,上皮细胞排列紧密,表面覆盖有大量纤毛(图 2A)。经24 h暴露,各浓度组斧足均未出现明显组织损伤。经48 h暴露,1.0 mg·L-1暴露组开始出现黏液细胞变形;2.0 mg·L-1暴露组开始出现黏液细胞变形以及上皮层损伤。经72 h暴露,1.0 mg· L-1暴露组黏液细胞变形加重;2.0 mg·L-1暴露组黏液细胞变形且上皮层损伤加重。经96 h暴露,0.005mg·L-1和0.01 mg·L-1暴露组的斧足均未出现明显损伤(图 2B和图 2C);0.1 mg·L-1暴露组开始出现细胞空泡化及上皮层损伤(图 2D);1.0 mg·L-1暴露组细胞空泡化以及上皮层损伤进一步加重(图 2E);2.0 mg·L-1暴露组上皮层损伤和细胞空泡化严重,空泡相互连接导致表皮细胞处出现断连,从而无法维持正常的组织形态(图 2F)。
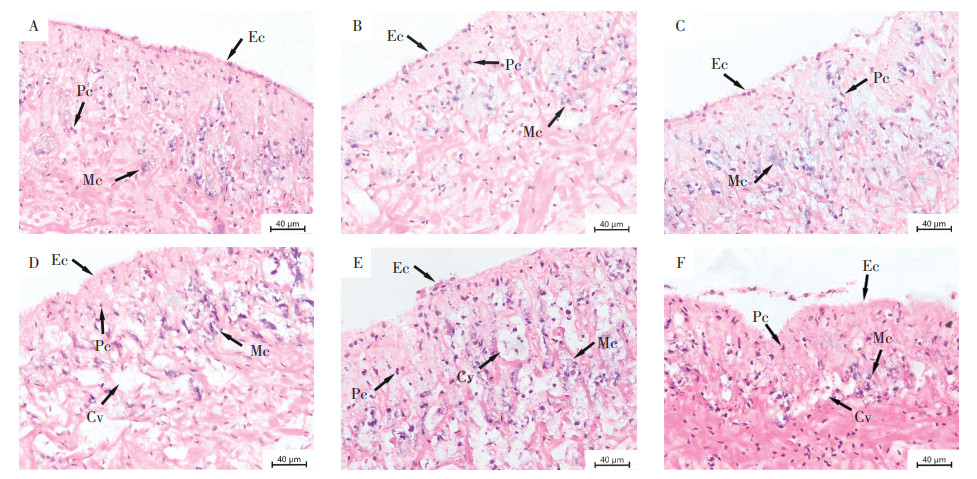
|
A:0 mg·L-1;B:0.005 mg·L-1;C:0.01 mg·L-1;D:0.1 mg·L-1;E:1.0 mg·L-1;F:2.0 mg·L-1 Ec:上皮细胞;Pc:色素细胞;Mc:黏液细胞;Cv:细胞空泡化。 Ec: epithelial cell; Pc: pigment cell; Mc: mucous cell; Cv: cell vacuolization 图 2 Cu暴露96 h对背角无齿蚌幼蚌斧足组织结构的影响 Figure 2 Effect of Cu exposure 96 h on histological structure of foot of Anodonta woodiana juveniles |
外套膜主要由内、外单层表皮及结缔组织组成,结缔组织中分布着色素细胞、巨噬细胞以及少量肌细胞。对照组外套膜组织结构始终保持完整,内外上皮层细胞排列紧密,表面覆盖有大量纤毛,少量色素细胞和巨噬细胞均匀地分布在结缔组织中(图 3A)。经24 h暴露,0.01 mg·L-1暴露组开始出现色素细胞增多,且色素细胞数量随暴露浓度的增加而增多。经过48 h和72 h暴露,各浓度组色素细胞持续增多。经96 h暴露,0.01 mg·L-1暴露组色素细胞和巨噬细胞显著增多(图 3C),0.1、1.0、2.0 mg·L-1暴露组色素细胞和巨噬细胞数量随着暴露浓度的升高而增加(图 3D至图 3F);2.0 mg·L-1暴露组开始出现上皮层损伤(图 3F)。
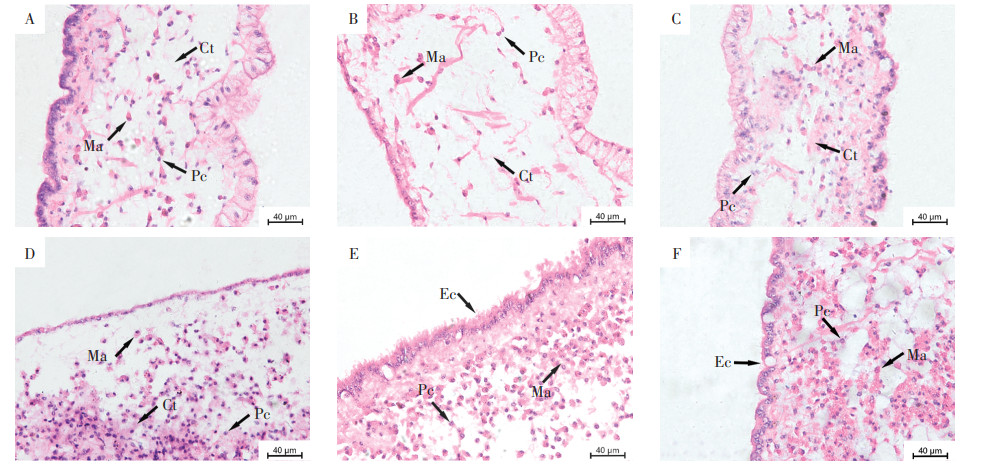
|
A:0 mg·L-1;B:0.005 mg·L-1;C:0.01 mg·L-1;D:0.1 mg·L-1;E:1 mg·L-1;F:2 mg·L-1 Pc:色素细胞;Ma:巨噬细胞;Ct:结缔组织;Ec:上皮细胞 Pc: pigment cell; Ma: macrophages; Ct: connective tissue; Ec: epithelial cell 图 3 Cu暴露96 h对背角无齿蚌幼蚌外套膜组织结构的影响 Figure 3 Effect of Cu exposure 96 h on the mantle tissue structure of Anodonta woodiana juveniles |
消化腺由消化小管、结缔组织和淋巴区域组成。对照组消化腺组织结构始终保持完整,小管上皮排列整齐,结缔组织充盈(图 4A)。经24、48、72 h暴露,各浓度组消化腺均未出现明显组织损伤。然而,经过96 h暴露,0.01 mg·L-1暴露组开始出现小管上皮细胞变形、淋巴区域扩大以及结缔组织萎缩(图 4C);0.1、1.0、2.0 mg·L-1暴露组开始出现小管上皮细胞变形以及结缔组织萎缩(图 4D至图 4F)。
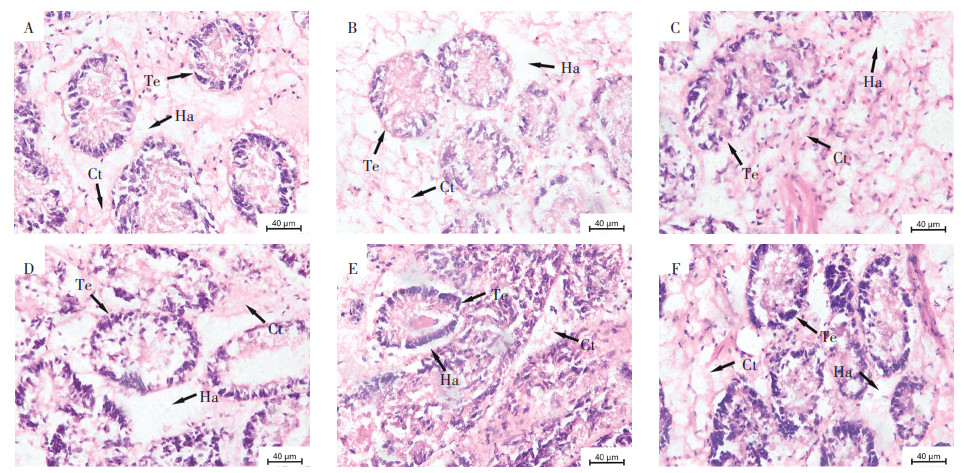
|
A:0 mg·L-1;B:0.005 mg·L-1;C:0.01 mg·L-1;D:0.1 mg·L-1;E:1 mg·L-1;F:2 mg·L-1 Ct:结缔组织;Ha:淋巴区域;Te:小管上皮细胞 Ct: connective tissue; Ha: hemolymphatic area; Te: tubule epithelium。 图 4 Cu暴露96 h对背角无齿蚌幼蚌消化腺组织结构的影响 Figure 4 Effect of Cu exposure 96 h on digestive gland structure of Anodonta woodiana juveniles |
Cu是生物必需元素,参与合成多种酶。然而,当Cu在生物体富集超过一定的阈值,就会对生物体产生严重的毒害作用。当Cu浓度达到0.005~0.01 mg· L-1时,就可能对无脊椎动物产生毒性[21]。需要高度重视的是,我国江河、湖泊、水库等重要渔业水域中Cu平均浓度为0.000 5~0.045 mg·L-1[2],超标率为8.7%(江河)~14.9%(湖泊、水库)[2],而养殖池塘中Cu浓度更是可高达2.0 mg·L-1[22]。本研究结果表明,当Cu浓度达到0.01 mg·L-1时,便会对背角无齿蚌幼蚌的鳃、外套膜和斧足产生明显的组织损伤,且损伤程度随着Cu浓度的升高和暴露时间的延长不断加重。值得注意的是,不同组织的损伤程度有明显差异,这可能与不同组织对元素积累具有特异性有关[23]。这与尖膀胱螺(Physa acuta)经Cu暴露的组织损伤结果相似[20]。
3.1 Cu对鳃的组织损伤效应随着Cu浓度的增加,鳃出现色素细胞和巨噬细胞增多、细胞空泡化、鳃丝萎缩以及结缔组织糜烂等现象。巨噬细胞增多一方面可以抵抗Cu对机体造成的损伤,另一方面其过量释放的酶也会破坏正常的组织结构、造成组织糜烂等现象。陈彩芳等[24]在以Cd胁迫泥蚶(Tegillarca granosa)的相关实验中也发现了相似的结果。对紫贻贝(Mytilus edulis)鳃的研究也表明,Cu胁迫会引起鳃组织发生炎症反应,造成血细胞增多、鳃丝膨大等现象[25]。李雨奎[26]研究发现,背角无齿蚌鳃受高浓度Cu胁迫会出现细胞空泡化和鳃丝受损严重的现象。相较于外套膜、消化腺和斧足,鳃是本实验中受损伤最严重的组织。这可能与该器官的特殊功能有关,鳃是主要的呼吸和滤水器官且与水体中的重金属离子接触最为频繁。水环境中的Cu可以通过离子通道主动运输、被动扩散或者与金属结合蛋白结合等途径转运到鳃中。Romeo等[27]研究表明Ruditapes decussatus的鳃对Cu的积累显著大于消化腺等其他器官。井维鑫[28]研究发现,鳃是背角无齿蚌Cd积累量最高的器官之一。在对花鳅(Cobitis taenia)的研究中发现,鳃和肝脏的Cu积累量随Cu浓度的增加而增加,且鳃积累量大于肝脏积累量[29]。综上所述,鳃可能是背角无齿蚌幼蚌主要的Cu富集器官之一且对Cu毒性灵敏,适宜用作淡水渔业生态环境Cu污染监测和毒性评价的靶器官。
3.2 Cu对斧足的组织损伤效应本研究发现斧足经Cu胁迫会出现黏液细胞变形、细胞空泡化以及上皮层损伤等现象。黏液分泌增加是背角无齿蚌对多种类型压力(包括物理刺激、化学刺激)的主要响应方式之一。低浓度Cu胁迫时,黏液细胞分泌量增加,分泌黏液以隔绝水体,减少水体重金属对机体影响。高浓度Cu胁迫时,表层的黏液和机体的代谢已经难以抵抗Cu的毒性损伤,造成斧足细胞空泡化以及上皮层损伤。
3.3 Cu对外套膜的组织损伤效应Cu对背角无齿蚌外套膜的毒性效应表现为色素细胞、巨噬细胞增多以及上皮层损伤等。以Cd胁迫背角无齿蚌也发现了相似的结果[30]。这与其他贝类的研究结果相一致,例如通过对尖膀胱螺进行Cu暴露发现外套膜先是出现色素细胞增多,后随Cu浓度增加和暴露时间的延长而出现细胞空泡化、上皮层损伤甚至坏死[20]。外套膜在0.01 mg·L-1暴露组,经24 h暴露就开始出现色素细胞增多现象,可能是因为外套膜与外界水体接触面积较大所引起的。然而,随着Cu浓度增加和暴露时间延长,组织损伤程度没有明显加重,推测可能是因为外套膜表面覆盖的纤毛起到了一定的屏障作用,大量的色素细胞和巨噬细胞也可以抵抗Cu胁迫对组织造成的损伤。
3.4 Cu对消化腺的组织损伤效应消化腺是产生消化酶、吸收养分、产生生物转化酶以及金属储存和解毒的关键新陈代谢器官。本研究结果显示背角无齿蚌幼蚌的消化腺在所有暴露组的前72 h内均未出现明显组织损伤,直到暴露96 h时在0.1 mg·L-1暴露组才开始出现小管上皮细胞变形和结缔组织萎缩现象。相较于其他器官,消化腺对Cu胁迫的敏感性较弱,可能是因为消化腺不与水体直接接触,且消化腺中存在一种黄色颗粒是重金属的储存场所,研究认为其与各种金属硫蛋白或脂褐素颗粒螯合使重金属污染物解毒的机制有关[31]。因此,Cu对幼蚌消化腺毒性损伤较弱,消化腺组织损伤程度不明显。
4 结论(1)迄今报道的我国有8.7% 的江河天然重要渔业水域,以及14.9% 的湖泊、水库重要渔业水域中Cu超标,这些水域中Cu浓度已高于可导致背角无齿蚌幼蚌发生组织损伤效应的水平。
(2)背角无齿蚌幼蚌对Cu毒性响应灵敏,其中鳃相较于其他组织对Cu毒性最为敏感,适宜用作淡水渔业生态环境Cu污染监测的靶器官。
| [1] |
吕静雅, 王璞, 赵文博, 等. 饲料级硫酸铜中二噁英类多氯联苯的污染特征及其来源研究[J]. 环境科学学报, 2020, 40(4): 1500-1506. LÜ Jing-ya, WANG Pu, ZHAO Wen-bo, et al. Characteristics and source of dioxin-like PCBs in the feed grade cupric sulfates[J]. Acta Scientiae Circumstantiae, 2020, 40(4): 1500-1506. |
| [2] |
农业农村部, 生态环境部. 2018中国渔业生态环境状况公报[R]. 北京: 中国水产科学研究院(农业农村部渔业生态环境监测中心), 2019: 18-33. Ministry of Agriculture and Rural Affairs, Ministry of Ecology and Environment. 2018 report on the state of the fishery ecoenvironment in China[R]. Beijing: Chinese Academy of Fishery Sciences (Fishery Eco-Environment Monitoring Center), 2019: 18-33. |
| [3] |
Jurgen M. Evolution of molluscan hemocyanin structures[J]. Biochimica et Biophysica Acta, 2013, 1834(9): 1840-1852. DOI:10.1016/j.bbapap.2013.02.020 |
| [4] |
Kato S, Matsui T, Gatsogiannis C, et al. Molluscan hemocyanin: Structure, evolution, and physiology[J]. Biophysical Reviews, 2018, 10(2): 191-202. DOI:10.1007/s12551-017-0349-4 |
| [5] |
Zuniga M, Vallejos P, Larraín A, et al. Toxicity of copper on four Chilean marine mussels[J]. Bulletin of Environmental Contamination and Toxicology, 2003, 71(6): 1167-1174. DOI:10.1007/s00128-003-8248-8 |
| [6] |
Osborne R K, Gillis P L, Prosser R S. Transgenerational effects of copper on a freshwater gastropod, Planorbella pilsbryi[J]. Freshwater Mollusk Biology and Conservation, 2020, 23(1): 42-54. DOI:10.31931/fmbc.v22i2.2020.42-54 |
| [7] |
陈修报, 郑浩然, 王洋, 等. 基于原代培养背角无齿蚌鳃细胞的镉毒性效应评价[J]. 环境科学学报, 2020, 40(7): 2665-2670. CHEN Xiu-bao, ZHENG Hao-ran, WANG Yang, et al. Cytotoxicity assessment of cadmium on primary gill cell culture from Anodonta woodiana[J]. Acta Scientiae Circumstantiae, 2020, 40(7): 2665-2670. |
| [8] |
杨健, 王慧, 朱宏宇, 等. 背角无齿蚌(Anodonta woodiana)在五里湖中的重金属富集[J]. 长江流域资源与环境, 2005, 14(3): 362-366. YANG Jian, WANG Hui, ZHU Hong-yu, et al. Bioaccumulation of heavy metals in Anodonta woodiana from Wulihu area of Taihu Lake[J]. Resources and Environment in the Yangtze Basin, 2005, 14(3): 362-366. |
| [9] |
Yang J, Harino H, Liu H B, et al. Monitoring the organotin contamination in the Taihu Lake of China by bivalve mussel Anodonta woodiana[J]. Bulletin of Environmental Contamination and Toxicology, 2008, 81(2): 164-168. DOI:10.1007/s00128-008-9464-z |
| [10] |
陈修报, 杨健, 刘洪波, 等. "淡水贝类观察"——生物阐释水污染和毒理的创新手段[J]. 湖泊科学, 2021, 33(1): 11-27. CHEN Xiu-bao, YANG Jian, LIU Hong-bo, et al. "Freshwater Mussel Watch": An innovative approach for interpretations of aquatic pollution and toxicology[J]. Journal of Lake Sciences, 2021, 33(1): 11-27. |
| [11] |
陈修报, 苏彦平, 孙磊, 等. 不同污染背景生境中背角无齿蚌的重金属积累特征[J]. 农业环境科学学报, 2013, 32(5): 1060-1067. CHEN Xiu-bao, SU Yan-ping, SUN Lei, et al. Bioaccumulation characteristics of heavy metals in bivalve Anodonta woodiana from different habitats with different pollution backgrounds[J]. Journal of AgroEnvironment Science, 2013, 32(5): 1060-1067. |
| [12] |
Liu H B, Chen X B, Oshima Y J. Biochemical changes in Chinese pond mussel Anodonta woodiana following exposure to copper[J]. Journal of the Faculty of Agriculture Kyushu University, 2018, 63(2): 311-318. DOI:10.5109/1955400 |
| [13] |
陈修报, 刘洪波, 苏彦平, 等. 镉对"标准化" 背角无齿蚌的急性毒性及脂质过氧化和DNA损伤的影响[J]. 农业环境科学学报, 2017, 36(10): 1960-1967. CHEN Xiu-bao, LIU Hong-bo, SU Yan-ping, et al. Acute toxicity of cadmium and its effects on lipid peroxidation and DNA damage in"standardized"Anodonta woodiana[J]. Journal of Agro-Environmental Science, 2017, 36(10): 1960-1967. DOI:10.11654/jaes.2017-0430 |
| [14] |
林子根, 井维鑫, 王兰. 亚慢性铜暴露对背角无齿蚌鳃抗氧化系统的影响[J]. 农业环境科学学报, 2019, 38(6): 1233-1239. LIN Zigen, JING Wei-xin, WANG Lan. Effect of sub-chronic copper exposure on the antioxidant system in the gills of Anodonta woodiana[J]. Journal of Agro-Environment Science, 2019, 38(6): 1233-1239. |
| [15] |
柏鸣, 石安静. 硫酸铜和酸碱度对河蚌血细胞免疫功能影响的研究[J]. 四川大学学报(自然科学版), 1999, 36(6): 3-5. BAI Ming, SHI An-jing. A study on the effects of copper sulfate and pH value on the immune capability of oyster blood[J]. Journal of Sichuan University (Natural Science Edition), 1999, 36(6): 3-5. |
| [16] |
王魏根, 王丽珍, 刘永定, 等. 椭圆背角无齿蚌对重金属元素的积累作用[J]. 云南大学学报(自然科学版), 2004, 26(6): 541-543. WANG Wei-gen, WANG Li-zhen, LIU Yong-ding, et al. Accumulation of metals in a clam Anodonta woodiana elliptica bred in Dianchi lake water[J]. Journal of Yunnan University(Natural Sciences Edition), 2004, 26(6): 541-543. |
| [17] |
Chen X B, Liu H B, Su Y P, et al. Morphological development and growth of the freshwater mussel Anodonta woodiana from early juvenile to adult[J]. Invertebrate Reproduction & Development, 2015, 59(3): 131-140. |
| [18] |
American Society for Testing and Materials. Standard guide for conducting laboratory toxicity tests with freshwater mussel[S]. American: Special Technical Report, 2009.
|
| [19] |
李阳, 薛素燕, 李加琦, 等. Cu2+胁迫对魁蚶生理生化和组织结构的影响[J]. 水产学报, 2018, 42(10): 1531-1540. LI Yang, XUE Su-yan, LI Jia-qi, et al. Effect of Cu2+ stress on physiology biochemistry and histopathological structure of Scapharca broughtonii[J]. Journal of Fisheries of China, 2018, 42(10): 1531-1540. |
| [20] |
Otludil B, Ayaz S. Effect of copper sulphate(CuSO4) on freshwater snail, Physa acuta draparnaud, 1805:A histopathological evaluation[J]. Bulletin of Environmental Contamination and Toxicology, 2020, 104(6): 738-747. DOI:10.1007/s00128-020-02846-5 |
| [21] |
Qadri H, Bhat R A, Mehmood M A, et al. Fresh water pollution dynamics and remediation[M]. Singapore: Springer Nature Singapore Pte Ltd, 2020: 27-50.
|
| [22] |
Li N, Zhao Y L, Yang J. Impact of waterborne copper on the structure of gills and hepatopancreas and its impact on the content of metallothionein in juvenile giant freshwater prawn Macrobrachium rosenbergii (Crustacea: Decapoda)[J]. Archives of Environmental Contamination and Toxicology, 2007, 52(1): 73-79. DOI:10.1007/s00244-005-0214-5 |
| [23] |
李威, 杨健, 陈修报, 等. 背角无齿蚌组织中的元素分布研究[J]. 农业环境科学学报, 2010, 29(3): 597-603. LI Wei, YANG Jian, CHEN Xiu-bao, et al. The distribution of elements in the tissues of mussel Anodonta woodiana[J]. Journal of Agro-Environment Science, 2010, 29(3): 597-603. |
| [24] |
陈彩芳, 沈伟良, 霍礼辉, 等. 重金属离子Cd2+对泥蚶鳃及肝脏细胞显微和超微结构的影响[J]. 水产学报, 2012, 36(4): 522-528. CHEN Cai-fang, SHEN Wei-liang, HUO Li-hui, et al. Effects of cadmium on the microstructure and ultrastructure of gill and hepatopancreas in Tegillarca granosa[J]. Journal of Fisheries of China, 2012, 36(4): 522-528. |
| [25] |
Inke S. Acute histological responses of the gill of the mussel, Mytilus edulis, to exposure by environmental pollutants[J]. Journal of Invertebrate Pathology, 1988, 52(1): 137-141. DOI:10.1016/0022-2011(88)90112-7 |
| [26] |
李雨奎. 硫酸铜对椭圆背角无齿蚌鳃的组织结构的影响[J]. 淮北煤炭师范学院学报(自然科学版), 2010, 31(4): 36-40. LI Yukui. The effects of heavy metal copper on histological structure of gills Anodonta woodiana elliptica[J]. Journal of Huaibei Coal Industry Teachers College (Natural Science), 2010, 31(4): 36-40. |
| [27] |
Romeo M, Gnassia-Barelli M. Metal distribution in different tissues and in subcellular fractions of the Mediterranean clam Ruditapes decussatus treated with cadmium, copper, or zinc[J]. Comparative Biochemistry and Physiology. Part C: Comparative Pharmacology and Toxicology, 1995, 111(3): 457-463. |
| [28] |
井维鑫. 亚慢性镉胁迫背角无齿蚌的氧化应激与机制研究[D]. 太原: 山西大学, 2019: 39-50. JING Wei-xin. Study on oxidative stress and mechanism in the freshwater mussel Anodonta woodiana exposed to subchronic cadmium[D]. Taiyuan: Shanxi University, 2019: 39-50. |
| [29] |
赵云龙, 李琳琪, 乔淑芬, 等. 铜离子对花鳅急性毒性研究[J]. 水产学杂志, 2020, 33(5): 65-69. ZHAO Yun-long, LI Lin-qi, QIAO Shu-fen, et al. Acute toxicity of copper ion to spined loach Cobitis taenia[J]. Chinese Journal of Fisheries, 2020, 33(5): 65-69. |
| [30] |
邢慧芳. 镉对背角无齿蚌(Anodonta woodiana)主要组织器官的毒性研究[D]. 太原: 山西大学, 2013: 39-42. XING Hui-fang. Effects of cadmium on the main tissues of the freshwater bivalve Anodonta woodiana[D]. Taiyuan: Shanxi University, 2013: 39-42. |
| [31] |
AbdAllah A T, Moustafa M A. Accumulation of lead and cadmium in the marine prosobranch Nerita saxtilis, chemical analysis, light and electron microscopy[J]. Environmental Pollution, 2002, 116(2): 185-191. |
 2021, Vol. 40
2021, Vol. 40


