2. 四川大学建筑与环境学院, 成都 610065
2. College of Architecture and Environment, Sichuan University, Chengdu 610065, China
钒是一种普遍存在于环境中的过渡元素,在现代工业中有着广泛应用,如钢铁、颜料、催化剂和药物等[1-2]。通常,钒以多种价态存在(如−1、0、+2、+3、+4、+5)[3],且其毒性随价态及溶解性的升高而增强,五价钒毒性最强[4-5]。钒是人和动物的必需元素,但超量会危害动植物生长[6-7],前人研究已证实了高浓度钒的致癌性和毒性。近年来,钒资源的广泛开采和利用,使得环境钒含量逐渐增多[8]。钒对环境的污染是全球性的环境问题,是涉及环境保护和经济效益的重大问题[9]。钒已被视为是一种与汞、铅和砷同等级的潜在危险污染物[10-11]。
环境中的钒源自母岩风化、化石燃料燃烧、钒钛磁铁矿开采及包括钢铁冶炼、电子、染色等的高温工业活动[12]。环境中钒的年排放量约为2.3×108 kg,其中一半以上沉积于土壤中,从而导致土壤钒浓度升高[13-14],而钒污染土壤可通过雨水淋溶导致地表水或地下水污染[15]。因此,环境中钒浓度的增加将对生物(包括人类、动物、植物及微生物)产生不利影响[3]。钒会使人产生恶心、轻度腹泻、胃痉挛等症状,人体内过量钒会增加肺癌发生的几率[14];高浓度钒也会对动物带来负面影响,如食欲不振、脱水、腹泻、自然流产等[16]。对植物而言,正如许多其他元素一样,微量钒有利于植物生长,其能促进叶绿素的合成、矿物元素的吸收和氮的同化[17],而高浓度钒则会抑制植物生长[11]。
鉴于环境中日益增多的钒可能引发的环境和健康问题,钒污染环境修复问题亟待解决。通常,钒污染环境修复包括物理-化学和生物等方法[18]。植物修复钒污染环境由于具有诸多优点(如投资少、环保、可持续等)[19-20]而备受关注,但其也存在一些瓶颈,如修复植物生物量普遍偏小、生长缓慢等。因此,修复植物的筛选对于植物修复而言极为关键。前人就植物修复钒污染环境进行了较深入的研究并取得了丰硕成果,如一些潜在钒超富集植物(Setaria viridis[21]、Phaseolus vulgaris L.[22]等)的发现及钒抗性内生菌(PRE01)[19]的分离等。但总体而言,目前发现的钒(潜在)超富集植物数目依旧较少,钒超富集植物的探寻进程远滞后于钒应用而带来的环境污染问题。因此,需进一步加大钒(潜在)超富集植物筛选力度,同时对一些抗逆能力较强的非超富集植物而言,探究植物钒胁迫响应及钒积累与转移特征对于应用其修复钒污染环境同样具有重要意义。紫花苜蓿是一种耐旱、耐寒、多年生草本饲用豆科植物[23],具有重要的生态价值、营养价值和重金属植物修复潜力[24]。先前的研究表明紫花苜蓿具有耐受多种重金属(如镍、镉、锌等)胁迫及高浓度钒胁迫的能力[25-26]。紫花苜蓿为多年生牧草作物,其生长迅速,且具有每年可多次大量收获等优势[27],这在极大程度上弥补了大多数修复植物生物量偏小、生长缓慢等劣势。因此,钒胁迫下紫花苜蓿生长响应特征的研究,特别是明确不同浓度钒胁迫时植株地上部、根部钒提取量及提取量占比的变化规律对于因地制宜地通过刈割紫花苜蓿地上部从而高效去除环境钒污染物具有重要意义。
因此,本文以紫花苜蓿为试材,采用水培方式探究了不同浓度钒胁迫对紫花苜蓿生长(包括株高、根长、叶绿体色素、光合气体参数、膜脂过氧化、膜透性、生物量)及钒在植株体内积累与转移的影响,从而更全面地明确钒胁迫下植株的生长响应特征,最终为通过紫花苜蓿修复钒环境污染提供理论依据。
1 材料与方法 1.1 试验设计试验于2019年3月在四川大学建筑与环境学院以溶液培养方式进行。紫花苜蓿种子源自中国农科院,种子萌发在人工气候培养箱(PRX-350A,宁波赛福实验仪器有限公司,中国)进行,温度为白天23 ℃、晚上18 ℃,湿度为白天70%、晚上80%,14 h光周期(光强约60 μmol·m-2·s-1)和10 h暗周期。
种子出芽前,每日用去离子水浇3次。发芽结束后用1/4强度改良霍格兰营养液(pH 6.5±0.1)浇灌。当发芽的幼苗长约2 cm时开始移苗。移苗过程借助人工修剪的海绵薄片进行。移苗后转入室内培养,室内温度为白天28 ℃、晚上18 ℃,光暗时长为光照(14± 1)h/黑暗(10±1)h。每盆移栽30株长势接近的幼苗,为缓解移栽过程对小苗产生的影响,移栽后的小苗在1/2强度改良完全霍格兰营养液中培养2周。之后将幼苗在改良的完全霍格兰营养液中培养1个月以获得较大生物量。在幼苗高约15 cm时将每盆稀苗为20株并开始钒胁迫处理,处理前幼苗均无营养缺乏或病理等症状。钒(以NaVO3·2H2O形式加入)处理包括0.1、0.5、2.0、4.0、10.0 mg·L-1 V和对照(不加钒)。试验期间每隔2 d更换一次营养液(每次每盆加1 L营养液)。本研究为完全随机区组设计,共6个处理,每个处理重复3次,即总共18盆植物。试验过程中所有塑料盆用黑色聚乙烯塑料袋包裹以模拟根系生长的暗环境。
幼苗在含不同浓度钒的营养液中培养50 d后收获。每棵植株分根、茎、叶三部分。根、茎、叶先用去离子水冲洗3 min,之后将根在0.02 mol · L-1 Na2 - EDTA溶液中浸泡30 min以去除吸附在其表面的钒,接着用二次去离子水仔细冲洗3次。经吸水纸吸干植物表面残留水后称其鲜质量,最后将鲜样在烘箱中于80 ℃恒温烘至恒质量(烘约72 h)并称组织干质量。烘干后混合每盆植株的相同组织并用石英研钵磨成粉末,过0.2 mm尼龙筛后干燥器内保存备用。
1.2 测定指标株高、根长测定:用直尺从茎基部到植株顶部和主根末端分别测最大株高和最长根长。
随机选取每个处理的植株若干,从顶端起向下取其第3~5片叶子用于各项指标的测定。
叶绿体色素测定:参照Lichtenthaler等[28]的方法。
光合气体参数测定:选择晴朗无云的早晨(9:00— 12:00)用便携式光合仪(GFS-3000,Walz公司,德国)测定苜蓿叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)及胞间CO2浓度(Ci)。
膜质过氧化产物丙二醛(MDA)含量测定:参照Zhang等[29]的方法。
叶片相对电导率(REC)测定:参照Ning等[30]方法。植物各组织钒浓度测定:采用智能微波消解仪(TOPEX+,PREEKEM,中国)消解植物各组织干样。所得消解液用二次去离子水稀释至50 mL,通过ICP-MS(NexION 300x,PerkinElmer,美国)测定稀释液钒浓度。溶液中钒检出限为0.1 μg·L-1。植物组织钒浓度测定过程用国家标准试样(GBW 10021)进行质控,钒标准回收率为97.4%~108.6%。
1.3 试验材料聚乙烯塑料容器(上口内径15.4 cm,下底内径13.2 cm,高15.0 cm)。试验所用试剂均为分析纯,购买于科龙化工试剂有限公司(成都),包括硝酸钙[Ca(NO3)2·4H2O]、磷酸二氢铵(NH4H2PO4)、硫酸镁(MgSO4 · 7H2O)、硼酸(H3BO3)、硫酸亚铁(FeSO4 · 7H2O)、乙二胺四乙酸二钠(C10H14N2O8Na2·2H2O)、硫酸锌(ZnSO4·7H2O)、硫酸铜(CuSO4·5H2O)、钼酸铵([NH4)6Mo7O24·4H2O]、氢氧化钠(NaOH)、盐酸(HCl)、偏钒酸钠(NaVO3·2H2O)。改良完全霍格兰营养液配方参见文献[11]。
1.4 数据分析及处理方法采用Microsoft Excel 2013软件处理数据,并通过Origin 2020和AI软件绘图,采用SAS 9.4统计软件对数据进行单因素方差分析和多重比较(Duncan,P < 0.05)。
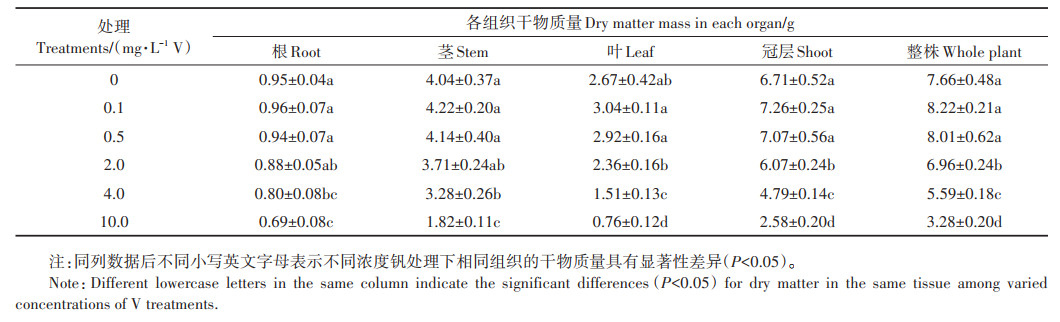
2 结果与分析 2.1 钒胁迫对株高、根长的影响不同浓度钒胁迫对紫花苜蓿株高和根长的影响有所差异(图 1)。在 < 4.0 mg·L-1 V时,各浓度处理的株高无明显变化(P>0.05),当钒浓度≥4.0 mg·L-1 V时,与对照相比,株高显著降低(P < 0.05)。而根长随钒浓度的增加先增加后降低。在≥0.5 mg·L-1 V时根长显著减小(P < 0.05)。与对照相比,株高在4.0 mg· L-1 V和10.0 mg·L-1 V处理时分别显著降低13.5% 和41.2%;根长在0.5、2.0、4.0、10.0 mg·L-1 V处理时分别显著降低14.4%、30.9%、33.1%、37.7%。
|
直方柱上方不同小写英文字母表示相同指标在不同处理下具有显著性差异(P < 0.05)。下同 Different lowercase letters on the histograms indicate significant differences for the same parameters among different treatments(P < 0.05). The same below 图 1 钒胁迫对苜蓿株高和根长的影响 Figure 1 Effect of vanadium stress on plant height and root length of alfalfa seedlings |
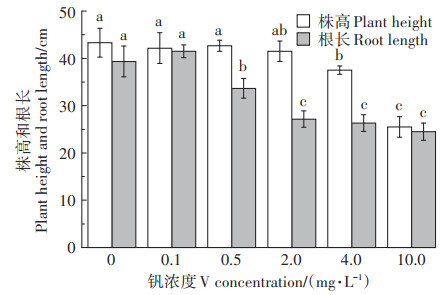
叶绿素a、b与类胡萝卜素变化趋势相似,均先升高后降低(图 2)。与对照相比,当钒浓度≤2.0 mg·L-1 V时,叶绿素a、b及类胡萝卜素含量无明显变化(P>0.05)。当钒浓度≥4.0 mg·L-1 V时叶绿素a、b及类胡萝卜素含量显著降低(P < 0.05)。在0.1 mg·L-1 V和0.5 mg·L-1 V处理时叶绿素a、b及类胡萝卜素含量略有升高(P>0.05)。即钒浓度≤2.0 mg·L-1 V时其对苜蓿叶绿体色素合成的影响不显著(P>0.05)。与对照相比,4.0 mg·L-1 V和10.0 mg·L-1 V处理时叶绿素a、b及类胡萝卜素分别显著降低39.4%、20.8%、33.7% 和76.7%、73.8%、71.3%。
|
图 2 钒胁迫对紫花苜蓿叶绿素a、b及类胡萝卜素含量的影响 Figure 2 Effect of vanadium stress on the content of chlorophyll a, b, and carotenoid of alfalfa seedlings |
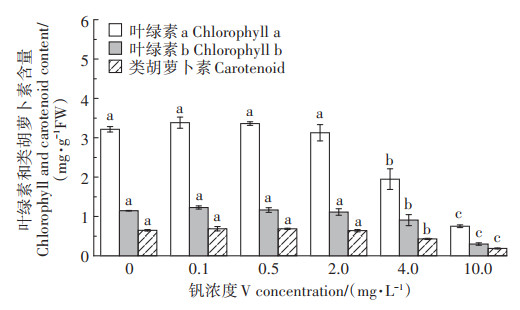
不同浓度钒胁迫对苜蓿叶片蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)及净光合速率(Pn)的影响如图 3所示。由图 3可知,Tr、Gs、Ci和Pn整体变化趋势一致均先升高后降低。与对照相比,Tr、Gs、Ci和Pn在低浓度钒(≤0.5 mg·L-1 V)处理时有所增加(P>0.05),但在高浓度(≥2.0 mg·L-1 V)时逐渐降低。气孔导度增大有助于增强蒸腾作用,从而促进植株对水分及矿物元素的吸收,故随水分进入植物体内的钒也相应增加,其毒性效应逐渐增大。相反,叶片气孔导度减小会降低植物蒸腾作用从而抑制植株对水分的吸收,特别是在10.0 mg · L-1 V时,Gs显著降低74.2%(P < 0.05),相应的Tr显著降低72.4%(P < 0.05)。因此,高浓度钒胁迫下植株通过大幅减小气孔导度,显著抑制蒸腾作用以减少随水分及养分吸收而进入植株体内的钒,从而极大地缓解了钒毒性效应。与对照相比,Tr、Gs和Pn在≥4.0 mg·L-1 V时显著降低(P < 0.05),而Ci仅在10.0 mg · L-1 V时显著降低(P < 0.05)。另外,蒸腾作用是植物吸收水分与矿物质的主要驱动力,由于气孔导度降低,植物对水分、养分的吸收将受到抑制,因而也影响了植物生物质生产。
|
图 3 钒胁迫对紫花苜蓿叶片光合气体参数的影响 Figure 3 Effect of vanadium stress on photosynthetic gas parameters of alfalfa leaf |
膜脂过氧化产物丙二醛(MDA)含量和叶片相对电导率均随钒浓度的增加而增加,并在4.0 mg·L-1 V时差异均达显著水平(P < 0.05,图 4)。0.1 mg·L-1 V时MDA含量和叶片相对电导率变化较小,与对照相比分别增加1.6% 和4.5%(P>0.05)。但随钒浓度的升高,叶片膜脂过氧化程度不断加重,细胞膜透性不断增大。与对照相比,4.0 mg·L-1 V和10.0 mg·L-1 V时叶片MDA含量分别增加0.8倍和3.3倍(P < 0.05),叶片相对电导率分别增加1.5倍和3.8倍(P < 0.05)。可见,高浓度钒(≥4.0 mg·L-1 V)胁迫明显增加了苜蓿叶片的膜脂过氧化程度,同时细胞膜透性也显著增大。
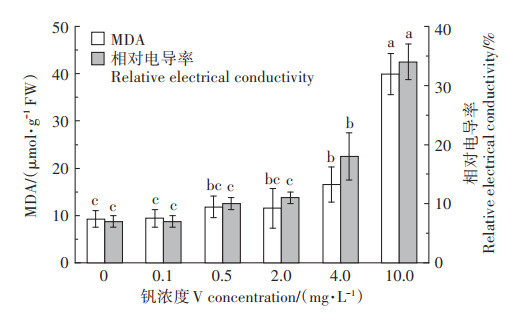
|
图 4 钒胁迫对叶片膜脂过氧化及质膜透性的影响 Figure 4 Effect of vanadium stress on membrane lipid peroxidation and lipid membrane permeability of the alfalfa leaf |
根、茎、叶钒浓度均随溶液钒浓度的增加而增加(图 5)。对照处理时各组织钒浓度为叶>根>茎,即植株吸收溶液中微量钒并转移至地上部的能力较强,而钒处理组各器官浓度为根>茎>叶。在0、0.1、0.5、2.0、4.0 mg·L-1 V和10.0 mg·L-1 V处理时根系钒浓度分别为0.4、3.9、31.5、152.9、345.2 mg · kg-1和647.0 mg · kg-1,其分别为对应浓度处理下茎部钒浓度(0.2、1.6、9.2、55.7、127.3 mg·kg-1和235.7 mg·kg-1)的2.0、2.4、3.4、2.7、2.7倍和2.7倍,叶片钒浓度(0.6、1.3、8.7、37.3、86.8 mg · kg-1和100.1 mg · kg-1)的0.7、3.0、3.6、4.1、4.0倍和6.5倍。
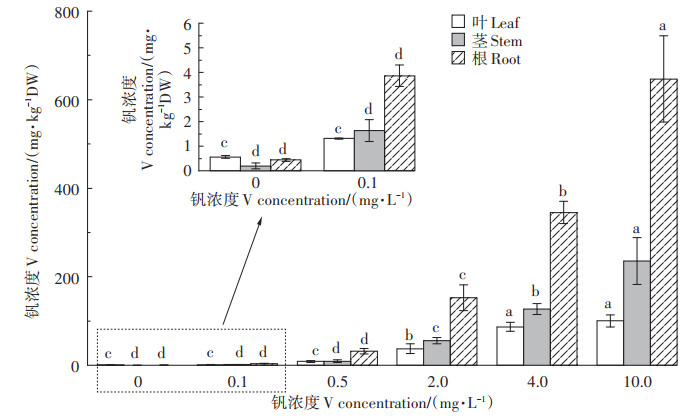
|
图 5 钒胁迫对紫花苜蓿各组织钒浓度的影响 Figure 5 Effect of vanadium stress on vanadium concentration in plant tissues of alfalfa |
转移系数(TF)随溶液钒浓度的增加先降低后有所升高,在0.5 mg·L-1 V时降至最低(图 6)。与对照相比,TF在0.1、0.5、2.0、4.0、10.0 mg·L-1 V处理时分别显著降低49.0%、63.9%、58.9%、57.4%、60.3%(P < 0.05)。钒浓度≥0.1 mg·L-1 V时,各处理之间TF无显著差异(P>0.05)。随溶液钒浓度的增加,植株吸收的钒不断增多,毒性效应逐渐增强。为缓解植株地上部因过多钒积累而引发的毒性效应,钒从根部向地上部转移减弱,因而根系吸收的钒进一步增多,这与在≥0.5 mg·L-1 V时根长显著受抑制相符合(图 1)。
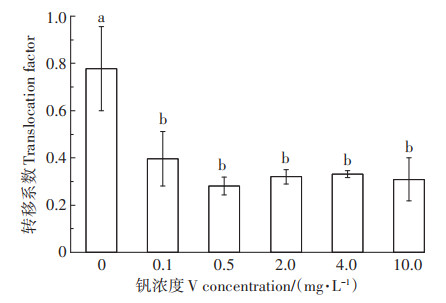
|
图 6 钒胁迫对紫花苜蓿钒转移系数的影响 Figure 6 Effect of vanadium stress on translocation factor(TF)of vanadium by alfalfa |
每盆植株根系及总的钒提取量随钒浓度的增加而增加,而冠层钒提取量随钒浓度的增加先升高后降低,在4.0 mg·L-1 V时达到最大(图 7)。可见4.0 mg· L-1 V时植株将根系钒转移至地上部的能力较强。当钒浓度≥0.5 mg·L-1 V时,每盆植株冠层及总的钒提取量显著(P < 0.05)高于对照,根系钒吸收量在≥2.0 mg· L-1 V时显著(P < 0.05)高于对照(图 7)。在0、0.1、0.5、2.0、4.0、10.0 mg·L-1 V处理时每盆植株根系钒吸收量分别为4.0×10-4、3.7×10-3、2.94×10-2、0.136 0、0.274 9、0.444 8 mg;冠层钒提取量分别为2.3×10-3、1.08×10-2、6.25×10-2、0.292 8、0.546 4、0.500 1 mg;钒总提取量分别为2.7×10-3、1.45×10-2、9.19×10-2、0.428 8、0.821 3、0.944 9 mg。2.0 mg·L-1 V时根系、冠层及总的钒提取量分别为0.5 mg·L-1 V时的4.6、4.7倍和4.7倍。可以看出虽然在2.0 mg·L-1 V时植株生长受到一定程度的抑制,但其根系、冠层及总的钒提取量相比0.5 mg· L-1 V处理显著增加(P < 0.05)。4.0 mg·L-1 V和10.0 mg·L-1 V时根系、冠层及总的钒提取量分别为2.0 mg·L-1 V时的2.0、1.9、1.9倍和3.3、1.7、2.2倍。
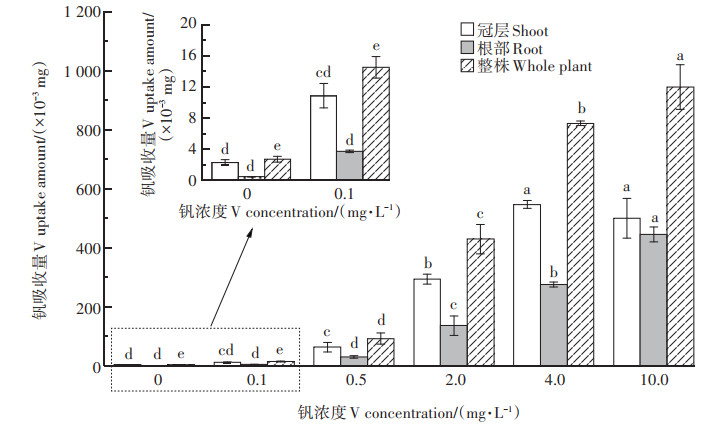
|
图 7 钒胁迫对紫花苜蓿冠层、根系及整株钒吸收量的影响 Figure 7 Effect of vanadium stress on uptake amount of vanadium in shoots, roots and the whole plants of alfalfa |
在0、0.1、0.5、2.0、4.0 mg·L-1 V和10.0 mg·L-1 V处理时冠层钒吸收量分别占整株钒吸收量的84.3%、74.4%、67.7%、68.6%、66.5% 和52.8%;而根系钒吸收量占总吸收量的比例分别为15.7%、25.6%、32.3%、31.4%、33.5% 和47.2%(图 8)。随溶液钒浓度的增加,根系钒吸收量所占比例显著增加,而冠层钒吸收量所占比例显著降低,并在0.5 mg·L-1 V时二者钒吸收量所占比例开始趋于稳定。因此,0.5 mg·L-1 V成为根系钒毒性效应的转折点,这也与此浓度下植株TF(图 6)最低相一致。在10.0 mg·L-1 V时,根系吸收钒所占比例较其他处理显著升高,而冠层吸收钒所占比例较其他处理显著降低(图 8),可见高浓度钒(10.0 mg·L-1 V)胁迫时,紫花苜蓿进一步增强根系对钒的积累以抑制钒向地上转移从而缓解其对植株地上部的毒害作用。
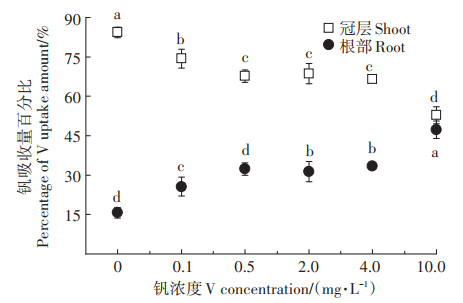
|
图 8 钒胁迫对植株冠层、根系钒吸收量百分比的影响 Figure 8 Effect of vanadium stress on vanadium uptake amount percentages in shoots and roots of alfalfa |
植株(根、茎、叶、冠层、整株)干物质量在0.1 mg· L-1 V处理时有所增加(P>0.05),之后随钒浓度的增加而降低(表 1)。与对照相比,0.5 mg·L-1 V时除根干物质量有所降低外,叶、茎、冠层及整株干物质量均有所增加(P>0.05),这与此浓度下仅根长显著受抑制而叶绿体色素、光合气体参数等均有所增加相一致(图 1~ 图 3)。另外,尽管0.5 mg·L-1 V时根系钒浓度及其钒提取量较对照无显著(P>0.05)差异(图 5和图 7),但此浓度下根系钒提取量占整株钒提取量的比例较≤ 0.1 mg·L-1 V处理显著升高(图 8)。即0.5 mg·L-1 V时根系钒吸收量占整株钒吸收量的比例较高且达稳定值,因此根系较多钒的积累也抑制了其生长。2.0 mg·L-1 V时根、茎、叶干物质量较对照无明显差异(P>0.05),但冠层和总干物质量显著降低(P < 0.05),这可能主要是由于钒毒性对各组织干物质积累抑制的累加效应。与对照相比,根、茎、叶、冠层及总干物质量均在≥ 4.0 mg·L-1 V时显著减小(P < 0.05)。4.0 mg·L-1 V和10.0 mg·L-1 V时根、茎、叶、冠层及整株干物质量相比对照分别显著降低15.8%、18.8%、43.4%、28.6%、27.0% 和27.4%、55.0%、71.5%、61.5%、57.2%(P < 0.05)。
|
|
表 1 钒胁迫对紫花苜蓿各组织干物质量的影响 Table 1 Effect of vanadium stress on dry matter mass in different tissues of alfalfa |
不同浓度钒胁迫对紫花苜蓿生长的影响具有一定的剂量效应关系。整体上,低浓度钒(0.1 mg·L-1 V)对植株生长影响不显著(P>0.05),而高浓度钒(≥4.0 mg·L-1 V)显著抑制了其生长(P < 0.05)。0.5 mg·L-1 V和2.0 mg·L-1 V时植株生长响应特征有所不同。根系对钒胁迫较敏感,在≥0.5 mg·L-1 V时根长显著(P < 0.05)减小(图 1),但株高、叶绿体色素、光合气体参数、叶片膜脂过氧化程度、膜透性在0.5 mg· L-1 V和2.0 mg·L-1 V时均无显著改变(P>0.05)。钒毒性可通过损坏或者破坏根系功能而抑制植物生长[31]。前人研究发现钒能够抑制细胞分裂[32]及根系生长[22]。钒对株高和(或)根长的抑制作用在鹰嘴豆[33]、大豆[34]、西瓜[35]和紫花苜蓿[36]等其他植物上也有报道。值得注意的是,钒对植物株高、根长的影响也与其胁迫时间有关。如短时间接触钒后,大麦根系伸长对钒毒性不敏感[37]。
叶绿体色素是植物进行光合作用的重要物质。通常,重金属会抑制叶绿素和类胡萝卜素的生成[38]。本试验发现低浓度钒(≤0.5 mg·L-1 V)处理时植株叶绿体色素有所增加但不明显(P>0.05),而高浓度钒(≥2.0 mg·L-1 V)抑制了叶绿体色素的合成,特别是在≥4.0 mg·L-1 V时叶绿体色素显著降低(P < 0.05,图 2)。前人研究表明钒可能参与了叶绿素的合成[39]。钒对叶绿素合成的促进作用可能与其促进植物对铁、镁元素的吸收有关,因为铁、镁是植物叶绿素合成的必需元素[18]。当然高浓度钒胁迫会降低植物叶绿素含量[40]。类似也有低浓度促进而高浓度钒抑制植物叶绿素合成的报道[17]。
钒不仅影响了紫花苜蓿叶绿体色素含量,而且也影响了其光合气体参数。整体上低浓度钒(≤0.5 mg· L-1 V)增加而高浓度钒(≥2.0 mg·L-1 V)降低了光合气体参数,特别地,气孔导度的减小及相应蒸腾速率的降低会抑制植物蒸腾作用,进而抑制植物对水分、养分的吸收。之前也有报道称钒酸盐能够抑制植物气孔导度[41]。Nawaz等[35]发现高浓度钒(50.0 mg·L-1 V)显著(P < 0.05)降低了西瓜的Pn、Tr、Gs和Ci。由于钒对蒸腾速率的抑制(图 3)从而抑制了植物吸收水分与养分的动力源。因此,钒对矿物元素吸收的抑制也成为植物生物量下降的重要原因之一[42]。
通常,重金属会诱导自由基和毒性氧的产生从而引发氧化胁迫,导致膜脂过氧化、膜损伤等[43]。膜脂过氧化是细胞水平上胁迫损伤的反映,其中膜脂过氧化产物丙二醛(MDA)是脂质过氧化的最终产物,已被广泛用作各种非生物胁迫条件下自由基引发的膜损伤指标[44]。高浓度钒(≥4.0 mg·L-1 V)诱导产生了明显的膜脂过氧化反应,同时细胞膜透性也显著增大。
3.2 钒胁迫对紫花苜蓿钒积累与转移的影响根系是植物接触毒性元素的首要器官,通常能够积累较冠层更多的金属[45]。本研究发现钒处理组各器官钒浓度为根>茎>叶,这一结果与侯明等[46]、Nawaz等[35]及Tian等[47]的研究结果一致。对照处理各组织钒浓度为叶>根>茎。另外,Hou等[48]和Qian等[14]发现钒在植物各组织中的积累顺序为根>叶>茎。而这些与本试验不一致的结果主要可能与植物特异性、生长条件及胁迫时间等因素有关。
根系吸收钒的能力有限,当钒超过根系能容纳的最大负荷时,根系钒开始向地上转移,这与高浓度钒(≥2.0 mg·L-1 V)处理时TF有所上升相符合(图 6)。苜蓿转移根部钒至地上部的能力(TF)在对照处理时较强,而钒处理组TF显著降低,在0.5 mg·L-1 V时TF降至最低。就植株钒提取量而言,冠层钒提取量在4.0 mg·L-1 V时达到最大,且此浓度下冠层钒提取量占总提取量的比例与0.5 mg·L-1 V和2.0 mg·L-1 V处理接近。虽然4.0 mg·L-1 V时紫花苜蓿生长明显受抑制,但其根系和冠层积累钒的比例较高(图 8)。因此,紫花苜蓿具有相对较强的抗钒毒性的自适应调节能力,但在最大浓度(10.0 mg·L-1 V)时植株所受的胁迫程度较4.0 mg·L-1 V显著增强。
4 结论(1)0.1 mg·L-1 V时紫花苜蓿生长无明显变化,高浓度钒(≥4.0 mg·L-1 V)显著抑制了植株的生长。根长在≥0.5 mg·L-1 V时显著减小。冠层和总干物质积累在≥2.0 mg·L-1 V时显著减小。
(2)0.5~4.0 mg·L-1 V时冠层和根系钒提取量占比较高且较稳定。
(3)4.0 mg·L-1 V时冠层钒提取量最大,此浓度下刈割植株地上部能去除更多钒污染物。
| [1] |
Liu H, Zhang B G, Yuan H Y, et al. Microbial reduction of vanadium (Ⅴ) in groundwater: Interactions with coexisting common electron acceptors and analysis of microbial community[J]. Environmental Pollution, 2017, 231: 1362-1369. DOI:10.1016/j.envpol.2017.08.111 |
| [2] |
丁旭彤, 蒋建国, 李德安, 等. 钙基固化剂对钒矿污染土壤固化效果的研究[J]. 农业环境科学学报, 2016, 35(2): 274-280. DING Xutong, JIANG Jian-guo, LI De-an, et al. Immobilizing effects of calcium-based agents on soil contaminated by vanadium ore[J]. Journal of Agro-Environment Science, 2016, 35(2): 274-280. |
| [3] |
Imtiaz M, Rizwan M S, Xiong S L, et al. Vanadium, recent advancements and research prospects: A review[J]. Environment International, 2015, 80: 79-88. DOI:10.1016/j.envint.2015.03.018 |
| [4] |
Liu Y, Liu G J, Qu Q Y, et al. Geochemistry of vanadium(Ⅴ) in Chinese coals[J]. Environmental Geochemistry and Health, 2017, 39(5): 967-986. DOI:10.1007/s10653-016-9877-2 |
| [5] |
杨洁, 司傲男, 解琳, 等. 耕作土壤中钒的形态特征研究[J]. 环境污染与防治, 2020, 42(4): 401-405. YANG Jie, SI Ao-nan, XIE Lin, et al. Study on the morphological characteristics of vanadium in cultivated soil[J]. Environmental Pollution and Control, 2020, 42(4): 401-405. |
| [6] |
矫旭东, 滕彦国. 土壤中钒污染的修复与治理技术研究[J]. 土壤通报, 2008, 39(2): 448-452. JIAO Xu-dong, TENG Yan-guo. Techniques on soil remediation and disposal of vanadium pollution[J]. Chinese Journal of Soil Science, 2008, 39(2): 448-452. DOI:10.3321/j.issn:0564-3945.2008.02.048 |
| [7] |
侯明, 郭零, 何剑亮. 不同水稻品种对钒的积累及化学形态[J]. 农业环境科学学报, 2013, 32(9): 1738-1744. HOU Ming, GUO Ling, HE Jian-liang. Accumulation and chemical forms of vanadium in different rice cultivars[J]. Journal of Agro-Environment Science, 2013, 32(9): 1738-1744. |
| [8] |
彭菲, 黄震, 黄占斌, 等. 纳米铁锰氧化物对钒的吸附特性研究[J]. 环境科学学报, 2019, 39(4): 1191-1197. PENG Fei, HUANG Zhen, HUANG Zhan-bin, et al. Study on the adsorption characteristics of vanadium by nano-iron-manganese oxide[J]. Acta Scientiae Circumstantiae, 2019, 39(4): 1191-1197. |
| [9] |
Shaheen S M, Rinklebe J. Vanadium in thirteen different soil profiles originating from Germany and Egypt: Geochemical fractionation and potential mobilization[J]. Applied Geochemistry, 2018, 88: 288-301. DOI:10.1016/j.apgeochem.2017.02.010 |
| [10] |
Xu Y H, Brandl H, Osterwalder S, et al. Vanadium-basidiomycete fungi interaction and its impact on vanadium biogeochemistry[J]. Environment International, 2019, 130: 104891. DOI:10.1016/j.envint.2019.06.001 |
| [11] |
Wu Z Z, Yang J Y, Zhang Y X, et al. Growth responses, accumulation, translocation and distribution of vanadium in tobacco and its potential in phytoremediation[J]. Ecotoxicology and Environmental Safety, 2021, 207: 111297. DOI:10.1016/j.ecoenv.2020.111297 |
| [12] |
Teng Y G, Yang J, Sun Z J, et al. Environmental vanadium distribution, mobility and bioaccumulation in different land-use districts in Panzhihua Region, SW China[J]. Environmental Monitoring and Assessment, 2011, 176: 605-620. DOI:10.1007/s10661-010-1607-0 |
| [13] |
Hope B K. An assessment of the global impact of anthropogenic vanadium[J]. Biogeochemistry, 1997, 37: 1-13. DOI:10.1023/A:1005761904149 |
| [14] |
Qian Y, Gallagher F J, Feng H, et al. Vanadium uptake and translocation in dominant plant species on an urban coastal brownfield site[J]. Science of the Total Environment, 2014, 476/477: 696-704. DOI:10.1016/j.scitotenv.2014.01.049 |
| [15] |
Zou Q, Li D A, Jiang J G, et al. Geochemical simulation of the stabilization process of vanadium-contaminated soil remediated with calcium oxide and ferrous sulfate[J]. Ecotoxicology and Environmental Safety, 2019, 174: 498-505. DOI:10.1016/j.ecoenv.2019.02.082 |
| [16] |
Anke M. Vanadium: An element both essential and toxic to plants, animals and humans?[J]. Anal Real Acad Nac Farm, 2004, 70: 961-999. |
| [17] |
García-Jiménez A, Trejo-Téllez, L I, Guillén-Sánchez D, et al. Vanadium stimulates pepper plant growth and flowering, increases concentrations of amino acids, sugars and chlorophylls, and modifies nutrient concentrations[J]. PLoS One, 2018, 13(8): e0201908. DOI:10.1371/journal.pone.0201908 |
| [18] |
Aihemaiti A, Gao Y C, Meng Y, et al. Review of plant-vanadium physiological interactions, bioaccumulation, and bioremediation of vanadium-contaminated sites[J]. Science of the Total Environment, 2020, 712: 135637. DOI:10.1016/j.scitotenv.2019.135637 |
| [19] |
Wang L, Lin H, Dong Y B, et al. Isolation of vanadium-resistance endophytic bacterium PRE01 from Pteris vittata in stone coal smelting district and characterization for potential use in phytoremediation[J]. Journal of Hazardous Materials, 2018, 341: 1-9. DOI:10.1016/j.jhazmat.2017.07.036 |
| [20] |
Chen L, Liu J R, Hu W F, et al. Vanadium in soil-plant system: Source, fate, toxicity, and bioremediation[J]. Journal of Hazardous Materials, 2021, 405: 124200. DOI:10.1016/j.jhazmat.2020.124200 |
| [21] |
Aihemaiti A, Jiang J G, Li D A, et al. Toxic metal tolerance in native plant species grown in a vanadium mining area[J]. Environmental Science and Pollution Research, 2017, 24: 26839-26850. DOI:10.1007/s11356-017-0250-5 |
| [22] |
Saco D, Martín S, San José P. Vanadium distribution in roots and leaves of Phaseolus vulgaris: Morphological and ultrastructural effects[J]. Biologia Plantarum, 2013, 57(1): 128-132. DOI:10.1007/s10535-012-0133-z |
| [23] |
Mielmann A. The utilisation of lucerne(Medicago sativa): A review[J]. British Food Journal, 2013, 115(4): 590-600. DOI:10.1108/00070701311317865 |
| [24] |
Cota-Ruiz K, Hernández-Viezcas J A, Varela-Ramírez A, et al. Toxicity of copper hydroxide nanoparticles, bulk copper hydroxide, and ionic copper to alfalfa plants: A spectroscopic and gene expression study[J]. Environmental Pollution, 2018, 243: 703-712. DOI:10.1016/j.envpol.2018.09.028 |
| [25] |
Peralta-Videa J R, Gardea-Torresdey J L, Gomez E, et al. Effect of mixed cadmium, copper, nickel and zinc at different pHs upon alfalfa growth and heavy metal uptake[J]. Environmental Pollution, 2002, 119(3): 291-301. DOI:10.1016/S0269-7491(02)00105-7 |
| [26] |
Yang J, Teng Y G, Wang J S, et al. Vanadium uptake by alfalfa grown in V-Cd-contaminated soil by pot experiment[J]. Biological Trace Element Research, 2011, 142(3): 787-795. DOI:10.1007/s12011-010-8777-z |
| [27] |
Wang Y, Ren H J, Pan H Y, et al. Enhanced tolerance and remediation to mixed contaminates of PCBs and 2, 4-DCP by transgenic alfalfa plants expressing the 2, 3-dihydroxybiphenyl-1, 2-dioxygenase[J]. Journal of Hazardous Materials, 2015, 286: 269-275. DOI:10.1016/j.jhazmat.2014.12.049 |
| [28] |
Lichtenthaler H K, Wellburn A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents[J]. Biochemical Society Transactions, 1983, 11(5): 591-592. DOI:10.1042/bst0110591 |
| [29] |
Zhang N, Zhao B, Zhang H J, et al. Melatonin promotes water-stress tolerance, lateral root formation, and seed germination in cucumber (Cucumis sativus L.)[J]. Journal of Pineal Research, 2012, 54(1): 15-23. |
| [30] |
Ning J F, Ai S Y, Yang S H, et al. Physiological and antioxidant responses of Basella alba to NaCl or Na2SO4 stress[J]. Acta Physiologiae Plantarum, 2015, 37(7): 126. DOI:10.1007/s11738-015-1860-5 |
| [31] |
Lin C Y, Trinh N N, Lin C W, et al. Transcriptome analysis of phytohormone, transporters and signaling pathways in response to vanadium stress in rice roots[J]. Plant Physiology and Biochemistry, 2013, 66: 98-104. DOI:10.1016/j.plaphy.2013.02.007 |
| [32] |
Meisch H U, Benzschawel H. The role of vanadium in green plants: Ⅲ. Influence on cell division of Chlorella[J]. Archives of Microbiology, 1978, 116: 91-95. DOI:10.1007/BF00408738 |
| [33] |
Imtiaz M, Ashraf M, Rizwn M S, et al. Vanadium toxicity in chickpea (Cicer arietinum L) grown in red soil: Effects on cell death, ROS and antioxidative systems[J]. Ecotoxicology and Environmental Safety, 2018, 158: 139-144. DOI:10.1016/j.ecoenv.2018.04.022 |
| [34] |
Yang J Y, Wang M, Jia Y B, et al. Toxicity of vanadium in soil on soybean at different growth stages[J]. Environmental Pollution, 2017, 231: 48-58. DOI:10.1016/j.envpol.2017.07.075 |
| [35] |
Nawaz M A, Jiao Y Y, Chen C, et al. Melatonin pretreatment improves vanadium stress tolerance of watermelon seedlings by reducing vanadium concentration in the leaves and regulating melatonin biosynthesis and antioxidant-related gene expression[J]. Journal of Plant Physiology, 2018, 220: 115-127. DOI:10.1016/j.jplph.2017.11.003 |
| [36] |
Wu Z Z, Zhang Y X, Yang J Y, et al. Effect of vanadium on testa, seed germination, and subsequent seedling growth of alfalfa(Medicago sativa L.)[J]. Journal of Plant Growth Regulation. DOI:10.1007/s00344-020-10206-0 |
| [37] |
Larsson M A, Baken S, Gustafsson J P, et al. Vanadium bioavailability and toxicity to soil microorganisms and plants[J]. Environmental Toxicology and Chemistry, 2013, 32(10): 2266-2273. DOI:10.1002/etc.2322 |
| [38] |
Baek S A, Han T, Ahn S K, et al. Effects of heavy metals on plant growths and pigment contents in Arabidopsis thaliana[J]. The Plant Pathology Journal, 2012, 28(4): 446-452. DOI:10.5423/PPJ.NT.01.2012.0006 |
| [39] |
Wang D L, Sañudo Wilhelmy S A. Vanadium speciation and cycling in coastal waters[J]. Marine Chemistry, 2009, 117: 52-58. DOI:10.1016/j.marchem.2009.06.001 |
| [40] |
Imtiaz M, Mushtaq M A, Rizwan M S, et al. Comparison of antioxidant enzyme activities and DNA damage in chickpea(Cicer arietinum L.) genotypes exposed to vanadium[J]. Environmental Science and Pollution Research, 2015, 23: 19787-19796. DOI:10.1007/s11356-016-7192-1 |
| [41] |
Saxe H, Rajagopal R. Effect of vanadate on bean leaf movement, stomatal conductance, barley leaf unrolling, respiration, and phosphatase activity[J]. Plant Physiology, 1981, 68: 880-884. DOI:10.1104/pp.68.4.880 |
| [42] |
Kaplan D I, Adriano D C, Carlson C L, et al. Vanadium: Toxicity and accumulation by beans[J]. Water, Air, and Soil Pollution, 1990, 49: 81-91. DOI:10.1007/BF00279512 |
| [43] |
Maleki M, Ghorbanpour M, Kariman K. Physiological and antioxidative responses of medicinal plants exposed to heavy metals stress[J]. Plant Gene, 2017, 11: 247-254. DOI:10.1016/j.plgene.2017.04.006 |
| [44] |
Yang P Z, Zhang P, Li B, et al. Effect of nodules on dehydration response in alfalfa(Medicago sativa L.)[J]. Environmental and Experimental Botany, 2013, 86: 29-34. DOI:10.1016/j.envexpbot.2011.05.012 |
| [45] |
Ashraf M, Ozturk M, Ahmad M S A. Plant adaptation and phytoremediation[M]. New York: Springer, 2010: 71-97.
|
| [46] |
侯明, 胡存杰, 熊玲, 等. 钒在枸杞幼苗中积累、转运及亚细胞分布[J]. 农业环境科学学报, 2013, 32(8): 1514-1519. HOU Ming, HU Cun-jie, XIONG Ling, et al. Accumulation, translocation and subcellular distribution of vanadium in Lycium barbarum seedling[J]. Journal of Agro-Environment Science, 2013, 32(8): 1514-1519. |
| [47] |
Tian L Y, Yang J Y, Huang J H. Uptake and speciation of vanadium in the rhizosphere soils of rape(Brassica juncea L.)[J]. Environmental Science and Pollution Research, 2015, 22: 9215-9223. DOI:10.1007/s11356-014-4031-0 |
| [48] |
Hou M, Lu C, Wei K X. Accumulation and speciation of vanadium in Lycium seedling[J]. Biological Trace Element Research, 2014, 159: 373-378. DOI:10.1007/s12011-014-0014-8 |
 2021, Vol. 40
2021, Vol. 40