2. 中山大学环境科学与工程学院, 广州 510275;
3. 中山大学广东省环境污染控制与修复重点实验室, 广州 510275;
4. 岭南现代农业科学与技术广东省实验室, 华南农业大学, 广州 510642
2. School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510275, China;
3. Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, Sun Yat-sen University, Guangzhou 510275, China;
4. Lingnan Modern Agricultural Science and Technology Guangdong Laboratory, South China Agricultural University, Guangzhou 510642, China
近年来,随着工业化和城市化的快速发展,土壤重金属污染日益严重,引起人们广泛关注。据《全国土壤污染状况调查公报》(2014年)[1],全国耕地土壤的点位超标率达19.4%,其中镉(Cd)位列第一。据统计,目前我国农田土壤Cd污染面积超过2×105 hm2[2]。重金属Cd是植物生长的非必需元素,其具有非常高的生物毒性,并能通过土壤-水-农作物的食物链传递给人类,从而威胁生态系统和人类健康[3]。研究发现,水稻作为世界半数人口的主要粮食作物[4],相较于其他粮食作物会吸收和积累更多的Cd[5],这对稻米安全生产和人类健康产生巨大的危害。如何解决稻田Cd污染,保证水稻的安全生产是目前农业和环保领域的研究热点。
目前应用于稻田Cd污染修复的技术主要包括土壤钝化技术和生理阻隔技术等。常见的Cd的钝化材料包括:碳酸钙等无机材料[6];海泡石、沸石等黏土材料;腐殖质、生物炭等有机材料、微生物菌剂及复合材料[7]。但这些材料大都成本较高,且具有二次释放风险[8-9]。生理阻隔技术更多是通过施加肥料以调节与稻米Cd积累相关的生理过程,抑制水稻对Cd等毒害元素的吸收、转运、积累,提高其解毒能力,从而降低稻米中Cd含量。目前报道较多的是硅、硒和锌,可有效降低稻米Cd积累[10-12]。
S是植物生长的必需营养元素之一[13],作物生产中S素的施用可使土壤Cd活性和生物有效性发生变化,进而影响作物对Cd的吸收、转运和积累。首先在淹水的水稻土中,添加的S素还原成的S2-会与Cd形成CdS沉淀,降低Cd的移动性[14-15]。其次,水稻土中S的氧化还原对根表铁膜的形成及土壤Cd的赋存形态产生影响[16],进一步影响Cd的生物有效性。再次,S在植物体内可代谢合成富含S的非蛋白巯基(半胱氨酸Cys、谷胱甘肽GSH和植物螯合肽PC),从而可以降低Cd毒性[17],其中PC对水稻Cd的迁移有重要影响[18-19]。
目前施加S素对Cd在水稻土-水稻体系中迁移和积累的研究主要聚焦在石膏、单质S、硫酸钠等S形态上[20-25],而对K2S研究较少;K2S属于还原性物质,其在淹水的水稻土中能否更有效地固定土壤Cd值得探讨。此外,K2S在补充S的同时也能补充K,在补充养分同时兼具了污染阻控潜力。本研究拟在施用足量石灰石(CaCO3)条件下,在土壤中分别施加K2SO4和K2S,比较研究不同形态硫(SO42-/S2-)对Cd在土壤中的活性以及对水稻吸收、转运Cd的影响差异,明确各自作用机制的异同,为稻田土壤Cd污染修复实践提供依据。
1 材料与方法 1.1 试供材料供试土壤采自广东省某金属矿区下游4 km处的农田0~20 cm耕层土,经风干后研磨过10、20目和100目筛保存备用。供试土壤的基本理化性质如表 1所示。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic properties of the tested soil |
供试水稻(Oryza sativa L.)品种为广8优169,种子购自广东省金稻种业有限公司。
1.2 盆栽试验设计将4 kg(10目)风干土装入塑料盆中(高30 cm、口径25 cm),同时每盆施加1.80 g NPK复合肥作为基肥,施加4.35 g·kg-1 CaCO3中和土壤酸性以保证水稻正常生长。淹水之前在距盆底约10 cm处安装土壤溶液取样器收集土壤溶液。淹水,每盆分别施加400.0 mg S·kg-1的K2S或K2SO4(S素施用水平是在相关文献[20-22, 26-27]和本课题组前期研究工作基础上确定,以不影响水稻生长为前提,通过调节土壤S/Cd比,给予足量S处理)并充分混匀,以不施加S素的土壤为对照组,共3个处理组,分别记作CK、K2S、K2SO4,每个处理组设置3个重复,随机排列。淹水深度保持高出土壤表面5cm,平衡两周,于2019年7月26日移栽幼苗(25 d),每盆2穴,每穴3株。水稻整个生育期内始终用纯水保持淹水4~5 cm,于2019年10月29日收获植物样品。
1.3 样品采集和前处理在水稻生长全程监测土壤pH和Eh。分别在水稻分蘖期、孕穗期、抽穗扬花期、成熟期用土壤溶液取样器(RhizoSphere MOM)采集土壤溶液,过滤(0.45 µm)后加硝酸酸化(溶液∶酸=9∶1),测定溶液中Fe、S浓度;同时采集土壤样品,用冷冻干燥机(FD-1A-50)干燥后以Tessier法[28]测定土壤Cd形态。成熟期收获水稻样品,用自来水洗净后用超纯水冲洗擦干,分别测定根、茎、叶、糙米的生物量。根、茎、叶的一部分鲜样用液氮冷冻后,保存在-80 ℃超低温冰箱,用于亚细胞分级分析;另一部分样品放入烘箱105 ℃杀青30 min,后60 ℃烘干至恒质量,分别测定根、茎、叶、糙米中Cd含量。
1.4 样品分析 1.4.1 土壤理化性质及土壤溶液测定土壤pH测定采用电位法(土∶水=1∶2.5),土壤有机质、碱解N、速效K采用常规法测定[29],有效P按NY/T 1121.7—2014、有效S按NY/T 1121.14—2006方法测定。以便携式pH/mV仪(Cyberscan pH 300)原位测定土壤溶液的pH和Eh,采用邻菲罗啉比色法测定土壤溶液中Fe(Ⅱ)浓度[29]。
1.4.2 Cd、As、S全量分析土壤Cd、As、S全量以王水-HClO4法消解(GB/T 17141—1997),植物样品采用HNO3+H2O2(V∶V=6∶2)微波消解仪(MARS6)消解(180 ℃,60 min),将消解管中溶液赶酸至剩余0.5 cm后,用2% HNO3定容,过滤待测(GB/T 5009.15—2014)。
1.4.3 土壤Cd赋存形态和有效态测定土壤Cd赋存形态测定采用Tessier五步连续提取法[28],分别为:水溶交换态(Cdexc)、碳酸盐结合态(Cdcar)、铁锰氧化物结合态(Cdiro)、有机硫化物态(Cdstr)和残渣态(Cdres)。有效态Cd用0.01 mol·L-1 CaCl2提取。提取液过0.45 μm滤膜待测。
1.4.4 植物Cd亚细胞分级参照Weigel等[30]的方法,取1.000 0 g鲜样,加入10.0 mL预冷的提取液,研磨成匀浆液。提取缓冲液的组成:250 mmol·L-1蔗糖,50 mmol·L-1 Tris-HCl(pH 7.50)和1 mmol·L-1二硫赤鲜醇,温度为4 ℃。匀浆液过80 μm的尼龙布,残渣部分为细胞壁组分(F1);过滤液在1 500 g下离心10 min(根部在2 500 g下离心20 min),沉淀为地上部茎和叶-叶绿体/地下部根-营养体(F2);再将上清液15 000 g离心30 min,沉淀为膜和细胞器组分(F3),上清液为胞液组分(F4)。所有过程在4 ℃下进行,各组分用5 mL硝酸消解测定Cd含量。
以石墨炉原子吸收光谱仪(AAS,Contro AA800,Germany)测定溶液中Cd,用电感耦合等离子体发射光谱仪(ICP-OES,Avio 500,Singapore)测定溶液中S、Fe总量。
1.4.5 分析质量控制试验以平行样、土壤成分分析标准物质GBW07443(GSF-3)和植物分析标准物质GBW(E)100349进行质量控制,误差控制在20% 以内。同时做试剂空白试验。试验所用器具均以10% HNO3(m/m)浸泡过夜,去离子水洗净干燥备用。
1.4.6 数据分析与处理转运系数(TF)=植物地上部Cd含量(mg·kg-1)/植物地下部Cd含量(mg·kg-1)
用SPSS 25.0、Excel 2017和Origin 9.1进行数据处理与绘图,以Duncan检验法检验处理间差异显著性,P < 0.05为差异显著。
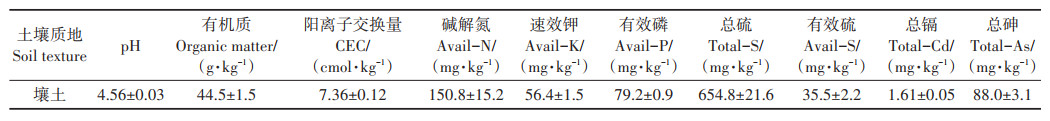
2 结果与分析 2.1 S素添加对水稻生物量和水稻Cd含量的影响 2.1.1 水稻生物量供试土壤Cd含量为1.61 mg·kg-1,超过土壤污染风险管制值。各处理均施加足量CaCO3,但CK处理水稻植株仍较为矮小,叶片数量、大小以及籽粒产量都远低于K2S和K2SO4处理(图 1)。与CK相比,K2S和K2SO4处理显著提高水稻总生物量(干质量)130.1%~186.7%,提高水稻籽粒产量167.2%~209.8%(P < 0.05),K2S处理水稻根、叶和糙米的生物量(干质量)比K2SO4处理分别增加49.8%~64.2%、6.6%~11.6% 和7.6%~24.0%。这说明施加K2S和K2SO4均能缓解Cd对水稻的毒害,增加水稻产量。
|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant differences among treatments(P < 0.05). The same below 图 1 不同处理下的水稻生物量 Figure 1 Rice biomass in different treatments |
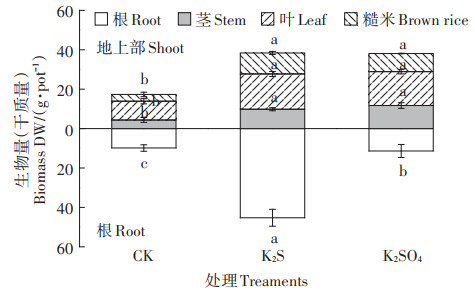
如图 2所示,CK的根、茎、叶和糙米中的Cd含量分别达到0.23、0.08、0.09 mg·kg-1和0.18 mg·kg-1,与CK相比,K2S处理使茎、叶的Cd含量分别提高60.0%~136.0%、60.0%~100.0%,但显著降低糙米Cd含量37.5%~50.0%,根的Cd含量与CK无显著差异。与K2S处理类似,K2SO4处理使根、茎、叶的Cd含量分别比CK增加123.0%~196.0%、136.0%~340.0% 和30.0%~37.5%,但显著降低糙米Cd含量31.2%~ 45.0%。施S处理的Cd含量分布均为根>茎>叶>糙米,但CK处理为根>糙米>叶>茎。与CK相比,K2SO4处理Cd主要积累在水稻根、茎部,而K2S处理则将Cd固定在水稻茎、叶部,两种施硫处理糙米中Cd的含量无显著差异。
|
图 2 水稻不同部位的Cd含量 Figure 2 Cd contents in different organs of rice |
如图 3a所示,由于持续淹水,各处理土壤溶液的Eh在-100~220 mV波动。S素添加降低分蘖期和成熟期的土壤溶液Eh,提高孕穗期土壤溶液Eh,抽穗扬花期各处理无显著差异。在孕穗期后期至成熟期,K2SO4处理Eh始终高于K2S处理。
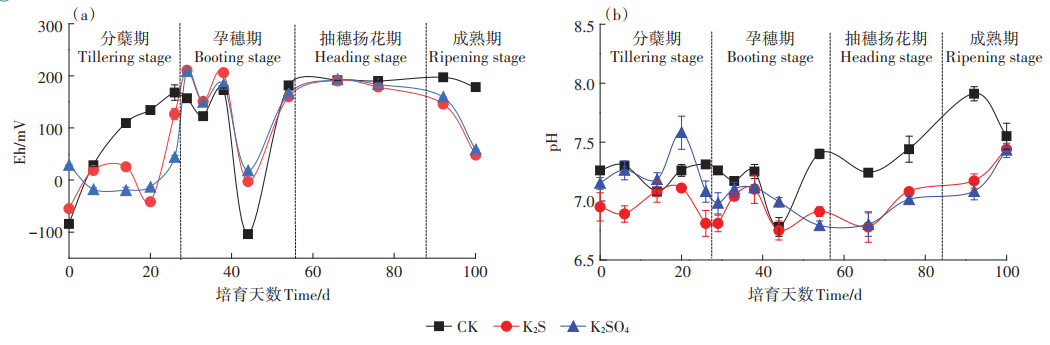
|
图 3 水稻不同生育期土壤溶液Eh和pH变化 Figure 3 Eh and pH changes of soil solution in different growth stages of rice |
如图 3b所示,各处理在整个生育期土壤溶液pH在6.50~8.00波动,4个时期CK的土壤溶液平均pH分别为7.27、7.17、7.34和7.73。与CK相比,施S处理均使土壤pH下降,且随水稻生长期的延长降幅增大,分蘖期和孕穗期K2SO4处理的pH大于K2S处理,而在生长后期低于K2S处理。K2S和K2SO4在水溶液中分别为碱性和中性物质,施入土壤后,K2S和K2SO4处理土壤pH均低于CK,且加入K2S(强碱性)处理土壤pH反而低于加入K2SO4(中性)处理,其原因是伴随K2S和K2SO4加入的K+与土壤胶体上的H+或Al3+发生置换,导致溶液中的H+或Al3+增加,引起土壤pH下降。由于K2S处理中K+置换出的H+与S2-形成的H2S是一种弱酸,从而导致这种置换反应比K2SO4处理的可逆置换更为完全,使K2S处理土壤胶体上更多的H+、Al3+进入溶液。此外,相同S处理水平,K2S处理引入的K+比K2SO4处理多,其置换出的H+、Al3+也更多。第三,K2SO4的还原也将消耗更多的H+,以上原因共同导致K2S处理土壤pH比K2SO4更低。在0~20 d中的个别时间点K2SO4处理的pH甚至高于CK,可能是K2SO4还原消耗H+所致。
水稻生长后期,与CK相比,K2S和K2SO4处理导致土壤酸化的效应进一步加剧。这一方面是上述K+置换H+、Al3+效应的延续;另一方面,在抽穗扬花期各处理组的Eh均大幅上升,表明含S处理在Eh回升的过程中可能发生硫化物如FeS2、FeS、CdS的氧化,硫氧化的同时释放H+,导致pH大幅下降。CK由于硫化物相对较少,其氧化释放的H+有限,因此,在抽穗扬花期和成熟期出现K2S、K2SO4处理土壤酸化效应进一步加剧的现象。在水稻生长后期,K2S处理土壤pH转而高于K2SO4处理,其原因是抽穗扬花期和成熟期K2SO4处理土壤氧化性高于K2S处理,导致K2SO4处理更多的硫化物如FeS2、CdS发生氧化,同时释放H+,因此在水稻生长后期K2SO4处理土壤pH比K2S处理低。
2.2.2 不同时期土壤Cd的赋存形态和有效性如图 4a所示,孕穗期,CK和K2S处理以CDiro为主,而K2SO4处理以Cdcar占优;抽穗扬花期,与CK相比,K2S处理主要使土壤Cd向CDiro和CDres转化,K2SO4处理则使土壤Cd向CDres转化;成熟期,与CK相比,K2S处理以CDiro和CDstr为主,K2SO4则以CDstr占优,且两处理的CDstr无显著差异。
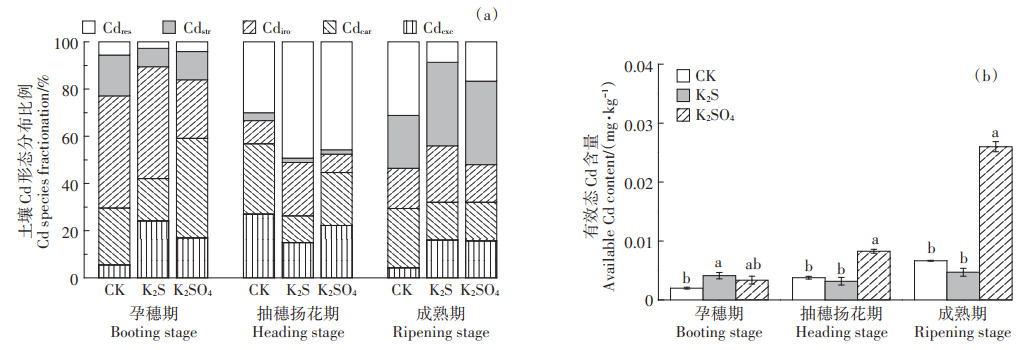
|
图 4 不同时期Cd的土壤赋存形态比例和有效态Cd含量 Figure 4 Cd species fractionation and available Cd content in soil in different stages |
如图 4b所示,与CK相比,K2S处理使孕穗期的土壤有效态Cd含量显著增加100%,抽穗扬花期与CK无显著差异,但使成熟期有效态Cd降低29.4%。与CK相比,K2SO4处理使抽穗扬花期和成熟期有效态Cd含量分别显著增加166.7% 和271.4%,孕穗期与CK无显著差异。综上,K2S处理在孕穗期对土壤Cd有一定活化效应,这可能是K2S添加前期,导致土壤pH出现显著下降引起土壤Cd的活化(图 3),但在抽穗扬花期和成熟期,K2S可促进Cd向铁锰氧化物和硫化物结合态转化(图 4a),使土壤Cd活性在成熟期出现显著下降。K2SO4处理则在抽穗扬花期和成熟期显著提高土壤Cd活性。两种不同形态S处理使Cd有效性出现分异与其对土壤Cd形态转化出现分异有密切关系。
2.2.3 不同时期土壤溶液中元素浓度变化如图 5a所示,土壤溶液中S浓度随水稻生长期的延长而逐渐降低;除成熟期外,K2S处理的土壤溶液S浓度均显著高于K2SO4和CK处理(P < 0.05)。
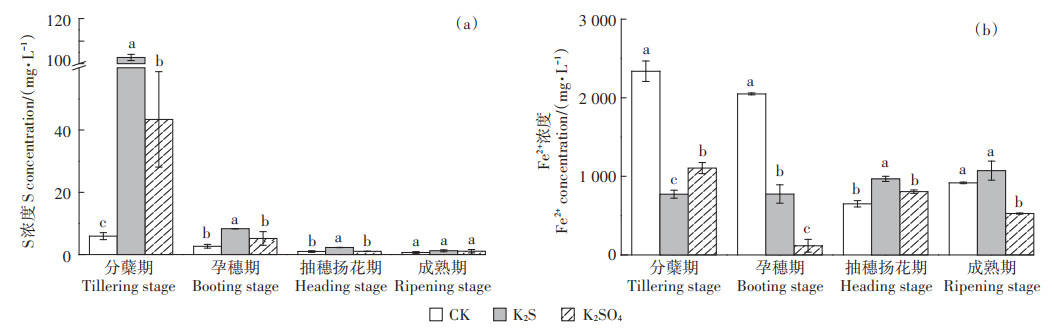
|
图 5 不同时期土壤溶液总S和Fe2+浓度 Figure 5 Total S and Fe2+ concentrations in soil solution in different stages of rice |
如图 5b所示,土壤溶液的Fe2+浓度在全育期内先降低后增加,除在分蘖期K2S处理Fe2+浓度低于K2SO4处理外,其余时期均显著高于K2SO4处理。这是因为处理初期即分蘖期,K2S解离出的大量S2-可与还原生成的Fe2+形成FeS沉淀,使溶液中Fe2+和S2-浓度快速下降。而K2SO4还原相对困难,其产生的S2-相对较少,沉淀Fe2+作用较弱,导致反应初期K2SO4处理和K2S处理Fe2+浓度与CK相比显著下降,且K2SO4处理Fe2+浓度高于K2S处理。在孕穗期至成熟期,K2S处理Fe2+浓度比K2SO4处理高。SO42-的添加降低土壤溶液的Fe2+, 这可能是在土壤溶液中,Fe(Ⅲ)和SO42-竞争电子受体,Fe(Ⅲ)的标准氧化还原电位大于SO42-,但水溶性SO42-的电子竞争能力比铁矿物形式存在的Fe(Ⅲ)更强,因此硫酸盐抑制Fe3+还原成Fe2+。而K2S处理还原性强于CK和K2SO4体系,更利于Fe2+的生成,而此时K2S处理溶液中S2-浓度由于前期与Fe2+生成沉淀已显著下降,不会再使Fe2+大量生成FeS沉淀而降低Fe2+浓度。
2.3 S素添加对水稻体内Cd转运和累积的影响 2.3.1 水稻不同部位的S、Fe含量如图 6所示,CK处理根、茎、叶和糙米中的S含量分别为830.2、1 139.6、1 654.2 mg·kg-1和1 602.5 mg· kg-1,表现为叶>糙米>茎>根。与CK相比,K2S处理使根、茎、叶的S含量分别增加49.8%~84.2%、104%~ 123%、107%~141%,使糙米S含量降低0.1%~11.6%,S含量表现为叶>茎>糙米>根,而K2SO4处理根、茎、叶、糙米S含量分别增加68.8%~133%、86.3%~ 93.7%、14%~41.5%、3.3%~7.2%,S含量表现为茎>叶>根>糙米。综上,K2S处理S含量由根、茎、叶依次升高,且叶中S含量显著高于K2SO4处理。与K2S处理相比,K2SO4处理则是根部S含量较高,茎、叶S含量相对较低,两处理糙米S含量无显著差异。
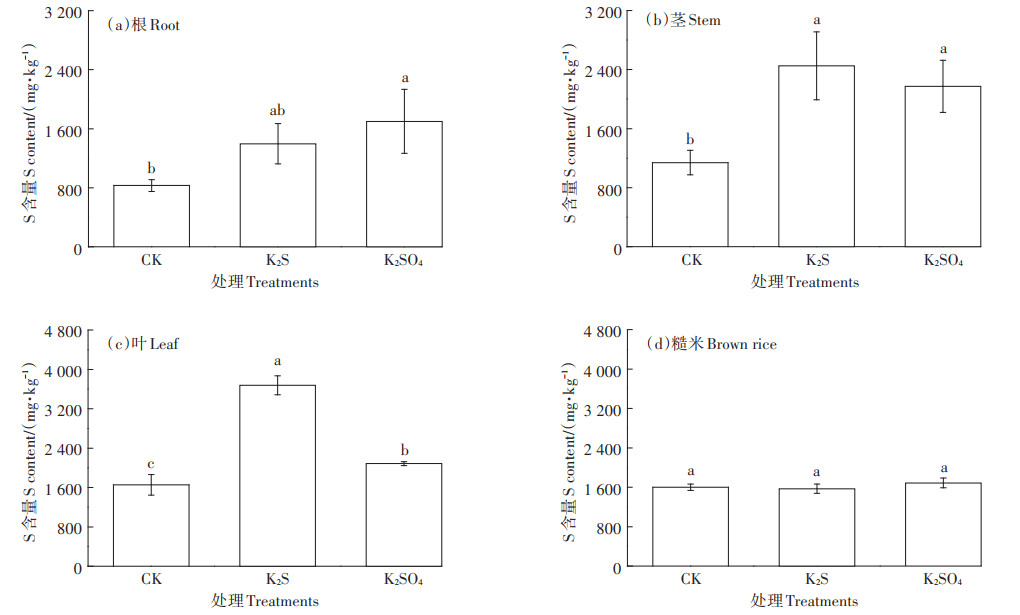
|
图 6 水稻不同部位的S含量 Figure 6 S contents in different organs of rice |
如图 7所示,CK处理根、茎、叶和糙米中的Fe含量分别为7 167.8、712.0、692.6 mg · kg-1和69.6 mg · kg-1。CK和K2SO4处理的Fe在水稻各部位的分布规律均为根>茎>叶>糙米,与Cd的分布相似。与CK相比,K2S处理使根、茎和糙米的Fe含量分别显著降低39.3%~43.5%、41.3%~53.5% 和98.6%~99.0%,叶与对照无显著差异;而K2SO4处理使糙米Fe含量显著降低90.5%~92.0%,但使根显著增加145.1%~158.1%,茎叶与对照无显著差异。与CK相比,施S处理均显著降低糙米Fe含量。Fe在不同处理水稻体内分布模式与Cd的分布表现出相似性。
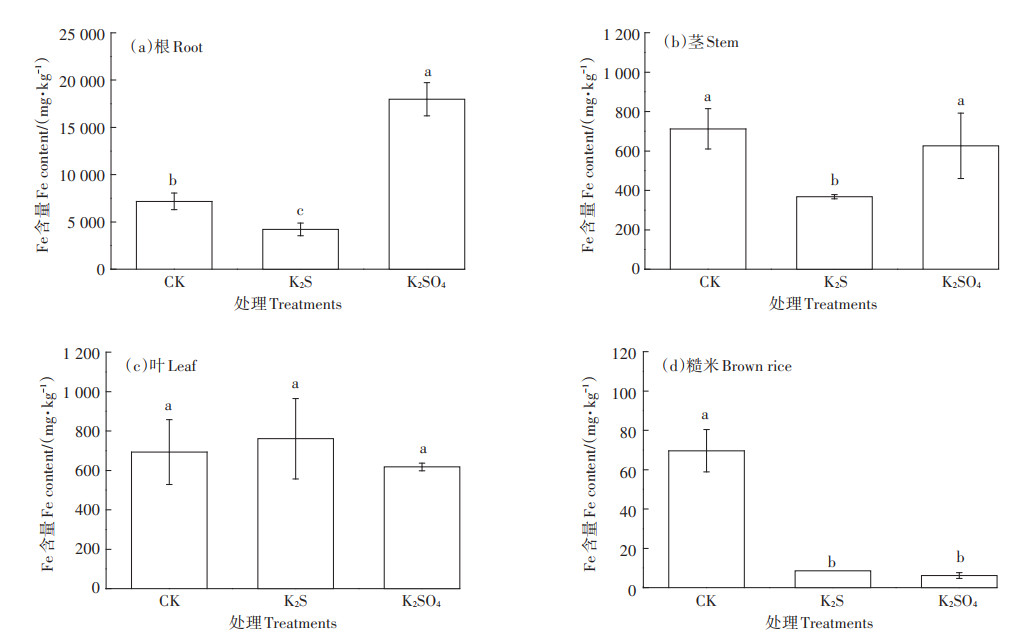
|
图 7 水稻不同部位的Fe含量 Figure 7 Fe contents in differents organs of rice |
如图 8所示,CK处理茎、叶和糙米Cd的TF分别为0.37、0.39和0.76,糙米Cd的TF在各处理中最高。K2S处理茎、叶和糙米Cd的TF均大于K2SO4处理,说明K2S处理有促进Cd向地上部转运的倾向,但能有效地将Cd固定在茎叶。K2SO4处理茎、叶、糙米Cd的TF依次下降,且低于K2S处理和CK,表明K2SO4有利于将Cd固定在根部,减少Cd从根向地上部转运,从而降低Cd向糙米转移的风险。
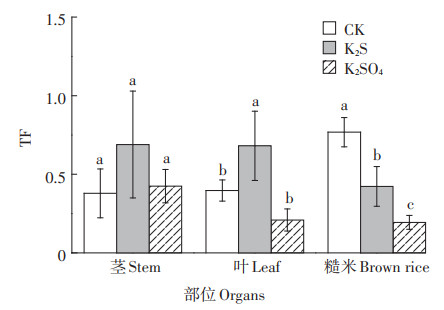
|
图 8 水稻不同部位Cd的转运系数 Figure 8 Cd transport coefficient in different organs of rice |
元素S是植物生长必需的营养元素,在本试验中,K2S和K2SO4处理显著增加水稻总生物量130.1%~ 186.7%,且K2S处理增加水稻糙米产量效果更佳(图 1)。本研究土壤Cd含量为1.61 mg·kg-1,是土壤Cd污染风险筛选值的5倍多,超过风险管制值(1.5 mg· kg-1),因此该土壤对水稻存在毒害效应。从水稻生长看,CK组尽管施加了足量CaCO3和肥料,但水稻植株仍较为矮小,叶片数量及大小以及籽粒产量都远低于K2S和K2SO4处理,表明K2S和K2SO4处理能在一定程度上缓解Cd对水稻的毒害,增加水稻的生物量。以纯钾计算钾肥用量,表现为K2S处理>K2SO4处理>CK,水稻生物量也呈现这样的规律,表明钾肥可能对水稻增产起到重要作用。此外,有研究表明[20]S素可促进巯基酶的合成,后者是叶绿素合成的重要组成部分,对脂肪和氮代谢也有重要影响,可促进水稻生长。此外,S在植物体内的代谢能促进富含硫的非蛋白巯基(半胱氨酸Cys、谷胱甘肽GSH和植物螯合肽PC)的合成,可以降低Cd毒性[17],这对水稻生长也有一定促进作用。钾的增产和S的解毒双重效应共同促进了水稻生物量的显著提高。
3.2 不同形态S对土壤Cd赋存形态及有效性的影响土壤Cd的赋存形态一定程度上反映Cd的植物有效性,可对水稻吸收Cd产生影响。由土壤有效态Cd含量可知(图 4b),与CK相比,K2S处理使孕穗期的土壤有效态Cd含量显著增加100%,抽穗扬花期与CK无显著差别,成熟期的有效态Cd含量显著降低29.4%。可以看到,随时间推移,与CK相比,K2S处理有效态Cd含量有逐步下降的趋势。与之相反,K2SO4处理有效态Cd含量在孕穗期比CK增长,但未达显著差异水平,随时间推移,K2SO4处理有效态Cd含量与CK相比有逐渐增长的趋势,并在抽穗扬花期和成熟期分别显著增加166.7%和271.4%。可以看出,K2S和K2SO4的影响有随时间逐步增强的效应。K2S处理在孕穗期对土壤Cd有一定活化效应,这应是K2S添加前期,K+置换H+、Al3+导致土壤pH出现显著下降引起的(图 4b)。但在抽穗扬花期和成熟期,K2S处理土壤pH与CK相比有进一步下降趋势,但土壤Cd活性并未随之增加,在成熟期有效态Cd含量甚至比CK显著降低29.4%。可能的机理是S2-可促进土壤中铁氧化物还原溶解生成Fe2+,生成的硫铁矿物可与Cd共沉淀[31],或Fe2+与未还原的Fe(Ⅲ)矿物形成混合Fe(Ⅱ)/Fe(Ⅲ)的二次铁矿物吸附Cd[32],造成K2S处理的Cd形态向低活性的铁锰氧化物结合态和硫化物结合态转化,尤其是铁锰氧化物结合态Cd显著高于CK和K2SO4处理,而铁锰氧化物结合态Cd在酸化和氧化环境下相对稳定,这可能是抽穗扬花期土壤酸化加剧和Eh回升条件下K2S处理土壤Cd的活性没有大幅增加,反而在成熟期相对CK出现显著下降的原因。此外,K2S处理在成熟期Eh显著低于CK,且低于K2SO4处理,这也有利于减少硫化物结合态Cd的氧化与释放。上述两方面可能是成熟期K2S处理有效态Cd含量比CK低的原因。K2SO4处理在孕穗期的土壤有效态Cd含量与CK相比有一定增长,但未达显著水平,这主要是K2SO4在作用初期,中性盐对土壤pH表现一定降低效应(图 3),但没有K2S作用显著,对土壤Cd活性的影响也相对有限。随着时间推移,K2SO4对土壤Cd活化效应逐渐增强,在抽穗扬花期和成熟期K2SO4使土壤有效态Cd含量分别比K2S处理和CK显著增加166.7%~420.0%、100.0%~271.4%(图 4b)。已有研究发现硫酸盐可以提高根际Cd生物有效性[33-36]。对比K2SO4和K2S处理的Cd形态(图 4),K2SO4处理铁锰氧化物结合态Cd显著低于K2S处理,而碳酸盐结合态Cd则显著高于K2S处理,碳酸盐结合态Cd在酸化条件下极易溶解释放Cd,这导致K2SO4处理在抽穗扬花期和成熟期土壤pH显著下降时,有效态Cd2+显著提高。此外,SO42-对Cd2+有一定的络合活化效应[33-34, 36],从而可以提高Cd2+活性。第三,K2SO4处理在抽穗扬花期和成熟期Eh显著升高,会造成硫化物如FeS2、FeS、CdS的氧化,释放与之结合的Cd2+的同时,显著降低pH[34],导致土壤Cd活性显著提高[20, 37-38]。抽穗扬花期和成熟期是水稻吸收、积累Cd的关键时期[39],在该时期使土壤保持还原状态,加入还原物质如有机质,将有利于降低Cd活性及水稻吸收[35]。K2S可能起到了类似作用。由于水稻不同生育期土壤氧化还原状况变化极大,不同形态S对土壤Cd形态分布及Cd活性的影响出现了显著分异。本研究表明,还原态S比氧化态S更有利于降低土壤Cd活性。
3.3 不同形态S对水稻体内Cd转运和分配的影响本研究结果表明,K2S处理有促进Cd向地上部转运的倾向,但能有效地将Cd固定在茎叶。而K2SO4处理则有利于将Cd固定在根部,减少Cd从根向地上部转运,从而降低Cd向籽粒转移的风险。从Cd在水稻根、茎、叶的亚细胞分布(图 9)可以看到,各处理组从根到茎、叶,Cd在胞液所占比例逐渐增加,且施S处理与CK相比有促进Cd向胞液转移的趋势。CK处理根、茎、叶Cd在胞液中所占比例分别为5.3%、20.6% 和59.2%。与CK相比,K2S和K2SO4处理使根、茎、叶部Cd的胞液比例分别增加了18.5%~28.9%、4.4%~ 20.7% 和14%~32.8%;K2SO4处理根和叶Cd的胞液占比为23.8%、92.0%,显著高于K2S处理,仅茎的占比低于K2S处理。K2SO4处理比K2S处理更有利于Cd在植物体内的液泡区隔化,这可能是其能够抑制Cd从根向地上部转运的原因。
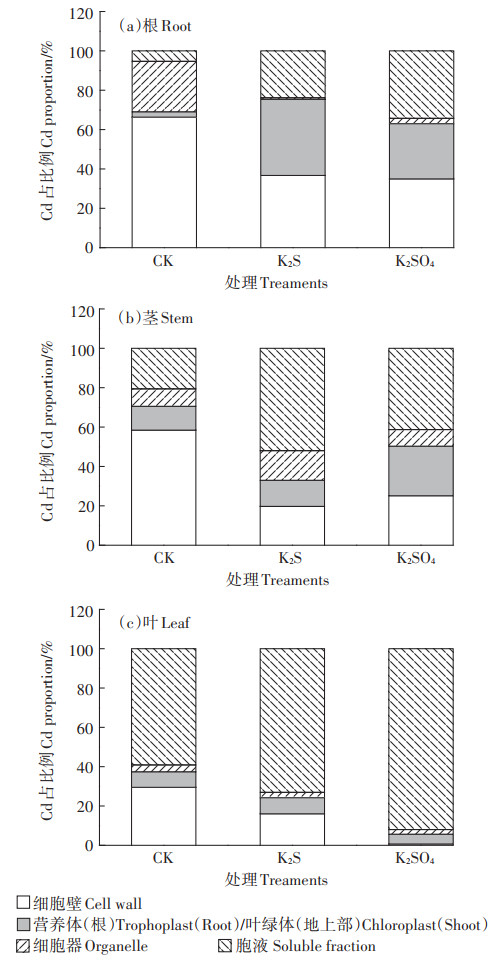
|
图 9 Cd在水稻根、茎、叶的亚细胞分布比例 Figure 9 Sub-cellular distribution proportion of Cd in organs of rice |
在本试验中,K2S处理地上部茎、叶S含量更高,而K2SO4处理的根系S含量更高(图 6),其分布与Cd分布表现出较高相似性。不同处理S在不同部位的富集可能有助于相关部位谷胱甘肽(GSH)和植物螯合肽(PC)的合成,并螯合更多的Cd转移到液泡区隔[40],使Cd在相应部位固定,从而减少Cd向籽粒迁移。
从K2S和K2SO4处理对土壤有效态Cd的影响可以看出,K2S对土壤Cd活性有一定抑制效应,而K2SO4则显著提高土壤Cd活性和植物吸收。但从糙米Cd含量看,K2S和K2SO4均能显著降低糙米Cd 31%~ 50%,表明S对Cd在植物体内迁移、转运和累积起到了重要的调节作用。本试验亚细胞分布的结果(图 9)表明,从根到茎、叶,Cd主要分布在细胞壁和液泡,且液泡所占比例由根向叶逐渐增加,施S处理可以显著促进地上部Cd向液泡转移,且K2SO4处理比K2S处理更有利于Cd在植物体内的液泡区隔化,这可能是K2SO4处理虽对土壤Cd有活化效应,但能够抑制Cd从根向地上部转运和在糙米中积累的原因。K2S则比K2SO4更有利于降低土壤Cd活性和植物吸收,并可通过促进将Cd有效区隔在叶片液泡中,进而限制Cd向糙米转运。
本试验中,不同处理水稻体内Fe分布模式与Cd的分布也表现出相似性。不同形态S所导致的土壤中Fe2+含量差异及植物吸收分配的差异也可能是引起Cd2+在水稻体内转运、积累差异的另一原因。
4 结论(1)在足量施用CaCO3条件下,K2S和K2SO4处理均能显著增加水稻的生物量,其中K2S增加糙米产量更显著。
(2)土壤中性条件下,足量K2S和K2SO4处理可使糙米Cd含量降低31%~50.0%,但同时使糙米Fe含量下降90%以上,两种施S处理间无显著差异。
(3)K2S处理通过促进土壤Cd向铁锰氧化物结合态和有机硫化物结合态Cd转化而使土壤Cd活性受到一定抑制;同时增加水稻茎、叶的S含量,有效将Cd液泡区隔化,将Cd固定在茎、叶,从而降低糙米Cd含量。
(4)K2SO4处理对土壤Cd有活化效应,但K2SO4处理比K2S处理更有利于Cd在植物体内的液泡区隔化,是其能够抑制Cd从根向地上部及糙米转运的原因。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014(5): 10-11. Department of Environmental Protection, Ministry of Land and Resources. Soil pollution status of nationwide bulletin[J]. China Environmental Protection Industry, 2014(5): 10-11. |
| [2] |
杨云帆, 夏卫生, 王小芳. 镉污染农田的不同修复技术现状及展望[J]. 中国农业信息, 2017(23): 49-51. YANG Yun-fan, XIA Weisheng, WANG Xiao-fang. Status and prospect of different remediation technologies for cadmium contaminated farmland[J]. China Agricultural Informatic, 2017(23): 49-51. |
| [3] |
Banerjee M, Banerjee N, Bhattacharjee P, et al. High arsenic in rice is associated with elevated genotoxic effects in humans[J]. Scientific Reports, 2013, 3(1): 2195. DOI:10.1038/srep02195 |
| [4] |
Meharg A A, Norton G, Deacon C, et al. Variation in rice cadmium related to human exposure[J]. Environmental Science & Technology, 2013, 47(11): 5613-5618. |
| [5] |
Su Y H, McGrath S P, Zhao F J. Rice is more efficient in arsenite uptake and translocation than wheat and barley[J]. Plant and Soil, 2010, 328(1/2): 27-34. |
| [6] |
Tlustos P, Szakova J, Korinek K, et al. The effect of liming on cadmium, lead, and zinc uptake reduction by spring wheat grown in contaminated soil[J]. Plant Soil and Environment, 2006, 52(1): 16-24. |
| [7] |
于焕云, 崔江虎, 乔江涛, 等. 稻田镉砷污染阻控原理与技术应用[J]. 农业环境科学报, 2018, 37(7): 1418-1426. YU Huan-yun, CUI Jiang-hu, QIAO Jiang-tao, et al. Principle and technique of arsenic and cadmium pollution control in paddy field[J]. Journal of AgroEnvironment Science, 2018, 37(7): 1418-1426. |
| [8] |
Vangronsveld J, Herzig R, Weyens N, et al. Phytoremediation of contaminated soils and groundwater: Lessons from the field[J]. Environmental Science and Pollution Research, 2009, 16(7): 765-794. DOI:10.1007/s11356-009-0213-6 |
| [9] |
Cang L, Zhou D M, Wang Q Y, et al. Impact of electrokinetic-assisted phytoremediation of heavy metal contaminated soil on its physicochemical properties, enzymatic and microbial activities[J]. Electrochimica Acta, 2012, 86: 41-48. DOI:10.1016/j.electacta.2012.04.112 |
| [10] |
Fahad S, Hussain S, Khan F, et al. Effects of tire rubber ash and zinc sulfate on crop productivity and cadmium accumulation in five rice cultivars under field conditions[J]. Environmental Science and Pollution Research, 2015, 22(16): 12439-12449. DOI:10.1007/s11356-015-4518-3 |
| [11] |
Gu H H, Qiu H, Tian T, et al. Mitigation effects of silicon rich amendments on heavy metal accumulation in rice(Oryza sativa L.) planted on multi-metal contaminated acidic soil[J]. Chemosphere, 2011, 83(9): 1234-1240. DOI:10.1016/j.chemosphere.2011.03.014 |
| [12] |
Feng R W, Wei C Y, Tu S X, et al. A dual role of Se on Cd toxicity: Evidences from the uptake of Cd and some essential elements and the growth responses in paddy rice[J]. Biological Trace Element Research, 2013, 151(1): 113-121. DOI:10.1007/s12011-012-9532-4 |
| [13] |
Gill S S, Tuteja N. Cadmium stress tolerance in crop plants probing the role of sulfur[J]. Plant Signaling & Behavior, 2011, 6(2): 215-222. |
| [14] |
Hassan M J, Wang Z Q, Zhang G P. Sulfur alleviates growth inhibition and oxidative stress caused by cadmium toxicity in rice[J]. Journal of Plant Nutrition, 2005, 28(10): 1785-1800. DOI:10.1080/01904160500251092 |
| [15] |
Kashem M A, Singh B R. Metal availability in contaminated soils: Ⅱ. Uptake of Cd, Ni and Zn in rice plants grown under flooded culture with organic matter addition[J]. Nutrient Cycling in Agroecosystems, 2001, 61(3): 257-266. DOI:10.1023/A:1013724521349 |
| [16] |
Hu Z Y, Zhu Y G, Li M, et al. Sulfur(S)-induced enhancement of iron plaque formation in the rhizosphere reduces arsenic accumulation in rice(Oryza sativa L.) seedlings[J]. Environmental Pollution, 2007, 147(2): 387-393. DOI:10.1016/j.envpol.2006.06.014 |
| [17] |
Verbruggen N, Hermans C, Schat H. Mechanisms to cope with arsenic or cadmium excess in plants[J]. Current Opinion in Plant Biology, 2009, 12(3): 364-372. DOI:10.1016/j.pbi.2009.05.001 |
| [18] |
Gong J M, Lee D A, Schroeder J I. Long-distance root-to-shoot transport of phytochelatins and cadmium in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(17): 10118-10123. DOI:10.1073/pnas.1734072100 |
| [19] |
Mendoza-Cozatl D, Loza-Tavera H, Hernandez-Navarro A, et al. Sulfur assimilation and glutathione metabolism under cadmium stress in yeast, protists and plants[J]. Fems Microbiology Reviews, 2005, 29(4): 653-671. DOI:10.1016/j.femsre.2004.09.004 |
| [20] |
Zhang D, Du G, Chen D, et al. Effect of elemental sulfur and gypsum application on the bioavailability and redistribution of cadmium during rice growth[J]. Science of the Total Environment, 2019, 657: 1460-1467. DOI:10.1016/j.scitotenv.2018.12.057 |
| [21] |
Fan J L, Hu Z Y, Ziadi N, et al. Excessive sulfur supply reduces cadmium accumulation in brown rice(Oryza sativa L.)[J]. Environmental Pollution, 2010, 158(2): 409-415. DOI:10.1016/j.envpol.2009.08.042 |
| [22] |
邹丽娜, 戴玉霞, 邱伟迪, 等. 硫素对土壤砷生物有效性与水稻吸收的影响研究[J]. 农业环境科学学报, 2018, 37(7): 1435-1447. ZOU Li-na, DAI Yu-xia, QIU Wei-di, et al. Effect of sulfur on the bioavailability of arsenic in soil and its accumulation in rice plant (Oryza sativa L.)[J]. Journal of Agro-Environment Science, 2018, 37(7): 1435-1447. |
| [23] |
Gao M X, Hu Z Y, Wang G D, et al. Effect of elemental sulfur supply on cadmium uptake into rice seedlings when cultivated in low and excess cadmium soils[J]. Communications in Soil Science and Plant Analysis, 2010, 41(8): 990-1003. DOI:10.1080/00103621003646071 |
| [24] |
Cao Z Z, Qin M L, Lin X Y, et al. Sulfur supply reduces cadmium uptake and translocation in rice grains(Oryza sativa L.) by enhancing iron plaque formation, cadmium chelation and vacuolar sequestration[J]. Environmental Pollution, 2018, 238: 76-84. DOI:10.1016/j.envpol.2018.02.083 |
| [25] |
Chen S, Sun L, Sun T, et al. Interaction between cadmium, lead and potassium fertilizer(K2SO4) in a soil-plant system[J]. Environmental Geochemistry and Health, 2007, 29(5): 435-446. DOI:10.1007/s10653-007-9088-y |
| [26] |
Fan J, Xia X, Hu Z, et al. Excessive sulfur supply reduces arsenic accumulation in brown rice[J]. Plant Soil and Environment, 2013, 59(4): 169-174. DOI:10.17221/882/2012-PSE |
| [27] |
王丹, 李鑫, 王代长, 等. 硫素对水稻根系铁锰胶膜形成及吸收镉的影响[J]. 环境科学, 2015, 36(5): 1877-1887. WANG Dan, LI Xin, WANG Dai-chang, et al. Influence of sulfur on the formation of Fe-Mn plaque on root and uptake of Cd by rice(Oryza sativa L.)[J]. Environmental Science, 2015, 36(5): 1877-1887. |
| [28] |
Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particular trace elements[J]. Environmental Technology, 1979, 15(1): 844-850. |
| [29] |
李酋开. 土壤农业化学常规分析方法[M]. 北京: 科学出版社, 1989: 67-116. LI Qiu-kai. Soil agro-chemistry conventional analysis methods[M]. Beijing: Science Press, 1989: 67-116. |
| [30] |
Weigel H J, Jager H J. Subcellular distribution and chemical form of cadmium in bean plants[J]. Plant Physiology, 1980, 65(3): 480-482. DOI:10.1104/pp.65.3.480 |
| [31] |
胡正义, 夏旭, 吴丛杨慧, 等. 硫在稻根微域中化学行为及其对水稻吸收重金属的影响机理[J]. 土壤, 2009, 41(1): 27-31. HU Zheng-yi, XIA Xu, WU Cong-yang-hui, et al. Chemical behaviors of sulfur in the rhizosphere of rice and its impacts on heavy metals uptake in rice[J]. Soil, 2009, 41(1): 27-31. |
| [32] |
Muehe E M, Adaktylou I J, Obst M, et al. Organic carbon and reducing conditions lead to cadmium immobilization by secondary Fe mineral formation in a pH-neutral soil[J]. Environmental Science & Technology, 2013, 47(23): 13430-13439. |
| [33] |
McLaughlin M J, Lambrechts R M, Smolders E, et al. Effects of sulfate on cadmium uptake by Swiss chard: Ⅱ. Effects due to sulfate addition to soil[J]. Plant and Soil, 1998, 202(2): 217-222. DOI:10.1023/A:1004381413048 |
| [34] |
Zhao Z Q, Zhu Y G, Li H Y, et al. Effects of forms and rates of potassium fertilizers on cadmium uptake by two cultivars of spring wheat (Triticum aestivum L.)[J]. Environment International, 2004, 29(7): 973-978. DOI:10.1016/S0160-4120(03)00081-3 |
| [35] |
Shi G, Lu H, Liu H, et al. Sulfate application decreases translocation of arsenic and cadmium within wheat(Triticum aestivum L.) plant[J]. Science of the Total Environment, 2020, 713: 136665. DOI:10.1016/j.scitotenv.2020.136665 |
| [36] |
Wang K, Fu G, Yu Y, et al. Effects of different potassium fertilizers on cadmium uptake by three crops[J]. Environmental Science and Pollution Research, 2019, 26(26): 27014-27022. DOI:10.1007/s11356-019-05930-4 |
| [37] |
Wang H Y, Wen S L, Chen P, et al. Mitigation of cadmium and arsenic in rice grain by applying different silicon fertilizers in contaminated fields[J]. Environmental Science and Pollution Research, 2016, 23(4): 3781-3788. DOI:10.1007/s11356-015-5638-5 |
| [38] |
Tahervand S, Jalali M. Sorption and desorption of potentially toxic metals(Cd, Cu, Ni and Zn) by soil amended with bentonite, calcite and zeolite as a function of pH[J]. Journal of Geochemical Exploration, 2017, 181: 148-159. DOI:10.1016/j.gexplo.2017.07.005 |
| [39] |
Rodda M S, Li G, Reid R J, et al. The timing of grain Cd accumulation in rice plants: The relative importance of remobilisation within the plant and root Cd uptake post-flowering[J]. Plant Soil, 2011, 347(1/2): 105-114. |
| [40] |
Yang J X, Liu Z Y, Wan X M, et al. Interaction between sulfur and lead in toxicity, iron plaque formation and lead accumulation in rice plant[J]. Ecotoxicology and Environmental Safety, 2016, 128: 206-212. DOI:10.1016/j.ecoenv.2016.02.021 |
 2021, Vol. 40
2021, Vol. 40