2. 国家环境保护土壤环境管理与污染控制重点实验室, 南京 210042;
3. 河海大学环境学院, 南京 210098
2. Key Laboratory of Soil Environmental Management and Pollution Control, Ministry of Ecology and Environment, Nanjing 210042, China;
3. College of Environment, Hohai University, Nanjing 210098, China
随着工农业生产如采矿、冶炼等活动的不断开展以及农药、化肥的过量施用,越来越多的重金属化合物被带入到土壤环境中,造成土壤重金属污染问题[1]。2014年公布的《全国土壤污染状况调查公报》显示,我国土壤重金属镉(Cd)的调查点位超标率达到7%,其中重度Cd污染点位比例为0.5%。Cd已经成为我国土壤尤其是耕地土壤中主要的无机污染物之一[2]。进入到土壤中的Cd能够与土壤胶体、有机质和矿物质等结合,还能以离子态形式(如Cd2+、CdOH+、CdCl+等)存在于土壤孔隙水环境中[3]。这部分离子态Cd较易与生物受体结合,进而在生物体内积累和分布,产生毒性响应。研究表明,与土壤中总Cd含量相比,通过原位土壤溶液采集器采集到的土壤孔隙水中Cd含量能够更好地预测植物体内Cd积累量及其迁移能力[4]。土壤孔隙水中的Cd含量及其形态被认为是土壤Cd生物有效性的主要来源之一。生物炭因具有较高的比表面积、丰富的表面含氧官能团和高的pH值等理化特性,能够通过表面沉淀、吸附、离子交换和静电结合等作用结合重金属离子,降低其生物有效性[5-6]。蒋田雨等[7]和佟雪娇等[8]的研究指出,施加2%~5% 的农作物秸秆生物炭(300、400 ℃)能显著提高不同性质红壤上Cu2+和Cd2+的吸附量;生物炭对土壤上重金属离子吸附量的促进作用不仅与生物炭类型有关,还取决于土壤主要理化性质如pH、阳离子交换量(CEC)和胶体表面电荷等。近年来,生物炭及其改性材料已经被广泛地应用于吸附去除土壤或水体环境中的重金属污染物,具有原材料来源广泛、成本低及环境友好等优势[9-12]。然而,与生物炭相关的研究较多关注其在环境中的吸附效应,需要更多地关注生物炭施加下重金属生物有效性的改变及其对产生的植物毒性效应的预测能力,进而为合理评价生物炭材料的安全适用性提供参考[13]。基于此,本研究拟开展模拟土壤溶液中生菜幼苗生长实验,分析玉米秸秆生物炭施加对溶液中Cd2+吸附行为的影响,探讨玉米秸秆生物炭施加对Cd生物有效性的影响及其与生菜生长及根中Cd积累量之间的预测关系。
1 材料与方法 1.1 供试生物炭特征与模拟土壤溶液制备供试生物炭的前体物料为玉米秸秆,将其经自来水和去离子水冲洗干净后放入烘箱中105 ℃烘干6 h,烘干后的秸秆在粉碎机中进行破碎后过60目(0.25 mm)筛保存[14]。烘干的玉米秸秆在ZBX1型炭化炉(中国科学院南京土壤研究所)进行厌氧烧制,具体操作过程参考已有研究[14-15]。玉米秸秆生物炭的制备条件为400 ℃下保持8 h后获得,冷却后的生物炭材料经研磨后过0.25 mm筛保存,以备炭材料性质表征及培养实验使用。玉米秸秆生物炭的主要性质为:pH 8.71±0.54(炭∶水=1∶20,Orion Star A211pH meter测定);生物炭中C、H、O元素的质量分数分别为80.8%、1.05% 和11.9%(Vario MICRO型元素分析仪);其Cd含量低于ICP-OES的最低检测限。
由于真实土壤组分多变,这为在可控实验条件下探讨不同pH值如何影响重金属产生植物毒性的研究增加了难度。参考Wang等[16]的研究,论文中采用模拟土壤溶液开展植物溶液培养实验。模拟土壤溶液的主要组成为0.20 mmol·L-1 CaCl2、0.20 mmol·L-1 MgCl2、1.0 mmol·L-1 KCl和1.0 mmol·L-1 NaCl。实验设置两个pH条件(4.3和7.0),分别使用适量的NaOH和HCl调节pH至目标值,并加入4 mmol·L-1 MES[2-(N-吗啡啉)乙磺酸]作为缓冲溶液控制实验条件下的pH值。Lock等[17]的研究表明,MES不会对溶液中金属离子的化学形态产生显著影响,且不具有生物体毒性。实验设置6个浓度的CdCl2处理水平,分别为0、0.5、1、2、5 μmol·L-1和15 μmol·L-1 CdCl2;2个生物炭处理水平,分别为0% 和2%(m/V)。因此,实验过程中的处理组为:2个生物质炭水平×2个pH水平×6个CdCl2水平=24组。
1.2 生菜培养实验生菜(Lactuca sativa var. longifolia)是一种常见的叶类蔬菜,适合于土壤和水培种植,其根系发达,较易于富集重金属污染物如Cd[18]。因此,本研究选择生菜开展模拟土壤溶液的植物培养实验。生菜种子购自河北省青县王镇种子繁育站。选择健康饱满的生菜种子在0.5% 的NaClO溶液中浸泡10 min消毒,然后用去离子水冲洗种子表面至少6次以上,去除残留的NaClO。用去离子水润湿滤纸并将其平铺于洗净的玻璃培养皿上,将生菜种子均匀地播散在滤纸上,放置于20 ℃、湿度为75%的光照培养箱中,黑暗条件下发芽48 h。生菜发芽实验参照Wang等[16]和美国环境保护署(EPA)的要求开展。发芽结束后,选择具有一致初始根长(1~2 cm)的生菜幼苗用于后续生菜培养实验。
将上述生菜幼苗仔细转入到装有500 mL处理组溶液的聚丙乙烯烧杯中,每个烧杯中移植6株生菜幼苗,开展生菜培养实验。实验用仪器均在实验前经酸浸泡至少24 h后清洗晾干。各处理组设置3个重复,均放置于20 ℃、湿度为75% 的光照培养箱中光照10 h,黑暗14 h条件下培养3 d。实验结束后,小心取出各处理组的生菜幼苗置于2 mmol·L-1的EDTA溶液中浸泡10 min,再用去离子水冲洗干净后放置于干燥的滤纸上吸干植株表面水分。用直尺测量每株幼苗的根长(cm),并在天平上称量幼苗鲜质量(mg)。上述指标测量完成后将生菜幼苗根切下,置于烘箱中105 ℃烘干4 h后冷却至恒质量,称量烘干后的根干质量(mg)并记录。将烘干后的根粉碎后放入到25 mL的三角烧瓶中,向其中加入20 mL 5 mol·L-1的HNO3(优级纯)溶液,轻轻晃动后静置过夜。将上述三角烧瓶置于电热板上消煮(70~150 ℃),待消煮液基本澄清后煮干酸液,再向其中加入5 mL 2 mol·L-1 HCl后转移至10 mL容量瓶中定容。样品消煮过程中采用国家标准物质菠菜(GBW 10015)进行质量控制。所有样品中Cd含量均通过ICP-MS测定(iCAP Qc,ThermoFisher,USA),GBW 10015的回收率为97.7%± 3.5%。
1.3 生物炭对Cd2+的吸附参考相关文献[7, 15],本研究配制Cd2+浓度为0、0.1、0.25、0.5、1.0、1.5 mmol·L-1的CdCl2溶液,以模拟土壤溶液(0.20 mmol·L-1 CaCl2、0.20 mmol·L-1 MgCl2、1.0 mmol·L-1 KCl和1.0 mmol·L-1 NaCl)作为吸附实验的背景溶液。称取质量为0.500 g的混合了玉米秸秆生物炭的土壤样品(见1.1)于50 mL塑料离心管中,分别加入25 mL上述浓度的Cd2+溶液,浓度为Ci,用HCl和NaOH分别调节溶液pH值为4.3和7.0,加入4 mmol·L-1的MES(醇醚磺基琥珀酸单酯二钠盐)以控制溶液pH值。每个处理组重复3次。封盖,25 ℃恒温振荡(250 r·min-1)24 h后以4 500 r·min-1离心10 min,离心上清液过0.45 μm滤膜后得到吸附平衡液,浓度为Ce。不同pH处理下Cd2+的吸附量(qe,mmol· kg-1)可通过下式计算:
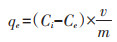
|
(1) |
式中:Ci和Ce分别为Cd2+在初始溶液和吸附平衡溶液中的浓度,mmol·L-1;v为平衡溶液的体积,mL;m为生物炭质量,g。
为探究Cd在生物炭上的吸附特性,论文中采用Langmuir和Freundlich公式对吸附等温线对数据进行拟合。公式分别为:

|
(2) |
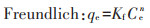
|
(3) |
式中:qe和qm分别为生物炭上Cd2+的平衡吸附量和最大吸附量,mmol·kg-1;Ce为Cd2+在吸附平衡溶液中的浓度,mmol·L-1;KL、Kf、n均为吸附常数。
1.4 生物炭的Zeta电位测定为探讨不同pH和Cd2+吸附对生物炭表面电荷特性的影响,对生物炭的表面Zeta电位值进行了测定。称取4.000 g过0.054 mm筛的玉米秸秆生物炭于250 mL三角瓶中,分别加入0、0.1、0.25、0.5、1.0、1.5 mmol· L-1的CdCl2溶液200 mL,以1 mmol·L-1的NaCl作为支持电解质。每个处理组设置4个平行。使用稀NaOH和HCl调节溶液pH值为4.3和7.0,25 ℃下振荡24 h后重新调节溶液pH值至4.3和7.0。将上述溶液室温下放置48 h后通过JS94H微电泳仪测定溶液的电泳淌度,并经由软件计算得到Zeta电位值。
1.5 数据处理与分析生菜幼苗的相对根伸长抑制率RRE可用于评价根的毒性响应,其计算公式为:

|
(4) |
式中:RLT、RLC分别为各处理组培养3 d后Cd2+胁迫下的根长和对照组中不含Cd2+下的根长,cm;RL0为生菜幼苗在Cd2+完全胁迫下的根长,即幼苗移植时的根长,cm。
通过Weibull公式能够拟合生菜幼苗暴露于各处理组时的相对根伸长抑制率指标,其公式为:
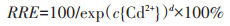
|
(5) |
式中:{Cd2+}为模拟土壤溶液中Cd的生物有效性,分别以总Cd含量(Cdtotal)和离子态Cd含量(Cd2+)表示;系数c和d均可通过回归分析得到。
在毒理学研究中,毒性污染物对生物体生长指标产生50% 抑制效应时候的浓度被定义为是该毒性污染物的EC50。在本研究中,当RRE=50% 时所需要的Cd的EC50值计算如下:
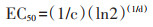
|
(6) |
生菜根中Cd的积累量(Cduptake)可基于米氏方程(Michaelis-Menten equation)进行拟合,其公式为:
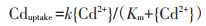
|
(7) |
式中:k为{Cd2+}与生物体上结合位点之间的结合、内化速率常数;Km为米氏常数;{Cd2+}为模拟土壤溶液中Cd的生物有效性,分别以总Cd含量(Cdtotal)和离子态Cd含量(Cd2+)表示。
实验中Cd2+含量基于模拟土壤溶液组成,通过Visual minteq 3.1软件计算得到;实验数据主要通过Sigmaplot 10.0进行数据拟合和作图。
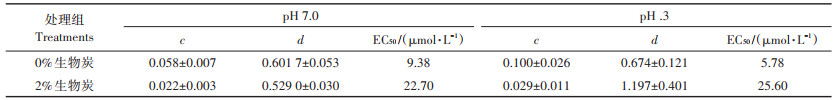
2 结果与讨论 2.1 不同pH对Cd2+在生物炭上吸附行为的影响不同pH值对Cd2+在玉米秸秆生物炭上吸附量的影响如图 1a所示。结果表明,Cd2+在生物炭上的吸附量会随溶液pH值和Cd2+平衡浓度的增加而增大。Langmuir和Freundlich公式均能较好地拟合Cd2+在生物炭上的吸附行为(r2>0.80),拟合参数结果见表 1。Langmuir公式拟合结果显示在pH 7.0时,生物炭对Cd2+的最大吸附量Qm为87.3 mg·g-1,这高于pH 4.3时的25.4 mgg-1;Freundlich公式拟合也得到了类似的结果,pH 7.0时较高的Kf值表明其中Cd2+的吸附强度要高于pH 4.3的处理组。与Freundlich公式相比,Langmuir公式能够更好地拟合Cd2+在生物炭上的吸附行为(表 1)。Zeta电位值反映的是溶液中的胶体颗粒在外加电场作用时胶体与溶液相滑动面上的电位值,它主要受到胶体表面电荷特性和环境条件等的影响。如图 1b所示,玉米秸秆生物炭表面带负电荷,其在pH 4.3时的表面电负性(-21.9±0.09 mV)小于pH 7.0(-23.8±0.67 mV)。随着溶液中Cd2+浓度的增大,生物炭表面电负性不断降低。对比图 1a和图 1b可以发现,生物炭的Zeta电位值变化趋势与Cd2+在生物炭上的吸附行为密切相关,即具有较低Zeta电位值的生物炭处理组中Cd2+吸附量更高。
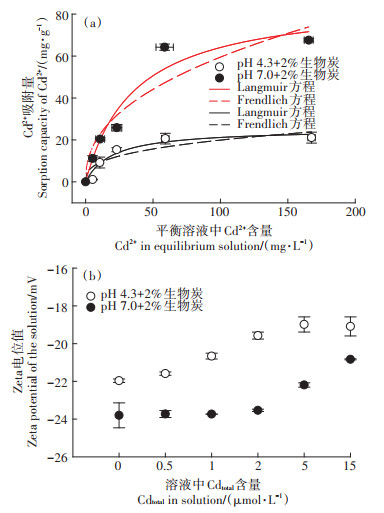
|
图 1 Cd2+在生物炭上的等温吸附和生物炭表面Zeta电位值的变化 Figure 1 Changes in soil Cd2+ adsorption behaviors and Zeta potential values |
|
|
表 1 Cd2+在生物炭上的等温吸附过程的Langmuir与Freundlich方程拟合 Table 1 Isothermal adsorption of Cd2+ on biochar based on Langmuir and Freundlich equations |
事实上,经厌氧热解过程制得的生物炭材料一般具有较强的碱性,这主要体现为其表面的无机物和有机物组分两部分[5]。一方面,生物质中的含碳组分在高温裂解条件下灰化,形成碳酸盐类物质,从而提高生物炭表面的碱性;另一方面,生物炭表面丰富的—COO—和—OH等含氧官能团以阴离子形式存在,能够与溶液中的H+结合,进而影响溶液的酸碱度。因此,本研究主要考虑pH值对Cd2+在生物炭上吸附行为的影响。此外,生物炭表面丰富的含氧官能团和盐基离子(Na、K、Ca和Mg等)还是生物炭阳离子交换量(CEC)的重要来源,这决定了生物炭表面负电荷的数量[6]。随着溶液pH值的升高,生物炭表面含氧官能团的解离程度增大,导致其表面有机阴离子数量增加,从而具有更低的Zeta电位值。蒋田雨等[7]的研究表明,稻草生物炭能够显著提高土壤胶体的电负性,进而通过静电吸附效应增加Cd2+在土壤上的吸附量。因此,溶液中的Cd2+能够通过非专性的静电吸附作用与生物炭相结合,且易于受到溶液pH值的影响。此外,李力等[11]的研究指出,生物炭上的π共轭芳香结构能够与Cd2+发生配位作用,从而增加Cd2+在生物炭上的吸附量,但该作用受溶液pH值的影响较小。
2.2 生物炭对生菜生长的影响不同pH条件下,施加生物炭对生菜幼苗根长和干质量的影响如图 2所示。生菜根长和干质量值均随溶液中Cd含量的增大而降低;2%玉米秸秆生物炭的施加能够促进生菜幼苗生长并缓解Cd对生长的抑制效应。与无生物炭处理的对照组相比,2% 生物炭施加将幼苗根长值分别提高了21.2%(pH 7.0)和6.84%(pH 4.3)。当溶液中Cd总量(Cdtotal)为5.3 µmol·L-1时,2% 生物炭施加下的幼苗根长分别提高了39.6%(pH 7.0)和70.7%(pH 4.3)。类似地,与无生物炭处理的对照相比,生物炭的施加显著提高了生菜干质量,分别达到24.8%(pH 7.0)和42.1%(pH 4.3)。生物炭材料通常含有丰富的矿质元素如Ca、Mg、Na和K等,使其不仅能通过离子交换等作用更多地结合溶液中的Cd2+,还能为植物生长提供必需的矿质养分[13]。因此,施加生物炭能够缓解Cd产生的生菜生长胁迫效应并促进其生物量的增加。
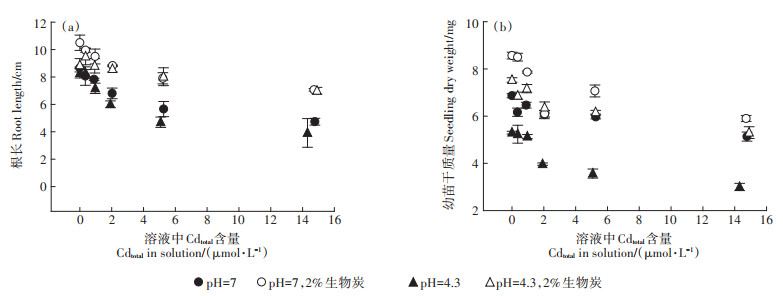
|
图 2 生菜幼苗根长和干质量与溶液中Cd总量(Cdtotal)之间的关系 Figure 2 Correlations between total content of Cd(Cdtotal)and root length or dry weight of lettuce seedlings |
通过Weibull公式分别拟合了溶液中Cdtotal含量,溶液中的Cd2+含量与生菜相对根伸长抑制率RRE之间的相关性(图 3)。结果发现,溶液中的Cd2+含量能够解释80% 的RRE变异性(r2=0.80,P < 0.001),这高于Cdtotal(r2=0.71,P < 0.001)。相较于重金属总量指标,土壤中离子态重金属含量被认为更能够表征重金属产生的植物毒性和积累效应。早在1983年,Morel[19]就提出了水环境中金属离子活度值是其生物有效性和毒性的主要来源的观点,即自由离子活度模型(FIAM)。在后续的研究中又陆续发现,环境因素如pH、有机质含量和共存阳离子等会对重金属离子的毒性效应产生影响(增强或缓解)[20]。基于Weibull公式的拟合参数,计算得到不同pH和生物炭施加水平下,生菜幼苗根生长达到50% 抑制时的Cd2+效应浓度值即EC50值(表 2)。在不施加生物炭时,较低的pH值(4.3)具有较高的根毒性效应,其EC50值(5.78 µmol· L-1)低于pH 7.0时的EC50值(9.38 µmol·L-1)。2% 的生物炭施加显著提高了两组pH值条件下的EC50值,pH 4.3时的EC50提高了4.43倍,pH 7.0时的EC50值提高了2.42倍。余淑娟等[21]通过8种不同pH值土壤上的番茄盆栽实验发现,土壤pH值是影响番茄根伸长响应外源Cd胁迫的重要因素,根生长达到20% 抑制率时的Cd浓度值(EC20)会随土壤pH值的增大而增大。事实上,在不同pH值和生物炭添加水平下,溶液中Cd2+含量的降低是处理组中EC50值升高的重要原因,生菜幼苗根长和干质量也会随之增加。
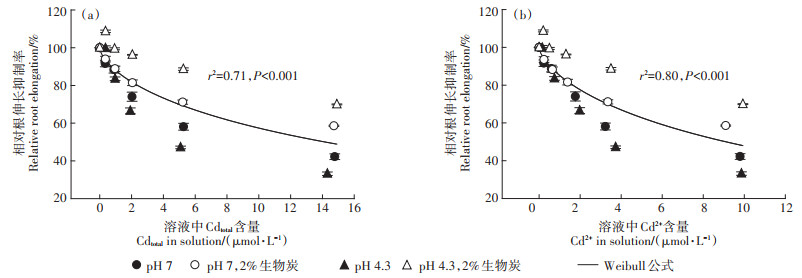
|
图 3 基于Weibull公式拟合生菜幼苗相对根伸长抑制率与溶液中Cd总量(Cdtotal)和Cd2+含量之间的关系 Figure 3 Correlations between the relative root elongation and total content of Cd(Cdtotal)or Cd2+ content in the solution based on Weibull equation |
|
|
表 2 基于Weibull公式计算得到50%根伸长抑制率时Cd2+的效应浓度值(EC50) Table 2 Effective concentrations of Cd2+(EC50)at 50% inhibition of root elongation based on Weibull equation |
尽管本研究得到了与前人[22-23]类似的结果,即溶液中金属离子浓度能够更好地预测其产生的植物根毒性效应如根长、体内金属积累量等,但仍需注意到,本研究中Cd2+与生菜幼苗根伸长抑制率之间的回归相关性仅略高于模拟土壤溶液中Cdtotal的预测能力。这可能与生物炭施加使得一部分Cd2+被吸附在其表面,从而减少了模拟土壤溶液中Cd2+含量有关,而基于Visual minteq软件计算得到的Cd2+活度值并不能完全反映溶液中Cd2+的真实含量。因此,在施用改良剂如生物炭的重金属污染土壤中,需要考虑改良剂对实际土壤孔隙水中重金属离子含量的影响,以综合全面评价改良剂的环境风险及其适用性。
2.3 生物炭对生菜幼苗根中Cd积累量的影响2% 生物炭施加对生菜根中Cd积累量的影响如图 4所示。生菜根中Cd的积累量会随着溶液中Cdtotal含量的增加而增加,但会随溶液pH值的增加而降低;2% 玉米秸秆生物炭的施加则减少了根中Cd的积累量。如当溶液中Cdtotal含量为14.8 µmol·L-1时,玉米秸秆生物炭的施加对根中Cd积累量的降低百分数分别为20.3%(pH 7.0)和17.3%(pH 4.3)。然而,生物炭降低根中Cd积累量的能力会随溶液中Cdtotal含量的增加而减小。当溶液中Cdtotal为0.40 µmol·L-1时,施加2%生物炭对根中Cd积累量的降低程度最高,分别达到65.1%(pH 7.0)和63.1%(pH 4.3)。基于米氏方程的拟合结果显示(图 4),模拟土壤溶液中Cd2+对根中Cd积累量的预测能力(r2=0.88,P < 0.001)略高于Cdtotal(r2=0.79,P < 0.001)。有研究指出[24],植物体内金属积累量与其毒性响应(如根伸长、酶活性等)之间具有较好的回归相关性,但在本研究中并没有发现类似的现象。线性回归分析结果显示(图 5),生菜幼苗根中Cd的积累量能够预测68%的生菜根长变异性数据(r2=0.68,P < 0.001),而对幼苗干质量的预测能力只有53%(r2=0.53,P < 0.001)。由此可见,进入到植物体内积累的重金属总量指标并不总能很好地表征其产生的毒性效应。Wallace等[25]指出,生物体内的重金属能够与不同的生物体组分结合。基于生物体亚细胞分室模型,可以将生物体内的重金属区分为生物解毒组分(微粒体和热稳定蛋白组分相结合的重金属)和生物毒性敏感组分(细胞器和热应激蛋白组分相结合的重金属)[26]。其中,生物毒性敏感组分的重金属是导致生物体毒性响应的主要因素。因此,相较于模拟土壤溶液中Cd2+含量(r2>0.75),生菜幼苗根中Cd的积累量(r2 < 0.70)并不能更好地反映Cd的生物有效性。此外,施加生物炭不仅能够降低Cd的生物有效性,还能够影响其他矿质养分如Ca、Si等的生物有效性,进而通过根表竞争结合位点和共享离子通道等形式影响Cd在植物体内的积累和分布[27-28]。

|
图 4 根中Cd积累量与溶液中Cd总量和Cd2+含量之间的关系及其Michaelis-Menten方程拟合 Figure 4 Correlations between root Cd accumulation and total Cd or Cd2+ content in solutions, based on the Michaelis-Menten equation |
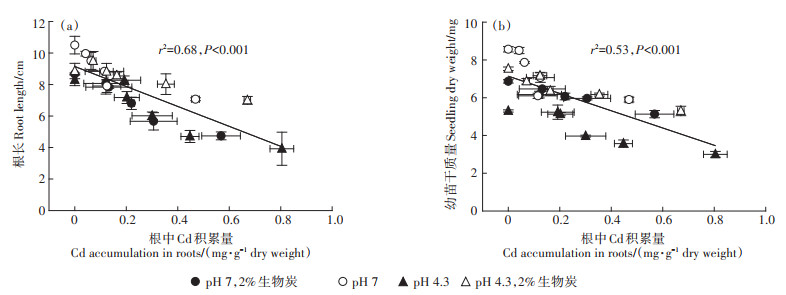
|
图 5 根中Cd积累量与根长和幼苗干质量之间的关系及其线性拟合 Figure 5 Linear correlations between root Cd accumulation and root lengthor seedling dry weight |
(1)Cd2+在玉米秸秆生物炭上的吸附行为符合Langmuir公式;玉米秸秆生物炭能够通过静电吸附效应结合溶液中的Cd2+,该过程会受到溶液pH值的影响。
(2)玉米秸秆生物炭施加能显著缓解重金属Cd对生菜幼苗根生长的胁迫效应,这与溶液中Cd2+含量降低有关;相较于溶液中Cdtotal含量和根中Cd积累量指标,溶液中Cd2+含量能够更好地评价幼苗根毒性效应,是玉米秸秆生物炭施加下Cd生物有效性的主要来源。
| [1] |
刘志彦, 田耀武, 陈桂珠. 矿区周围稻米重金属积累及健康风险分析[J]. 生态与农村环境学报, 2010, 26(1): 35-40. LIU Zhi-yan, TIAN Yao-wu, CHEN Gui-zhu. Accumulation of heavy metals in rice growing around mining area and its human health risk analysis[J]. Journal of Ecology and Rural Environment, 2010, 26(1): 35-40. DOI:10.3969/j.issn.1673-4831.2010.01.007 |
| [2] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[R]. 北京: 环境保护部, 国土资源部. 2014. Department of Environmental Protection, Ministry of Land and Resources. National survey of soil pollution[R]. Beijing: Department of Environmental Protection, Ministry of Land and Resources. 2014. |
| [3] |
Wan Y, Camara A Y, Yu Y, et al. Cadmium dynamics in soil pore water and uptake by rice: Influences of soil-applied selenite with different water managements[J]. Environ Pollut, 2018, 240: 523-533. DOI:10.1016/j.envpol.2018.04.044 |
| [4] |
Beesley L, Moreno-Jiménez E, Clemente R, et al. Mobility of arsenic, cadmium and zinc in a multi-element contaminated soil profile assessed by in-situ soil pore water sampling, column leaching and sequential extraction[J]. Environ Pollut, 2010, 158(1): 155-160. DOI:10.1016/j.envpol.2009.07.021 |
| [5] |
钱林波. 生物碳对酸性土壤中有害金属植物毒性缓解及阻控机理[D]. 杭州: 浙江大学, 2014. QIAN Lin-bo. The phytotoxicity alleviation and adsorption mechanism of toxic metals of acidic soil by biochar amendment[D]. Hangzhou: Zhejiang University, 2014. |
| [6] |
徐仁扣, 赵安珍, 肖双成, 等. 农作物残体制备的生物质炭对水中亚甲基蓝的吸附作用[J]. 环境科学, 2012, 33(1): 142-146. XU Ren-kou, ZHAO An -zhen, XIAO Shuang-cheng, et al. Adsorption of methylene blue from water by the biochars generated from crop residues[J]. Environmental Science, 2012, 33(1): 142-146. DOI:10.3969/j.issn.1000-6923.2012.01.023 |
| [7] |
蒋田雨, 姜军, 徐仁扣, 等. 稻草生物质炭对3种可变电荷土壤吸附Cd(Ⅱ)的影响[J]. 农业环境科学学报, 2012, 31(6): 1111-1117. JIANG Tian-yu, JIANG Jun, XU Ren-kou, et al. Effect of biochar from rice straw on adsorption of Cd(Ⅱ)by variable charge soils[J]. Journal of Agro-Environment Science, 2012, 31(6): 1111-1117. |
| [8] |
佟雪娇, 李九玉, 姜军, 等. 添加农作物秸秆炭对红壤吸附Cu(Ⅱ) 的影响[J]. 生态与农村环境学报, 2011, 27(5): 37-41. TONG Xue-jiao, LI Jiu-yu, JIANG Jun, et al. Effect of biochars derived from crop straws on Cu(Ⅱ)adsorption by red soils[J]. Journal of Ecology and Rural Environment, 2011, 27(5): 37-41. DOI:10.3969/j.issn.1673-4831.2011.05.007 |
| [9] |
Wang Y, Wang S, Wang C, et al. Simultaneous immobilization of soil Cd(Ⅱ)and As(Ⅴ)by Fe-modified biochar[J]. International Journal of Environmental Research and Public Health, 2020, 17(3): 827. DOI:10.3390/ijerph17030827 |
| [10] |
Uchimiya M, Chang S, Klasson K T. Screening biochars for heavy metal retention in soil: Role of oxygen functional groups[J]. J Hazard Mater, 2011, 190(1/2/3): 432-441. |
| [11] |
李力, 陆宇超, 刘娅, 等. 玉米秸秆生物炭对Cd(Ⅱ)的吸附机理研究[J]. 农业环境科学学报, 2012, 31(11): 2277-2283. LI Li, LU Yu-chao, LIU Ya, et al. Adsorption mechanisms of cadmium(Ⅱ)on biochars derived from corn straw[J]. Journal of Agro-Environment Science, 2012, 31(11): 2277-2283. |
| [12] |
He L, Zhong H, Liu G, et al. Remediation of heavy metal contaminated soils by biochar: Mechanisms, potential risks and applications in China[J]. Environ Pollut, 2019, 252: 846-855. DOI:10.1016/j.envpol.2019.05.151 |
| [13] |
Wang Y, Tang D, Yuan X, et al. Effect of amendments on soil Cd sorption and trophic transfer of Cd and mineral nutrition along the food chain[J]. Ecotoxicol Environ Saf, 2020, 189: 110045. DOI:10.1016/j.ecoenv.2019.110045 |
| [14] |
Li M, Wang Y, Liu M, et al. Three-year field observation of biochar-mediated changes in soil organic carbon and microbial activity[J]. J Environ Qual, 2019, 48(3): 717-726. DOI:10.2134/jeq2018.10.0354 |
| [15] |
汪宜敏, 唐豆豆, 张晓辉, 等. 玉米秸秆炭对红壤镉吸附及养分含量、赋存形态的影响[J]. 农业环境科学学报, 2017, 36(12): 2445-2452. WANG Yi-min, TANG Dou-dou, ZHANG Xiao -hui, et al. Effects of corn-straw biochar on cadmium adsorption, nutrient contents, and chemical forms in red soil[J]. Journal of Agro-Environment Science, 2017, 36(12): 2445-2452. DOI:10.11654/jaes.2017-0964 |
| [16] |
Wang Y M, Kinraide T B, Wang P, et al. Modeling rhizotoxicity and uptake of Zn and Co singly and in binary mixture in wheat in terms of the cell membrane surface electrical potential[J]. Environ Sci Technol, 2013, 47: 2831-2838. DOI:10.1021/es3022107 |
| [17] |
Lock K, de Schamphelaere K, Becaus S, et al. Development and vali dation of a terrestrial biotic ligand model predicting the effect of cobalt on root growth of barley(Hordeum vulgare)[J]. Environ Pollut, 2007, 147: 626-633. DOI:10.1016/j.envpol.2006.10.003 |
| [18] |
Li C, Dang F, Cang L, et al. Internal distribution of Cd in lettuce and resulting effects on Cd trophic transfer to the snail: Achatina fulica[J]. Chemosphere, 2015, 135: 123-128. DOI:10.1016/j.chemosphere.2015.03.096 |
| [19] |
Morel F M M. Principles of aquatic chemistry[M]. New York: John Wiley, 1983.
|
| [20] |
Li L, Zhou D, Luo X, et al. Effect of major cations and pH on the acute toxicity of cadmium to the earthworm Eisenia fetida: Implications for the biotic ligand model approach[J]. Arch Environ Contam Toxicol, 2008, 55(1): 70-77. DOI:10.1007/s00244-007-9100-7 |
| [21] |
余淑娟, 高树芳, 屈应明, 等. 不同土壤条件下镉对番茄根系的毒害效应及其毒害临界值研究[J]. 农业环境科学学报, 2014, 33(4): 640-646. YU Shu-juan, GAO Shu-fang, QU Ying-ming, et al. Toxicity and its threshold of cadmium to tomato roots in different soils[J]. Journal of Agro-Environment Science, 2014, 33(4): 640-646. |
| [22] |
Kopittke P, Kinraide T, Wang P, et al. Alleviation of Cu and Pb rhizotoxicities in cowpea(Vigna unguiculata)as related to ion activities at root-cell plasma membrane surface[J]. Environ Sci Technol, 2011, 45(11): 4966-4973. DOI:10.1021/es1041404 |
| [23] |
Wang Y, Kinraide T, Wang P, et al. Surface electrical potentials of root cell plasma membranes: Implications for ion interactions, rhizotoxicity, and uptake[J]. International Journal of Molecular Sciences, 2014, 15(12): 22661-22677. DOI:10.3390/ijms151222661 |
| [24] |
Li D D, Zhou D M, Wang P, et al. Subcellular Cd distribution and its correlation with antioxidant enzymatic activities in wheat(Triticum aestivum)roots[J]. Ecotoxicol Environ Saf, 2011, 74(4): 874-881. DOI:10.1016/j.ecoenv.2010.12.006 |
| [25] |
Wallace W G, Lee B G, Luoma S N. Subcellular compartmentalization of Cd and Zn in two bivalves. I. significance of metal-sensitive fractions(MSF)and biologically detoxified metal(BDM)[J]. Mar Ecol Prog Ser, 2003, 249: 183-197. DOI:10.3354/meps249183 |
| [26] |
Wang W X, Rainbow P S. Subcellular partitioning and the prediction of cadmium toxicity to aquatic organisms[J]. Environ Chem, 2007, 3(6): 395-399. |
| [27] |
李连祯, 罗小三, 周东美. 土壤溶液中Ca2+降低Cd2+对赤子爱胜蚓的毒性[J]. 中国环境科学, 2007(5): 681-685. LI Lian-zhen, LUO Xiao-san, ZHOU Dong-mei. Calcium antagonizes the toxicity of cadmium to E. fetida in simulated soil solution[J]. China Environmental Science, 2007(5): 681-685. DOI:10.3321/j.issn:1000-6923.2007.05.023 |
| [28] |
Wu D, Yamaji N, Yamane M, et al. The HvNramp5 transporter mediates uptake of cadmium and manganese, but not iron[J]. Plant Physiol, 2016, 172(3): 1899-1910. DOI:10.1104/pp.16.01189 |
 2021, Vol. 40
2021, Vol. 40