2. 中国农业科学院研究生院, 北京 100081;
3. 中国农业科学院农业水资源高效安全利用重点开放实验室, 河南 新乡 453002
2. Graduate University of Chinese Academy of Agricultural Sciences, Beijing 100081, China;
3. Key Laboratory of High Efficient and Safe Utilization of Agriculture Water Resources, Chinese Academy of Agricultural Sciences, Xinxiang 453002, China
再生水等非常规水资源用于灌溉对缓解我国农业水资源紧缺现状具有重要意义[1]。此外,我国作为畜禽养殖大国,养殖废水也呈现出量大、集中等特点[2]。再生水和养殖废水中不仅含有N、P和K等营养元素,也含有重金属、有机污染物和致病微生物等有害物质[3-5]。经一定处理后用于灌溉会改变土壤pH、有机质含量及团聚体稳定性等理化性质,也可能会造成盐分、重金属和有机污染物等在土壤中迁移累积,从而对农田生态环境构成威胁[6-7]。土壤重金属污染问题也尤为突出,Cd污染物点位超标率在所有无机污染物中超标率最高[8]。
Cd是一种广泛存在、毒性大且迁移能力强的非必需微量元素。关于Cd在土壤中吸附-解吸特性已有大量研究。吸附-解吸作为影响Cd在土壤中迁移、滞留及生物有效性的关键因素[9],受土壤pH、阳离子交换量(CEC)、有机质、黏粒及CaCO3含量等土壤理化性质的综合影响[10-11]。土壤中盐分累积会促使Cd在土壤中的迁移[12],CO32-等阴离子可能会抑制Cd在土壤中的迁移,SO42-、Cl-和NO3-可与Cd形成水溶性络合物抑制土壤对Cd的吸附[9, 13],PO43-等离子可能促使Cd形成沉淀从而降低Cd在土壤中迁移,有机质会增加土壤对Cd的固定能力[11, 14]。但关于不同水源灌溉后对土壤吸附Cd能力变化的影响研究鲜见报道。
水资源是否能够安全用于农业灌溉直接决定土壤环境质量和生态系统平衡。近年来,再生水和养殖废水灌溉对土壤-植物系统的影响方面已有较多研究[4, 15]。再生水灌溉会增加土壤盐分、碳酸盐、SO42-及Cl-等的含量,养殖废水灌溉会增加土壤有机质、有效磷和NO3-含量[4, 16]。但关于在农业生产实际中使用再生水和养殖废水等非常规水源灌溉对土壤吸附Cd能力的复合影响几乎未见报道,且主要影响因素尚不清楚。因此,本研究选取我国典型的潮土和红壤作为研究对象,在室内对土壤进行再生水和养殖废水灌溉,培养一段时间后,向土壤中加入不同浓度Cd溶液进行吸附和解吸试验。本研究可为评价不同水源灌溉后Cd在土壤中迁移风险提供科学依据,同时为非常规水资源安全利用提供一定参考。
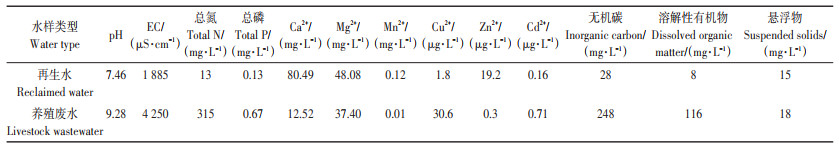
1 材料与方法 1.1 试验水样与土壤本研究所用再生水主要指城市污水经适当再生工艺处理后,符合《城镇污水处理厂污染物排放标准》(GB 18918—2002)、《城市污水再生利用绿地灌溉水质》(GB/T 25499—2010)和《城市污水再生利用农田灌溉用水水质》(GB 20922—2007),可用于工业、农业、市政杂用和回补地下水等。试验所用再生水取自河南省新乡市骆驼湾污水处理厂(厦门水务集团新乡城建投资有限公司),该厂设计处理能力为日处理污水15.00万m3。污水来源主要为新乡市部分区域的生活污水(东至新四街,西至西华大道,南至科隆大道,北至卫河),处理厂处理设备运转良好,日平均处理污水量为9.77万m3。该公司采用先进的污水处理设备,厂区主体工艺采用A/O处理工艺,试验所用再生水采自二沉池出水。所用养殖废水采自于新乡市盛达牧业有限公司Ⅰ级规模集约化养猪场厌氧发酵罐发酵后的沼液。该沼液符合《畜禽养殖业污染物排放标准》(GB 18596—2001)。水样采集后保存于4℃冰箱,每次使用前摇匀,无其他进一步处理。水样基本性质如表 1所示。
|
|
表 1 试验用再生水和养殖废水性质 Table 1 Chemical characteristics of reclaimed water and livestock wastewater used in this study |
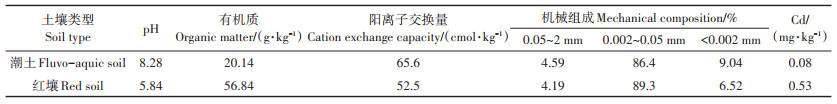
供试土壤为采集于天津市宁河区(117°40′47″E,39°25′ 22″ N)的潮土和湖南祁阳(111°52′ 12″ E,26° 45′29″N)的红壤,采集地点均为水稻田,采样深度为0~20 cm。土样经室内风干,去除杂物,磨碎后过2 mm尼龙筛,备用。土壤基本性质见表 2。
|
|
表 2 供试土壤基本理化性质 Table 2 Physical and chemical properties of soils used in this study |
称300 g风干土壤于圆形塑料盆(底部直径15 cm,盆口直径23 cm,深7 cm)中,分别添加水质差异明显的再生水、养殖废水以及去离子水,所有塑料盆置于室温下进行培养。由于地下水含有Ca2+、Mg2+和Na+等阳离子以及HCO3-和SO42-等阴离子,无法作为只考虑水分的对照。因而为了区分水分本身和水质的影响,选用电阻率为18.25 MΩ·cm的去离子水为对照。为了模拟水稻田的淹水状态,在试验最初加了225 g的水,之后每2 d补一次水(约45 g)以弥补水分损失。虽然潮土每日水分蒸腾量稍大于红壤,但所有处理总加水量控制一致(900 g),试验持续了30 d左右。本研究在严格控制除水源以外的条件保持一致的前提下,在理论上阐明前期再生水和养殖废水灌溉以及灌溉引起的水中有机物在土壤累积等综合作用对土壤固Cd能力的影响。培养结束后,土壤风干磨碎。部分用于基本理化性质测定,其余用于吸附动力学和等温吸附试验。培养后的土样分别记为去离子水灌溉潮土(FDS)、养殖废水灌溉潮土(FLS)、再生水灌溉潮土(FRS)、去离子水灌溉红壤(RDS)、养殖废水灌溉红壤(RLS)和再生水灌溉红壤(RRS)。
1.2.2 Cd吸附动力学试验支持电解质为0.01 mol·L-1的NaNO3,使用优级纯Cd(NO3)2·4H2O配制Cd浓度为25 mg·L-1的Cd溶液。称取土样50.00 g于500 mL烧杯中,放入磁子后置于磁力搅拌器上,加入上述Cd溶液500 mL(固液比1∶10[11, 17-18])后,室温(25±1)℃条件下迅速开始搅拌。在磁力搅拌器的搅拌作用下,整个体系已混匀,每次取样时均为搅拌状态下均匀混合的水土悬液,能够最大程度地维持土水比基本不变。在搅拌开始的第0.5、1、2、4、7、10、15、30 min、1、2、4、8、12、24 h和48 h测定溶液pH,并同时用两个注射器各吸取混合悬液5 mL。吸取完毕后迅速用0.45 μm滤膜过滤,随后用原子吸收分光光度计(AAS)(AA-6300,SHIMADZU,Japan)测定溶液中Cd浓度。吸附动力学试验表明,吸附24 h后已基本处于平衡状态,这与前人研究结果一致[19]。因此在后续等温吸附试验中统一采用24 h。
1.2.3 等温吸附试验以0.01 mol·L-1的NaNO3为支持电解质溶液配制0、5、10、25 mg·L-1和50 mg·L-1的Cd溶液。称取培养后的土壤各3.000 g于50 mL聚乙烯离心管中,记录含盖离心管质量,加入30 mL上述Cd溶液,加盖密封,涡旋混匀1 min后,置于恒温(25±1)℃振荡器(200 r· min-1)振荡24 h后取出,4 000 r·min-1离心10 min。随后将上清液用定量滤纸(GB/T 1914—1993)过滤至聚乙烯离心管中,加1% 浓HNO3酸化,用原子吸收分光光度计测定上清液Cd浓度。每个处理均设置3个重复,另外设置了不加Cd的NaNO3溶液为空白。
选用Freundlich和Langmuir方程对吸附等温线进行拟合:
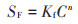
|
(1) |
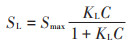
|
(2) |
式中:SF和SL为吸附量,mg·kg-1;C为平衡溶液中Cd浓度,mg·L-1;Kf、n、Smax和KL为模型参数。
固液分配系数Kd表征固相对溶质滞留能力及溶质向液相移动的程度,常被广泛用于比较不同土壤对特定离子的吸附能力[20]。Kd计算如下[21-22]:
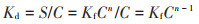
|
(3) |
式中:Kd为Freundlich方程参数Kf和n估计的固-液分配系数值,L·kg-1。
1.2.4 Cd吸附形态解吸土壤对Cd的吸附能力主要取决于Cd在土壤中的化学形态和与土壤的结合形式[23-24]。因此,进一步探究了土壤吸附Cd的形态分布对再生水和养殖废水灌溉的响应。吸附试验完成后,小心倾倒出上清液并对含盖聚乙烯离心管和残余物称量,随后分别用1 mol·L-1的KNO3、0.05 mol·L-1的EDTA-2Na(pH 6.0)和0.01 mol·L-1的HCl各30 mL溶液依次分别解吸1 h,得到交换态、络合态和沉淀态Cd[25-28],并计算出残余态Cd。土壤吸附Cd形态占比计算公式如下:
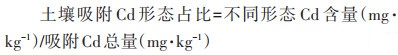
|
(4) |
采用BaCl2缓冲液法[29]测定土壤阳离子交换量(CEC);激光粒度分布仪(BT-9300HT)测定土壤粒径;pH计(Orion-star A211,USA)测定土样pH(土水比为1∶5);土壤全氮、全磷采用连续流动分析仪法(Auto Analyzer 3型,德国BRAN LUEBBE,灵敏度0.001 AUFS)测定;依据《土壤农业化学分析方法》[30]测定土壤有机质、碳酸钙、速效钾和速效磷含量。采用SPSS 25进行数据方差分析和相关性分析,利用Origin 2020b进行图形绘制和数据拟合。
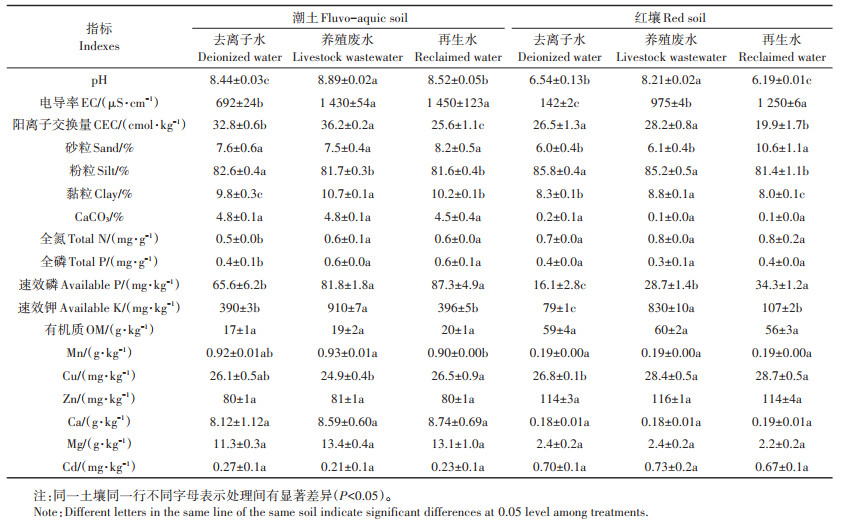
2 结果与分析 2.1 不同水源灌溉对土壤理化性质的影响不同水源灌溉后潮土和红壤的理化性质如表 3所示。与土壤初始pH相比,两种土壤的所有处理pH均有不同程度的增加。因为试验是为了模拟水稻田的淹水状态,加水量超过了饱和含水率,虽然土壤表层相对干燥,土壤下层基本处于还原状态,土壤中大多数还原反应均消耗质子,从而增加了土壤pH。与对照相比,养殖废水灌溉显著增加了潮土和红壤pH;再生水灌溉显著增加了潮土pH。两种水源灌溉均明显地增加了两种土壤电导率(EC)。养殖废水灌溉显著增加了两种土壤黏粒含量,再生水灌溉显著增加了潮土黏粒含量。与对照相比,养殖废水灌溉显著增加了两种土壤速效磷和速效钾含量;再生水灌溉显著增加了两种土壤速效磷含量,显著降低了两种土壤CEC。此外,除养殖废水和再生水处理后红壤Cu含量显著增加外,两种水源灌溉对土壤中Mn、Zn、Ca、Mg和Cd含量基本无显著影响。
|
|
表 3 不同水源灌溉后土壤的理化性质 Table 3 Physical and chemical properties of soils irrigated by different water sources |
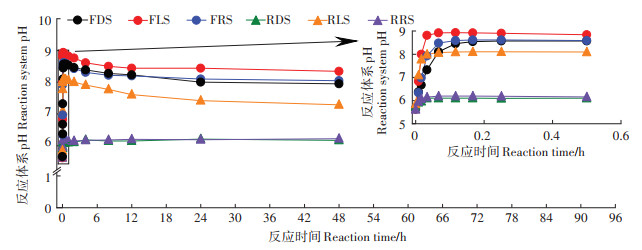
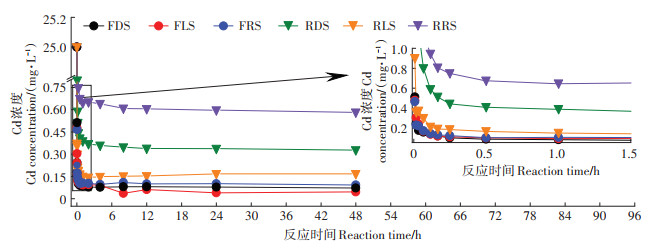
Cd初始浓度为25 mg·L-1时,不同水源灌溉后土壤反应体系pH动态变化和Cd浓度变化如图 1和图 2所示。反应体系pH最初10 min迅速增加,随后基本稳定(RDS和RRS)或有一定下降(RLS、FDS、FLS及FRS)。试验所有土壤溶液反应体系Cd浓度随时间变化趋势基本一致:最初30 min迅速下降,随后逐渐稳定。潮土反应体系残留Cd浓度明显低于红壤。平衡阶段(24~48 h),不同水源对两种土壤溶液反应体系残留Cd浓度的影响均表现为:再生水灌溉土壤>去离子水灌溉土壤>养殖废水灌溉土壤。这表明Cd初始浓度为25 mg·L-1时,与对照相比,养殖废水灌溉增加了土壤对Cd吸附,而再生水灌溉减弱了土壤对Cd的吸附。
|
图 1 体系pH变化的动态曲线 Figure 1 Dynamic of pH in the reaction systems |
|
图 2 体系Cd浓度变化的动态曲线 Figure 2 Dynamic of Cd concentration in the reaction systems |
不同初始Cd浓度下等温吸附试验结果如图 3所示。随Cd浓度增加,吸附24 h后溶液中残留Cd浓度也随之增加。所有处理红壤平衡溶液中Cd浓度明显高于潮土,表明红壤吸附Cd的能力低于潮土。与对照相比,再生水灌溉显著增加了潮土和红壤平衡溶液中Cd浓度。Cd初始浓度为5、10、25 mg·L-1和50 mg· L-1时,再生水灌溉的潮土平衡溶液中Cd浓度分别比去离子水处理增加了76.72%、40.40%、36.27% 和41.03%,再生水灌溉红壤分别增加了70.01%、87.04%、31.43%和80.57%,表明再生水灌溉降低了红壤和潮土对Cd的吸附,这与吸附动力学试验结果一致。与对照相比,低初始Cd浓度(5 mg·L-1和10 mg· L-1)时,养殖废水灌溉显著增加了潮土和红壤平衡溶液中Cd浓度,且红壤平衡溶液中Cd浓度增幅高于潮土;Cd浓度较高(25 mg·L-1和50 mg·L-1)时,养殖废水灌溉降低了潮土和红壤平衡溶液中Cd浓度,表明Cd初始浓度较高时养殖废水灌溉增加了红壤和潮土对Cd的吸附。
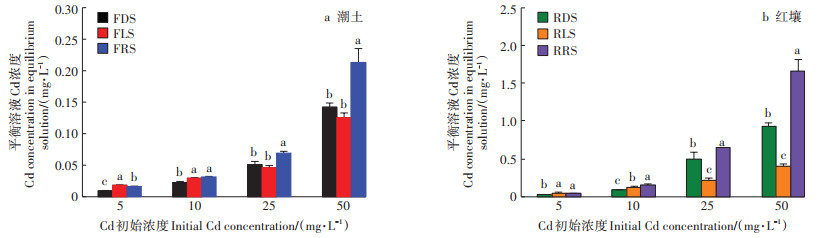
|
同一初始浓度不同字母表示处理间差异显著(P < 0.05)。下同 Different letters in the same initial concentration indicate significant differences among treatments at 0.05 level. The same below 图 3 不同水源灌溉潮土和红壤平衡溶液中Cd浓度 Figure 3 Cd concentration in equilibrium solution of fluvo-aquic soil and red soil irrigated with different water sources |
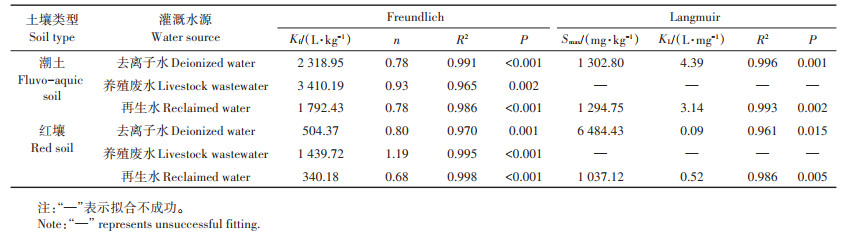
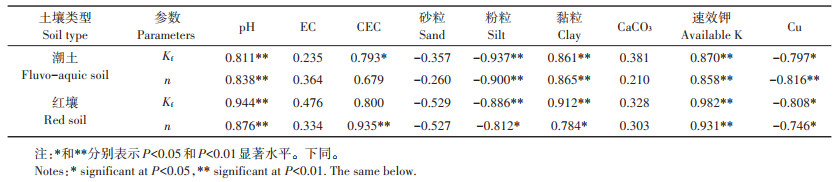
本研究采用Freundlich和Langmuir模型对吸附过程进行拟合,拟合参数如表 4所示。通过Langmuir方程拟合分析后发现,Langmuir方程无法拟合养殖废水灌溉的土壤对Cd的吸附。拟合结果表明,Freundlich模型能够较好地拟合灌溉后土壤对Cd的吸附过程,R2均在0.965以上(P < 0.01)。养殖废水灌溉潮土和红壤Kf值分别比相应的对照提高47.1% 和185.4%,再生水灌溉潮土和红壤Kf值分别比对照降低22.7%和32.6%。养殖废水灌溉潮土和红壤n值分别比对照增加了19.2% 和48.8%,再生水灌溉红壤n值比对照减小15.0%。
|
|
表 4 Freundlich和Langmuir方程拟合参数 Table 4 Fitting parameters of Freundlich and Langmuir models |
Freundlich模型能够较好地拟合不同水源灌溉后土壤对Cd吸附的过程。因此,进一步估算了Cd固液分配系数Kd值[22]。Kd值越高表明污染物在土壤溶液中越易被固持,越低表明污染物越容易滞留在溶液中并迁移转化[31]。再生水和养殖废水处理的土壤Cd分配系数随Cd初始浓度的变化情况如图 4所示。再生水处理后潮土的Kd值均显著低于对照;养殖废水处理后潮土Kd值在Cd初始浓度较低时低于对照,在Cd初始浓度较高时与对照无显著差异。除最低Cd浓度外,养殖废水处理红壤Kd值均显著高于对照,再生水处理红壤的Kd值均低于对照,并在Cd浓度较高时有显著差异。总体上,对照和再生水处理的潮土和红壤Kd值随Cd浓度增加而降低。尽管养殖废水处理的潮土Kd值随Cd浓度增加而轻微降低,但经养殖废水处理后红壤的Kd值随Cd浓度增加有增加趋势。养殖废水灌溉处理的红壤对Cd有较强的吸附能力,尤其是在Cd浓度为25 mg·L-1和50 mg·L-1时。此外,Freundlich拟合参数Kf和n也证明了这一点,所以推测在本试验10~50 mg·L-1的Cd浓度范围远没有达到养殖废水处理红壤的最大吸附容量,即吸附位点相对过量。因而Cd固液分配系数在增加,但并无显著差异。
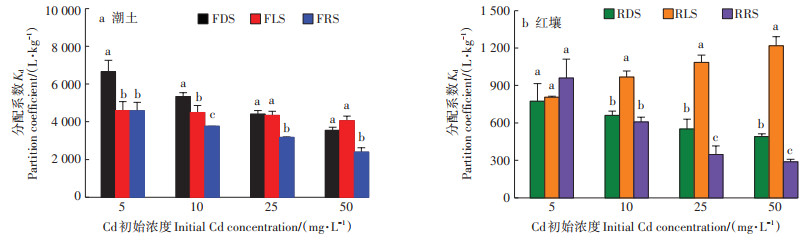
|
图 4 不同水源灌溉潮土和红壤固液分配系数Kd Figure 4 Solid-liquid distribution coefficient of fluvo-aquic soil and red soil irrigated with different water sources |
不同水源灌溉后潮土吸附Cd形态分布如图 5所示。与对照相比,Cd初始浓度较低时,再生水处理显著降低了潮土络合态Cd含量;Cd初始浓度为5 mg· L-1时,养殖废水和再生水处理均显著增加了潮土交换态、沉淀态和残余态Cd含量,但Cd初始浓度为10 mg·L-1时显著降低了残余态Cd含量。养殖废水灌溉处理的沉淀态和残余态Cd含量在Cd浓度为10 mg·L-1时相比对照有所降低,络合态Cd含量有所升高。这表明Cd浓度较低时,再生水灌溉主要通过减少潮土络合态Cd含量进而降低潮土对Cd吸附总量,养殖废水灌溉对Cd吸附总量降低主要是潮土络合态和残余态Cd含量减少所致。

|
图 5 不同水源灌溉潮土在Cd浓度为5、10、25 mg·L-1和50 mg·L-1吸附Cd形态分布 Figure 5 Form distribution of adsorbed Cd at 5, 10, 25 mg·L-1 and 50 mg·L-1 Cd concentrations irrigated by different water sources in fluvo-aquic soil |
Cd浓度为25 mg·L-1时,不同处理间各形态Cd含量的相对变化与10 mg·L-1类似,同样表明络合态Cd变化是影响该浓度下Cd吸附总量变化的主要原因。Cd浓度为50 mg·L-1时,养殖废水处理的交换态和络合态Cd均显著降低,而沉淀态Cd显著增加。再生水处理降低了潮土交换态、络合态和沉淀态Cd含量。这表明,Cd浓度较高时,养殖废水灌溉主要通过增加潮土络合态和沉淀态Cd含量进而增加潮土对Cd的吸附,潮土络合态和残余态Cd含量的降低是再生水灌溉降低潮土对Cd吸附总量的主要原因。
不同水源灌溉后红壤吸附Cd形态分布如图 6所示。与对照相比,养殖废水和再生水灌溉均显著降低了红壤交换态Cd含量,且养殖废水处理红壤交换态Cd含量降低幅度最大。Cd浓度最低时,两种水源灌溉的土壤交换态和沉淀态Cd含量减少降低了土壤对Cd吸附。Cd浓度为10 mg·L-1时,交换态和络合态Cd含量减少导致了Cd吸附量的下降。Cd浓度较高时,虽然养殖废水灌溉减少红壤交换态Cd含量,但也增加了红壤络合态和残余态Cd含量,从而增加了红壤对Cd吸附。再生水灌溉在Cd浓度较高时,由于主要减少了红壤交换态Cd含量从而降低了红壤对Cd的吸附。

|
图 6 不同水源灌溉红壤在Cd浓度为5、10、25 mg·L-1和50 mg·L-1吸附Cd形态分布 Figure 6 Form distribution of adsorbed Cd at 5, 10, 25 mg·L-1 and 50 mg·L-1 Cd concentrations irrigated by different water sources in red soil |
不同水源灌溉潮土和红壤各形态Cd占Cd吸附总量的比例如图 7所示。试验所有处理下两种土壤络合态Cd占比最高。潮土交换态Cd占比随Cd浓度增加先降低后增加。Cd浓度为5 mg·L-1时,再生水灌溉的潮土交换态Cd占比高于对照,养殖废水灌溉的潮土交换态Cd占比低于对照;随Cd浓度增加,养殖废水和再生水灌溉潮土络合态Cd占比均较对照降低。红壤交换态Cd占比随Cd浓度增加总体上呈逐渐增加趋势,养殖废水和再生水灌溉的红壤交换态Cd占比均明显低于对照。

|
图 7 不同水源灌溉潮土和红壤交换态、络合态、沉淀态和残余态Cd形态占比 Figure 7 Proportion of exchangeable, complexed, precipitated and residual Cd forms in fluvo-aquic soil and red soil |
不同水源灌溉的潮土络合态Cd占比呈现“V”型趋势,并在Cd浓度为25 mg·L-1时所有处理的潮土络合态Cd占比最低。再生水灌溉处理的潮土络合态Cd占比均低于对照,养殖废水灌溉处理的潮土络合态Cd占比除在Cd浓度最低和最高时低于对照外,其他Cd浓度时均高于对照。不同水源灌溉红壤络合态Cd占比随Cd浓度增加基本呈现一定降低趋势;Cd浓度较高时,养殖废水灌溉红壤络合态Cd占比较对照和再生水灌溉明显升高;Cd浓度为5 mg·L-1和50 mg· L-1时,再生水灌溉处理的红壤络合态Cd占比明显高于对照。
不同水源灌溉处理的潮土沉淀态Cd占比呈倒“V”趋势,且均随Cd浓度增加先升高后降低。再生水灌溉潮土沉淀态Cd占比均高于对照,养殖废水灌溉潮土沉淀态Cd占比在Cd浓度为5 mg·L-1和50 mg· L-1时高于对照,其他浓度基本无显著差异。不同水源灌溉处理的红壤沉淀态Cd占比随Cd浓度增加基本呈现逐渐增加趋势。除最低Cd浓度外,再生水灌溉处理的红壤沉淀态Cd占比基本高于对照,养殖废水灌溉处理的红壤沉淀态Cd占比除Cd浓度在25 mg·L-1低于对照外,其他浓度均高于对照。沉淀态Cd的形成受土壤pH、Cd初始浓度、土壤有机质和土壤阴阳离子等的综合影响,且随Cd浓度变化呈现出浓度差异。因此,养殖废水灌溉处理的潮土沉淀态Cd含量在不同Cd初始浓度时并不总是高于对照。
所有不同水源灌溉处理的红壤和潮土残余态Cd占比均随Cd浓度增加而基本呈现增加趋势。Cd浓度最低时,再生水灌溉处理的潮土残余态Cd占比明显高于对照;养殖灌溉处理的潮土残余态Cd占比只在Cd浓度为10 mg·L-1和25 mg·L-1时低于对照。养殖废水和再生水灌溉处理的红壤残余态Cd占比除在Cd浓度为10 mg·L-1时显著高于对照外,其他浓度均无显著性差异。
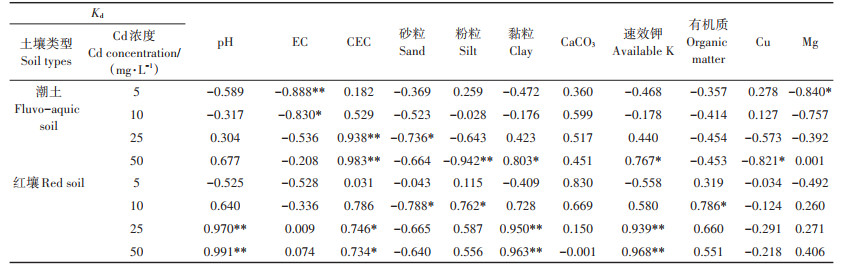
3 讨论土壤对Cd的吸附是影响Cd在土壤中迁移滞留的主要因素[32]。再生水和养殖废水灌溉后,土壤理化性质如土壤pH、电导率、CEC及黏粒含量等会发生改变[4, 33-34],从而影响潮土和红壤对Cd的吸附。Cd浓度较低时,虽然养殖废水和再生水处理的潮土和红壤pH基本高于对照,但都不同程度地降低了潮土和红壤对Cd的吸附能力。一方面可能是因为养殖废水和再生水灌溉增加了潮土和红壤Ca、Mg、Cu和Zn等含量。Freundlich模型参数与土壤理化性质相关性分析也表明,潮土和红壤对Cd的吸附能力与土壤Cu含量呈显著负相关(表 5)。研究表明[17, 35],土壤对Cu和Zn吸附能力明显强于Cd,这可能是因为Cu和Zn能够与土壤有机质牢固结合并形成配合物,而配合物能与Cd竞争吸附点位,从而降低了土壤对Cd的吸附[36]。另一方面,养殖废水和再生水灌溉处理明显增加了潮土和红壤中盐分含量,而盐分增加能促进Cd在土壤中释放[12]。Cd浓度较低时,不同水源处理的潮土盐分含量和Kd值呈显著性负相关关系(表 6),这说明养殖废水和再生水灌溉处理后土壤盐分含量的增加也降低了潮土对Cd固持能力。Acosta等[37]研究结果同样表明,盐分的增加提高了Cd在沉积物中的迁移能力。养殖废水和再生水灌溉带入的盐基离子尤其是Cl-能够与Cd结合形成CdCl+和CdCl2等稳定配合物,进而减少了土壤对Cd的吸附[13, 16]。
|
|
表 5 Freundlich模型参数和土壤理化性质相关性分析 Table 5 Correlation analysis of Freundlich model parameters and soil physicochemical properties |
|
|
表 6 Kd值与土壤理化性质相关性分析 Table 6 Correlation analysis of Kd parameters and soil physicochemical properties |
Cd浓度较高时,养殖废水灌溉处理增加了潮土和红壤对Cd吸附,再生水灌溉处理减少了潮土和红壤对Cd吸附。养殖废水灌溉处理的潮土和红壤对Cd吸附能力增加可能是土壤pH升高导致土壤表面负电荷增加所致[38],这进一步体现在Cd浓度较高时Kd与土壤pH及CEC的正相关性方面。Cd吸附于土壤的过程依赖土壤表面的负电荷,优先地以非专性吸附的方式吸附在土壤表面,随后以专性吸附的方式滞留于土壤中[9, 39]。Freundlich模型参数与土壤pH和黏粒含量等理化性质显著相关也表明,再生水灌溉降低了红壤pH和黏粒含量,从而减小了土壤对Cd的亲和能力,因而吸附Cd能力也有所降低。此外,再生水灌溉显著降低红壤CEC,增加了土壤中Cu等的含量,从而减小了红壤对Cd的吸附。
本试验Cd浓度范围内,所有不同水源灌溉的潮土Kd值明显高于红壤。Shaheen等[21]研究也表明,碱性土壤Kd值显著高于酸性土壤。土壤pH能够控制土壤溶液中氢氧化物、碳酸盐和磷酸盐等的溶解度,从而使Cd能够以被土壤吸附、与土壤内外表面络合及形成沉淀等方式滞留于土壤中[40],故在潮土pH较高时表现出较高的Kd值。养殖废水和再生水灌溉处理的潮土和红壤对Cd的吸附能力也体现在对Cd赋存形态的影响上。再生水灌溉较对照整体上降低了土壤Kd值,同时再生水灌溉处理的土壤平衡溶液中Cd浓度高于对照,表明再生水灌溉处理致使Cd易滞留于潮土和红壤溶液中,减少了潮土络合态和交换态Cd占比及红壤交换态和残余态Cd占比,从而表现出对Cd较低的吸附能力。Cd浓度较低时,养殖废水灌溉处理的潮土和红壤受其灌溉带入的盐分影响,减少潮土络合态和红壤交换态Cd占比,从而减弱了对Cd的吸附能力。但随Cd浓度增加,Kd值与土壤CEC和黏粒含量在Cd浓度较高时显著正相关,养殖废水灌溉能够增加潮土和红壤的CEC和黏粒含量,增加土壤络合态Cd含量进而增加了对Cd的吸附能力;而再生水灌溉降低了红壤阳离子交换量和黏粒含量,进而减弱了红壤对Cd的吸附能力[11]。
4 结论(1)与对照相比,前期再生水灌溉显著降低了潮土和红壤对Cd的吸附,前期养殖废水灌溉在Cd浓度较低时显著降低潮土和红壤对Cd的吸附,但在Cd浓度较高时显著增加了潮土和红壤对Cd的吸附。Freundlich模型参数能够较好地拟合不同水源灌溉后土壤对Cd的吸附。
(2)土壤对Cd的吸附以络合态为主。前期再生水灌溉主要通过改变土壤交换态、络合态和残余态Cd含量从而改变潮土和红壤对Cd的吸附;前期养殖废水灌溉主要通过改变土壤交换态和络合态Cd含量,从而改变潮土和红壤对Cd的吸附。
(3)土壤pH、黏粒含量、土壤Cu含量和土壤盐分是影响前期不同水源灌溉后土壤吸附Cd能力差异的主要因素。
| [1] |
胡雅琪, 吴文勇. 中国农业非常规水资源灌溉现状与发展策略[J]. 中国工程科学, 2018, 20(5): 69-76. HU Ya-qi, WU Wen-yong. Review and development strategy of irrigation with unconventional water resources in China[J]. Strategic Study of CAE, 2018, 20(5): 69-76. |
| [2] |
缪畅, 贺美, 肖围. 畜禽养殖场废水处理研究现状[J]. 应用化工, 2020, 49(6): 1481-1484. MIAO Chang, HE Mei, XIAO Wei. Research status of wastewater treatment from livestock and poultry farms[J]. Applied Chemical Industry, 2020, 49(6): 1481-1484. DOI:10.3969/j.issn.1671-3206.2020.06.034 |
| [3] |
Zalacáin D, Bienes R, Sastre-Merlín A, et al. Influence of reclaimed water irrigation in soil physical properties of urban parks: A case study in Madrid(Spain)[J]. Catena, 2019, 180: 333-340. DOI:10.1016/j.catena.2019.05.012 |
| [4] |
刘源, 崔二苹, 李中阳, 等. 再生水和养殖废水灌溉下土壤-植物系统养分和重金属迁移特征[J]. 灌溉排水学报, 2018, 37(2): 45-51. LIU Yuan, CUI Er-ping, LI Zhong-yang, et al. Differences of nutrient and heavy metals migration in soil-plant system irrigated by reclaimed water and livestock wastewater[J]. Journal of Irrigation and Drainage, 2018, 37(2): 45-51. |
| [5] |
韩洋, 李平, 齐学斌, 等. 再生水灌水水平对土壤重金属及致病菌分布的影响[J]. 中国环境科学, 2019, 39(2): 723-731. HAN Yang, LI Ping, QI Xue-bin, et al. Effects of different irrigation levels of reclaimed water on the distribution of soil heavy metals and typical pathogenic bacteria[J]. China Environmental Science, 2019, 39(2): 723-731. DOI:10.3969/j.issn.1000-6923.2019.02.035 |
| [6] |
龚雪, 王继华, 关健飞, 等. 再生水灌溉对土壤化学性质及可培养微生物的影响[J]. 环境科学, 2014, 35(9): 3572-3579. GONG Xue, WANG Ji-hua, GUAN Jian-fei, et al. Impact of reclaimed water irrigation on soil chemical properties and culturable microorganisms[J]. Environmental Science, 2014, 35(9): 3572-3579. |
| [7] |
Christou A, Agüera A, Bayona J M, et al. The potential implications of reclaimed wastewater reuse for irrigation on the agricultural environment: The knowns and unknowns of the fate of antibiotics and antibiotic resistant bacteria and resistance genes: A review[J]. Water Research, 2017, 123: 448-467. DOI:10.1016/j.watres.2017.07.004 |
| [8] |
环境保护部和国土资源部等相关负责人就全国土壤污染状况调查答记者问[J]. 资源与人居环境, 2014, 36(4): 4-6. Ministry of Environmental Protection & Ministry of Land and Resources. Report on the national general survey of soil contamination[J]. Resources and Habitant Environment, 2014, 36(4): 4-6. |
| [9] |
Loganathan P, Vigneswaran S, Kandasamy J, et al. Cadmium sorption and desorption in soils: A review[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(5): 489-533. DOI:10.1080/10643389.2010.520234 |
| [10] |
Zhao X, Jiang T, Du B. Effect of organic matter and calcium carbonate on behaviors of cadmium adsorption-desorption on/from purple paddy soils[J]. Chemosphere, 2014, 99: 41-48. DOI:10.1016/j.chemosphere.2013.09.030 |
| [11] |
Elbana T A, Selim H M. Modeling of cadmium and nickel release from different soils[J]. Geoderma, 2019, 338: 78-87. DOI:10.1016/j.geoderma.2018.11.041 |
| [12] |
Zhao S, Feng C H, Wang D X, et al. Salinity increases the mobility of Cd, Cu, Mn, and Pb in the sediments of Yangtze Estuary: Relative role of sediments'properties and metal speciation[J]. Chemosphere, 2013, 91(7): 977-984. DOI:10.1016/j.chemosphere.2013.02.001 |
| [13] |
Kubier A, Wilkin R T, Pichler T. Cadmium in soils and groundwater: A review[J]. Applied Geochemistry, 2019, 108. |
| [14] |
Petruzzelli G, Guidi G, Lubrano L. Organic matter as an influencing factor on copper and cadmium adsorption by soils[J]. Water Air & Soil Pollution, 1978, 9(3): 263-269. |
| [15] |
Liu X J, Liang C Z, Liu X H, et al. Occurrence and human health risk assessment of pharmaceuticals and personal care products in real agricultural systems with long-term reclaimed wastewater irrigation in Beijing, China[J]. Ecotoxicology and Environmental Safety, 2020, 190: 110022. DOI:10.1016/j.ecoenv.2019.110022 |
| [16] |
刘源, 崔二苹, 李中阳, 等. 再生水和养殖废水灌溉下生物质炭和果胶对土壤盐碱化的影响[J]. 灌溉排水学报, 2018, 37(6): 16-23. LIU Yuan, CUI Er-ping, LI Zhong-yang, et al. Effect of irrigating biochar-and pectin-amended soil with treated municipal wastewater and swine wastewater on soil salinity and sodicty[J]. Journal of Irrigation and Drainage, 2018, 37(6): 16-23. |
| [17] |
Elbana T A, Selima H M, Akrami N, et al. Freundlich sorption parameters for cadmium, copper, nickel, lead, and zinc for different soils: Influence of kinetics[J]. Geoderma, 2018, 324: 80-88. DOI:10.1016/j.geoderma.2018.03.019 |
| [18] |
Campillo-Cora C, Conde-Cid M, Arias-Estévez M, et al. Specific adsorption of heavy metals in soils: Individual and competitive experiments[J]. Agronomy, 2020, 10(8): 1113. DOI:10.3390/agronomy10081113 |
| [19] |
王金贵. 我国典型农田土壤中重金属镉的吸附-解吸特征研究[D]. 杨凌: 西北农林科技大学, 2012: 18-20. WANG Jin-gui. Adsorption-desorption characteristics of cadmium in typical agricultural soils in China[D]. Yangling: Northwest A & F University, 2012: 18-20. |
| [20] |
Reddy M R, Dunn S J. Distribution coefficients for nickel and zinc in soils[J]. Environmental Pollution, 1986, 11(4): 303-313. |
| [21] |
Shaheen S M, Tsadilas C D, Mitsibonas T, et al. Distribution coefficient of copper in different soils from Egypt and Greece[J]. Communications in Soil Science and Plant Analysis, 2009, 40(1-6): 214-226. DOI:10.1080/00103620802625625 |
| [22] |
Shaheen S M. Sorption and lability of cadmium and lead in different soils from Egypt and Greece[J]. Geoderma, 2009, 153(1/2): 61-68. |
| [23] |
Violante A, Cozzolino V, Perelomov L, et al. Mobility and bioavailability of heavy metals and metalloids in soil environments[J]. Journal of Soil Science and Plant Nutrition, 2010, 10(3): 266-290. |
| [24] |
张朝阳, 彭平安, 宋建中, 等. 改进BCR法分析国家土壤标准物质中重金属化学形态[J]. 生态环境学报, 2012, 21(11): 1881-1884. ZHANG Chao-yang, PENG Ping-an, SONG Jian-zhong, et al. Utilization of modified BCR procedure for the chemical speciation of heavy metals in Chinese soil reference material[J]. Ecology and Environmental Sciences, 2012, 21(11): 1881-1884. DOI:10.3969/j.issn.1674-5906.2012.11.019 |
| [25] |
Xu R K, Zhao A Z. Effect of biochars on adsorption of Cu(Ⅱ), Pb(Ⅱ)and Cd(Ⅱ)by three variable charge soils from southern China[J]. Environmental Science and Pollution Research, 2013, 20(12): 8491-8501. DOI:10.1007/s11356-013-1769-8 |
| [26] |
Harter, Robert D. Effect of soil pH on adsorption of lead, copper, zinc and nickel[J]. Soil Science Society of America Journal, 1983, 47(1): 47-51. DOI:10.2136/sssaj1983.03615995004700010009x |
| [27] |
Zhou Q, Liu Z D, Liu Y, et al. Relative abundance of chemical forms of Cu(Ⅱ)and Cd(Ⅱ)on soybean roots as influenced by pH, cations and organic acids[J]. Scientific Reports, 2016, 6(1): 1-9. DOI:10.1038/s41598-016-0001-8 |
| [28] |
Sérgio S, Carina A E C, Armando C D, et al. Influence of different organic amendments on the potential availability of metals from soil: A study on metal fractionation and extraction kinetics by EDTA[J]. Chemosphere, 2010, 78(4): 389-396. DOI:10.1016/j.chemosphere.2009.11.008 |
| [29] |
王虹, 崔桂霞. 用氯化钡缓冲液法测定土壤阳离子交换量[J]. 土壤, 1989(1): 49-51. WANG Hong, CUI Gui-xia. The determination of soil cation exchange capacity by the method of Barium chloride buffer solution[J]. Soils, 1989(1): 49-51. |
| [30] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999. LU Ru-kun. Chemical analysis of soil agriculture[M]. Beijing: China Agricultural Science and Technology Press, 1999. |
| [31] |
Anderson P R, Christensen T H. Distribution coefficients of Cd, Co, Ni, and Zn in soils[J]. Journal of Soil Science, 1988, 39(1): 15-22. DOI:10.1111/j.1365-2389.1988.tb01190.x |
| [32] |
Bradl H B. Adsorption of heavy metal ions on soils and soils constituents[J]. Journal of Colloid and Interface Science, 2004, 277(1): 1-18. DOI:10.1016/j.jcis.2004.04.005 |
| [33] |
David Z, Silvia M, Ramón B, et al. Salt accumulation in soils and plants under reclaimed water irrigation in urban parks of Madrid (Spain)[J]. Agricultural Water Management, 2019, 213: 468-476. DOI:10.1016/j.agwat.2018.10.031 |
| [34] |
Xu J, Wu L, Chang A C, et al. Impact of long-term reclaimed wastewater irrigation on agricultural soils: A preliminary assessment[J]. Journal of Hazardous Materials, 2010, 183(1): 780-786. |
| [35] |
Gomes P C, Fontes M P F, Da Silva A G, et al. Selectivity sequence and competitive adsorption of heavy metals by Brazilian soils[J]. Soil Science Society of America Journal, 2001, 65(4): 1115-1121. DOI:10.2136/sssaj2001.6541115x |
| [36] |
Petruzzelli G, Guidi G, Lubrano L. Organic matter as an influencing factor on copper and cadmium adsorption by soils[J]. Water Air & Soil Pollution, 1978, 9(3): 263-269. |
| [37] |
Acosta J A, Jansen B, Kalbitz K, et al. Salinity increases mobility of heavy metals in soils[J]. Chemosphere, 2011, 85(8): 1318-1324. DOI:10.1016/j.chemosphere.2011.07.046 |
| [38] |
Naidu R, Kookana R S, Sumner M E, et al. Cadmium sorption and transport in variable charge soils: A review[J]. Journal of Environmental Quality, 1997, 26(3): 602-617. |
| [39] |
Naidu R, Bolan N S, Kookana R S, et al. Ionic-strength and pH effects on the sorption of cadmium and the surface charge of soils[J]. European Journal of Soil Science, 1994, 45(4): 419-429. DOI:10.1111/j.1365-2389.1994.tb00527.x |
| [40] |
Silveira M L A, Alleoni L R F, Guilherme L R G. Biosolids and heavy metals in soils[J]. Scientia Agricola, 2003, 60(4): 793-806. DOI:10.1590/S0103-90162003000400029 |
 2021, Vol. 40
2021, Vol. 40