土壤和水体镉[Cd(Ⅱ)]污染是一个全球性问题,其不仅对食品安全有负面影响,而且会增加健康风险[1-2]。其中,Cd(Ⅱ)污染水体若未经有效处理而任意排放或被用于农田灌溉,将造成受纳环境重金属污染。因此,有必要从源头上加强Cd(Ⅱ)污染水体的修复。在水体镉污染的修复方面,各种常规处理方法如膜分离、电化学处理和化学沉淀等被广泛用于重金属污染废水修复[3]。然而,这些常规方法价格昂贵[4],尤其是当废水中的Cd(Ⅱ)浓度在1~100 mg·L-1的范围内时[5]。近年来,微生物修复法作为一种低能量消耗的处理方法,引起广大科研工作者的高度关注,由于其材料易获取、生态环保、易于操作等优点,成为重金属污染环境治理领域的研究热点[6]。研究证实,微生物修复是通过微生物作用将生物可利用的有毒Cd(Ⅱ)迁移或转化为低毒或无害物质[6-8]。
微生物吸附剂,包括细菌、藻类、真菌和内生菌等,已经被广泛研究并应用于吸附重金属离子[3, 9-11]。微生物吸附过程主要发生在细胞外,包括物理吸附、离子交换和化学吸附[12-14]。除了生物吸附,生物矿化在水体重金属修复上也有广泛的应用前景。生物矿化是微生物介导下把有毒重金属转化为不相容的危害较小的化合物[15]。目前,大多数研究都集中在生物合成金属硫化物,因为生物体中天然富含硫,并且具有较低的内在毒性[16]。已有大量的研究证实硫酸盐还原菌能在厌氧条件下还原硫酸盐生成硫化氢并参与多种重金属离子的沉淀,在重金属污染废水处理中具有重要的应用价值[16-19]。Wang等[20]研究发现荧光铜绿假单胞菌Pseudomonas aeruginosa CW-96-1在有氧培养过程中,可以通过沉淀硫化镉去除溶液中99% 以上Cd(Ⅱ)。Sanghi等[21]发现固定化真菌Coriolus versicolor可以通过合成硫化镉高效去除水溶液中的Cd(Ⅱ),2 h内去除率达98%,同时合成粒径100~200 nm硫化镉纳米颗粒。工程改造的大肠杆菌Treponema denticola通过过量表达半胱氨酸脱巯基酶促进硫化镉沉淀并有效去除水溶液中的Cd(Ⅱ)[22-23]。因此,微生物介导生物合成金属硫化物可以作为一种强大的工具,应用于有毒重金属污水的生物修复,并有可能转化为功能性纳米颗粒[24]。鉴于此,本研究希望通过实验室筛选纯化获得一株新的镉抗性细菌,探究其通过生物合成硫化镉应用于Cd(Ⅱ)污水高效修复及其转化为功能性纳米材料的可能性,并对生物合成的硫化镉颗粒进行表征分析。
1 材料与方法 1.1 供试土壤土壤样品采集于中国湖北大冶铜矿区,用铁锹取0~20 cm的地表土,装入灭菌自封袋后带回实验室,保藏于4 ℃冰箱备用。土壤的部分化学和物理特性见表 1。
|
|
表 1 土壤样品的部分理化性质 Table 1 Selected chemical and physical properties of soils |
主要试剂:硝酸镉[Cd(NO4)2]、L-半胱氨酸(Lcysteine);培养基:LB培养基、M9培养基;主要仪器:透射电子显微镜(TEM)、扫描电子显微镜(SEM)、能量色散X射线光谱(EDS)分析仪、X射线衍射分析(XRD)、荧光分光光度计(Shimadzu RF-5301)等。
1.3 菌种筛选与鉴定将10 g重金属污染的土壤添加到90 mL无菌去离子水中,在旋转振荡器充分振荡30 min(180 r· min-1,28 ℃),然后放置0.5 h。取10 mL上清液接种至90 mL新鲜无菌含1 mmol·L-1 Cd(Ⅱ)的LB培养基中,放置到28 ℃、180 r·min-1的摇床中,培养5 d;随后培养物转接到含有1 mmol·L-1 Cd(Ⅱ)浓度的LB培养基中继续驯化培养3次;最后将驯化培养物连续稀释接种到含有1 mmol·L-1 Cd(Ⅱ)LB琼脂平板上,28 ℃恒温培养箱培养4 d;从含1 mmol·L-1 Cd(Ⅱ)的固体平板中挑取单菌落,并进行至少两次划线纯化,将抗性水平稳定、生长速度快的菌株甘油保藏于-80 ℃冰箱中备用。
纯化的抗镉菌株的分子鉴定通过16S rRNA基因测序确定。通过菌落PCR的方法,使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′- ACGGHTACCTTGTTTACGACTT - 3′)扩增基因16S rRNA[25]。PCR反应条件:95 ℃,3 min;95 ℃,30 s;55℃,30 s;72 ℃,90 s;30个循环;72 ℃,7 min。然后使用PCR纯化试剂盒(Sangon Biotech Co.Ltd. Shanghai,China)纯化PCR产物,并由上海生物工程有限公司测序。将得到的16S rRNA在NCBI GenBank上比对核苷酸序列,并用MEGA 6.0软件构建系统进化树。
通过在LB固体平板上划线,培养72 h观察其颜色、黏度及其他菌落特征。取生长指数期的细菌进行革兰氏染色和荚膜染色,在显微镜下观察其形态特征。同时参照《常见细菌系统鉴定手册》,对细菌进行生理生化实验。
1.4 菌株对多种重金属抗性测定将菌株按照1% 接种到液体LB培养基中(28 ℃,180 r·min-1)过夜培养,用新鲜灭菌LB培养基稀释至初始OD600为0.5作为接种液,然后接种到含有不同浓度的CdNO3(0.5~10 mmol·L-1)、CuSO4·5H2O(0.5~15 mmol·L-1)、ZnSO4(0.5~30 mmol·L-1)、Pb(NO3)2(0.5~ 10 mmol·L-1)、CoCl3(0.5~10 mmol·L-1)、MnCl2·4H2O(0.5~30 mmol·L-1)和K2Cr2O7(0.5~2 mmol·L-1)的新鲜LB液体培养基中于28 ℃恒温培养箱培养72 h。然后接种到LB琼脂平板上,根据有无单克隆生长来评估各金属的最低抑制浓度(MIC)。同时,按照相同的方法评估菌株N1905在M9培养基中对各金属的抗性。
1.5 不同镉浓度下菌株生长曲线测定在液体培养物中评估不同镉浓度条件下镉抗性细菌菌株生长。将细菌在LB培养基中培养过夜,然后将培养物OD600稀释至0.5作为接种溶液。按照1% 的接种量接种到含有0、0.5、1、2、4 mmol · L-1或6 mmol·L-1 Cd(Ⅱ)的50 mL LB液体培养基中培养,在28 ℃下,180 r·min-1振荡培养72 h,每8 h取样通过分光光度计在600 nm测定吸光度。
1.6 菌株产硫化氢测定选择4种含硫物质,分别是硫代硫酸钠(Na2S2O3)、硫酸钠(Na2SO4)、硫脲(CH4N2S)和L-半胱氨酸(Lcysteine),作为底物评估菌株的产硫化氢能力。将细菌在LB培养基中培养过夜,通过离心(8 000 r·min-1,15 min)收集细胞,用去离子(DI)水洗涤两次,并重悬于M9基本培养基中使用初始OD600=0.5作为接种液。按照1% 的接种量分别接种到含有2 mmol · L-1 Na2S2O3、Na2SO4、CH4N2S和L-cysteine的M9液体培养基中培养,再将灭菌醋酸铅试纸悬挂于试管中,于28 ℃培养箱中培养2 d,如果醋酸铅试纸变黑则为产硫化氢,反之为不产硫化氢。
1.7 菌株生物合成硫化镉将重悬于M9培养基的接种液(OD600=0.5)按照1% 的接种量接种到含有2 mmol·L-1 L-半胱氨酸和0.25~2.0 mmol · L-1硝酸镉的M9液体培养基中,于28 ℃、180 r·min-1培养箱中培养24 h,在培养过程中不断观察培养物情况。同时,使用Shimadzu UV-Vis 3600光谱仪测定培养物的吸收光谱,在350 nm激发波长下使用Shimadzu RF-5301荧光分光光度计测量培养物发射光谱。
1.8 XRD、SEM-EDS和TEM分析对于X射线衍射分析(XRD),首先离心(4 ℃,8 000 r·min-1,8 min)收集上述实验条件下的样品,并用PBS(pH 7.0)洗涤两次并冷冻干燥,使用Cu Kα辐射下记录2θ范围从5°到80°的图谱。为了进行透射电子显微镜(TEM)分析,在培养24 h后离心收集样品,然后将样品沉淀用PBS(pH 7.0)洗涤两次,并用4%戊二醛固定液固定4 h,然后在30%、50%、70%、90% 和100% 的乙醇中连续脱水。通过JEOL JSM- 6390LV扫描电子显微镜(SEM,Tokyo,Japan)与OXFORD INCA x-sight能量色散X射线光谱仪(EDX,Abingdon,Oxfordshire,UK)观察测定。上机前,所有样品都进行了喷金处理。使用200kV JEOL 2000FX常规TEM分析样品之前进行了超薄切片样品制备,包括固定、脱水、浸泡、包埋、切片和染色等过程。
1.9 评估3种环境因子对菌株N1905去除Cd(Ⅱ)的影响为了研究菌株N1905通过生物合成硫化镉修复Cd(Ⅱ)污染水体的潜在用途,研究了不同初始L- 半胱氨酸、不同pH和溶解氧饱和度对菌株去除镉效果的影响。为了研究初始L-半胱氨酸浓度的影响,将菌株N1905细胞在LB中培养过夜,通过8 000 r· min-1离心15 min收集细胞,用去离子(DI)水洗涤两次,并重悬于M9基本培养基中(初始OD600=0.5),然后向体系中加入L-半胱氨酸(0.5~20 mmol·L-1)和硝酸镉(1 mmol·L-1),并在28 ℃、180 r·min-1摇床培养24 h。将24 h时的培养物以8 000 r·min-1离心15 min,使用原子吸收光谱法(AAS)分析上清液的Cd(Ⅱ)含量。在初始Cd(Ⅱ)浓度为1 mmol·L-1时,还测定了初始pH(5~9)和溶解氧对菌株N1905去除Cd(Ⅱ)的影响。所有的实验设置3个重复。
2 结果与讨论 2.1 耐镉细菌的鉴定通过驯化筛选,获得了数株可以在含1 mmol·L-1 Cd(Ⅱ)的固体LB平板上生长的菌株。经过在含1 mmol·L-1 Cd(Ⅱ)的固体LB平板上多次划线,发现有1株生长快速的菌株,命名为N1905。菌株N1905菌落较小,淡黄色,表面湿润;革兰氏阴性,呈短杆状,没有荚膜。生化实验结果表明菌株N1905具有运动性,不能水解淀粉,不能液化明胶,也不能水解尿素,但可以利用单糖(葡萄糖)、蔗糖等。氧化酶和过氧化氢酶呈阳性,可以产吲哚乙酸。为了确定菌株N1905与已知菌株的进化关系,将获得的N1905菌株的16S rRNA基因序列在NCBI数据库中进行序列比对,通过序列同源性分析,N1905最接近Enterobacter ludwigii,显示99%相似性,并且根据系统发育分析(图 1),菌株N1905与Enterobacter ludwigii在同一类群中,关系最密切,故命名为Enterobacter ludwigii N1905。

|
图 1 基于16S rRNA序列构建的Enterobacter ludwigii N1905系统发育树 Figure 1 Neighbor-joining tree based on Enterobacter ludwigii N1905 16S rRNA gene sequences |
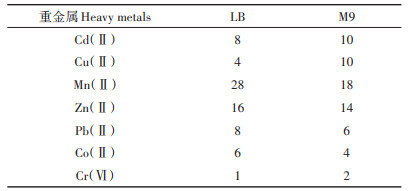
由表 2可知,在液体LB和M9培养基中,菌株Enterobacter ludwigii N1905可以分别耐受8 mmol·L-1和10 mmol·L-1 Cd(Ⅱ)。除此,菌株N1905对其他多种重金属如Cu(Ⅱ)、Mn(Ⅱ)、Zn(Ⅱ)、Pb(Ⅱ)、Co(Ⅱ)和Cr(Ⅵ)具有耐受性。这些结果说明,筛选的Cd(Ⅱ)抗性菌株N1905有着广泛的重金属抗性,这可能是由于其筛选纯化自多种重金属污染的土壤。生活在被污染土壤中的微生物往往会通过改变自身的生化和结构特征、生理特性和遗传基因等来适应环境,从而产生各种机制应对各种复杂的环境[26]。这一特性暗示菌株N1905对于多种重金属复合污染的水体具有修复潜能。
|
|
表 2 菌株Enterobacter ludwigii N1905对不同重金属的抗性/(mmol·L-1) Table 2 Tolerance/resistance of bacteria N1905 to heavy metals/(mmol·L-1) |
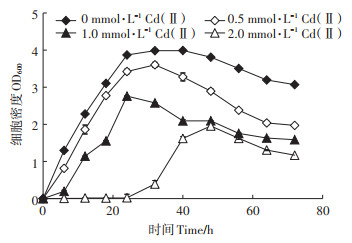
图 2显示了菌株N1905在不同镉浓度下测量的生长曲线,在含2 mmol·L-1 Cd(Ⅱ)液体LB中仍然可以达到较高的生物量(48 h,OD600约为1.8)。同时也发现2 mmol·L-1 Cd(Ⅱ)会干扰细菌的正常生长并延迟对数期,细菌生长受到明显抑制。这可能是由于细胞正常代谢被细胞内摄取的Cd(Ⅱ)或被吸附在细胞外表面上的Cd(Ⅱ)抑制[27-28]。
|
图 2 不同镉浓度下Enterobacter ludwigii N1905的生长曲线 Figure 2 Growth curve of Enterobacter ludwigii N1905 under different Cd(Ⅱ)concentrations |
在液体培养基中评估菌株N1905产硫化氢能力,分别在M9液体培养基中加入Na2S2O3、Na2SO4、CH4N2S和L-半胱氨酸4种底物,通过醋酸铅试剂定性测定。结果表明,只有外加L-半胱氨酸情况下菌株N1905通过代谢产生硫化氢(表 3)。已有研究发现细菌嗜麦芽寡养单胞菌Stenotrophomonas maltophilia strain SMCD1在提供L-半胱氨酸同样能够合成硫化氢,并沉淀硫化镉[29]。因此,有必要评估L-半胱氨酸对菌株N1905去除Cd(Ⅱ)的影响。
|
|
表 3 菌株Enterobacter ludwigii N1905产硫化氢能力 Table 3 Hydrogen sulfide production capacity of strain Enterobacter ludwigii N1905 |
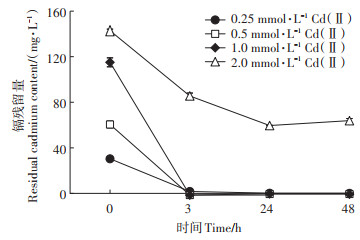
如图 3所示,添加2 mmol·L-1 L-半胱氨酸到不同初始Cd(Ⅱ)浓度的培养体系中可以明显地去除或降低溶液中的Cd(Ⅱ)浓度。在初始Cd(Ⅱ)浓度为0.25、0.5 mmol·L-1和1 mmol·L-1时,培养3 h后,溶液中的Cd(Ⅱ)完全被菌株N1905固化,Cd(Ⅱ)去除率为100%。在Cd(Ⅱ)浓度高达2 mmol·L-1时,菌株N1905同样可以明显降低溶液中的Cd(Ⅱ),在3 h时去除溶液40.0% 的Cd(Ⅱ);随着培养时间延长,继续沉淀Cd(Ⅱ),在24 h时Cd(Ⅱ)去除率最大,达55.3%。同时在细菌N1905、硝酸镉和L-半胱氨酸的共存培养过程中,培养物悬浮液由最初白色不透明状最终变为黄色悬浮物,根据以前的报道初步证实菌株N1905通过生物合成硫化镉高效去除溶液中的Cd(Ⅱ)[30]。该结果表明镉抗性细菌N1905可以通过生物矿化硫化镉用于Cd(Ⅱ)污染水体的生物修复。
|
图 3 L-半胱氨酸对菌株N1905去除Cd(Ⅱ)的影响 Figure 3 Effect of L-cysteine on Cd(Ⅱ)removal by bacteria N1905 |
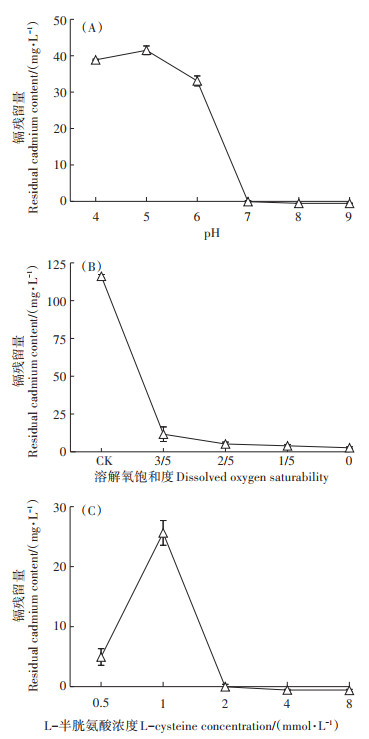
如图 4所示,结果表明初始L-半胱氨酸含量、pH和溶解氧饱和度均影响菌株对Cd(Ⅱ)的去除能力。在初始Cd(Ⅱ)浓度为1 mmol·L-1和初始L-半胱氨酸为2 mmol·L-1条件下,随pH值升高,Cd(Ⅱ)去除率升高,在pH为4~9范围内,菌株N1905对Cd(Ⅱ)去除率为64.3%~100%(图 4A)。L-半胱氨酸是菌株产硫化氢沉淀硫化镉的关键,因此有必要探究不同L-半胱氨酸添加量对菌株生物沉淀硫化镉的影响。结果表明,初始Cd(Ⅱ)浓度为1 mmol·L-1,当L-半胱氨酸浓度分别为0.5、1、2、4 mmol·L-1和8 mmol·L-1时,菌株N1905对Cd(Ⅱ)去除率分别为91.9%、73.7%、100%、100%和100%(图 4C)。不同初始Cd(Ⅱ)浓度处理的实验结果表明,高浓度Cd(Ⅱ)浓度限制菌株高效解毒(图 3)。这些结果表明,水体Cd(Ⅱ)污染水平及L-半胱氨酸添加量对于高效Cd(Ⅱ)去除非常重要。同时,研究发现菌株N1905可以在少量氧气存在条件下高效去除Cd(Ⅱ),其中液封条件下,镉去除率最高,达97.7%(图 4B)。上述这些结果表明,菌株N1905可以通过生物合成硫化镉应用于多种复杂水溶液中重金属Cd(Ⅱ)的高效去除。
|
图 4 环境变量对菌株N1905生物合成硫化镉去除Cd(Ⅱ)的影响 Figure 4 Effect of environmental variables on Cd-depletion of strain N1905 via biosynthesis CdS |
为了进一步分析合成的黄色沉淀物是否为硫化镉晶体,离心收集培养后的黄色悬浮物,经冷冻干燥,并通过XRD分析,见图 5A。从XRD图谱中发现,在26.5°、44.0°和52.1°处显示出3个明显的峰,它们分别指向硫化镉的(111)、(220)和(311)晶体面(图 5A),这与硫化镉的面心立方(FCC)晶体结构基本一致。XRD分析结果进一步证实了硫化镉晶体的形成。SEM分析结果表明细胞表面存在大量的颗粒物质,经EDS元素分析显示其富含大量S元素和Cd元素,暗示颗粒物质为硫化镉纳米颗粒(图 5C)。这一结果也说明菌株N1905可能主要在细胞外沉淀硫化镉。超薄切片的TEM图像进一步证实菌株N1905在细胞外合成硫化镉纳米颗粒(图 5B)。这与光合细菌Rhodopseudomonas palustris生物合成硫化镉颗粒机制不同,后者是在细胞内合成后转运至细胞外[31]。
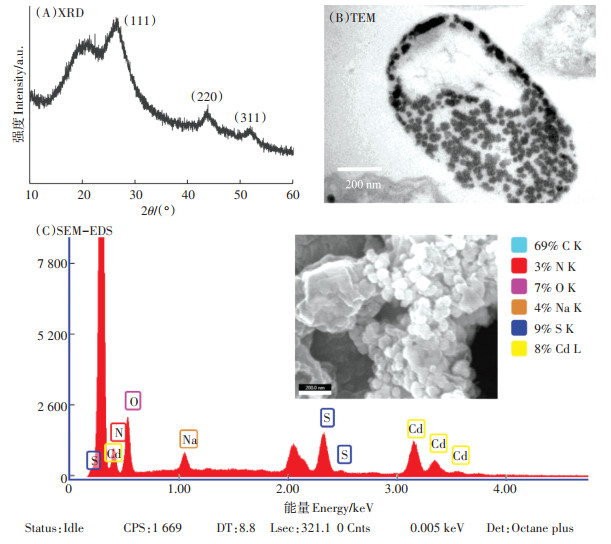
|
图 5 细菌N1905-硫化镉混合物的特征分析 Figure 5 Characterization of strain N1905-CdS hybrids |
同时,测定培养液的吸收和荧光光谱特征,结果发现培养物有明显的吸收光谱峰和荧光光谱峰(图 6),这与先前所报道的硫化镉纳米颗粒的吸收峰一致。该结果表明菌株能够利用L-半胱氨酸产硫化氢沉淀Cd(Ⅱ),并转化为具有光学特性的硫化镉纳米颗粒。已有研究证明生物合成硫化镉纳米粒子依赖于由半胱氨酸脱巯基酶及其催化的L-半胱氨酸的硫化氢产生[29, 32-34]。这说明菌株N1905可以向胞外分泌半胱氨酸脱巯基酶并参与沉淀硫化镉颗粒。
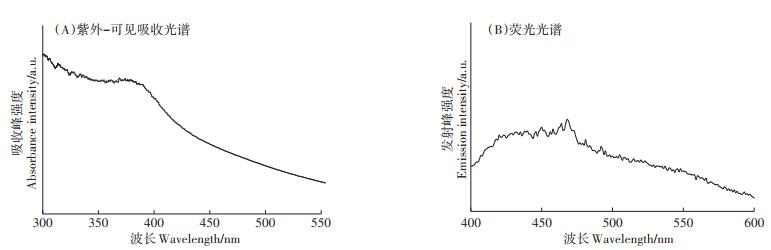
|
图 6 培养物的紫外-可见吸收光谱和荧光光谱图 Figure 6 UV-visible absorption spectra and emission spectra of culture sample |
总之,本研究发现,新筛选获得的镉抗性菌株N1905能够利用L-半胱氨酸高效去除水溶液中的Cd(Ⅱ),并转化为具有光学特性的硫化镉纳米颗粒。
3 结论(1)从重金属污染土样中,通过驯化筛选分离获得一株高抗Cd(Ⅱ)的菌株N1905,基于16S rRNA分析鉴定为Enterobacter ludwigii N1905。
(2)菌株Enterobacter ludwigii N1905具有多种重金属耐受性,在液体LB中,N1905可以最高耐受8 mmol·L-1 Cd(Ⅱ),液体M9中可以最高耐受10 mmol· L-1 Cd(Ⅱ)。在不同Cd(Ⅱ)浓度下的生长曲线表明,高浓度重金属Cd(Ⅱ)会干扰细菌的正常生长。
(3)菌株Enterobacter ludwigii N1905在提供L-半胱氨酸条件下产硫化氢,并在细胞外沉淀Cd(Ⅱ),转化为具有光学特性的硫化镉纳米颗粒。
(4)菌株Enterobacter ludwigii N1905在培养基条件下通过生物矿化形成硫化镉,对消除Cd(Ⅱ)污染有较好应用潜力。
| [1] |
Lu Y, Song S, Wang R, et al. Impacts of soil and water pollution on food safety and health risks in China[J]. Environment International, 2015, 77: 5-15. DOI:10.1016/j.envint.2014.12.010 |
| [2] |
刘茂生. 有害元素镉与人体健康[J]. 微量元素与健康研究, 2005, 22(4): 66-67. LIU Mao-sheng. Harmful element cadmium and human health[J]. Studies of Trace Elements and Health, 2005, 22(4): 66-67. DOI:10.3969/j.issn.1005-5320.2005.04.031 |
| [3] |
Ahluwalia S S, Goyal D. Microbial and plant derived biomass for removal of heavy metals from wastewater[J]. Bioresource Technology, 2007, 98: 2243-2257. DOI:10.1016/j.biortech.2005.12.006 |
| [4] |
Srivastava S, Agrawal S B, Mondal M K. A review on progress of heavy metal removal using adsorbents of microbial and plant origin[J]. Environmental Science & Pollution Research, 2015, 22(20): 15386-15415. |
| [5] |
Hou Y, Cheng K, Li Z, et al. Biosorption of cadmium and manganese using free cells of Klebsiella sp. isolated from waste water[J]. PloS One, 2015, 10: e0140962. DOI:10.1371/journal.pone.0140962 |
| [6] |
Mosa K A, Saadoun I, Kumar K, et al. Potential biotechnological strategies for the cleanup of heavy metals and metalloids[J]. Frontiers in Plant Science, 2016, 7: 303. |
| [7] |
Chojnacka K. Biosorption and bioaccumulation: The prospects for practical applications[J]. Environment International, 2010, 36(3): 299-307. DOI:10.1016/j.envint.2009.12.001 |
| [8] |
Jacob J M, Lens P N, Balakrishnan R M. Microbial synthesis of chalcogenide semiconductor nanoparticles: A review[J]. Microbial Biotechnology, 2016, 9(1): 11-21. DOI:10.1111/1751-7915.12297 |
| [9] |
Wang J, Chen C. Biosorbents for heavy metals removal and their future[J]. Biotechnology Advances, 2009, 27(2): 195-226. DOI:10.1016/j.biotechadv.2008.11.002 |
| [10] |
Feng D, Aldrich C. Adsorption of heavy metals by biomaterials derived from the marine alga Ecklonia maxima[J]. Hydrometallurgy, 2004, 73(1): 1-10. |
| [11] |
Khan Z, Rehman A, Hussain S Z, et al. Cadmium resistance and uptake by bacterium, Salmonella enterica 43C, isolated from industrial effluent[J]. AMB Express, 2016, 6(1): 54. DOI:10.1186/s13568-016-0225-9 |
| [12] |
曹德菊, 杨训, 张千, 等. 重金属污染环境的微生物修复原理研究进展[J]. 安全与环境学报, 2016, 16(6): 315-321. CAO De-ju, YANG Xun, ZHANG Qian, et al. Research progress on bioremediation principle of heavy metal polluted environment[J]. Journal of Safety and Environment, 2016, 16(6): 315-321. |
| [13] |
杨海, 黄新, 林子增, 等. 重金属污染土壤微生物修复技术研究进展[J]. 应用化工, 2019, 328(6): 179-184. YANG Hai, HUANG Xin, LIN Zi-zeng, et al. Research progress on microbial remediation[J]. Applied Chemical Industry, 2019, 328(6): 179-184. |
| [14] |
Xu S Z, Xing Y H, Liu S, et al. Characterization of Cd(Ⅱ)biosorption by Pseudomonas sp. strain 375, a novel biosorbent isolated from soil polluted with heavy metals in Southern China[J]. Chemosphere, 2019, 240: 124893. |
| [15] |
党政, 代群威, 赵玉连. 生物矿化在重金属污染治理领域的研究进展[J]. 环境科学研究, 2018(7): 1182-1192. DANG Zheng, DAI Qun-wei, ZHAO Yu-lian. Research progress of biomineralization in the treatment of heavy metal contamination[J]. Research of Environmental Sciences, 2018(7): 1182-1192. |
| [16] |
Kiran M G, Pakshirajan K, Das G. Heavy metal removal from multicomponent system by sulfate reducing bacteria: Mechanism and cell surface characterization[J]. Journal of Hazardous Materials, 2017, 324(Part A): 62-70. |
| [17] |
Le Pape P, Battaglia-Brunet F, Parmentier M, et al. Complete removal of arsenic and zinc from a heavily contaminated acid mine drainage via an indigenous SRB consortium[J]. Journal of Hazardous Materials, 2017, 321: 764-772. DOI:10.1016/j.jhazmat.2016.09.060 |
| [18] |
肖利萍, 张镭, 李月. 硫酸盐还原菌及其在废水厌氧治理中的应用[J]. 水资源与水工程学报, 2011, 22(1): 45-49. XIAO Li-ping, ZHANG Lei, LI Yue. Application of sulfate-reducing bacteria to anaerobic wastewater treatment[J]. Journal of Water Resources and Water Engineering, 2011, 22(1): 45-49. |
| [19] |
林海, 李真, 贺银海, 等. 硫酸盐还原菌治理酸性矿山废水研究进展[J]. 环境保护科学, 2019, 45(5): 25-31. LIN Hai, LI Zhen, HE Yin-hai, et al. Advances in treatment of acid mine drainage by sulfate-reducing bacteria[J]. Environmental Protection Science, 2019, 45(5): 25-31. |
| [20] |
Wang C L, Michels P C. Cadmium removal by a new strain of Pseudomonas aeruginosa in aerobic culture[J]. Applied & Environmental Microbiology, 1997, 63(10): 4075-4078. |
| [21] |
Sanghi R, Verma P. A facile green extracellular biosynthesis of CdS nanoparticles by immobilized fungus[J]. Chemical Engineering Journal, 2009, 155(3): 886-891. DOI:10.1016/j.cej.2009.08.006 |
| [22] |
Wang C, Lum A, Ozuna S, et al. Aerobic sulfide production and cadmium precipitation by Escherichia coli expressing the Treponema denticola cysteine desulfhydrase gene[J]. Applied Microbiology and Biotechnology, 2001, 56(3): 425-430. |
| [23] |
Marusak K E, Feng Y, Eben C F, et al. Cadmium sulphide quantum dots with tunable electronic properties by bacterial precipitation[J]. RSC Advances, 2016, 6(80): 76158. DOI:10.1039/C6RA13835G |
| [24] |
Vena M P, Jobbágy M, Bilmes S A. Microorganism mediated biosynthesis of metal chalcogenides: A powerful tool to transform toxic effluents into functional nanomaterials[J]. Science of the Total Environment, 2016, 565: 804-810. DOI:10.1016/j.scitotenv.2016.04.019 |
| [25] |
Aksu Z. Application of biosorption for the removal of organic pollutants: A review[J]. Process Biochemistry, 2005, 40(3): 997-1026. |
| [26] |
Abou-Shanab R A I, Berkum P V, Angle J S. Heavy metal resistance and genotypic analysis of metal resistance genes in gram-positive and gram-negative bacteria present in Ni-rich serpentine soil and in the rhizosphere of Alyssum murale[J]. Chemosphere, 2007, 68(2): 360-367. DOI:10.1016/j.chemosphere.2006.12.051 |
| [27] |
Lemire J A, Harrison J J, Turner R J. Antimicrobial activity of metals: Mechanisms, molecular targets and applications[J]. Nature Reviews Microbiology, 2013, 11: 371-384. DOI:10.1038/nrmicro3028 |
| [28] |
Gadd G M. Heavy metal accumulation by bacteria and other microorganisms[J]. Experientia, 1990, 46(8): 834-840. DOI:10.1007/BF01935534 |
| [29] |
Yang Z, Lu L, Berard V F, et al. Biomanufacturing of CdS quantum dots[J]. Green Chemistry, 2015, 17(7): 3775-3782. DOI:10.1039/C5GC00194C |
| [30] |
Sakimoto K K, Wong A B, Yang P. Self-photosensitization of nonphotosynthetic bacteria for solar-to-chemical production[J]. Science, 2016, 351(6268): 74. DOI:10.1126/science.aad3317 |
| [31] |
Bai H J, Zhang Z M, Guo Y, et al. Biosynthesis of cadmium sulfide nanoparticles by photosynthetic bacteria Rhodopseudomonas palustris[J]. Colloids Surf B Biointerfaces, 2009, 70(1): 142-146. DOI:10.1016/j.colsurfb.2008.12.025 |
| [32] |
Robert D, Li L, Christopher J, et al. Single-enzyme biomineralization of cadmium sulfide nanocrystals with controlled optical properties[J]. PNAS, 2016, 113(19): 5275-5280. DOI:10.1073/pnas.1523633113 |
| [33] |
Edwards C D, Beatty J C, Loiselle J B, et al. Aerobic transformation of cadmium through metal sulfide biosynthesis in photosynthetic microorganisms[J]. BMC Microbiology, 2013, 13(1): 161. DOI:10.1186/1471-2180-13-161 |
| [34] |
Gallardo C, Monrás J P, Plaza D O, et al. Low-temperature biosynthesis of fluorescent semiconductor nanoparticles(CdS) by oxidative stress resistant antarctic bacteria[J]. Journal of Biotechnology, 2014, 187: 108-115. DOI:10.1016/j.jbiotec.2014.07.017 |
 2021, Vol. 40
2021, Vol. 40