重金属污染是全球面临的重大环境污染问题之一,《全国土壤污染状况调查公报》及中国农田土壤重金属富集状况空间分布研究显示,我国农田土壤重金属超标现象普遍存在,其中镉(Cd)超标最为严重[1-2]。Cd是植物生长发育非必需元素,由于它存在着强毒性与可迁移性,被植物根系吸收的Cd会随营养元素迁移至籽粒中。Cd的积累会破坏植物的养分吸收和水分平衡,干扰植物正常代谢和加速植物衰老,进而影响作物产量品质。据报道,每年因Cd污染而减产的粮食高达1 000万t;同时在作物可食部位积累的Cd通过食物链的富集进入人体,威胁人类的生命健康[3-4]。土壤对Cd的吸附-解吸是影响Cd在土壤溶液中浓度、生物有效性及迁移的重要因素,该过程受土壤类型、土壤溶液组成和土壤化学及矿物学特性影响[5]。
土壤中的重金属通常以不同形态存在。一般离子态和可交换态易被植物直接吸收利用,属于植物可利用态,其他形态在土壤氧化还原条件或pH改变时可转化为可交换态,被植物吸收[6-7];降低土壤中植物可利用态重金属成为土壤重金属污染修复的关键,化学钝化修复属于一种比较直接和广泛采用的有效方法,化学钝化的修复效率取决于修复剂的选择。常见的修复材料有石灰、黏土、稻草、有机肥、沸石、海泡石等[8],均能有效降低土壤Cd、Pb的生物有效性[9-10]。研究表明,硫的供应能抑制作物对Cd的吸收,且硫是植物生长和蛋白质合成的必需元素,被称为仅次于氮、磷、钾的第四要素,化肥品种中有硫肥类别,硫在植物的生长发育和逆境响应中起重要作用[11]。
土壤中硫元素主要以无机硫和有机硫两种形式存在,两者之间的比例受土壤类型、pH、排水状况、有机质含量等因素影响[12]。无机硫通常被吸收转化为在养分和功能上具有重要作用的含硫有机化合物,这些有机物能够与重金属结合形成金属硫蛋白、生物螯合素等,降低重金属对植物的毒性[13-14];如胱氨酸和半胱氨酸、金属硫蛋白等,这些化合物具有清除自由氧基、防止植物氧化损伤等功能,也能与重金属结合,避免重金属损伤植物质膜或细胞[15]。另外,硫通过循环与环境中的重金属结合形成金属配位体,影响重金属迁移及生物有效性。在气候温和的条件下,土壤中高达90% 的硫元素以有机硫的形式存在,无机硫相对于有机硫,更能有效将重金属固定在底渣中[16]。有机硫可分为碳键合态和非碳键合态硫(硫酸酯类)[17];土壤有机硫经矿化后只有部分能被植物吸收利用[18]。近年来国内外学者对硫在水稻Cd吸收方面的影响展开了广泛研究,结果表明[11, 19],硫肥促进低水平Cd毒害下小麦幼苗叶、根生长,增加幼苗中叶绿素含量;施用硫酸盐能显著降低水稻对Cd的吸收等。有学者认为施加外源硫抑制重金属的活性[20],而其他一些学者持相反的看法[21-22],认为施加外源硫可以提高重金属的生物可利用性。基于此,本试验选用硫化钠作为钝化剂,同时选用常见的土壤钝化材料[23]:金属氢氧化物、金属氧化物、硅酸盐、有机肥等作为对比,结合室内Cd污染土壤培养和水稻盆栽试验,研究外源硫化钠对土壤-水稻系统中Cd的迁移积累及对土壤Eh、pH和水稻生长的影响,旨在为硫化钠调控污染土壤中Cd活性、降低水稻对Cd的吸收积累提供依据。
1 材料和方法 1.1 供试材料土壤:供试土壤采自长沙县北山镇重金属污染农田(28.398°N,113.018°E),土壤类型为麻砂泥(沙壤土),土壤基本理化性质:pH值5.1,有机质15.62 g· kg-1,全氮0.548 g·kg-1,全磷0.319 g·kg-1,全钾14.32 g·kg-1;水解性氮35 mg·kg-1,有效磷2.84 mg·kg-1,速效钾101 mg·kg-1;总Cd为1.08 mg·kg-1。土壤采集后,经风干,磨细,过5 mm筛后用于土壤吸附培养及盆栽试验。
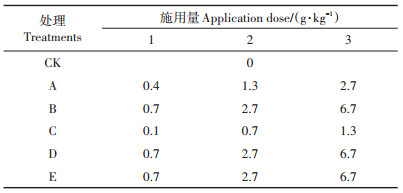
钝化剂:试验所用金属盐为硫化钠(分析纯,≥98%),同时在土壤培养阶段选用硅酸钙(分析纯,≥99%)、氢氧化镁(分析纯,≥95%)、动物残体腐解有机肥以及牛粪(高温充分腐熟发酵,有机质含量大于45%)作为钝化剂;盆栽试验阶段选用氧化钙(分析纯,≥98%)处理作对比。分析纯级试剂购自国药集团,有机肥采购于湖南省畜牧研究所养殖场,各改良材料中重金属Cd含量如表 1所示。
|
|
表 1 钝化剂中重金属Cd含量情况(mg·kg-1) Table 1 Cd average content in passivation agent(mg·kg-1) |
水稻品种:早稻品种"中早39",购自湖南省水稻研究所金色农华种业科技有限公司。
1.2 试验设计 1.2.1 土壤培养试验试验为单因素对比设计,设置对照、氢氧化镁(氢氧化物A)、硅酸钙(硅肥B)、硫化钠(C)、有机肥(动物有机肥D、牛粪E)共6个处理;每个处理(对照除外)设置3个不同钝化剂施用量,重复3次,具体施用量见表 2。称取100 g过筛土壤,同时加入1.0 mg·L-1 CdCl2溶液,加水搅拌均匀(土液比为1∶1.5),老化平衡30 d后,依次加入不同剂量钝化材料,搅拌均匀,覆膜培养;依次培养7、14 d,采用无菌注射器取上清液(约5 mL)过0.45 µm微孔滤膜后待测;相比空白对照,计算各钝化材料单位质量对土壤活性Cd的钝化相对吸附量,筛选钝化能力及钝化持续时间较好的钝化材料用于盆栽试验。具体计算公式如下:

|
|
|
表 2 各钝化剂施用剂量 Table 2 Application dose of passivation agents |
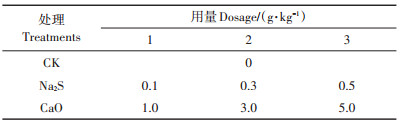
室内土壤培养试验结果筛选出硫化钠作为一种钝化效率高的改良土壤金属沉淀剂,进一步优化施用剂量,进行水稻培育试验。盆栽试验为单因素对比设计,设置空白对照、硫化钠、氧化钙3个处理,每个处理设置3个不同浓度施用量(具体施用量见表 3),重复3次。选用塑料盆规格为25 cm(高)×20 cm(直径),称取1.5 kg自然Cd污染土壤,加入不同剂量土壤钝化剂,依据全国土壤养分含量分级标准,供试污染土壤养分等级为4~5级(中-低),氮、磷、钾施用量参考早稻大田试验施用量(每公顷施用150 kg N、75 kg P、105 kg K)的2~3倍,即每千克加入0.4 g尿素、0.15 g五氧化二磷、0.25 g氧化钾。土壤、钝化剂、肥料混匀后加入去离子水搅拌均匀,放置平衡2周后,将株高5 cm左右的水稻秧苗移栽入盆(1兜·盆-1),后期追施少量尿素,各处理水肥管理保持一致,待水稻成熟取样。
|
|
表 3 盆栽试验各处理用量 Table 3 Dosage of different passivation agents in each pot experiments |
水稻成熟期将水稻整株取出,同时采集适量土壤。水稻样品先后用自来水和纯水清洗,105 ℃杀青1 h后,80 ℃烘干至恒质量,记录水稻各组织器官(根、茎叶、稻谷)质量,利用植物粉碎机研磨成粉末,用于测定重金属含量。土壤样品室内风干过0.8 mm孔径,测试pH和土壤有效Cd;同时水稻成熟期原位监测土壤氧化还原电位(Eh)。
1.3.2 测定指标与方法水稻各组织器官和土壤样品依据《食品安全国家标准食品中多元素的测定》(GB 5009.268—2016)测定Cd的含量。利用硝酸-双氧水混合预处理,放入微波消解仪(Mars 6 CEM,美国)中进行样品消解,消解试液采用电感耦合等离子体质谱仪(i Cap-Q ICPMS,Thermo Fisher Scientific赛默飞世尔科技,美国) 进行分析测试。测试条件:使用KED抗干扰模式,CCT气体流速为4.5 mL·min-1,冷却气(氩气)流速14 L·min-1,仪器自动扫描次数为150,测试过程以铑(103Rh)作为内标,内标回收率在95%~105%;仪器Cd检出限为0.02 µg·L-1,方法检出限为0.002 mg·kg-1,同时以GSW10049标准样品作为标准质控。过筛土壤样品分别用去离子水、0.005 mol·L-1 DTPA-0.1 mol·L-1 TEA-0.01 mol·L-1 CaCl2浸提[24],石墨炉-火焰原子吸收光谱仪(PinAAcle 900T Perkin Elmer珀金埃尔默美国) 测定土壤中离子态/DTPA态Cd的含量,石墨炉原子吸收Cd检出限为0.05 µg·L-1,同时以NSA-5标准样品作为标准质控。试验所用的试剂均为优级纯,试验器皿使用前用10%硝酸浸泡24 h以上。
1.4 数据处理试验数据应用Excel 2016和SPSS 20软件进行统计分析。采用单因素方差分析(Duncan与Pearson法)对不同处理下各参数含量差异显著性与相关性进行分析。
2 结果与讨论 2.1 硫化钠对土壤中活性Cd吸附影响添加钝化剂7 d后,空白对照处理土壤上清液中Cd含量为986 μg·L-1,与CK相比,除D处理(动物残体腐解有机肥)外,其余处理下土壤溶液中Cd浓度随施用量的增加均呈现不同程度的降低(图 1)。其中处理A、B、C平均降幅为66%、91% 和60%(P<0.05);牛粪(E)处理下Cd浓度降低35%;动物有机肥(D)处理下土壤溶液中Cd浓度呈现增加趋势(平均增加27%)。6个处理下,单位质量钝化剂(1 g)对Cd的相对吸附量由大到小依次为C(368 μg)>A(196 μg)>B (120 μg)>E(46 μg)>D(-35 μg),硫化钠处理吸附量最高,氢氧化物和硅肥次之;14 d后各钝化剂处理对Cd均有不同程度的吸附能力,吸附效果随用量增加而增加,与处理7 d趋势一致;6种钝化剂单位质量(1 g)对Cd的相对吸附量略有降低,A(181 μg)>C(160 μg)>B(115 μg)>E(37 μg)>D(-41 μg),硫化钠(C)处理降低较为显著。
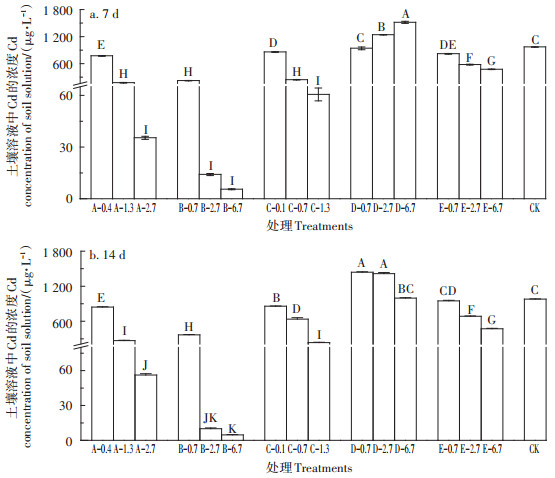
|
不同大写字母表示处理间差异显著(P<0.01) Different capital letters indicate significant differences among treatments(P<0.01) 图 1 各钝化剂处理下土壤溶液中Cd的浓度 Figure 1 Cd content in the soil solution under different passivation agents |
成熟期对水稻各个器官组织生物量进行统计,硫化钠、生石灰不同剂量处理下对水稻发育影响各不相同。如图 2所示,硫化钠低剂量处理下水稻根系生物量平均增加59%(P<0.05)、29%、17%;硫化钠处理下水稻茎叶生物量平均比CK高8% 左右,无显著差异;硫化钠各剂量处理下稻谷生物量分别增加59% (P<0.05)、25% 和17%。相比之下,生石灰各剂量处理下水稻各个器官组织生物量随施用量增加而降低,根系生物量低于对照17%、36%和53%(P<0.05);茎叶低于对照26%(P<0.05)、37%(P<0.05)和64% (P<0.05);施用中、高剂量生石灰处理下,稻谷低于对照14%和35%(P<0.05)。
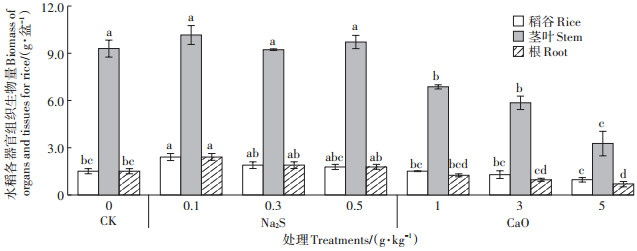
|
不同小写字母表示处理间差异显著(P<0.05)。下同 Different lowercase letters indicate significant differences among treatments(P<0.05). The same below 图 2 收获期水稻根、茎叶、稻谷生物量 Figure 2 Biomass of organs and tissues for rice |
水稻各组织器官中Cd积累情况如图 3所示,Cd2+在水稻根系中含量最高,总体表现为根>茎叶>稻谷,根中Cd平均含量为稻谷的15.9倍,茎叶的4.4倍,所有处理均显著降低Cd在各个器官中的积累(P<0.05)。
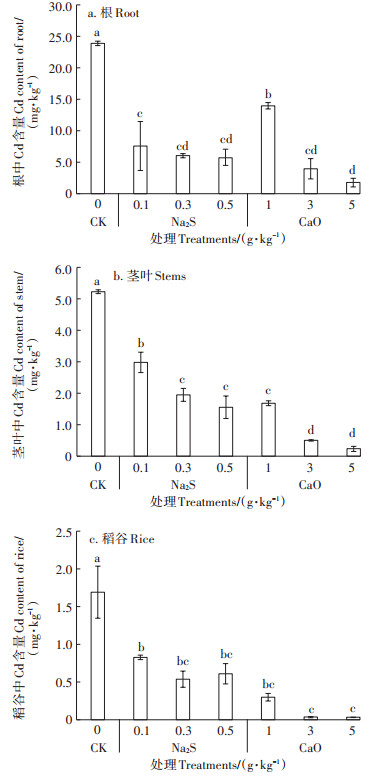
|
图 3 水稻各器官组织中Cd积累情况 Figure 3 Cd accumulation in rice organs and tissues |
根系中CK处理下积累23.90 mg·kg-1,1 g·kg-1 CaO处理次之,降低41%(P<0.05);硫化钠3个不同剂量处理分别降低68%、74% 和76%,3 g·kg-1 CaO处理降低83%,5 g·kg-1 CaO处理下Cd积累最低(图 3a)。茎叶中空白处理下Cd积累为5.20 mg·kg-1,5 g·kg-1 CaO最低(0.24 mg·kg-1),降低95%;其次为3 g·kg-1 CaO处理,降Cd效率为90%;硫化钠处理下Cd积累量随施用剂量增加而降低,降低比例为42%~70%(图 3b)。稻谷中Cd积累趋势与茎叶一致,空白处理Cd积累1.70 mg·kg-1,5 g·kg-1 CaO最低(0.03 mg·kg-1),降幅98%;硫化钠处理下Cd积累量随施用剂量增加先降低后略增加,增幅无显著差异,降Cd率为51%~ 68%,其中0.3 g·kg-1 Na2S处理下Cd积累最低(0.54 mg·kg-1)(图 3c)。
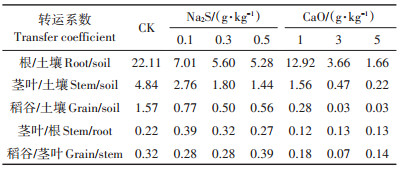
硫化钠、生石灰对水稻各组织器官Cd积累转运系数各异,如表 4所示,CK处理水稻地上部分(茎叶、稻谷)和根系Cd富集系数均最高,硫化钠和生石灰处理后,地上部分和根系Cd富集系数显著降低。单位质量施用硫化钠对水稻根-土壤Cd转运系数的降幅高于生石灰(表 4)。水稻茎叶-根Cd转运系数硫化钠处理略高于CK,生石灰处理低于对照,不同施用量间无显著差异;低、中剂量硫化钠处理下,水稻稻谷- 茎叶Cd转运系数低于CK,生石灰处理下稻谷-茎叶Cd转运系数降低50%。
|
|
表 4 不同处理下水稻器官组织间Cd转运系数 Table 4 Cd migration coefficient for the rice organs and tissues under the different treatments |
水稻成熟期原位监测土壤氧化还原电位(Eh)和土壤pH如图 4所示,对照土壤pH为5.3,硫化钠处理下土壤pH随施用量增加略有上升,施用高剂量硫化钠,土壤pH增加0.3,与CK无显著差异。氧化钙5、3、1 g·kg-1剂量处理下土壤pH分别为7.7、7.0和6.2,均显著高于CK(P<0.05),氧化钙低剂量处理下土壤pH增加速率(斜率)高于高剂量。空白处理下土壤Eh为-130 mV,硫化钠处理下土壤Eh随施用剂量增加而增加,低、中剂量处理下土壤Eh略低于CK,差异不显著;高剂量处理下Eh增至-49 mV(P<0.05);氧化钙处理下土壤Eh随施用量增加而降低,除5 g·kg-1 CaO处理低于CK(-216 mV,P<0.05),其余处理均高于空白处理(图 4)。
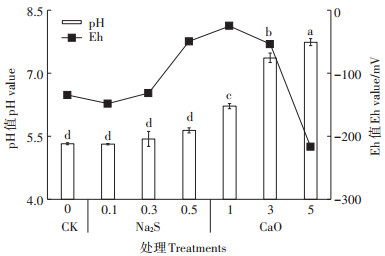
|
图 4 不同处理下土壤pH与Eh变化 Figure 4 Correlation between soil pH and Eh under different treatments |
土壤水提取态Cd和DTPA提取态Cd在各剂量处理下含量各不相同(图 5a、图 5b);水溶液提取态中,空白对照Cd含量为2.03 µg·kg-1;5、3、1 g·kg-1氧化钙处理下,土壤水提取态Cd分别降低84%、86%和59% (P<0.05);硫化钠不同梯度处理下土壤水提取态Cd含量依次显著降低,硫化钠高剂量处理下,水提取态Cd含量为0.9 µg·kg-1,降低55%(P<0.05),低、中剂量分别降低18%、29%(P<0.05);DTPA提取态Cd与水提取态变化趋势大致相同,空白对照处理下土壤DTPA-Cd为0.45 mg·kg-1,硫化钠处理下DTPA-Cd含量略有降低,各剂量处理下DTPA-Cd降低17% 左右;氧化钙处理下,土壤DTPA-Cd比例降低38%~43% (P<0.05)。
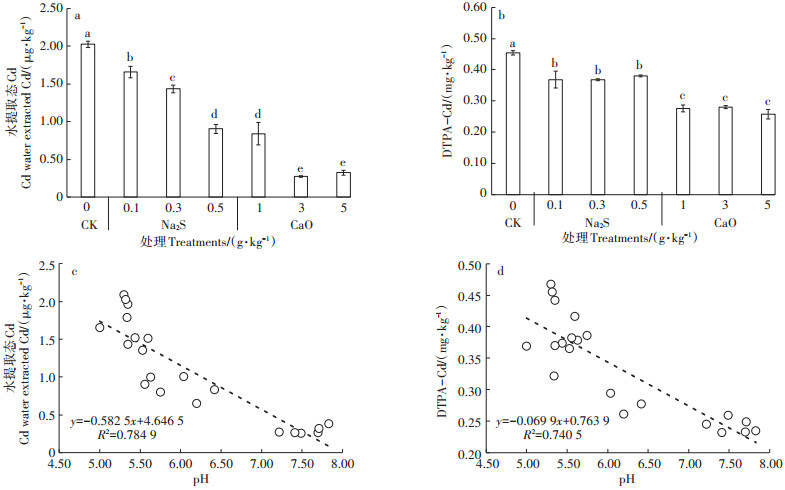
|
图 5 土壤不同提取态Cd浓度以及与pH相关性分析 Figure 5 Cd concentration and its correlation with pH in different extracted states of soil |
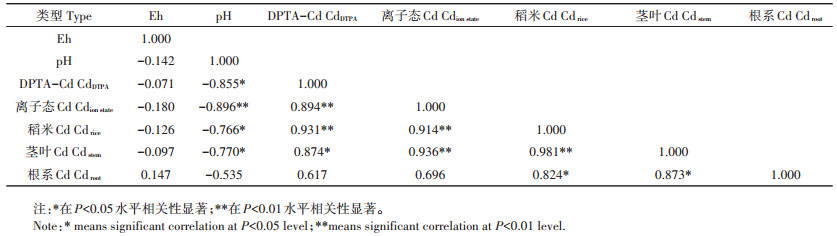
土壤水提取态Cd、DTPA提取态Cd含量与土壤pH均呈显著负相关,其中水提取态Cd与pH呈极显著负相关,相关系数分别为R水=0.89,RDTPA=0.86(图 5c、图 5d、表 5)。由表 5可知,土壤离子态Cd与水稻地上部分(茎叶、籽粒)Cd积累呈极显著相关(R茎叶= 0.936;R籽粒=0.914),稻米和茎叶中Cd的含量与土壤pH呈显著负相关,与水稻根系Cd呈显著正相关;土壤Eh与水稻-土壤系统中Cd的积累无显著相关。
|
|
表 5 土壤pH、Eh与土壤-水稻Cd积累相关性 Table 5 Correlation of soil pH, Eh and Cd accumulation in soil-rice plant system |
土壤培养试验中动物有机肥处理下土壤离子态Cd含量有所上升,推测与其腐植酸成分有关,腐植酸中的黄腐酸具备稳定的结构框架及丰富的官能团,其活性基团间以氢键结合成网络状结构,从而在分子表面形成特殊的孔状结构,使其能与金属离子发生离子交换,起传递金属阳离子作用,黄腐酸从无机矿物中释放出金属阳离子并生成水溶性络合物,从而提高金属有效性[25]。腐植酸最重要的特征在于能够结合不溶性金属离子、氧化物和氢氧化物,并在需要时缓慢地连续释放到植物中。腐植酸主要通过离子交换、络合和吸附作用影响重金属在土壤和水体中的形态和分布,其结构的复杂性和多样性使得不同来源的腐植酸与重金属离子之间的吸附作用存在一定的差异。
土壤培养试验中,单位质量硫化钠吸附量7 d后最高,14 d后有所降低,而盆栽试验土壤硫化钠不同剂量处理下离子态Cd降幅高于DTPA态Cd;土壤pH随硫化钠使用量的增加呈现升高趋势,与CK处理下土壤pH相比无显著差异,该结果与前人有关研究结果相反[26]。综上,推测其与S2-在土壤中的氧化还原相关,在土壤胶体环境下,含硫化合物钝化作用原理主要是利用硫元素将重金属有效态Cd矿化为难被作物利用的稳定硫化态Cd,降低土壤中重金属Cd的有效浓度、迁移性和生物有效性,而S2-在土壤胶体颗粒中是不稳定的存在,其在水和氧气环境下易转变为硫酸盐、亚硫酸盐、硫代硫酸盐以及硫化氢。不同形态的硫素对土壤Cd的钝化效果不一,硫酸根在土壤厌氧条件下被还原为S2-;S2-与Cd2+生成硫化镉难溶物[27];在排水晒田条件下,S2-易被氧化,此时硫化钠中Cd被释放出来,导致稻田活性Cd的增加。硫化钠作为强碱弱酸盐,水解后呈碱性,使土壤pH增加,而本研究结果显示,硫化钠处理下土壤pH与CK处理无显著差别,可能的原因如下:一是本试验中硫化钠剂量适中,不足以带来土壤pH变化;二是S2-水解后生成的硫酸盐、亚硫酸盐减缓了土壤pH的增加;三是南方稻田土壤普遍呈酸性(pH 5.2左右),土壤的缓冲作用在一定程度上中和了硫化钠水解产生的氢氧根离子。
3.2 硫化钠对水稻各组织器官中Cd积累迁移影响硫化钠水解后产生的硫化氢具有良好的亲脂性,易穿过细胞膜传递信号,调节植物代谢及生长发育[28];本试验外源硫化钠的施用能显著增加根系和稻谷生物量50% 以上,发达的根系促使作物更好地发育生长。同时,硫化钠的施用对水稻根系Cd的积累有明显抑制作用,抑制率达70%,高于其对土壤Cd的固定效率,推测与硫素强化根表铁膜对Cd的阻控相关。水稻根系的根表铁膜能吸附Cd[29-30],并限制Cd进入根部细胞;水稻根系分泌物中大量的硫和铁是土壤胶体中主要的电子供体,它们在各形态之间转化时发生的氧化还原过程将导致根际微环境的Eh发生变化,对铁、锰活性产生影响,该类离子在水稻根际可以通过Cd竞争金属转运蛋白来降低Cd的吸收。硫化钠处理下水稻地上部分对Cd的积累显著低于CK,水稻T根/土壤系数水平显著低于CK,随硫化钠施用剂量增加而降低;T茎叶/根略高于CK,硫化钠低剂量施用下,T茎叶/根值最高,随着施用量的增加而降低;低、中剂量施用下,T稻谷/茎叶低于CK;说明硫素的增加加强了水稻地上部分Cd的茎叶区室化作用,降低Cd向籽粒的运输,低剂量硫素介入下,植物茎叶区室化作用明显,随着剂量的增加,硫素的拮抗作用主要发生在根系向上运输过程中,茎叶区室化占比下降。硫进入植物体后参与半胱氨酸(Cys)、甲硫氨酸(Met)和谷胱甘肽的代谢,这些非蛋白巯基物质均可络合重金属,进行区室化作用[31-33],阻隔Cd从茎叶进入籽粒中,从而降低稻谷籽粒中Cd的含量。籽粒中Cd的积累随硫化钠施用量的增加呈现先降低后略增加,增幅无显著差异。在该土壤环境下,硫化钠的建议施用量为0.3 g·kg-1。高剂量硫素的加入,与稻米籽粒Cd的进一步降低无显著相关,且可能带来土壤pH的增加,同时硫化钠的输入对土壤微生物多样性及土壤胶体板结的作用需要进一步被评估,外源硫化钠施用过程中产生的硫化氢气体对土壤环境的影响也需要被关注。
硫化钠作用下具有生物有效性的活性Cd转化为碳酸盐结合态,Cd的其他形态在固定过程中变化不显著[34]。硫化钠的施用显著降低土壤离子态Cd比例(图 1、图 5),硫化钠降低稻谷Cd的积累主要通过以下两个途径:一是钝化土壤中离子态Cd的活性,使其转变为更稳定的结合态;二是硫元素的存在影响根际对Cd的吸收,联合植物体内非蛋白巯基物质对Cd的区室化作用,降低了Cd由茎秆向籽粒的运输。相比直接施用氧化钙,外源硫化钠能够在一定程度上有效降低稻谷中Cd的积累,维持土壤pH环境;在提高Cd污染地区农产品安全质量的同时保持土壤基本理化性质;合理增施硫肥可增加水稻产量,并促进有效穗的形成及提高实粒数的占比,有利于作物经济产量与质量品质的保证;而过量的硫化钠会对土壤环境带来潜在的影响,且使水稻产量的增产效果下降,因此合理适量地利用硫化钠对Cd污染地区粮食安全生产有重要意义。
4 结论(1) 硫化钠能有效降低土壤离子态Cd比例(降低55%),使其转变为更稳定的结合态,从而降低土壤Cd的迁移效率和生物有效性;同时,水解释放的S2-在土壤溶液环境中形成硫酸盐,减缓了硫化钠对土壤pH的增加作用。
(2) 硫化钠的施用对水稻根系Cd的积累有明显抑制作用,促进茎叶对Cd的区室化,降低Cd由茎叶向籽粒的运输,0.3 g·kg-1处理下稻谷中Cd的积累降低68%。硫化钠的施用同时有效增加水稻产量,0.1 g·kg-1处理下促进根系生物量增长59%,稻谷增产59%。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. 北京: 环境保护部, 国土资源部, 2014-04-17. Ministry of Environmental Protection, Ministry of Land and Resources. National survey of soil pollution[EB/OL]. Beijing: Ministry of Environmental Protection, Ministry of Land and Resources, 2014-04-17. |
| [2] |
张小敏, 张秀英, 钟太洋, 等. 中国农田土壤重金属富集状况及空间分布研究[J]. 环境科学, 2014, 35(2): 692-703. ZHANG X M, ZHANG X Y, ZHONG T Y, et al. Spatial distribution and accumulation of heavy metal in arable land soil of China[J]. Environmental Science, 2014, 35(2): 692-703. |
| [3] |
时萌, 王芙蓉, 王棚涛. 植物响应重金属镉胁迫的耐性机理研究进展[J]. 生命科学, 2016, 28(4): 504-512. SHI M, WANG F R, WANG P T. Research advances in the tolerance mechanism of plant response to heavy metal cadmium stress[J]. Chinese Bulletin of Life Sciences, 2016, 28(4): 504-512. |
| [4] |
何李生. 镉对水稻生长和养分吸收的影响及质外体在水稻耐受镉毒害中的作用[D]. 杭州: 浙江大学, 2007: 11-22. HE L S. Effects of cadmium on growth and nutrient uptake of rice and the possible role of apoplast in tolerance to cadmium[D]. Hangzhou: Zhejiang University, 2007: 11-22. |
| [5] |
张会民, 徐明岗, 吕家珑, 等. pH对土壤及其组分吸附和解吸镉的影响研究进展[J]. 农业环境科学学报, 2005(增刊1): 320-324. ZHANG H M, XU M G, LÜ J L, et al. A review of studies on effects of pH on cadmium sorption and desorption in soil[J]. Journal of Agro-Environment Science, 2005(Suppl 1): 320-324. |
| [6] |
王芳丽, 宋宁宁, 王瑞刚, 等. 土壤-甘蔗作物系统中镉的生物有效性研究[J]. 农业环境科学学报, 2012, 31(5): 904-912. WANG F L, SONG N N, WANG R G, et al. Cadmium bioavailability in soil-sugarcane system[J]. Journal of Agro-Environment Science, 2012, 31(5): 904-912. |
| [7] |
周婷, 南忠仁, 王胜利, 等. 干旱区绿洲土壤Cd/Pb复合污染下重金属形态转化与生物有效性[J]. 农业环境科学学报, 2012, 31(6): 1089-1096. ZHOU T, NAN Z R, WANG S L, et al. Speciation and bioavailability of heavy metals under combined pollution of cadmium and lead in arid oasis soils[J]. Journal of Agro-Environment Science, 2012, 31(6): 1089-1096. |
| [8] |
MERY M, ORNELLA A, SANDRO B, et al. Accumulation of heavy metals from contaminated soil to plants and evaluation of soil remediation by vermiculite[J]. Chemosphere, 2011, 82(2): 169-178. DOI:10.1016/j.chemosphere.2010.10.028 |
| [9] |
胡星明, 袁新松, 王丽平, 等. 磷肥和稻草对土壤重金属形态、微生物活性和植物有效性的影响[J]. 环境科学研究, 2012, 25(1): 77-82. HU X M, YUAN X S, WANG L P, et al. Effects of phosphate fertilizer and rice straw on soil heavy metal fraction, microbial activity and phytoavailability[J]. Research of Environmental Sciences, 2012, 25(1): 77-82. |
| [10] |
王林, 徐应明, 孙国红, 等. 海泡石和磷酸盐对镉铅污染稻田土壤的钝化修复效应与机理研究[J]. 生态环境学报, 2012, 21(2): 314-320. WANG L, XU Y M, SUN G H, et al. Effect and mechanism of immobilization of paddy soil contaminated by cadmium and lead using sepiolite and phosphate[J]. Ecology and Environmental Sciences, 2012, 21(2): 314-320. |
| [11] |
王云, 张海军, 唐为忠, 等. 硫对镉胁迫下小麦幼苗生长和一些生理特性的影响[J]. 农业环境科学学报, 2008, 27(3): 1029-1032. WANG Y, ZHANG H J, TANG W Z, et al. Effect of sulfur on plant growth and some physiological characteristics of wheat seedlings under cadmium stress[J]. Journal of Agro-Environment Science, 2008, 27(3): 1029-1032. DOI:10.3321/j.issn:1672-2043.2008.03.034 |
| [12] |
李书田, 林葆, 周卫. 土壤硫素形态及其转化研究进展[J]. 土壤通报, 2001, 32(3): 132-135, 146. LI S T, LIN B, ZHOU W. Review on sulphur transformation and availability in soil[J]. Chinese Journal of Soil Science, 2001, 32(3): 132-135, 146. |
| [13] |
孙丽娟, 段德超, 鹏程, 等. 硫对土壤重金属形态转化及植物有效性的影响研究进展[J]. 应用生态学报, 2014, 25(7): 2141-2148. SUN L J, DUAN D C, PENG C, et al. Influence of sulfur on the speciation transformation and phytoavailable of heavy metals in soil: A review[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 2141-2148. |
| [14] |
TAN W N, ZHI A L, ZOU B. Molecular mechanisms of plant tolerance to heavy metals[J]. Journal of Plant Ecology, 2006, 30(4): 703-712. DOI:10.17521/cjpe.2006.0092 |
| [15] |
SAITO K. Regulation of sulfate transport and synthesis of sulfur-containing amino acids[J]. Current Opinion in Plant Biology, 2000, 3(3): 188-195. DOI:10.1016/S1369-5266(00)00063-7 |
| [16] |
何婵. 硫对城市生活垃圾热处理过程中重金属迁移规律的影响[D]. 广州: 华南理工大学, 2015: 54-55. HE C. Effect of surfer on transfer behavior of trace elements during MSW thermal treatment[D]. Guangzhou: South China University of Technology, 2015: 54-55. |
| [17] |
罗奇祥. 土壤硫素状况及其测试法[J]. 江西农业科学学报, 1994, 6(2): 135-143. LUO Q X. Soil sulfur status and its test method[J]. Acta Agriculturae Jiangxi, 1994, 6(2): 135-143. |
| [18] |
张基茂, 黄运湘. 硫对水稻镉吸收的影响机理[J]. 作物研究, 2017, 31(1): 82-87. ZHANG J M, HUANG Y X. Effect of sulfur on cadmium absorption of rice[J]. Crop Research, 2017, 31(1): 82-87. |
| [19] |
梁泰帅, 刘昌欣, 康靖全, 等. 硫对镉胁迫下小白菜镉富集、光合速率等生理特性的影响[J]. 农业环境科学学报, 2015, 34(8): 1455-1463. LIANG T S, LIU C X, KANG J Q, et al. Effects of sulfur on cadmium accumulation, photosynthesis and some other physiological characteristics of pakchoi(Brassica chinensis L.) under cadmium stresses[J]. Journal of Agro-Environment Science, 2015, 34(8): 1455-1463. |
| [20] |
LIU Y G, ZHOU M, ZENG G M, et al. Bioleaching of heavy metals from mine tailings by indigenous sulfur oxidizing bacteria: Effects of substrate concentration[J]. Bioresource Technology, 2008, 99(10): 4124-4129. |
| [21] |
SHI J Y, LIN H R, YUAN X F, et al. Enhancement of copper availability and microbial community changes in rice rhizospheres affected by sulfur[J]. Molecules, 2011, 16(2): 1409-1417. |
| [22] |
WANG Y P, LI Q B, HUI W, et al. Effect of sulphur on soil Cu/Zn availability and microbial community composition[J]. Journal of Hazardous Materials, 2008, 159(2/3): 385-389. |
| [23] |
杜志敏, 向凌云, 杜凯敏, 等. 磷灰石、石灰对Cd胁迫下黑麦草根形态及Cd吸收影响研究[J]. 农业环境科学学报, 2021, 40(1): 92-101. DU Z M, XIANG L Y, DU K M, et al. Effects of apatite and lime on root morphology and cadmium uptake by ryegrass under cadmium stress[J]. Journal of Agro-Environment Science,, 2021, 40(1): 92-101. |
| [24] |
徐亚平, 刘凤枝, 蔡彦明, 等. 土壤中铅镉有效态提取剂的选择[J]. 农业环境与发展, 2005(4): 46-48. XU Y P, LIU F Z, CAI Y M, et al. Selection of extractant of available lead and cadmium in soil[J]. Agro-Environment & Development, 2005(4): 46-48. |
| [25] |
白玲玉, 陈世宝, 华珞, 等. 腐植酸与Cd、Zn的络合特性研究[J]. 核农学报, 2000, 14(1): 44-48. BAI L Y, CHEN S B, HUA L, et al. Studies on characteristics of complexation of Cd and Zn with humic acids[J]. Acta Agriculturae Nucleatae Sinica, 2000, 14(1): 44-48. |
| [26] |
喻福涛, 钟乐乐, 商容生, 等. 硫化物对某镉污染水稻土中有效态镉的影响[J]. 环境科学与技术, 2018, 41(增刊1): 58-61. YU F T, ZHONG L L, SHANG R S, et al. Effect of sulfate on available cadmium in a cadmium polluted paddy soil[J]. Environmental Science & Technology, 2018, 41(Suppl 1): 58-61. |
| [27] |
MROEAU J W, WEBER P K, MARTIN M C, et al. Extracellular proteins limit the dispersal of biogenic nanoparticles[J]. Science, 2007, 316: 1600-1603. |
| [28] |
周祥宇. 硫化氢对镉胁迫下油菜生长的影响及其调控机制[D]. 合肥: 安徽农业大学, 2019: 15-18. ZHOU X Y. The regulative effects of hydrogen sulfide on growth and cadmium stress tolerance of oil seed rape[D]. Hefei: Anhui Agricultural University, 2019: 15-18. |
| [29] |
MLADENOV N, ZHENG Y, MILLER M P, et al. Dissolved organic matter sources and consequences for iron and arsenic mobilization in Bangladesh aquifers[J]. Environmental Science and Technology, 2010, 44(1): 123-128. |
| [30] |
SHAO G S, CHEN M X, WANG D Y, et al. Using iron fertilizer to control Cd accumulation in rice plants: A new promising technology[J]. Science in China (Series C), 2008, 51(3): 245-253. DOI:10.1007/s11427-008-0031-y |
| [31] |
孙惠莉. 镉硫交互对小白菜生长生理特性和镉含量的影响[D]. 杨凌: 西北农林科技大学, 2013: 13-17. SUN H L. Effects of sulfate and cadmium interaction on growth and physiological characteristics and cadmium content in pakchoi (Brassica Chininsis L. )[D]. Yangling: Northwest A&F University, 2013: 13-17. |
| [32] |
NOCITO F F, PIROVANO L, COCUCCI M, et al. Cadmium induced sulfate uptake in maize roots[J]. Plant Physiology, 2002, 129(3): 1872-1879. |
| [33] |
安志装, 王校常, 严蔚东, 等. 镉硫交互处理对水稻吸收累积镉及其蛋白巯基含量的影响[J]. 土壤学报, 2004, 41(5): 728-734. AN Z Z, WANG X C, YAN W D, et al. Effects of sulfate and cadmium interaction on cadmium accumulation and content of nonprotein thiols in rice seedling[J]. Acta Pedologica Sinica, 2004, 41(5): 728-734. |
| [34] |
曹宇, 陈明, 张佳文, 等. 硫化钠对土壤中铅镉的固定效果[J]. 环境工程学报, 2014, 8(2): 782-788. CAO Y, CHEN M, ZHANG J W, et al. Immobilization of lead and cadmium in soil by sulfide[J]. Chinese Journal of Environmental Engineering, 2014, 8(2): 782-788. |
 2021, Vol. 40
2021, Vol. 40