2. 桂林理工大学, 岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541004;
3. 桂林理工大学植物与生态工程学院, 广西 桂林 541004;
4. 桂林理工大学旅游与风景园林学院, 广西 桂林 541004
2. Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area, Guilin University of Technology, Guilin 541004, China;
3. College of Plant and Ecological Engineering, Guilin University of Technology, Guilin 541004, China;
4. College of Tourism & Landscape Architecture, Guilin University of Technology, Guilin 541004, China
土壤重金属污染问题已经成为危害农业生产和人类健康的全球性环境问题[1-2]。《全国土壤污染状况调查公报》显示,我国土壤Cd、Pb、Zn等重金属污染严重[3]。植物修复技术作为目前国内外重金属污染土壤修复的有效方法和主流方向,已经成为土壤重金属污染修复的关键技术之一[4-5],而超富集植物作为植物修复技术的核心载体,在清除土壤重金属污染物的过程中发挥了关键作用[6-7],但也存在一些局限性,例如大部分超富集植物植株矮小、生物量低、生长缓慢、需要的修复时间较长,往往是数年甚至数十年[8-10]。
为了克服植物修复技术的不足,近年来发展的植物间作修复技术得到了广泛的研究与应用[11-12]。间作源自农业的立体种植,是指在同一土地上按照不同比例种植不同种类农作物的种植方式,通过提高养分、光、水等物质利用效率,从而提高作物产量和作物质量[13-15]。许多研究表明,间作能够促进或者抑制植物对重金属的吸收。间作的植物不同,可能会出现协同效应或者拮抗效应[16-17]。例如,Cd超富集植物龙葵与茄子间作可以增强龙葵对Cd的吸收,同时降低茄子对Cd的吸收[17]。向日葵与蒜间作可以降低蒜苗中的重金属浓度[18]。菊苣、籽粒苋、三叶草、紫花苜蓿及紫云英与空心菜间作会提高空心菜茎叶Cd含量,但是高丹草、苏丹草、狼尾草与空心菜间作会显著降低空心菜茎叶Cd含量[19]。
能源植物通常是指利用光能效率高、具有合成较高还原性烃的能力、可产生接近石油成分和可替代石油使用的产品的植物以及富含油脂、糖类、淀粉类、纤维素等的植物[20]。目前关于能源植物对重金属污染土壤修复潜力的研究正在积极地开展[21-24]。研究表明,甜高粱(Sorghum dochna)[25]、皇草(Pennisetum americanum × P. thyphoideum)[26]、芒草(Miscanthus sinensis)[27]等能源植物均对重金属具有较强的耐性和富集能力。在重金属污染土壤同时种植超富集植物与能源植物,不仅能够通过生态位互补作用更好地利用土壤养分和修复不同层次的土壤,还可以生产生物质获得经济效益,保证植物修复的经济可持续性,达到边修复边生产的目的。
目前关于超富集植物与能源植物的间作对重金属污染土壤修复潜力的研究鲜见报道。少花龙葵(Solanum photeinocarpum)生长速度快、适应能力强、种植简单,且对Cd有极强的耐性及较高的富集能力[11]。翅果菊(Pterocypsela indica)是近年来西南地区常见高生物量牧草,在此前的Cd超富集植物筛选实验中发现其为一种潜在的Cd超富集植物[28]。皇草(Pennisetum americanum×P. thyphoideum)是由南美洲象草与非洲狼尾草杂交选育而成的三倍体多年生直立丛生刈割型禾本科能源植物,对Cd、Pb、Zn污染土壤具有修复潜力[26, 29]。甜高粱(Sorghum bicolor)因其具有生长迅速、抗逆性强、乙醇转化率高等特点而成为一种优良的饲料作物、糖料作物和可再生能源植物,并对多种重金属具有很强的吸收能力,被认为是最具开发潜力的能源植物之一[30]。本研究以广西壮族自治区桂林市阳朔县思的村铅锌尾矿附近的Cd、Pb、Zn复合污染农田土为研究对象,选用少花龙葵、翅果菊与能源植物皇草、甜高粱进行间作,研究间作对Cd、Pb、Zn累积的影响,找出修复Cd、Pb、Zn污染农田土壤的最佳间作组合。
1 材料与方法 1.1 实验材料供试植物:少花龙葵和翅果菊种子采自野外;皇草购买于江西省新余市江西稻草人农业园;甜高粱品种为大力士,购买于河北省邢台市恒力种子有限公司。
供试土壤:采自广西壮族自治区桂林市阳朔县思的村铅锌尾矿附近重金属污染农田,其理化性质为:pH 7.47,有机质4.35%,全N 2.51 g·kg-1,全P 301.02 mg·kg-1,全K 15.25 g·kg-1,全Cd 12.22 mg·kg-1,全Pb 699 mg·kg-1,全Zn 1 104 mg·kg-1。与《土壤环境质量标准农用地土壤污染风险管控标准(试行)》(GB 15618—2018)的筛选值相比,实验用土中Cd、Pb、Zn含量分别超标20.3、4.9倍和4.4倍,因此,实验用土Cd污染最为严重,同时存在一定程度的Pb与Zn污染。
1.2 实验设计本实验设8个处理:少花龙葵单作(SP-M)、翅果菊单作(PI-M)、皇草单作(PP-M)、甜高粱单作(SBM)、少花龙葵与皇草间作(少花龙葵+皇草,SP//PP)、少花龙葵与甜高粱间作(少花龙葵+甜高粱,SP//SB)、翅果菊与皇草间作(翅果菊+皇草,PI//PP)、翅果菊与甜高粱间作(翅果菊+甜高粱,PI//SB)。每组处理设4个重复。
采用温室种植实验,取0~30 cm表层土壤,自然风干后过1 cm筛,装入塑料盆(上、下口径分别为22、18 cm,高24 cm),每盆4 kg土壤,浇水,稳定7 d后播种。待植株长出4片真叶后进行间苗定植,其中少花龙葵、翅果菊单作每盆留苗6株,株距为5 cm;能源植物每盆留苗2株,株距为10 cm,间作时少花龙葵、翅果菊留苗3株,能源植物留苗1株,株距为5 cm。每种植物的生长周期为3个月,生长温度为25±2 ℃(白天) 和16±2 ℃(夜晚),种植期间定期浇水,使土壤含水量保持在田间含水率的70%左右,观察其生长状况。
1.3 指标测定 1.3.1 土壤基本理化性质及重金属有效态测定土壤有机质测定参考鲍士旦《土壤农化分析》[31],采用水合热重铬酸钾氧化-比色法。土壤Cd、Pb、Zn总量采用美国环保局(USEPA)推荐的HNO3+H2O2的电热板加热湿法消解体系(USEPA 3050B)进行消解,土壤有效态Cd、Pb、Zn含量采用DTPA法浸提。
1.3.2 植物生长指标植株收获后,用直尺测定各植物株高和根长,将植物分解成根、地上部分,用去离子水将植物反复清洗3遍,之后将植物鲜样置于烘箱内,105 ℃杀青30 min,70 ℃烘干至恒质量,称量得到植物根、地上部生物量。
1.3.3 植物中Cd、Pb、Zn含量测定使用粉碎机将根、茎、叶干样粉碎,植物各部分Cd、Pb和Zn含量采用美国环保局(USEPA)推荐的HNO3 + H2O2的电热板加热湿法消解体系(USEPA 3050B)进行消解测定,并计算各植物对土壤的富集系数、转运系数、植物重金属累积量及植物修复时间,其公式为:

|

|

|

|

|
所有数据使用Excel 2010和SPSS 22.0进行整理和统计分析,新复极差法(Duncan法)进行均值比较和差异显著性检验(P<0.05),使用Origin 8.5作图。
2 结果与分析 2.1 土壤有机质如图 1所示,与无植物对照相比,仅翅果菊+皇草中土壤有机质含量显著下降;而单间作处理间没有显著差异。总体来说,各处理中土壤有机质含量较对照组下降,主要是植物生长过程中需要消耗土壤中的营养物质,有机质含量会发生改变。

|
平均值±标准误差(n=4),不同字母表示各处理间差异显著(P<0.05)。下同 Mean ± standard error (n=4), different letters indicate significant difference among treatments(P < 0.05). The same below 图 1 不同处理下土壤有机质含量 Figure 1 Soil organic matter content under different treatments |
由图 2可知,与对照相比,能源植物皇草、甜高粱单作后土壤Cd、Pb和Zn有效态含量显著下降,少花龙葵和翅果菊的单作无显著差异;少花龙葵+皇草处理后土壤Cd、Pb和Zn有效态含量均高于皇草单作,但与少花龙葵单作没有显著差异;少花龙葵+甜高粱处理后土壤Pb有效态含量明显高于甜高粱单作;翅果菊+皇草处理土壤Cd有效态含量高于皇草单作;而翅果菊+甜高粱处理仅土壤Zn有效态含量高于甜高粱单作。4种间作的土壤Cd、Pb、Zn有效态含量均高于两单作或介于两单作之间。

|
图 2 不同处理下土壤Cd、Pb、Zn有效态含量 Figure 2 Contents of Cd, Pb and Zn in soil under different treatments |
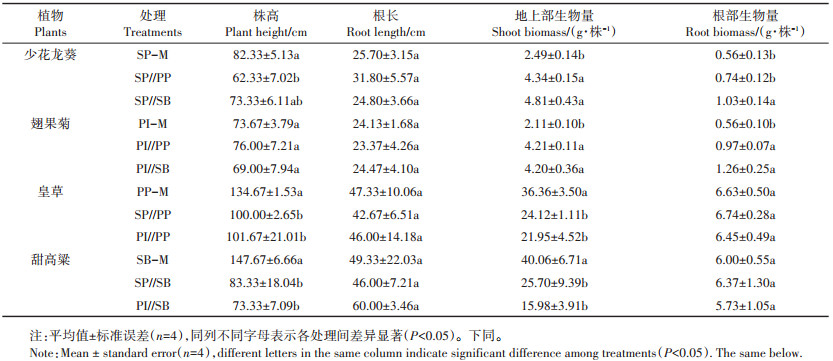
由表 1可知,重金属污染土壤胁迫下超富集植物和能源植物均能正常生长,表现出4种植物对Cd、Pb和Zn的耐受能力。与单作相比,少花龙葵+皇草和少花龙葵+甜高粱处理中植物的株高均显著下降,显著增加少花龙葵地上部和根部的生物量,降低了皇草和甜高粱的生物量;对于翅果菊,翅果菊+皇草和翅果菊+甜高粱处理显著增加了其地上部和根部的生物量,而皇草和甜高粱地上部生物量均显著下降,且植物株高均显著下降。但间作对植物根长均无显著影响。
|
|
表 1 不同处理条件下植物的生长参数 Table 1 Plant growth parameters under different treatment conditions |
总体而言,间作能显著增加少花龙葵和翅果菊的总生物量,但显著降低能源植物皇草和甜高粱的地上部生物量,间作处理下各植物株高均显著下降。
2.4 植物Cd、Pb、Zn含量图 3为不同处理下植物Cd、Pb、Zn的含量变化。由图 3(A)、图 3(B)可知,少花龙葵+皇草处理后显著增加了皇草地上部Cd含量,为单作的5.19倍,对少花龙葵Cd含量没有显著影响;少花龙葵+甜高粱处理后少花龙葵和甜高粱地上部Cd含量均显著增加,分别为单作的1.34倍和3.95倍;与单作相比,翅果菊+皇草处理后两者地上部Cd含量显著增加,分别为单作的2.74倍和5.22倍,根部Cd含量分别为单作的3.19倍和2.45倍;翅果菊+甜高粱处理植物Cd含量较单作均无显著差异。

|
不同字母表示同一部位不同处理间差异显著(P<0.05) Different letters indicate significant difference among different treatments in the same part(P<0.05) 图 3 不同处理下植物的Cd、Pb、Zn含量 Figure 3 Cd, Pb and Zn content of plants under different treatments |
由图 3(C)、图 3(D)可知,少花龙葵与翅果菊间作处理后植物的Pb含量较单作均无显著性差异。而少花龙葵+皇草处理降低了皇草根部Pb含量,降幅为54.4%;翅果菊+甜高粱处理下甜高粱地上部Pb含量为单作的1.56倍。
由图 3(E)、图 3(F)可知,与单作相比,间作处理对少花龙葵Zn的吸收没有显著差异;少花龙葵+皇草处理后显著增加了皇草地上部Zn含量,为单作的2.85倍;少花龙葵+甜高粱处理后甜高粱地上部和根部Zn含量分别为单作的2.19倍和1.88倍;翅果菊+皇草处理后两者地上部Zn含量显著增加,分别为单作的2.49倍和2.55倍,且翅果菊根部Zn含量为单作的2.03倍。
2.5 植物对Cd、Pb、Zn的富集系数和转运系数从表 2可看出,间作提高了各植物对Cd的富集系数(BCF),对Pb、Zn的BCF没有明显影响,但各处理组的BCF均小于1。间作有效促进了植物对Cd和Zn的转运,而对Pb的转运影响较小;翅果菊Cd的转运系数(TF)均大于1,其余植物的TF大部分小于1。
|
|
表 2 不同处理下植物对Cd、Pb、Zn的富集系数及转运系数 Table 2 BCF and TF of Cd, Pb and Zn by plants in different treatments |
图 4为不同处理下单株植物地上部Cd、Pb和Zn的累积量变化。少花龙葵与皇草和甜高粱间作能显著增加3种植物地上部Cd累积量,其中少花龙葵+皇草地上部Cd累积量分别是少花龙葵和皇草单作的1.74倍和3.36倍;少花龙葵+甜高粱处理的地上部Cd累积量分别是两者单作处理的2.60倍和2.45倍;与单作相比,翅果菊的间作处理也存在明显的差异,其中翅果菊+皇草处理的地上部Cd累积量分别是两者单作处理的5.37倍和3.12倍;翅果菊+甜高粱地上部Cd累积量是翅果菊单作的2.51倍。而间作对植物地上部Pb和Zn的累积存在不同的影响,如少花龙葵+甜高粱处理的地上部Pb和Zn累积量是少花龙葵单作处理的1.94倍和2.11倍;翅果菊+皇草处理的Zn累积量是翅果菊单作处理的4.91倍;而翅果菊+甜高粱处理的Zn累积量是翅果菊单作处理的2.16倍。因此,各间作都能显著提高少花龙葵、翅果菊和能源植物皇草、甜高粱的单株地上部Cd累积,对植物地上部Pb和Zn的累积影响存在差异。

|
图 4 不同处理下单株植物地上部Cd、Pb、Zn累积量 Figure 4 Cd, Pb and Zn accumulation in the shoot of single plant under different treatments |
在所有处理中,单盆中Cd的累积量均存在显著差异(P<0.05)(图 5A)。不同处理下,4种植物中Cd累积量在76.76~397.65 μg·盆-1,Pb累积量在26.85~ 158.28 μg·盆-1,Zn累积量在834.90~4 169.42 μg· 盆-1。翅果菊+皇草处理时,对Cd(397.65 μg·盆-1)和Zn(4 169.42 μg·盆-1)的累积量最大,其次为少花龙葵+皇草处理;同时少花龙葵+皇草处理对Pb(158.28 μg·盆-1)累积量最大,翅果菊+皇草对Pb累积量为98.17 μg·盆-1。

|
图 5 不同处理下单盆植物地上部Cd、Pb、Zn累积量 Figure 5 Cd, Pb and Zn accumulation in the shoot of single pot under different treatments |
根据国家土壤环境质量标准《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618— 2018)规定,使用1.3.3中植物修复时间计算公式计算了土壤Cd、Pb和Zn达到农用土壤的风险筛选值时所需修复时间。由图 6比较可知,翅果菊+皇草处理所需修复时间最短(39 a),其次为少花龙葵+皇草处理(57 a)。因此,翅果菊与皇草间作和少花龙葵与皇草间作处理可应用于Cd、Pb、Zn污染土壤的修复。

|
图 6 达到修复目的所需时间 Figure 6 Time required for phytoremediation |
间作组合的不同会对土壤的理化性质产生不同程度的影响[32-33]。本研究中有机质含量下降,主要是植物生长过程中需要消耗土壤中的营养物质,但可能由于4种植物对生长环境需求的复杂性,各处理间有机质含量没有显著性差异。间作处理下植物之间的相互作用可能会促进根系分泌有机酸或酶类物质,与重金属结合形成复合物,以提高或降低重金属的生物有效性[34-36]。ZHAN等[37]研究了续断菊与蚕豆间作对Cd、Pb积累的影响,单作蚕豆后土壤有效态Cd含量降低,有效态Pb含量无明显变化,而两者间作后土壤Cd和Pb的有效态含量均显著降低。3种Cd积累植物互相间作时,仅碎米芥和球序卷耳的间作显著提高土壤pH;小飞蓬和碎米芥间作后土壤有效Cd含量介于两单作之间,而小飞蓬和球序卷耳间作土壤有效态Cd含量仅显著高于小飞蓬单作[38]。本研究中,单种两种Cd富集植物少花龙葵和翅果菊对土壤Cd、Pb和Zn有效态含量无显著影响,主要是由于在弱碱性条件下,富集植物会对根际土壤中的重金属产生活化作用,使土壤中有效态重金属含量增加[39],而富集植物主要吸收土壤中有效态重金属,两者叠加导致植物富集量增加。于保港等[40]的研究中,蚕豆与莎草间作后,蚕豆根际土壤有效态Pb、Cd和Zn的含量显著增加,而体内Pb、Cd和Zn累积量显著降低。在本研究中能源植物单作显著降低了土壤重金属含量,表现出能源植物单作时对重金属的累积明显高于其他两种植物单作。
植物的生长状况和产量是反映土壤环境质量的重要指标[41]。间作可能产生的效应是相互促进或相互竞争,分析的指标不同,产生的结果也不同。本研究发现,4种植物在重金属污染土壤中生长速度较快,没有出现中毒症状,表明这些植物都能适应该受污染的土壤条件(表 1)。间作使少花龙葵和能源植物株高下降,显著提高了少花龙葵和翅果菊的生物量,但显著降低了能源植物生物量。研究表明在间作中超富集植物竞争力强,而能源植物处于劣势,生长受抑制,可能是根的交错和对微量元素竞争的结果。类似的研究中花卉Cd富集植物(向日葵、硫华菊、凤仙花等)与葡萄间作,其中花卉植物充分利用了营养等资源而抑制了葡萄的生长[42];玉米和6种不同的豆科类植物间作,玉米生物量都有所下降[43],表现了间作中植物种间对水和肥料等的竞争[44]。
不同植物间作时,对重金属的吸收存在差异。与单作相比,间作可以改变植物根系环境,如不同种类和比例的根系分泌物,可能会直接固定或溶解土壤中的重金属,进而增加或减少植物对重金属的吸收[45-47]。蒋成爱等[48]发现超富集植物东南景天与玉米间作时,东南景天地上部Pb和Zn含量比单作增加13%~22%,同时显著增加了玉米的Pb含量,降低了玉米Cd和Zn的含量。伴矿景天与早竹间作后,伴矿景天地上部Cu含量上升,Cd和Zn含量下降,而早竹地上部Cd含量上升,Cu和Zn含量下降[49]。本研究发现,所有处理中,少花龙葵+甜高粱的地上部Cd含量显著高于两植物单作处理,地上部Zn含量仅显著高于甜高粱单作;翅果菊+皇草的地上部Cd和Zn含量均显著高于其单作处理;而翅果菊+甜高粱间作提高了翅果菊地上部Pb含量,不同植物间作处理表现出较明显的差异。研究表明不同植物物种间作对重金属吸收的差异可能是由分泌物和酶的类型、数量和功能的改变引起的,也可能是由植物间和植物内对各种元素的竞争引起的[50]。TF值越高,则吸收的重金属越能集中在易于收获的地上部,这类植物用于修复重金属污染的土壤优势越大[51]。本研究中,单间作处理下翅果菊Cd的TF均大于1,表明翅果菊修复Cd污染的能力较高;间作提高了4种植物对Cd的转运能力,主要表现为4种植物对Cd较强的富集能力。但总体上,根部Cd、Pb、Zn含量明显高于地上部。VERKLEIJ等[52]指出根系一般是植物储存金属的首选,与其他研究结果一致。
植物修复土壤重金属的效率主要由植物对重金属的累积量决定,而累积量决定于对重金属的吸收能力和生物量两个方面[53]。重金属的累积在植物物种间和单个物种的栽培品种之间差异很大,并且受不同的间作组合的影响[54-55]。在本研究中,大部分间作处理对单株Cd和Zn累积都有积极影响,然而,对单株Pb积累没有表现出规律性的变化(图 5)。因此,不同物种间作也可能不会促进富集植物对重金属的积累。如3种Cd富集植物繁缕、牛繁缕和猪殃殃两两间作中,繁缕或牛繁缕和猪殃殃间作时不能显著提高植物对Cd的富集能力[16]。单盆植物中地上部Cd和Zn的累积量最大的为翅果菊与皇草间作,其次为少花龙葵与皇草间作;单盆植物地上部Pb累积量最大为少花龙葵与皇草间作。通过计算修复时间后发现(图 6),翅果菊与皇草间作所需修复时间最短(39年),其次为少花龙葵与皇草间作处理(57年)。所以,翅果菊与皇草间作和少花龙葵与皇草间作可应用于Cd、Pb、Zn污染土壤的修复。
4 结论(1) 能源植物皇草和甜高粱单作显著降低了土壤Cd、Pb、Zn有效态含量,而两种Cd富集植物少花龙葵和翅果菊单作或与能源植物间作时,均对土壤Cd、Pb和Zn有一定的活化作用。
(2) 与单作相比,间作显著促进了少花龙葵和翅果菊的生长,但抑制了能源植物皇草和甜高粱的生长。
(3) 少花龙葵与甜高粱间作显著提高了两种植物地上部Cd含量,翅果菊与皇草间作显著提高了两植物地上部Cd和Zn含量。
(4) 翅果菊与皇草间作和少花龙葵与皇草间作处理能够实现边修复边生产的修复模式。
| [1] |
YAN D, HU X F, WU X H, et al. Affects of mining activities on Cd pollution to the paddy soils and rice grain in Hunan Province, Central South China[J]. Environmental Monitoring and Assessment, 2013, 185(12): 9843-9856. DOI:10.1007/s10661-013-3296-y |
| [2] |
GU J F, ZHOU H, TANG H L, et al. Cadmium and arsenic accumulation during the rice growth period under in situ remediation[J]. Ecotoxicology and Environmental Safety, 2019, 171(4): 451-459. |
| [3] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[R]. 北京: 环境保护部, 国土资源部, 2014. Ministry of Environmental Protection, Ministry of Land and Resources. National survey bulletin on soil pollution[R]. Beijing: Ministry of Environmental Protection, Ministry of Land and Resources, 2014. |
| [4] |
HE B, YUN Z J, SHI J B, et al. Research progress of heavy metal pollution in China: Sources, analytical methods, status, and toxicity[J]. Chinese Science Bulletin, 2013, 58: 134-140. |
| [5] |
MARQUES A, RANGEL A, CASTRO P. Remediation of heavy metal contaminated soils: Phytoremediation as a potentially promising cleanup technology[J]. Critical Reviews in Environmental Science and Technology, 2009, 39(8): 622-654. DOI:10.1080/10643380701798272 |
| [6] |
龙新宪, 杨肖娥, 倪吾钟. 重金属污染土壤修复技术研究的现状与展望[J]. 应用生态学报, 2002, 13(6): 757-762. LONG X X, YANG X E, NI W Z. Current situation and prospect on the remediation of soils contaminated by heavy metals[J]. Chinese Journal of Applied Ecology, 2002, 13(6): 757-762. DOI:10.3321/j.issn:1001-9332.2002.06.028 |
| [7] |
DANH L T, TRUONG P, MAMMUCARI R, et al. A critical review of the arsenic uptake mechanisms and phytoremediation potential of Pteris vittata[J]. International Journal of Phytoremediation, 2014, 16(5): 429-453. DOI:10.1080/15226514.2013.798613 |
| [8] |
WEI S H, ZHOU Q X, WANG X, et al. A newly-discovered Cd-hyper-accumulator Solanum nigrum L.[J]. Chinese Science Bulletin, 2005, 50(1): 33-38. DOI:10.1360/982004-292 |
| [9] |
ZHANG X F, XIA H P, LI Z A, et al. Identification of a new potential Cd-hyperaccumulator Solanum photeinocarpum by soil seed bank-metal concentration gradient method[J]. Journal of Hazardous Materials, 2011, 189(1/2): 414-419. |
| [10] |
张杏锋, 高波, 桂林理工大学. 一种治理土壤镉污染的植物修复方法: 201810694274.3[P]. 2018-06-29. ZHANG X F, GAO B, Guilin University of Technology. A phytoremediation method for soil cadmium pollution: 201810694274.3[P]. 2018-06-29. |
| [11] |
廖晓勇, 陈同斌, 阎秀兰, 等. 提高植物修复效率的技术途径与强化措施[J]. 环境科学学报, 2007, 27(6): 881-893. LIAO X Y, CHEN T B, YAN X L, et al. Enhancement of heavy metal removal in phytoremediation of soils contaminated with heavy metals[J]. Acta Scientiae Circumstantiae, 2007, 27(6): 881-893. DOI:10.3321/j.issn:0253-2468.2007.06.001 |
| [12] |
SHAHID M, AUSTRUY A, ECHEVARRIA G, et al. EDTA-enhanced phytoremediation of heavy metals: A review[J]. Soil and Sediment Contaminationation, 2014, 23(4): 389-416. DOI:10.1080/15320383.2014.831029 |
| [13] |
KUMAR G P, YADAV S K, THAWALE P R, et al. Growth of Jatropha curcus on heavy metal contaminated soil amended with industrial wastes and azotobacter: A greenhouse study[J]. Bioresource Technology, 2008, 99(6): 2078-2082. DOI:10.1016/j.biortech.2007.03.032 |
| [14] |
WAN X M, LEI M, CHEN T B. Cost-benefit calculation of phytoremediation technology for heavy-metal-contaminated soil[J]. Science of the Total Environment, 2016, 563: 796-802. |
| [15] |
LI C Y, HE X H, ZHU S S, et al. Crop diversity for yield increase[J]. PLoS One, 2009, 4(11): e8049. DOI:10.1371/journal.pone.0008049 |
| [16] |
LU Q, LI J, CHEN F, et al. Effects of mutual intercropping on the cadmium accumulation in accumulator plants Stellaria media, Malachium aquaticum, and Galium aparine[J]. Environmental Monitoring and Assessment, 2017, 189: 622. DOI:10.1007/s10661-017-6322-7 |
| [17] |
TANG Y, HE J, YU X N, et al. Intercropping with Solanum nigrum and Solanum photeinocarpum from two ecoclimatic regions promotes growth and reduces cadmium uptake of eggplant seedlings[J]. Pedosphere, 2017, 27(3): 638-644. DOI:10.1016/S1002-0160(17)60358-8 |
| [18] |
ZHANG Y, HU J L, BAI J F, et al. Intercropping with sunflower and inoculation with arbuscular mycorrhizal fungi promotes growth of garlic chive in metal-contaminated soil at a WEEE-recycling site[J]. Ecotoxicology & Environmental Safety, 2019, 167: 376-384. |
| [19] |
孟楠, 王萌, 陈莉, 等. 不同草本植物间作对Cd污染土壤的修复效果[J]. 中国环境科学, 2018, 38(7): 2618-2624. MENG N, WANG M, CHEN L, et al. Remediation efficiency of Cd polluted soil by intercropping with herbaceous plants[J]. China Environmental Science, 2018, 38(7): 2618-2624. DOI:10.3969/j.issn.1000-6923.2018.07.030 |
| [20] |
于辉, 向佐湘, 杨知建. 草本能源植物资源的开发与利用[J]. 草业科学, 2008, 25(12): 46-50. YU H, XIANG Z X, YANG Z J. Development and utilization of herbaceous energy plant resources[J]. Pratacultural Science, 2008, 25(12): 46-50. DOI:10.3969/j.issn.1001-0629.2008.12.010 |
| [21] |
DASTYAR W, RAHEEM A, HE J, et al. Biofuel production using thermochemical conversion of heavy metal-contaminated biomass (HMCB)harvested from phytoextraction process[J]. Chemical Engineering Journal, 2019, 358: 759-785. DOI:10.1016/j.cej.2018.08.111 |
| [22] |
WITTERS N, MENDELSOHN R O, VAN S S, et al. Phytoremediation, a sustainable remediation technology? Conclusions from a case study. Ⅰ: Energy production and carbon dioxide abatement[J]. Biomass & Bioenergy, 2012, 39: 454-469. |
| [23] |
侯新村, 范希峰, 武菊英, 等. 草本能源植物修复重金属污染土壤的潜力[J]. 中国草地学报, 2012, 34(1): 59-64. HOU X C, FAN X F, WU J Y, et al. Potentiality of herbaceous bioenergy plants in remediation of soil contaminated by heavy metals[J]. Chinese Journal of Grassland, 2012, 34(1): 59-64. DOI:10.3969/j.issn.1673-5021.2012.01.011 |
| [24] |
余海波, 宋静, 骆永明, 等. 典型重金属污染农田能源植物示范种植研究[J]. 环境监测管理与技术, 2011, 23(3): 71-76. YU H B, SONG J, LUO Y M, et al. Field demonstration of energy plants production on heavy metal contaminated farm land[J]. The Administration and Technique of Environmental Monitoring, 2011, 23(3): 71-76. DOI:10.3969/j.issn.1006-2009.2011.03.014 |
| [25] |
薛忠财, 李纪红, 李十中, 等. 能源作物甜高粱对镉污染农田的修复潜力研究[J]. 环境科学学报, 2018, 38(4): 1621-1627. XUE Z C, LI J H, LI S Z, et al. Study on the phytoremediation potential of energy crop sweet sorghum to Cd-contaminated agriculture soil[J]. Acta Scientiae Circumstantiae, 2018, 38(4): 1621-1627. |
| [26] |
ZHANG X F, ZHANG X H, GAO B, et al. Effect of cadmium on growth, photosynthesis, mineral nutrition and metal accumulation of an energy crop, king grass(Pennisetum americanum×P. purpureum)[J]. Biomass & Bioenergy, 2014, 67: 179-187. |
| [27] |
李勤奋, 杜卫兵, 李志安, 等. 金属矿区芒草种群对重金属的积累及其与土壤特性的关系[J]. 生态学杂志, 2006, 25(3): 255-258. LI Q F, DU W B, LI Z A, et al. Heavy metals accumulation in mining area's Miscanthus sinensis populations and its relationship with soil characters[J]. Chinese Journal of Ecology, 2006, 25(3): 255-258. |
| [28] |
ZHANG X F, WU C S, NIE X Q, et al. Identification of a new potential Cd-accumulator Pterocypsela indica(L.)Shih[J]. Bulletin of Environmental Contamination and Toxicology, 2021. DOI:10.1007/s00128-021-03165-z |
| [29] |
易自成, 贺俊波, 程华, 等. Cd对皇竹草构件生长及生理特性的影响[J]. 农业环境科学学报, 2014, 33(2): 276-282. YI Z C, HE J B, CHENG H, et al. Effects of Cd on growth and physiological characteristics of Phyllostachys heterocycla[J]. Journal of Agro-Environment Science, 2014, 33(2): 276-282. |
| [30] |
DANIELA D, VIANA B M, DOS SANTOS J V, et al. Arbuscular mycorrhizal fungi favor the initial growth of Acacia mangium, Sorghum bicolor, and Urochloa brizantha in soil contaminated with Zn, Cu, Pb, and Cd[J]. Bulletin of Environment Contamination and Toxicology, 2018, 101(3): 386-391. DOI:10.1007/s00128-018-2405-6 |
| [31] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. BAO S D. Soil agrochemical analysis[M]. Beijing: China Agriculture Press, 2000. |
| [32] |
LIU T J, Cheng Z H, Meng H W, et al. Growth, yield and quality of spring tomato and physicochemical properties of medium in a tomato/garlic intercropping system under plastic tunnel organic medium cultivation[J]. Scientia Horticulturae, 2014, 170: 159-168. DOI:10.1016/j.scienta.2014.02.039 |
| [33] |
LI X, SUN M L, ZHANG H, et al. Use of mulberry-soybean intercropping in salt-alkali soil impacts the diversity of the soil bacterial community[J]. Microbial Biotechnology, 2016, 9(3): 293-304. DOI:10.1111/1751-7915.12342 |
| [34] |
YANG Y Y, JUNG J Y, SONG W Y, et al. Identification of rice varieties with high tolerance or sensitivity to lead and characterization of the mechanism of tolerance[J]. Plant Physiology, 2000, 124(3): 1019-1026. DOI:10.1104/pp.124.3.1019 |
| [35] |
GRAMLICH A, TANDY S, ANDRES C, et al. Cadmium uptake by cocoa trees in agroforestry and monoculture systems under conventional and organic management[J]. Science of the Total Environment, 2017, 580: 677-686. DOI:10.1016/j.scitotenv.2016.12.014 |
| [36] |
周显勇, 刘鸿雁, 刘艳萍, 等. 植物修复重金属和抗生素复合污染土壤微生物数量和酶活性的变化[J]. 农业环境科学学报, 2019, 38(6): 1248-1255. ZHOU X Y, LIU H Y, LIU Y P, et al. Changes of microbial quantity and enzyme activity in phytoremediation soil contaminated by heavy metals and antibiotics[J]. Journal of Agro-Environment Science, 2019, 38(6): 1248-1255. |
| [37] |
ZHAN F D, QIN L, GUO X H, et al. Cadmium and lead accumulation and low-molecular-weight organic acids secreted by roots in an intercropping of a cadmium accumulator Sonchus asper L. with Vicia faba L.[J]. RSC Advances, 2016, 6(40): 33240-33248. DOI:10.1039/C5RA26601G |
| [38] |
XIA H, LIANG D, CHEN F, et al. Effects of mutual intercropping on cadmium accumulation by the accumulator plants Conyza canadensis, Cardamine hirsuta, and Cerastium glomeratum[J]. International Journal of Phytoremediation, 2018, 20(9): 855-861. DOI:10.1080/15226514.2018.1438356 |
| [39] |
ZHU S, MA X, GUO R, et al. A field study on heavy metals phytoat-tenuation potential of monocropping and intercropping of maize and/or legumes in weakly alkaline soils[J]. International Journal of Phytore-mediation, 2016, 18(10): 1014-1021. DOI:10.1080/15226514.2016.1183570 |
| [40] |
于保港, 秦丽, 湛方栋, 等. 间作对莎草与蚕豆体内铅镉锌化学形态分布的影响[J]. 农业环境科学学报, 2018, 37(4): 621-631. YU B G, QIN L, ZHAN F D, et al. Effects of intercropping on chemical speciation distribution of lead, cadmium and zinc in sedge and broad bean[J]. Journal of Agro-Environment Science, 2018, 37(4): 621-631. |
| [41] |
赵宁宁, 邱丹, 韦燕燕, 等. 蜈蚣草-玉米套作模式对玉米砷胁迫的缓解效应[J]. 生态环境学报, 2019, 28(5): 1021-1028. ZHAO N N, QIU D, WEI Y Y, et al. Alleviating effect of centipede corn intercropping mode on arsenic stress in maize[J]. Ecology and Environmental Sciences, 2019, 28(5): 1021-1028. |
| [42] |
CHEN H Q, LIN L J, LIAO M, et al. Effects of intercropping with floricultural accumulator plants on cadmium accumulation in grapevine[J]. Environmental Science and Pollution Research, 2019, 26(24): 24474-24481. DOI:10.1007/s11356-019-05697-8 |
| [43] |
LIU Y, ZHUANG P, LI Z A, et al. Cadmium accumulation in maize monoculture and intercropping with six legume species[J]. Acta Agriculturae Scandinavica, 2013, 63(4): 376-382. |
| [44] |
GITARI H I, KARANJA N N, GACHENE C K K, et al. Nitrogen and phosphorous uptake by potato(Solanum tuberosum L.)and their use efficiency under potato-legume intercropping systems[J]. Field Crops Research, 2018, 222: 78-84. DOI:10.1016/j.fcr.2018.03.019 |
| [45] |
YUAN M Z. The mechanisms of root exudates of maize in improvement of iron nutrition of peanut in peanut/maize intercropping system by 14C tracer technique[J]. Acta Agriculturae Nucleatae Sinica, 2004, 18(1): 43-46. |
| [46] |
GUO X F, LI H S, CHEN H. The effects of biochar and intercropping on the Cd, Cr and Zn speciation in soils and plant uptake by Machilus pauhoi[J]. Bulletin of Environmental Contamination & Toxicology, 2017, 98(4): 1-8. DOI:10.1007/s00128-016-2013-2 |
| [47] |
闫仁俊, 韩磊, 赵亚萍, 等. 玉米与龙葵间作模式对植物生长及Cd富集特征的影响[J]. 农业环境科学学报, 2020, 39(10): 2162-2171. YAN R J, HAN L, ZHAO Y P, et al. Effects of intercropping patterns of maize and Solanum nigrum on plant growth and Cd accumulation characteristics[J]. Journal of Agro-Environment Science, 2020, 39(10): 2162-2171. DOI:10.11654/jaes.2020-0639 |
| [48] |
蒋成爱, 吴启堂, 吴顺辉, 等. 东南景天与不同植物混作对土壤重金属吸收的影响[J]. 中国环境科学, 2009, 29(9): 985-990. JIANG C G, WU Q T, WU S H, et al. Effects of Sedum alfredii and different plants on soil heavy metal uptake[J]. Chinese Environmental Science, 2009, 29(9): 985-990. DOI:10.3321/j.issn:1000-6923.2009.09.017 |
| [49] |
BIAN F Y, ZHONG Z K, WU S C, et al. Comparison of heavy metal phytoremediation in monoculture and intercropping systems of Phyllostachys praecox and Sedum plumbizincicola in polluted soil[J]. International Journal of Phytoremediation, 2018, 20(5): 490-498. DOI:10.1080/15226514.2017.1374339 |
| [50] |
BRUCE E P. Ground water issue phytoremediation of contaminated soil and groundwater at hazardous waste sizes[J]. Environmental Protection Agency, 2001, 540: 1-36. |
| [51] |
MALIK R N, SYED A, HUSAIN Z. Classification and ordination of vegetation communities of the Lohibehr reserve forest and its surrounding areas, Rawalpindi, Pakistan[J]. Pakistan Journal of Botany, 2006, 38(3): 543-558. |
| [52] |
VERKLEIJ J A C, SCHAT H, SHAW A J. Mechanisms of metal tolerance in higher plants[J]. Heavy Metal Tolerance in Plants Evolutionary Aspects, 1990. |
| [53] |
MCGRATH S P, ZHAO F J. Phytoextraction of metals and metalloids from contaminated soils[J]. Current Opinion in Biotechnology, 2003, 14(3): 277-282. DOI:10.1016/S0958-1669(03)00060-0 |
| [54] |
LIN L J, LUO L, YANG D Y, et al. Effects of intercropping with accumulator on cadmium accumulation of Galinsoga parviflora[J]. Journal of Soil and Water Conservation, 2014, 28(6): 319-324. |
| [55] |
WEN W, ZHAO H, MA J, et al. Efects of mutual intercropping on Pb and Zn accumulation of accumulator plants Rumex nepalensis, Lolium perenne and Trifolium repens[J]. Chemistry and Ecology, 2018, 34(3): 259-271. DOI:10.1080/02757540.2018.1427229 |
 2021, Vol. 40
2021, Vol. 40