汞是毒性最强的重金属元素之一,可通过食物链富集到很高浓度,严重威胁人体健康[1]。膳食汞,尤其是甲基汞,可导致欧盟国家每年80万~180万新生儿智力受损以及我国新生儿智商平均下降0.146,并与男性罹患不育症密切相关[2-3]。2014年发布的《全国土壤污染状况调查公报》显示我国农业土壤中汞的点位超标率为1.6%。土壤中高含量的汞容易导致食品中汞超过国家标准规定的粮食汞限量值(GB 2762— 2017),造成食品安全隐患。由于特殊的好厌氧交替、微生物群落结构等条件,无机汞在稻田体系中容易发生甲基化,导致稻田甲基汞的大量形成[4]。和无机汞相比,甲基汞毒性更强,超过60% 的稻米汞是以甲基汞的形式存在[5-6]。近期一项风险评估研究也显示,我国居民暴露的甲基汞有7%~96% 来自于膳食稻米[7-8]。
稻米中的甲基汞主要依赖于水稻根系吸收甲基汞以及甲基汞在水稻体内的向上转运,因此稻田是稻米甲基汞的主要来源。目前修复汞污染土壤的方法包括土壤淋洗、低温热解析、植物修复等,但是这些修复技术存在修复周期长、破坏土壤理化性质等缺点[9-11]。近期的研究表明,土壤中施加钝化剂如硒、含硅材料、无机硫等可以有效降低土壤甲基汞的产生和水稻对甲基汞的蓄积[12-16]。然而硒的安全剂量范围窄,能否大规模推行目前尚不清楚。而无机硫则对土壤甲基汞的产生起着降低和提高的双重作用[14-15]。在水体沉积物中可溶性有机碳和甲基汞产生之间存在正相关关系[17]。生物炭由于其较大的比表面积和丰富的官能团,而被广泛用于重金属污染土壤的修复。稻田土壤施加生物炭显著降低了土壤甲基汞的生物有效性和稻米甲基汞含量[18-19]。WANG等[19]研究发现,生物炭施加降低甲基汞产生及甲基汞有效性的原因在于生物炭中的有机硫化合物。扩展X射线吸收精细结构(EXAFS)光谱显示,还原性有机硫和氧/ 氮基团参与了Hg-(Ⅱ)与土壤中腐殖质的络合作用[20]。有研究显示在硫化物存在的条件下,可溶性有机质增加了微生物汞的甲基化[19]。因此,有机硫在土壤甲基汞产生过程中扮演什么角色,起作用的关键因子是汞与有机硫的络合,还是可溶性有机碳的溶出,亦或是有机硫引起的其他离子的溶出,目前这些问题尚不明确。本研究采用简单的有机硫(谷胱甘肽),研究了有机硫施加对稻田土壤甲基汞产生及有效性的影响,并对有机硫影响甲基汞产生和有效性的关键因子进行了探讨。
1 材料与方法 1.1 土壤采集因早期民间无序混汞冶炼活动,福建省泉州市某企业周边的稻田土壤汞含量达到(15.658±12.726) mg·kg-1,严重超过《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)中汞的风险管制值[21]。试验土壤采自泉州市某企业周边稻田表层土壤。土样经充分混合、风干过筛后,测定土壤基本理化性质以及土壤中总汞、甲基汞含量。试验土壤pH 6.37,总汞和甲基汞含量分别为(18.34±2.63)mg· kg-1和(3.21±0.48)μg·kg-1,总硫和有机质含量分别为0.24 g·kg-1和6.54 g·kg-1。
1.2 试验处理早期的研究结果表明,施加0.5%(m/m)的生物炭显著降低了稻田土壤中甲基汞的产生、甲基汞的生物有效性和甲基汞在稻米中的蓄积量(82%~87%)[18-19]。万山汞矿区周边污染土壤中硫含量为8~767 mg· kg-1[22],其他汞矿区周边土壤中硫含量介于1 100~37 400 mg·kg-1[23-24]。基于此,本研究中还原型谷胱甘肽施用量设置为0、500 mg·kg-1和1 000 mg·kg-1,分别用CK、Low-G和High-G表示。每个处理组设置两个平行。试验具体操作为:称取5 g过2 mm筛的土壤于50 mL离心管中,淹水高度2 cm。为了增加土壤中微生物活动,每个处理组中加入乳酸钠(终浓度为5 mmol·L-1) 作为电子供体[25]。所有处理组放置在28 ℃黑暗的培养箱中,试验周期为60 d。考虑到试验第0 d土壤理化性质及甲基汞含量变化不显著,因此分别在第10、30 d和60 d收集土壤样品。土壤样品离心(4 000 r·min-1)10 min,分离上清液和土壤固相,上清液用0.2 μm微孔过滤膜过滤即为土壤溶液,土壤固相冷冻干燥后研磨过100目筛。所有样品保存在-20 ℃备用。
1.3 分析方法试验分析指标包括土壤pH、总汞、甲基汞、土壤溶液甲基汞、铁、锰、可溶性有机碳(DOC)等。土壤总汞采用电感耦合等离子体质谱测定(ICP-MS,Nex⁃ ION300X,Perkin Elmer,USA)。土壤pH采用pH计在室温下测定(土∶水=1∶2.5)(HACH,USA)。土壤溶液中铁和锰含量采用电感耦合等离子体质谱测定(ICP-MS,NexION300X,Perkin Elmer,USA)。土壤溶液中可溶性有机碳采用总有机碳分析仪测定(Vario Max Cube,Elementar)。土壤中总硫含量采用元素分析仪测定(EA3100,Euro Vector,Italy)。土壤中甲基汞含量用氢氧化钾-甲醇提取后采用气相色谱分离冷原子荧光测定(GC-CVAFS,Brooks Rand MERX,USA)。为保证试验的准确性,在测定总汞和甲基汞的过程中加入标准物质[GBW07405(GSS-5)和ERMCC80,欧洲IRMM],标准物质中汞的回收率为90%~ 108%。
1.4 数据分析试验数据分析、统计和作图采用的软件为SPSS 19.0、Origin 8.5和Sigma plot 12.5。差异显著性分析采用LSD法,差异显著水平为5%。
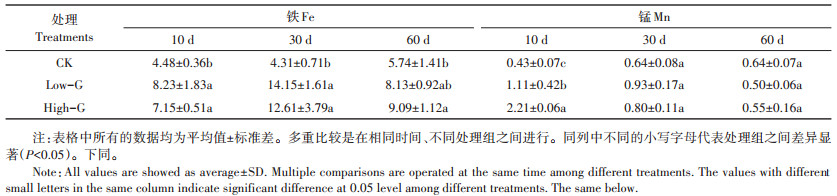
2 结果与分析 2.1 谷胱甘肽对土壤溶液铁和锰含量的影响不同时间段采集的土壤溶液中铁和锰的含量见表 1。从整个模拟试验周期看,土壤溶液中铁含量表现出先升高后降低的趋势,在模拟试验第30 d增加,到第60 d下降。培养试验第60 d土壤溶液中铁含量与第10 d没有显著差异。和CK组相比,模拟试验第10、30 d和60 d,谷胱甘肽施加均提高了土壤溶液中铁的含量。在试验第10 d,Low-G和High-G处理土壤溶液中铁的增加率分别为83.71%和59.60%;第30 d和60 d,两个处理中铁的增加率分别为228.31%、192.58% 和41.64%、58.36%。因此,谷胱甘肽施加促进了土壤中铁的溶出,其施用量对铁溶出的影响不显著。
|
|
表 1 土壤溶液中铁和锰的含量(mg·L-1) Table 1 Fe and Mn contents in soil solution(mg·L-1) |
在第10 d和第30 d,谷胱甘肽添加促进了土壤溶液中锰的溶出,但只是在第10 d土壤溶液中锰含量呈现显著差异。和CK组相比,第60 d谷胱甘肽施加反而降低了土壤溶液中锰的含量,但差异不显著。因此,谷胱甘肽施加在土壤培养前期显著促进了土壤中锰的溶出,随着培养时间的增加,谷胱甘肽施加降低了土壤溶液中锰含量,但是影响不显著。
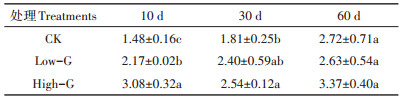
2.2 谷胱甘肽对土壤可溶性有机碳含量的影响不同时间段采集的土壤溶液中可溶性有机碳的含量见表 2。从表 2可以看出,CK组和Low-G组中,随着培养时间的延长,土壤中可溶性有机碳含量呈现增加的趋势。和CK组相比,第10 d两个谷胱甘肽施加处理都显著增加了可溶性有机碳的含量。但是在第30 d和第60 d,谷胱甘肽的施加对可溶性有机碳的含量影响不显著。综上,谷胱甘肽在试验前期显著提高了可溶性有机碳的含量,且随着谷胱甘肽施用量的增加,可溶性有机碳的含量增高;但在试验后期,谷胱甘肽施加对土壤溶液中有机碳含量影响不显著。
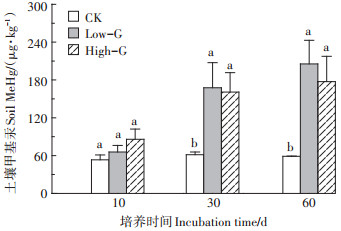
2.3 谷胱甘肽施加对土壤固相中甲基汞含量的影响图 1表示在土壤模拟试验不同时间段,谷胱甘肽施加对土壤固相甲基汞含量的影响。从图 1可以看出,在土壤培养的第10 d,两个浓度的谷胱甘肽提高了土壤固相中甲基汞的含量,但是差异不显著。第30 d和60 d,两个浓度的谷胱甘肽都显著提高了土壤中甲基汞的含量。在土壤培养的后期,谷胱甘肽添加对土壤甲基汞的增加率为87.36%~212.48%。尽管谷胱甘肽施加增加了土壤固相甲基汞含量,但施加量对土壤固相甲基汞含量的影响不显著。
|
|
表 2 土壤可溶性有机碳(mg·L-1) Table 2 DOC contents in soil solution(mg·L-1) |
|
图中不同小写字母表示同一时间不同处理组之间差异显著(P<0.05)。下同 Different lowercase letters show significant differences at 0.05 levels in different treatments. The same below 图 1 谷胱甘肽施加对土壤甲基汞含量的影响 Figure 1 Content of methylmercury in soil treated with glutathione |
图 2表示谷胱甘肽施加对土壤中甲基汞有效性的影响。从图 2可以看出,在土壤培养的第30 d和60 d,两个浓度的谷胱甘肽显著提高了土壤溶液中甲基汞的含量,这和土壤固相甲基汞含量变化规律一致。土壤溶液中甲基汞的含量与谷胱甘肽的施用量关系不显著。在土壤培养的第30 d和第60 d,两个浓度的谷胱甘肽对土壤溶液中甲基汞含量的增加率分别为4 380%、5 346.83%和5 388%、5 890.30%。因此,谷胱甘肽施加显著促进了土壤中甲基汞的溶出,但随着试验时间的延长,土壤溶液中甲基汞含量没有显著提高。

|
图 2 有机硫施加对土壤溶液甲基汞含量的影响 Figure 2 Content of methylmercury in soil solution treated with organic sulfur |
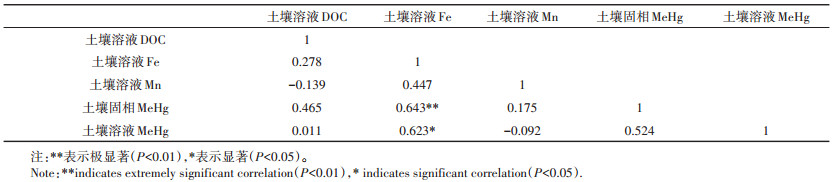
表 3为谷胱甘肽添加后,土壤溶液中铁、锰、有机碳、甲基汞含量及土壤固相中甲基汞之间的相关性分析结果。从表 3可以看出,土壤溶液中可溶性有机碳与土壤溶液中铁、锰、甲基汞及土壤固相中甲基汞之间均不存在显著相关性。但是土壤溶液中铁与土壤固相、土壤溶液中甲基汞之间存在显著的正相关关系。此外,土壤固相中的甲基汞与土壤溶液中甲基汞之间也存在正相关关系。
|
|
表 3 有机硫施加后土壤溶液中铁、锰、DOC、土壤甲基汞以及土壤溶液甲基汞之间的相关性分析 Table 3 Correlation analysis between Fe, Mn, DOC, MeHg in soil solution and MeHg in soil after organic sulfur application |
本研究发现和CK组相比,第30 d和第60 d两个剂量的谷胱甘肽施加显著提高了土壤固相和土壤溶液甲基汞含量,土壤固相中甲基汞的提高率为87.36%~212.48%,土壤溶液中甲基汞的提高率为4 380%~5 890.30%。因此简单的有机硫化合物添加促进了土壤汞的甲基化和甲基汞的有效性。根据路易斯酸碱理论,汞属于路易斯软酸,易于与路易斯软碱如巯基结合,因此汞与有机硫化合物的络合作用可以影响土壤中无机汞的形态。稻田土壤中甲基汞的产生取决于无机汞的形态。不同形态的无机汞甲基化能力不同,具体为β-HgS<α-HgS<FeS-HgⅡ<NOMHgⅡ<Hg(NO3)2(aq)[25]。GU等[26]研究发现,还原型的腐植酸对无机汞起着氧化和还原的双重作用,该作用主要取决于还原型腐植酸的浓度。SHU等[18]研究发现,生物炭中类似于二苯并噻吩(Dibenzothiophene) 的比例占到23%,硫主要以无机硫类似于硫酸盐的形式存在[18]。他们发现生物炭降低甲基汞产生及生物有效性的原因在于生物炭中的有机硫化合物与汞之间的络合作用。载硫生物炭被认为是一种优良的土壤汞钝化材料[27]。有机质可以促进硫化汞的溶出,且芳香度越高溶出作用越强。而无机离子(如氯离子、硫酸根以及S2-)和有机酸(乙酸、EDTA和半胱氨酸)无法促进硫化汞的溶出[28]。也有研究表明有机质促进汞甲基化的一个很重要原因在于可溶性有机质阻止了硫化汞的聚集,促进了小颗粒硫化汞的形成[19]。本研究结果显示土壤固相和溶液中甲基汞的含量与土壤中可溶性有机碳的含量呈正相关,有机硫化合物添加显著促进了土壤中甲基汞的产生和甲基汞的有效性,这与早期的研究结果一致。
3.2 土壤中铁、锰溶出对土壤甲基汞产生及甲基汞有效性的影响本研究发现有机硫施加促进了土壤中铁、锰尤其是铁的溶出。淹水条件利于土壤中硫转化为S2-,而S2-被报道能够将Fe3+还原为Fe2+,将MnO2还原为Mn2+[29],因此有机硫的施加提高了土壤溶液中铁、锰含量。早期的研究显示铁盐添加降低了底泥中甲基汞的产生,这是因为多硫铁化合物的存在影响了体系中中性可溶性汞硫络合物如HgS0和Hg(HS)20[30-31]的形成。也有研究发现汞甲基化与介质中铁的浓度密切相关,低浓度的铁能够促进汞甲基化,而随着铁浓度的增加,汞甲基化率反而降低[32]。这说明土壤中铁浓度是影响无机汞甲基化的一个重要因子。硫化汞是土壤中重要的汞存在形态,硫化汞的溶出也与铁的浓度密切相关。Fe3+作为氧化剂,可以催化硫化汞转化为可溶性的Hg2+[33]。相关性分析结果表明,土壤固相和溶液中甲基汞均与土壤溶液中铁之间存在显著正相关关系。逐步回归得到如下回归模型:土壤固相甲基汞=19.550+11.598[Fe],R2=0.414,F=0.004;土壤溶液甲基汞=-3.712+0.947[Fe],R2=0.388,F=0.03。上述结果说明土壤中铁的溶出是影响土壤甲基汞含量及有效性的一个关键因子。
4 结论(1) 稻田土壤施加有机硫显著提高了土壤中铁、锰的溶出,以及土壤中可溶性有机碳的含量。
(2) 培养初期(10 d)有机硫施加对土壤中甲基汞的影响不显著。随着时间的延长,有机硫施加显著提高了土壤中甲基汞的产生以及甲基汞的溶出。
(3) 有机硫施加不仅可以通过络合作用影响无机汞的形态,还可以通过影响土壤中铁、锰等离子的溶出影响甲基汞的产生及有效性,且土壤中铁的溶出是影响汞甲基化的关键因子。
| [1] |
JIANG G B, SHI J B, FENG X B. Mercury pollution in China[J]. Environment Science & Technology, 2006, 40(12): 3672-3678. |
| [2] |
CHEN L, LIANG S, LIU M, et al. Trans-provincial health impacts of atmospheric mercury emissions in China[J]. Nature Communications, 2019, 10(1): 1484. DOI:10.1038/s41467-019-09080-6 |
| [3] |
王登强, 林丽颖, 冷旭媚, 等. 金属汞对男性生殖系统的影响[J]. 中国工业医学杂志, 2010, 23(2): 122-123. WANG D Q, LIN L Y, LENG X M, et al. Effect of mercury on male reproductive system[J]. Chinese Journal of Industrial Medicine, 2010, 23(2): 122-123. |
| [4] |
GILMOUR C C, PODAR M, BULLOCK A L, et al. Mercury methylation by novel microorganisms from new environments[J]. Environmental Science & Technology, 2013, 47(20): 11810-11820. |
| [5] |
ZHAO J T, LI Y F, LI Y Y, et al. Selenium modulates mercury uptake and distribution in rice(Oryza sativa L.), in correlation with mercury species and exposure level[J]. Metallomics, 2014, 6(10): 1951-1957. DOI:10.1039/C4MT00170B |
| [6] |
WANG Y J, DANG F, EVANS R D, et al. Mechanistic understanding of MeHg-Se antagonism in soil-rice systems: The key role of antagonism in soil[J]. Scientific Report, 2016, 6: 19477. DOI:10.1038/srep19477 |
| [7] |
GONG Y, NUNES L M, GREENFIELD B K, et al. Bioaccessibility-corrected risk assessment of urban dietary methylmercury exposure via fish and rice consumption in China[J]. Science of the Total Environment, 2018, 630: 222-230. DOI:10.1016/j.scitotenv.2018.02.224 |
| [8] |
ZHANG H, FENG X, LARSSEN T, et al. In inland China, rice, rather than fish, is the major pathway for methylmercury exposure[J]. Environment Health Perspectives, 2010, 118: 1183-1188. DOI:10.1289/ehp.1001915 |
| [9] |
赖莉. 低温热解法修复贵州清镇地区汞重污染土壤[D]. 贵阳: 贵州师范大学, 2008. LAI L. Remediation of mercury-contaminated soils by using low temperature thermal desorption in Qingzhen, Guizhou master thesis[D]. Guiyang: Guizhou Normal University, 2008. |
| [10] |
邱蓉, 张军方, 董泽琴, 等. 汞污染农田土壤低温热解处理性能研究[J]. 环境科学与技术, 2014, 37(1): 48-52. QIU R, ZHANG J F, DONG Z Q, et al. Low-temperature thermal desorption of farmland soil contaminated by mercury[J]. Environmental Science & Technology, 2014, 37(1): 48-52. |
| [11] |
龙育堂, 熊建平. 苎麻对稻田土壤汞净化效果研究[J]. 农业环境保护, 1994, 13(1): 30-33. LONG Y T, XIONG J P. Study on the removal efficiency of mercury in paddy soil using Boehmeria nivea(L.) Gaudich[J]. Agro-environmental Protection, 1994, 13(1): 30-33. |
| [12] |
LI Y F, ZHAO J T, LI Y Y, et al. The concentration of selenium matters: A field study on mercury accumulation in rice by selenite treatment in Qingzhen, Guizhou, China[J]. Plant and Soil, 2015, 391: 195-205. DOI:10.1007/s11104-015-2418-4 |
| [13] |
LI Y Y, ZHU N L, LIANG X J, et al. Silica nanoparticles alleviate mercury toxicity via immobilization and inactivation of Hg(Ⅱ)in soybean(Glycine max)[J]. Environmental Science: Nano, 2020, 7(2): 1807-1817. |
| [14] |
LI Y Y, LI H L, YU Y, et al. Thiosulfate amendment reduces mercury accumulation in rice(Oryza sativa L.)[J]. Plant and Soil, 2018, 430: 413-422. DOI:10.1007/s11104-018-3726-2 |
| [15] |
LI Y Y, ZHAO J T, ZHONG H, et al. Understanding enhanced microbial MeHg production in mining-contaminated paddy soils under sulfate amendment: Changes in Hg mobility or microbial methylators[J]. Environmental Science & Technology, 2019, 53(4): 1844-1852. |
| [16] |
LI Y Y, HU W J, ZHAO J T, et al. Selenium decreases methylmercury and increases nutritional elements in rice growing in mercury-contaminated farmland[J]. Ecotoxicology and Environmental Safety, 2019, 182: 109447. DOI:10.1016/j.ecoenv.2019.109447 |
| [17] |
GRAHAM A M, ALIKEN G R, GILMOUR C C. Dissolved organic matter enhances microbial mercury methylation under sulfidic conditions[J]. Environmental Science & Technology, 2012, 46(5): 2715-2723. |
| [18] |
SHU R, WANG Y J, ZHONG H. Biochar amendment reduced methylmercury accumulation in rice plants[J]. Journal of Hazard Materials, 2016, 313: 1-8. DOI:10.1016/j.jhazmat.2016.03.080 |
| [19] |
WANG Y J, DANG F, ZHENG X, et al. Biochar amendment to further reduce methylmercury accumulation in rice grown in selenium-amended paddy soil[J]. Journal of Hazard Materials, 2019, 365: 590-596. DOI:10.1016/j.jhazmat.2018.11.052 |
| [20] |
SKYLLBERG U, BLOOM P R, QIAN J, et al. Complexation of mercury(Ⅱ)in soil organic matter: EXAFS evidence for linear two-coordination with reduced sulfur groups[J]. Environmental Science & Technology, 2006, 40(13): 4174-4180. |
| [21] |
乔胜英, 刘江, 胡方泱, 等. 福建省德化县金矿区民间冶炼活动相关的土壤与大气汞污染特征[J]. 地质科技情报, 2017, 36(5): 216-221. QIAO S Y, LIU J, HU F Y, et al. Artisanal gold mining related mercury pollution in soils and atmosphere in mountains in Dehua County, Fujian Province[J]. Geological Science and Technology Information, 2017, 36(5): 216-221. |
| [22] |
YAN L, LARSSEN T, VOGT R D, et al. Identification of fractions of mercury in water, soil and sediment from a typical Hg mining area in Wanshan, Guizhou Province, China[J]. Applied Geochemistry, 2010, 25(1): 60-68. DOI:10.1016/j.apgeochem.2009.10.001 |
| [23] |
SIERA C, SAIZ J R A, GALLEGO J L R. Nanofiltration of acid mine drainage in abandoned mercury mining area[J]. Water, Air, & Soil Pollution, 2013, 224(10): 1-12. DOI:10.1007/s11270-013-1734-7 |
| [24] |
GARCIA-ORDIALES E, ESBRI J M, COVELLI S, et al. Heavy metal contamination in sediments of an artificial reservoir impacted by longterm mining activity in the Almaden mercury district(Spain)[J]. Environmental Science and Pollution Research, 2016, 23(7): 6024-6038. DOI:10.1007/s11356-015-4770-6 |
| [25] |
JONSSON S, SKYLLBERG U, NLSSON M B, et al. Mercury methylation rates for geochemically relevant Hg(Ⅱ)species in sediments[J]. Environmental Science & Technology, 2012, 46(21): 11653-11659. |
| [26] |
GU B H, BIAN Y R, MILLER C L, et al. Mercury reduction and complexation by natural organic matter in anoxic environments[J]. Proceedings of the National Academy of Sciences, India, 2011, 108(4): 1479-1483. DOI:10.1073/pnas.1008747108 |
| [27] |
CONNOR D, PENG T Y, LI G H, et al. Sulfur-modified rice husk biochar: A green method for the remediation of mercury contaminated soil[J]. Science of the Total Environment, 2018, 621: 819-826. DOI:10.1016/j.scitotenv.2017.11.213 |
| [28] |
RAVICHANDRAN M, AIKEN G R, REDDY M M, et al. Enhanced dissolution of cinnabar(mercuric sulfide)by dissolved organic matter isolated from the Florida Everglades[J]. Environmental Science & Technology, 1998, 32(21): 3305-3311. |
| [29] |
HU Z Y, ZHU Y G, LI M, et al. Sulfur(S)-induced enhancement of iron plaque formation in the rhizosphere reduces arsenic accumulation in rice(Oryza sativa L.)seedlings[J]. Environmental Pollution, 2007, 147: 387-393. DOI:10.1016/j.envpol.2006.06.014 |
| [30] |
MEHROTAR A S, SEDLAK D L. Decrease in net mercury methylation rates following iron amendment to anoxic wetland sediment slurries[J]. Environmental Science & Technology, 2005, 39(8): 2564-2570. |
| [31] |
MEHROTAR A S, HORNE A J, SEDLAK D L. Reduction of net mercury methylation by iron in Desulfobulbus propionicus(1pr3)cultures: Implications for engineered wetlands[J]. Environmental Science & Technology, 2003, 37(13): 3018-3023. |
| [32] |
钟顺清, 仇广乐, 冯新斌. 铁硫耦合影响甲基汞在土壤-水稻系统中迁移转化的研究进展[J]. 生态学杂志, 2017, 36(8): 2351-2357. ZHONG S Q, QIU G L, FENG X B. Coupling of iron and sulfur on the migration and transformation of methylmercury in soilrice system: A review[J]. Journal of Ecology, 2017, 36(8): 2351-2357. |
| [33] |
WANG Y J, YANG Y J, LI D P, et al. Bioxidative dissolution of cinnabar by iron-oxidizing bacteria[J]. Biochemical Engineering Journal, 2013, 74: 102-106. DOI:10.1016/j.bej.2013.02.013 |
 2021, Vol. 40
2021, Vol. 40