受建库筑坝等水利工程与气候变化的双重影响,河湖水系水文自然过程发生了显著变化,导致河流生态基流减少甚至断流,河湖之间的水文连通过程受阻。据估计,全球有50% 的河流因水文连通受阻导致河流流量不足,水面面积萎缩,且面临生境破碎化风险[1]。同时,水文连通关系的减弱直接干扰了水体中物质、能量和生物的迁移交换过程,最终影响水生生物群落结构及生物多样性[2]。浮游植物作为水生生态系统初级生产者,具有个体小、生活周期短等特点,且基本无自主游动能力,易随水漂流,其群落结构对水文连通强度尤为敏感[3-4],水文连通强弱对浮游植物群落结构极具重要性。
目前研究水文连通对浮游植物的影响多从河湖、河漫滩及湖-湖间等横向和纵向连通角度考察浮游植物群落结构变化及识别关键水环境因子。有研究表明,漫滩中水文连通变化会影响浮游植物物种组成、丰富度、生物多样性及相似性,如DESCY等[5]发现浮游植物物种组成随河流主干道、支流和湖泊连通性改变而变化,其中高连通性时绿藻是主河道、支流和湖泊的优势物种,而低连通性时硅藻为主河道优势物种,隐藻和蓝藻为支流与湖泊的优势物种;CHAPARRO等[6]调查发现奥地利多瑙河河漫滩浮游植物物种丰度在高连通时期显著高于低连通时期;YUAN等[7]研究发现水文连通性使相互连接的湖泊间浮游植物群落相似性增强;MENG等[8]研究发现高连通时期浮游植物Alpha多样性指数显著高于低连通时期。而纵向连通变化也会对河湖水系水动力过程和水体营养物质输移产生影响,进而改变浮游植物群落物种组成、生物量及丰富度。有许多研究探讨了河流水动力指标与浮游植物群落特征的关系,但观点有些差异,如燕文明等[9]研究发现缓流水体中浮游植物优势种的物种丰度与水体流速呈正相关关系;DAS等[10]则发现浮游植物物种丰度与河流流速呈负相关关系;李亚军等[11]进一步研究发现水体流速与浮游植物物种丰度间存在单峰关系,且存在浮游植物生长的最优流量区间;龙天渝等[12]通过构建藻类生长与流域的二维非稳态藻类生长动力学模型,证实水体流速与浮游植物物种丰度间存在单峰关系,且以嘉陵江重庆主城段为例,其流速在0.04 m·s-1时最有利于藻类生长繁殖;也有研究集中关注水体营养物质输移对浮游植物群落结构产生的影响,但目前尚未统一的结论,如GINDERS等[13]认为溶解活性磷(PO4-P)、水温、电导率和溶解氧(DO)等是影响浮游植物物种丰度和生物量的关键因子。MORESCO等[14]则发现COD、电导率和NH4+-N为影响隐藻、裸藻、甲藻的关键因子,而对绿藻影响较小。目前关于白洋淀研究多利用浮游植物进行水质评价[15-16]或仅关注白洋淀淀区浮游植物与环境因子的相关关系[17-18],而忽略白洋淀流域纵向连通条件下水文水质对河湖水系浮游植物的影响,尤其是流速、水文连通强度等因素,会直接或间接改变浮游植物群落的密度和被动扩散等,但目前影响程度并不清楚。
本文以白洋淀流域河湖水系为研究对象,通过野外调查、室内检测、多元统计等方法,分析流域河湖水文连通对浮游植物物种生物量、丰度及生物多样性的影响,探究不同连通性河段的浮游植物相似性,揭示影响浮游植物群落分布的关键水文水质因子,为白洋淀流域水生态环境修复及管理部门科学决策提供科学支撑。
1 材料与方法 1.1 研究区概况白洋淀流域地处海河流域中部,横跨河北、山西、北京3个省市,地理位置为38°7′43″~39°39′56″N,119°10′50″~116°8′51″E。流域地势西北高东南低,自西向东呈现山脉-丘陵-洼淀区的地貌。由于白洋淀流域上游修建水库总库容(3.62×109 m3)超过流域多年(1956—2005年)平均径流量2.366×109 m3,近年来白洋淀及其入淀河流多依赖人工补水来保障其生态需水,且白洋淀入淀河流中只有孝义河、府河、白沟引河常年有水(图 1)。
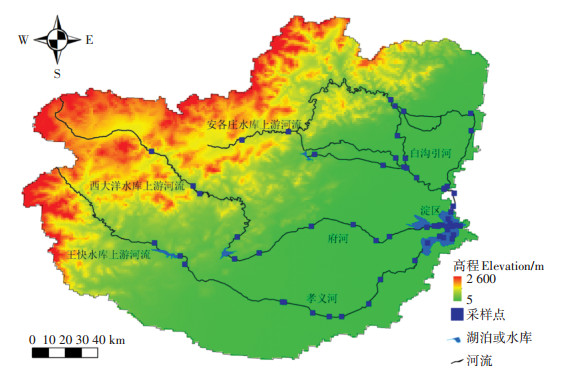
|
图 1 白洋淀流域上游河流、入淀河流及淀区采样点分布图 Figure 1 Location of rivers, reservoirs and Baiyangdian Lake sampling sites in the Baiyangdian Basin |
白洋淀大部分入淀河流季节性断流,多依赖上游水库泄水,近些年来王快水库、西大洋水库等多于冬季和春季进行下泄。考虑到有水河段浮游植物群落构建需要一定时间,本研究在2019年6月27日至7月4日进行浮游植物采样工作。在王快、西大洋、安各庄水库上游河流、府河、孝义河、白沟引河入淀河流及淀区共布设54个采样点,采集浮游植物样品及水样,采样点分布见图 1。水化学指标和浮游植物样品采集分别参照《水环境监测规范》(SL 219—2013)和《内陆水域浮游植物监测技术规程》(SL 733—2016)进行。采样期间所有河流、湖泊水深均在1~5 m,故在水面下0.5 m处进行采样。每个样点分别取3个平行样品。将采集得到的定性和定量浮游植物样品加入1%水样体积的鲁哥试剂进行固定,随后送至实验室进行物种种类和数目鉴定。
参照《中国淡水藻类——系统、分类及生态》[19]、《高级水生生物学》[20]进行浮游植物物种鉴定,采用光学显微镜(BM2000)对浮游植物定量样品进行细胞计数和体积测量[21],每个样品计数3次取平均值。其生物量测定参照《内陆水域浮游植物监测技术规程》(SL 733—2016)将浮游植物细胞体积换算成生物量(mg·L-1,湿质量)。使用多参数水质仪(YSI Pro Plus,美国YSI公司)测定水温(T)、溶解氧(DO)、pH;透明度(SD)采用塞氏盘法进行测定,水深(Depth)利用便携式标尺进行测量;流速采用LS1206B便携式流速测算仪进行测定,若遇到采样点附近存在闸口,则统一选闸口下游水流平稳区域进行测定;同时在每个站点采集1 L地表水水样,送至实验室进行水质指标的检验,指标包括COD(HJ 828—2017)、氨氮(HJ 665— 2013)、总磷(GB 11893—1989)、总氮(GB 11894— 1989)、磷酸盐(HJ 670—2013)。
1.3 水文连通强度计算采用单位距离内闸坝数量的倒数表征水文连通强度[22](公式1),并计算不同河段区域的连通性强度指数(LoC)。
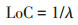
|
(1) |
式中:λ 为百公里河道内闸坝个数。LoC数值越大,连通程度越好。
1.4 统计分析利用Mcnaugton优势度指数(Y)确定优势种,计算公式如下:
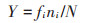
|
(2) |
式中:fi为第i 种浮游植物在各样点出现的频率;ni为第i 种浮游植物个体数;N 为浮游植物总个体数。当Y > 0.02时,认为该物种为优势种群。
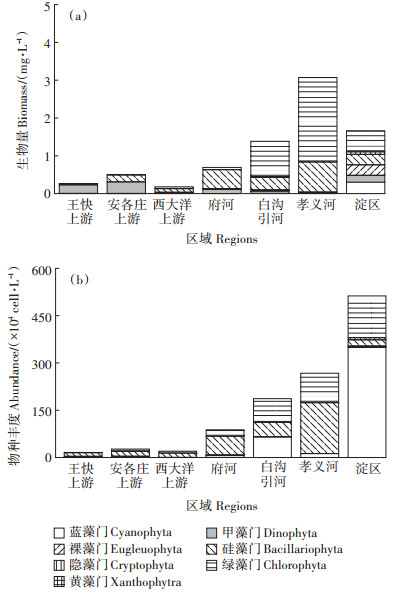
选用Shannon-Wiener指数(H ′)[23]、Pielou指数(J)[24]评估浮游植物群落多样性,计算公式如下:
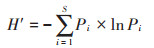
|
(3) |
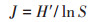
|
(4) |
式中:Pi为浮游植物第i 种占整个浮游植物个体数的比例;S 为浮游植物物种数。
利用SPSS 22.0对白洋淀流域浮游植物物种丰度、生物量及多样性指数进行单因素方差分析,判断其空间分布差异。采用非度量多维尺度分析(Nonmetric multidimensional scaling,NMDS)和相似性检验(Analysis of similarities,ANOSIM)对白洋淀流域浮游植物群落进行分析,确定白洋淀流域浮游植物相似性及显著性。对不同区域间浮游植物优势种与水环境因子进行冗余分析(Redundancy analysis,RDA),确定影响不同区域间浮游植物优势种的关键水环境因子。
2 结果与分析 2.1 白洋淀流域河湖水系水文连通强度的空间差异在本次采样期间,白洋淀流域不同典型河段的实测流速如图 2a所示,安各庄水库上游河流流速最大,均值为1.29 m·s-1,其次为西大洋水库上游河流(0.61 m·s-1)。进一步计算了白洋淀流域7个典型河段的纵向连通性指数(LoC),LoC指数在0.06~0.84波动(图 2b),其中LoC指数最高的是王快水库上游河流(0.84),其次是西大洋水库上游河流(0.44)、安各庄水库上游河流(0.24)和淀区(0.17),而府河、白沟引河、孝义河的连通性系数较低,在0.06~0.08范围内。
|
图 2 白洋淀流域不同区域流速及水文连通性指数分布图 Figure 2 Flow rate and longitudinal connectivity index in the Baiyangdian Basin |
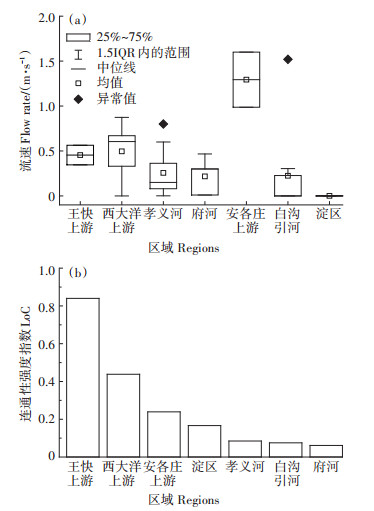
进一步分析了白洋淀流域河湖水系水化学指标变化(图 3)。COD在府河最大,为(36.20±14.18)mg· L-1,王快上游河流COD含量最小,为(4.90±0.21)mg· L-1。7个区域内氨氮均值在0~1.51 mg·L-1波动,其中府河氨氮含量最高,为(1.51±1.48)mg·L-1。总磷、磷酸盐在府河均最高,分别为(0.39±0.31)、(0.27±0.17)mg·L-1。总氮含量均值在0.24~6.09 mg·L-1波动,其中府河总氮值最高为9.98 mg·L-1。
|
图 3 白洋淀流域水化学指标变化 Figure 3 Change in main water quality index in the Baiyangdian Basin |
本次调查共发现浮游植物7门51属96种,其中绿藻门种类最多,有17属41种,其次是硅藻门(17属28种)和蓝藻门(9属12种),黄藻门占比最少,只有1属1种,且仅出现在白洋淀淀区。各个区域的浮游植物种类数也存在较大差异,淀区采集到的浮游植物物种数最多(68种),而安各庄水库上游河流仅发现19种。7个区域内的浮游植物种类组成不同,在王快、安各庄和西大洋水库上游河流和府河4个区域,硅藻门为主要优势门类,占比分别为54.55%、57.89%、51.72%和50.00%,而在白沟引河、孝义河、白洋淀淀区3个区域则以绿藻门为主要优势门类,占比分别为45.28%、45.24%和50.00%(图 4)。7个区域以小环藻(Cyclotella sp.)、尖针杆藻(Synedra acus)、舟形藻(Navicula sp.)、近缘桥弯藻(Cymbella affinis)、扁圆卵形藻(Cocconeis placentula)、菱形藻(Nitzschia sp.)、四尾栅藻(Scenedesmus quadricauda)、微小平裂藻(Merismopedia tenuissima)、小席藻(Phormidium tenus)、小颤藻(Oscillatoria tenuis)、类颤鱼腥藻(Anabaena osdllarioides)、卷曲长孢藻(Anabaena circinalis)、顶锥十字藻(Crucigenia apiculata)为主要的优势物种。

|
图 4 白洋淀流域浮游植物种类组成及占比 Figure 4 Species composition and proportion of each phytoplankton taxonomy in the Baiyangdian Basin |
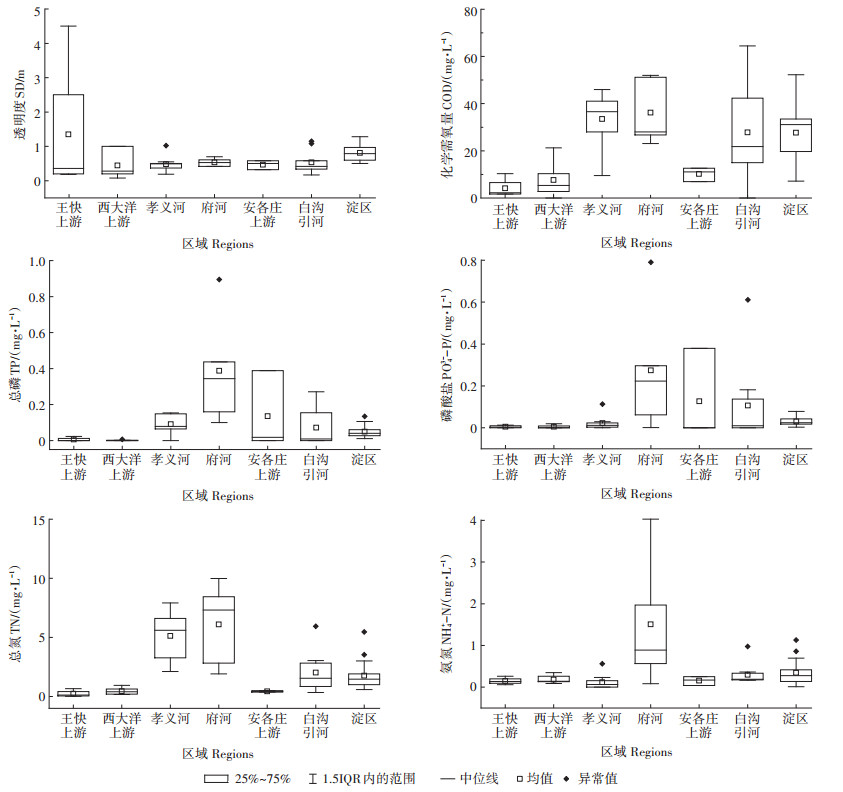
调查获得的浮游植物生物量(图 5a)呈现西大洋水库上游河流 < 王快水库上游河流 < 安各庄水库上游河流 < 府河 < 白沟引河 < 淀区 < 孝义河趋势,生物量最高值(7.43 mg·L-1)点出现在孝义河,生物量最低值(0.03 mg·L-1)点出现在西大洋水库上游河流;西大洋水库上游河流生物量均值最小为0.30 mg·L-1,孝义河生物量均值最大为3.07 mg·L-1。王快水库上游河流和安各庄水库上游河流生物量构成以甲藻门为主,分别占总生物量的84.78%和63.75%,而西大洋水库上游河流和府河硅藻门占生物量的63.52%和72.33%,白沟引河和孝义河生物量构成以绿藻门为主,分别占67.94% 和72.79%,淀区绿藻门占33.27%,其次为蓝藻门(18.02%)、硅藻门(16.75%)、裸藻门(16.71%)。
|
图 5 白洋淀流域不同区域浮游植物物种生物量及丰度 Figure 5 Variation of phytoplankton biomass and abundance in the Baiyangdian Basin |
浮游植物平均物种丰度(图 5b)为2.60×106 cell· L-1,王快水库上游河流平均物种丰度最低(1.62×105 cell·L-1),物种丰度最低值点出现在西大洋水库上游(6.71×104 cell·L-1),白洋淀淀区平均物种丰度为5.13× 106 cell·L-1,物种丰度最高值点出现在白洋淀淀区,为1.37×107 cell·L-1;各个区域物种丰度大小关系为:王快水库上游河流 < 西大洋水库上游河流 < 安各庄水库上游河流 < 府河 < 白沟引河 < 孝义河 < 淀区。王快水库上游河流、安各庄水库上游河流、西大洋水库上游河流、府河、孝义河物种丰度构成以硅藻门为主,分别占总物种丰度的69.81%、56.81%、68.35%、68.10%和60.40%,白沟引河物种丰度构成以绿藻门(39.63%)和蓝藻门(34.53%)为主,其次为硅藻门(24.75%),而淀区物种丰度构成以蓝藻门为主(68.05%),其次为绿藻门(25.83%),硅藻门仅占3.82%。
2.3.3 浮游植物生物多样性特征白洋淀流域浮游植物多样性如图 6所示。7个河湖区段Shannon-Wiener指数均值在2.15~2.85(图 6a),其中孝义河最低,与淀区有显著性差异(P < 0.05)。Pielou指数均值在0.61~0.88(图 6b),其中王快水库上游河流、安各庄水库上游河流、西大洋水库上游河流均与孝义河的Pielou指数有显著性差异(P < 0.05)。

|
图 6 白洋淀流域浮游植物生物多样性 Figure 6 Biodiversity of phytoplankton community in the Baiyangdian Basin |
对白洋淀流域7个区域浮游植物进行NMDS分析(图 7),应力值(Stress)为0.17,其相似性分析达到理想排序水平(Stress=0.20)。NMDS分析结果显示,白洋淀流域浮游植物相似性差异明显,将白洋淀流域浮游植物划分为3个区域:水库上游河流、入淀河流及淀区。3个区域相似性(ANOSIM)检验结果(表 1)表明:水库上游河流、入淀河流及淀区组间差异显著不同于组内差异(N=54,P < 0.01)。图 7中点代表每个区域的点位。浮游植物优势种所在位置距离某点较近,表明该优势物种分布于该点可能性较大。优势种小平裂藻(Merismopedia tenuissima)、四尾栅藻(Scenedesmus quadricauda)分布在入淀河流区域,NMDS2轴-0.08~0,为白沟引河和府河优势物种,小环藻(Cyclotella sp.)、短棘盘星藻(Pediastrum boryanum)分布在入淀河流区域NMDS2轴-0.2~0.3,主要为孝义河优势种。其他优势种则主要分布在淀区。
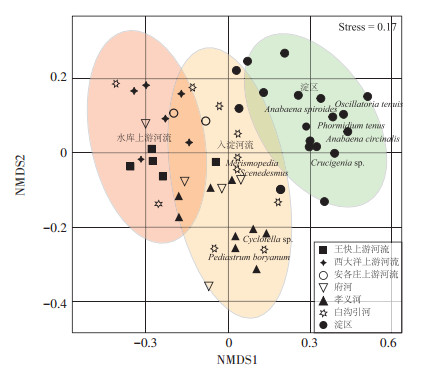
|
图 7 白洋淀流域浮游植物非度量多维标度图 Figure 7 Results of non-metric multidimensional scaling in the Baiyangdian Basin |
|
|
表 1 白洋淀流域3个区域相似性分析(ANOSIM)结果 Table 1 Results of analysis of similarities among three river-lake system in the Baiyangdian Basin |
对白洋淀流域3个典型区域的浮游植物优势物种、水环境因子以及水文连通特征进行了RDA分析,结果如图 8所示。对于流域的水库上游河流,前两个排序轴共解释了浮游植物群落结构总变异的74.69%(图 8a)。结果显示,COD、TP、流速是影响该区域浮游植物优势种群落结构变化的关键环境因子,而影响该区域浮游植物优势物种的关键环境因子存在差异,小环藻(Cyclotella sp.)、舟形藻(Navicula sp.)与COD、Depth、SD、LoC指数呈正相关关系,与流速、NH4+-N呈负相关关系;四尾栅藻(Scenedesmus quadricauda)则主要受水体中DO、T、TP、NH4+-N、PO43--P含量影响,与LoC指数呈负相关关系;近缘桥弯藻(Cymbella affinis)、菱形藻(Nitzschia sp.)、扁圆卵形藻(Cocconeis placentula)与流速、TP、NH4+-N、PO43--P含量正相关,与SD、Depth呈负相关关系;尖针杆藻(Synedra acus)则主要受流速的影响。
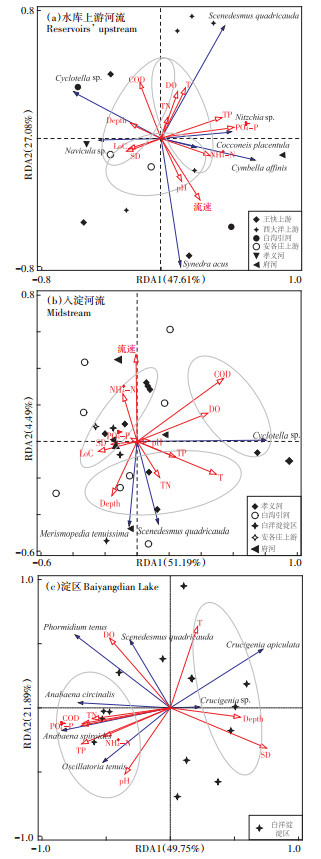
|
图 8 典型区域浮游植物优势物种与水环境因子RDA排序图 Figure 8 RDA ordination among three areas in the Baiyangdian Basin |
对于入淀河流,前两个排序轴共解释了浮游植物群落结构总变异的55.68%(图 8b)。COD、TN、流速是影响该区域浮游植物优势种群落结构变化的关键环境因子,而影响该区域浮游植物优势物种的关键环境因子存在差异,优势物种小平裂藻(Merismopedia tenuissima)、四尾栅藻(Scenedesmus quadricauda)与TN、TP、T、水深均呈正相关关系,而小环藻(Cyclotella sp.)则主要与COD、DO呈现正相关关系。此外,SD、LoC指数、PO43--P、NH4+-N为影响府河、孝义河部分点浮游植物的关键环境因子。
对于淀区,前两个排序轴共解释了浮游植物群落结构总变异的71.74%(图 8c),DO、TP、COD是影响该区域浮游植物优势物种群落结构变化的关键环境因子,而影响区域浮游植物优势物种的关键环境因子存在差异,顶锥十字藻(Crucigenia apiculata)、十字藻(Crucigenia sp.)主要受Depth、T、SD影响,小席藻(Phormidium tenus)与DO呈显著负相关,类颤鱼腥藻(Anabaena osdllarioides)、卷曲长孢藻(Anabaena circinalis)、小颤藻(Oscillatoria tenuis)则主要受COD、TN、PO43--P、TP、NH4+-N的影响。
3 讨论 3.1 水文水动力过程对浮游植物群落的影响机制分析水库、闸坝等直接反映纵向水文连通程度的水工构筑物改变了河湖水系的水动力特征,在一定程度上改变了浮游植物的迁移模式[25-26],阻断了其生物连通[27]。本研究识别出了流速指标对浮游植物群落影响的主要贡献。白洋淀上游为山区地带,水力坡度较大,流速不稳定,浮游植物细胞壁可能会因水流剪切力破碎,光合能力受损,使浮游植物的生长受到抑制[28];而入淀河流因上游水库和闸坝的存在,河流流速远小于上游山区部分,水流较小且相对平稳,氧含量和水体扩散能力达到浮游植物适宜的生长条件,其生物量和物种丰度逐渐上升。此外,不同种类的浮游植物对流速等指标响应有显著差异性,其中,硅藻和蓝藻对水流流速变化较为敏感[11],本研究支撑了这一观点,研究显示夏季硅藻类从上游区的33.33%减少到淀区的14.52%,蓝藻类从11.11% 增加到14.52%。有研究表明水体透明度通过影响浮游植物光合作用而改变其群落组成[29]。本研究显示SD为影响淀区浮游植物优势种的关键环境因子,特别是与顶锥十字藻(Crucigenia apiculata)、十字藻(Crucigenia sp.)相关性最强;对于中游有水河流区域而言,浮游植物也受到SD的影响。
3.2 水系营养物质输移对浮游植物群落的影响机制分析水文连通会影响河湖营养物质输移,进而影响浮游植物群落组成[26, 30-31]。本研究中水库上游TP含量少,而磷元素又是浮游植物种群生长繁殖所必需元素,因此水体中TP含量成为限制该区域夏季浮游植物生物量增加的关键因子。而有水河流区的关键营养物质为COD、TN,在有水河流区流速较为适合,且营养物质元素较为充足,这可能是有水河流区夏季浮游植物大量繁殖的原因[32-33]。淀区的关键营养物质为COD、TP,浮游植物可大量繁殖,但淀区基本为风生流,流速小,浮游植物大量繁殖时需要消耗水体中的氧气[34],因此水体中的DO也成为其关键因子。
不同种类的浮游植物对营养物质的种类反应有差异[35],如顶锥十字藻(Crucigenia apiculata)、十字藻(Crucigenia sp.)主要受Depth、T影响,小席藻(Phormidium tenus)与DO呈显著负相关,类颤鱼腥藻(Anabaena osdllarioides)、卷曲长孢藻(Anabaena circinalis)、小颤藻(Oscillatoria tenuis)则主要受COD、TN、PO43--P、TP、NH4+-N的影响,因此,厘清水文连通对浮游植物影响机制,使浮游植物生长繁殖维持在合理范围内,对于维持生态系统稳定及防止富营养化具有重要意义。
3.3 河湖水系水文连通与生物连通的关系初探防洪、兴修水利等导致白洋淀上游河流修建了大量的闸坝和水库,隔断了河道的纵向连通性,改变了河流自然状态,使相互连接的水生生境发生改变。水文连通是实现生物连通的载体,不同区域的水生生物主动或被动联系必须通过水文连通功能完成,水文连通的下降或阻断势必影响水生生物的生长、繁殖及迁移[36]。因此,完整的水文连通是促进能量及营养物质的循环、保持生境的多样性的前提条件。另一方面,生物连通是水文连通生态属性与功能的集中体现,受影响的生物连通则会对水文功能性连通进行反馈。当水生生物受到水文连通干扰后,其功能性状、种群结构等会发生一定程度的改变,甚至整个食物网结构会随之改变[5, 37],使整个水文连通的生态功能输出发生改变。本文从白洋淀河湖水系纵向连通角度出发,研究其对浮游植物群落的影响,为深入探讨生物连通与水文连通的响应关系及系统量化两者关系奠定了基础。
4 结论(1)白洋淀流域水文连通性指数在0.06~0.84波动,其中王快水库上游河流连通性最好(0.84),府河、白沟引河与孝义河的连通性较差,约为0.06~0.08。
(2)白洋淀流域浮游植物生物量及物种丰度呈现空间差异。其中,孝义河的生物量均值最大(3.07 mg·L-1),西大洋水库上游河流最小(0.30 mg·L-1);白洋淀淀区的物种丰度最大(5.13×106 cell·L-1),王快水库上游河流最小(1.62×105 cell·L-1)。
(3)非度量多维度分析结果表明白洋淀不同连通性河段的夏季浮游植物按相似性分为3个不同区域:水库上游河流、入淀河流、淀区。
(4)影响白洋淀流域各个区域浮游植物优势种群落结构关键水环境因子存在明显差异,其中水库上游河流的浮游植物受COD、TP、流速的影响,入淀河流则受到COD、TN、流速的影响,而淀区的主要影响因子为DO、TP和COD。
| [1] |
BARBAROSSA V, SCHMITT R J P, HUIJBREGTS M A J, et al. Impacts of current and future large dams on the geographic range connectivity of freshwater fish worldwide[J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(7): 3648-3655. DOI:10.1073/pnas.1912776117 |
| [2] |
JACKSON C R, PRINGLE C M. Ecological benefits of reduced hydrologic connectivity in intensively developed landscapes[J]. Bioscience, 2010, 60(1): 37-46. DOI:10.1525/bio.2010.60.1.8 |
| [3] |
BINI L M, LANDEIRO V L, PADIAL A A, et al. Nutrient enrichment is related to two facets of beta diversity for stream invertebrates across the United States[J]. Ecology, 2014, 95(6): 1569-1578. DOI:10.1890/13-0656.1 |
| [4] |
WANG J, ZHANG Z, JOHNSON B. Low flows and downstream decline in phytoplankton contribute to impaired water quality in the lower Minnesota River[J]. Water Research, 2019, 161: 262-273. DOI:10.1016/j.watres.2019.05.090 |
| [5] |
DESCY J P, DARCHAMBEAU F, LAMBERT T, et al. Phytoplankton dynamics in the Congo River[J]. Freshwater Biology, 2017, 62(1): 87-101. DOI:10.1111/fwb.12851 |
| [6] |
CHAPARRO G, HORVATH Z, O'FARRELL I, et al. Plankton metacommunities in floodplain wetlands under contrasting hydrological conditions[J]. Freshwater Biology, 2018, 63(4): 380-391. DOI:10.1111/fwb.13076 |
| [7] |
YUAN Y, JIANG M, LIU X, et al. Environmental variables influencing phytoplankton communities in hydrologically connected aquatic habitats in the Lake Xingkai basin[J]. Ecological Indicators, 2018, 91: 1-12. DOI:10.1016/j.ecolind.2018.03.085 |
| [8] |
MENG F, LI Z, LI L, et al. Phytoplankton alpha diversity indices response the trophic state variation in hydrologically connected aquatic habitats in the Harbin Section of the Songhua River[J]. Scientific Reports, 2020, 10(1): 21337-21337. DOI:10.1038/s41598-020-78300-7 |
| [9] |
燕文明, 钱宝, 杨婷婷, 等. 平水期东洞庭湖主要入湖口藻类群落结构特征对环境因子的响应[J]. 水文, 2020, 40(1): 86-96. YAN W M, QIAN B, YANG T T, et al. Response of community structure characteristics of planktonic algae to environmental factors in main entrances of east Dongting Lake during normal season[J]. Journal of China Hydrology, 2020, 40(1): 86-96. DOI:10.3969/j.issn.1006-009X.2020.01.021 |
| [10] |
DAS SARKAR S, SAHOO A K, GOGOI P, et al. Phytoplankton biomass in relation to flow dynamics: The case of a tropical river Mahanadi, India[J]. Tropical Ecology, 2019, 60(4): 485-494. DOI:10.1007/s42965-019-00048-7 |
| [11] |
李亚军, 张海涛, 肖晶, 等. 筑坝河流水动力条件对浮游植物动态变化的影响[J]. 地球与环境, 2019, 47(6): 857-863. LI Y J, ZHANG H T, XIAO J, et al. Effects of river hydrology on phytoplankton dynamics in dammed rivers[J]. Earth and Environment, 2019, 47(6): 857-863. |
| [12] |
龙天渝, 蒙国湖, 吴磊, 等. 水动力条件对嘉陵江重庆主城段藻类生长影响的数值模拟[J]. 环境科学, 2010, 31(7): 1498-1503. LONG T Y, MENG G H, WU L, et al. Numerical simulation for effects of hydrodynamic condition on algae growth in Chongqing reaches of Jialing River[J]. Environmental Science, 2010, 31(7): 1498-1503. |
| [13] |
GINDERS M A, COLLIER K J, DUGGAN I C, et al. Influence of hydrological connectivity on plankton communities in natural and reconstructed side-arms of a large New Zealand River[J]. River Research and Applications, 2016, 32(8): 1675-1686. DOI:10.1002/rra.3008 |
| [14] |
MORESCO G A, BORTOLINI J C, DIAS J D, et al. Drivers of phytoplankton richness and diversity components in Neotropical floodplain lakes, from small to large spatial scales[J]. Hydrobiologia, 2017, 799(1): 203-215. DOI:10.1007/s10750-017-3214-3 |
| [15] |
王瑜, 刘录三, 舒俭民, 等. 白洋淀浮游植物群落结构与水质评价[J]. 湖泊科学, 2011, 23(4): 575-580. WANG Y, LIU L S, SHU J M, et al. Community structure of phytoplankton and the water quality assessment in Lake Baiyangdian[J]. Journal of Lake Sciences, 2011, 23(4): 575-580. |
| [16] |
金磊, 李林钰, 周杨, 等. 白洋淀三大典型水域浮游植物群落及水质评价[J]. 河北大学学报(自然科学版), 2017, 37(3): 329-336. JIN L, LI L Y, ZHOU Y, et al. Phytoplankton community and water quality analysis of three typical waters in Baiyangdian Lake[J]. Journal of Hebei University(Natural Science Edition), 2017, 37(3): 329-336. DOI:10.3969/j.issn.1000-1565.2017.03.017 |
| [17] |
刘存歧, 孔祥玲, 张治荣, 等. 基于RDA的白洋淀浮游植物群落动态特征分析[J]. 河北大学学报(自然科学版), 2016, 36(3): 278-285. LIU C Q, KONG X L, ZHANG Z R, et al. Dynamics of phytoplankton community in Baiyangdian Lake based on the redundancy analysis(RDA)[J]. Journal of Hebei University(Natural Science Edition), 2016, 36(3): 278-285. DOI:10.3969/j.issn.1000-1565.2016.03.010 |
| [18] |
李娜, 周绪申, 孙博闻, 等. 白洋淀浮游植物群落的时空变化及其与环境因子的关系[J]. 湖泊科学, 2020, 32(3): 772-783. LI N, ZHOU X S, SUN B W, et al. Spatiotemporal variation of phytoplankton community and its relationship with environmental factors in the Lake Baiyangdian[J]. Journal of Lake Sciences, 2020, 32(3): 772-783. |
| [19] |
胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态[M]. 北京: 科学出版社, 2006. HU H J, WEI Y X. The freshwater algae of China systematics, taxonomy and ecology[M]. Beijing: Science Press, 2006. |
| [20] |
刘建康. 高级水生生物学[M]. 北京: 科学出版社, 1999. LIU J K. Advanced aquatic biology[M]. Beijing: Science Press, 1999. |
| [21] |
铁程, 张榆霞, 金玉, 等. 显微镜计数法测定浮游植物的研究进展及修订建议[J]. 中国环境监测, 2018, 34(6): 179-186. TIE C, ZHANG Y X, JIN Y, et al. Research progress and revised recommendations of microscope count method for the enumeration of phytoplankton[J]. Environmental Monitoring in China, 2018, 34(6): 179-186. |
| [22] |
WANG J, ZHANG Z, JOHNSON B. Low flows and downstream decline in phytoplankton contribute to impaired water quality in the lower Minnesota River[J]. Water Research, 2019, 161: 262-273. DOI:10.1016/j.watres.2019.05.090 |
| [23] |
SHANNON C E, WEAVER E. The mathematical theory of communication[M]. Urbana: University of Illinois Press, 1963: 1-144.
|
| [24] |
PIELOU E C. Ecological diversity[M]. New York: Wiley, 1975.
|
| [25] |
KARMAKAR M, LEAVITT P R, PATOINE A. Effects of bridge construction and wastewater effluent on phytoplankton abundance and sediment geochemistry in an Atlantic temperate coastal bay since 1930[J]. Estuaries and Coasts, 2019, 42(2): 365-377. DOI:10.1007/s12237-018-0483-7 |
| [26] |
鲍林林, 李叙勇, 苏静君. 筑坝河流磷素的迁移转化及其富营养化特征[J]. 生态学报, 2017, 37(14): 4663-4670. BAO L L, LI X Y, SU J J. Phosphorus cycling and the associated ecological effects of entrophication in dam regulated rivers[J]. Acta Ecologica Sinica, 2017, 37(14): 4663-4670. |
| [27] |
LACERDA N C, GARCIA-BERTHOU E, DIAS J D, et al. Cumulative ecological effects of a neotropical reservoir cascade across multiple assemblages[J]. Hydrobiologia, 2018, 819(1): 77-91. DOI:10.1007/s10750-018-3630-z |
| [28] |
JONES N L, THOMPSON J K, ARRIGO K R, et al. Hydrodynamic control of phytoplankton loss to the benthos in an estuarine environment[J]. Limnology and Oceanography, 2009, 54(3): 952-969. DOI:10.4319/lo.2009.54.3.0952 |
| [29] |
ZHANG Y, PENG C, HUANG S, et al. The relative role of spatial and environmental processes on seasonal variations of phytoplankton beta diversity along different anthropogenic disturbances of subtropical rivers in China[J]. Environmental Science and Pollution Research, 2019, 26(2): 1422-1434. DOI:10.1007/s11356-018-3632-4 |
| [30] |
SUN L, WANG H, KAN Y, et al. Distribution of phytoplankton community and its influence factors in an urban river network, East China[J]. Front Environmental Science & Engineering, 2018, 12(6): 1-12. |
| [31] |
SALMASO N. Long-term phytoplankton community changes in a deep subalpine lake: Responses to nutrient availability and climatic fluctuations[J]. Freshwater Biology, 2010, 55(4): 825-846. DOI:10.1111/j.1365-2427.2009.02325.x |
| [32] |
CELEKLI A, OZTURK B, KAPI M. Relationship between phytoplankton composition and environmental variables in an artificial pond[J]. Algal Research-Biomass Biofuels and Bioproducts, 2014, 5: 37-41. |
| [33] |
TERBRAAK C J F. Canonical correspondence analysis a new eigenvector for multivariate direct gradient analysis[J]. Ecology, 1986, 67(5): 1167-1179. DOI:10.2307/1938672 |
| [34] |
刘毛亚, 童春富, 吴逢润. 太浦河水体叶绿素a纵向演变特征及主要影响因子[J]. 生态学报, 2020, 40(19): 7084-7092. LIU M Y, TONG C F, WU F R. Longitudinal variation characteristics of chlorophyll a and the influencing factors along the Taipu River[J]. Acta Ecologica Sinica, 2020, 40(19): 7084-7092. |
| [35] |
HU J, CHI S, HU J. An attempt to measure longitudinal connectivity based on the community structure of phytoplankton[J]. Environmental Monitoring and Assessment, 2019, 191(6): 382-396. DOI:10.1007/s10661-019-7511-3 |
| [36] |
PARKER M, MAC NALLY R. Habitat loss and the habitat fragmentation threshold: An experimental evaluation of impacts on richness and total abundances using grassland invertebrates[J]. Biological Conservation, 2002, 105(2): 217-229. DOI:10.1016/S0006-3207(01)00184-7 |
| [37] |
SIEBERS A R, PETTIT N E, SKRZYPEK G, et al. Hydrology and pool morphology shape the trophic base of macroinvertebrate assemblages in ephemeral stream pools[J]. Freshwater Science, 2020, 39(3): 461-475. DOI:10.1086/709647 |
 2021, Vol. 40
2021, Vol. 40



