2. 上海市环境科学研究院, 上海 200233
2. Shanghai Academy of Environmental Sciences, Shanghai 200233, China
我国是猪肉消费大国,猪肉需求的快速增长促进了集中式养猪业的发展。据统计,很多地区的规模化养猪程度已经超过90%[1],这就意味着会集中产生大量的养猪废水。养猪废水中蕴含大量的有机物和氮磷等元素,若不经妥善处理,将会造成环境污染和水生生态恶化。虽然各规模化养殖场大多建立了厌氧产沼气工程,但产生的发酵液的处理问题依然严峻。另一方面,我国的蛋白饲料原料严重缺乏,种植业可提供的饲料蛋白质缺口较大,种植所需氮磷肥料主要依赖工业生产和磷矿开采,而后者存在枯竭风险[2]。因此,对于可持续的食品和饲料生产而言,废水中的养分回收和再循环尤为重要,例如从养猪废水中回收和循环利用氮磷等[3]。
微藻是一类具有高光合效率的初级生产者,它们可以在高浓度废水中生长良好,对废水中氮、磷等营养物质的去除有很大的潜能。利用废水培养微藻回收氮磷是目前的研究热点之一,在节约微藻培养的成本上有明显的优势[4]。近年来,将回收的微藻用于食物、饲料和生物燃料开发的研究也受到了广泛的关注[5-6]。目前用于微藻培养的废水主要包括生活废水、工业废水以及农业废水等。LI等[7]的研究发现,利用高压灭菌后的生活废水作为底物进行微藻培养时,微藻最高生长量为0.24 g·L-1·d-1,但是生活废水氮磷含量低,且对废水进行高温高压灭菌预处理成本较高。CHENG等[8]研究发现养猪废水是微藻培养的理想来源,但底物中大分子的有机物难以被微生物利用,另一方面,高浓度的污染物会对微藻的生长速率和生物量产生不利影响。
为了提高微藻的生长量,NAM等[9]的研究表明适当稀释的养猪废水对微藻的生长有一定的促进作用,稀释8倍的猪粪废水可获得0.25 g·L-1·d-1的小球藻。然而稀释倍数较高会造成处理水量的增加。WANG等[10]将废水先经过高温灭菌后再进行微藻培养,但高压灭菌加大了微藻培养的成本以及操作难度,不适合大规模推广应用。在自然界中,细菌和微藻的关系经常被认为是互惠共生。POSADAS等[11]发现藻菌生物膜反应器对有机物的去除率比普通细菌生物膜反应器高1倍,但是藻菌生物膜反应器限制了微藻的生长以及收获。微藻在利用水体营养物质形成新的微藻细胞的同时,释放出氧气供菌群利用。而微生物菌群分解有机物产生的小分子物质更易于被微藻利用,从而刺激微藻的生长。但是过量微生物菌群的存在会与微藻争夺营养物质,有些细菌可以通过释放可溶性纤维素酶或细胞外物质导致微藻死亡[12]。因此,如何通过藻菌共生系统和藻菌的协同作用,在降低废水有机污染物的同时,最大化促进微藻的产量和氮磷的转化是未来研究的重点。
本研究针对养猪废水资源化利用率低以及微藻纯培养产率较低的问题,开展养猪废水消化液经藻菌共生系统转化为以收获微藻为主体的资源化利用研究。以养猪废水消化液作为底物,首先对藻菌共生体系的藻菌比例进行优化,构建互惠共生的藻菌体系;然后对微藻接种浓度和光照周期等关键参数进行探究;最后在优化的工艺条件下运行藻菌共生反应器,深入分析其运行特性和机制,为其应用于养猪废水的资源化处理提供支撑。
1 材料与方法 1.1 实验材料本研究以小球藻(Chlorella)[13]为研究藻种,在TAP[14]培养基中大量培养至对数生长期,采用蒸馏水多次清洗,离心重新悬浮后备用。以上海市某污水处理厂的活性污泥作为菌种来源,在4 ℃下静置24 h浓缩后作为接种污泥使用,浓缩后污泥的混合液悬浮固体浓度(Mixed liquid suspended solids,MLSS)和混合液挥发性悬浮固体(Mixed liquid volatile suspended solids,MLVSS)分别为7.56 g·L-1和3.70 g·L-1。本研究所用废水底物为养猪场的厌氧消化出水,取自上海市金山区某养猪厂厌氧消化池,其溶解性化学需氧量(SCOD)、溶解性总氮(TDN)、溶解性总磷(TDP)、氨氮(NH4+ -N)和硝态氮(NO3- -N)浓度分别为(1 585.0±37.5)、(1 204.5±1.5)、(61.6±1.1)、(1 065.0± 15.0)mg·L-1和(0.6±0.2)mg·L-1,浊度为(104.5±0.2)NTU。
1.2 实验装置 1.2.1 批次实验装置批次实验装置主要用于藻菌共生系统关键工艺参数(包括藻菌比例、微藻接种浓度和光照周期)的优化。主体为玻璃锥形瓶,其有效体积为250 mL。实验时将底物和藻(或藻菌)在玻璃锥形瓶中混合,放置在恒温光照摇床上,温度控制在25~27 ℃,光源为LED灯,光强为92.27 μmol·m-2·s-1。
1.2.2 反应器设置反应器的运行实验在两个透明有机玻璃制成的圆柱体反应器中进行,反应器高70 cm,内径为7 cm,有效工作容积为9.2 L。外部左右两侧设置LED灯架,用于提供微藻生长必需的光源。反应器底部均设置搅拌器以保持体系的均一性。同时在反应器内的中部安装了自动加热装置使反应器运行温度恒定在(26±1)℃,实验装置如图 1所示。
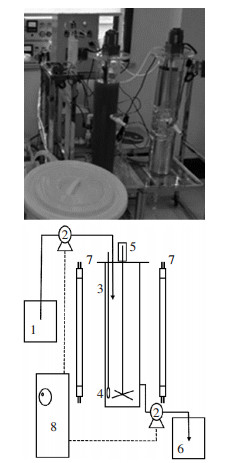
|
1.进水箱;2.蠕动泵;3.反应器柱;4.微孔曝气;5.搅拌装置;6.出水箱;7.LED灯管;8.PLC系统 1.Water inlet tank; 2.Peristaltic pump; 3.Reactor column; 4.Microporous aeration; 5.Mixing device; 6.Water outlet tank; 7.LED lamp; 8.PLC system 图 1 藻菌共生反应器装置示意图 Figure 1 Schematic diagram of algal-bacteria symbiotic reactor |
本研究以养猪废水厌氧发酵液为底物进行微藻培养,分成两部分进行。
首先在批次实验中探究了添加不同比例的污泥对废水中氮磷去除和微藻生长量的影响,共设置5个藻菌比[微藻∶污泥(以MLSS计),质量比,下同]分别为1∶0、1∶0.2、1∶0.5、1∶1和1∶5,设置微藻初始接种浓度为0.2 g·L-1,并提供持续光照。然后在上述适宜的藻菌比条件下,对微藻初始接种浓度进一步优化,微藻初始接种浓度分别设定为0.05、0.1 g·L-1和0.2 g· L-1,并提供持续光照。最后,选取优化的藻菌比和微藻接种浓度,设定3个不同光照周期,分别为8 h光∶ 16 h暗(8L∶16D)、12 h光∶12 h暗(12L∶12D)、24 h光∶ 0 h暗(24L∶0D)。
在批次实验的基础上,选取优化后的工艺参数,构建和运行微藻纯培养反应器R1和藻菌共生反应器R2。进一步对比反应器中微藻生物量产出以及氮磷资源化的差异。反应器中微藻初始浓度均为0.2 g· L-1,光照周期为12L∶12D。微藻纯培养反应器中藻菌比为1∶0,藻菌共生反应器中藻菌比为1∶0.2。
批次实验均设置3次重复实验,反应器取3个平行样进行相关指标的测定,结果表达为均值±标准差。
1.4 采样分析方法实验期间每日采集反应器中的混合溶液,进行微藻生物量和总生物量的测定。样品上清液通过0.45 μm的滤膜过滤后进行水质指标分析。分析指标包括SCOD、NH4+ -N、TDN、TDP、NO3- -N、MLSS、MLVSS,均采用标准方法测定[15]。溶解氧(DO)浓度采用便携式溶解氧仪测定,pH值使用便携式pH仪测定,浊度使用浊度仪测定。微藻浓度由叶绿素浓度计算而得,叶绿素浓度的提取和测定参考相关文献[16]。
1.5 数据处理方法实验数据采用Excel 2019和SPSS 24软件进行统计分析。采用单因素ANOVA检验以LSD法及Waller-Duncan法分析不同藻菌比下SCOD、TDN、TDP和NH4+ -N之间的差异显著性。使用Origin 2018作图。
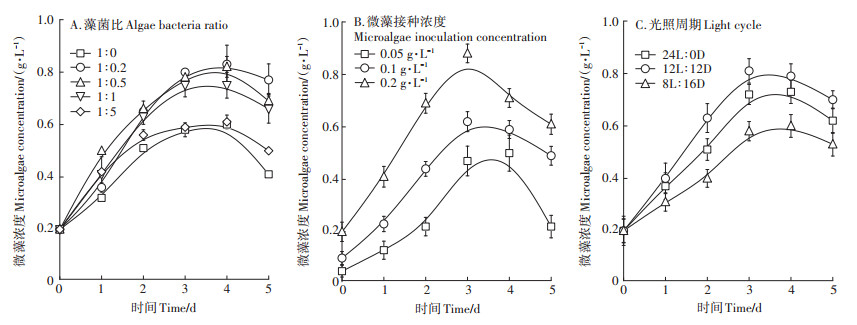
2 结果与讨论 2.1 藻菌共生系统关键工艺参数对微藻生物量的影响微藻在不同工艺参数下的生长情况如图 2所示。结果表明,微藻纯培养系统中微藻的生长量都低于藻菌共生系统。不同藻菌比下微藻最高产量分别为0.58、0.83、0.82、0.75 g·L-1和0.61 g·L-1。微生物可以分解复杂的有机底物,产生易于被微藻利用的小分子有机酸[17]。但是过多的污泥会与微藻争夺环境中的营养物质[18],并且随着活性污泥的添加,系统中的浊度从最初的104 NTU增加到了653 NTU,导致系统透光性差,微藻光合作用速率下降,限制了微藻的生长。因此,投入过量的污泥会使得微藻因失去竞争优势而走向衰亡。由此可见,加入适量的污泥构成的藻菌共生系统,即当藻菌比例为1∶0.2时,能够形成良好的藻菌互惠共生关系。
|
图 2 不同工艺参数下微藻生长曲线 Figure 2 Growth curves of microalgae under different operational parameters |
微藻的初始接种浓度影响微藻在废水中的适应性和生长速率。固定藻菌比例为1:0.2的条件下,当微藻初始接种浓度为0.05、0.1 g·L-1和0.2 g·L-1时,微藻的最大增长量分别为0.41、0.52 g·L-1和0.68 g·L-1。在不同光照周期系统中,微藻均能正常生长。如图 2C所示,相比于其他两个系统,在12L∶12D系统中,微藻达到了最高的生长速率和生长量,分别为0.2 g· L-1·d-1和0.81 g·L-1,24L∶0D系统次之,8L∶16D系统最小。这一结果与其他研究中光照周期对微藻生长的影响趋势一致[19-20]。从微藻生物质的变化趋势来看,微藻的光合作用存在一定的饱和时间[21],在此范围内,光照时间越长,微藻积累量越大。因此,在微藻培养过程中,需要选用适宜的光照周期。
综上所述,在利用养猪废水厌氧发酵液培养微藻时,加入适量的活性污泥构建藻菌共生体系,有助于微藻的生长繁殖。并且采用藻菌比1∶0.2、微藻接种浓度0.2 g·L-1、光照周期12L∶12D时,能够获得最优的微藻生长量。
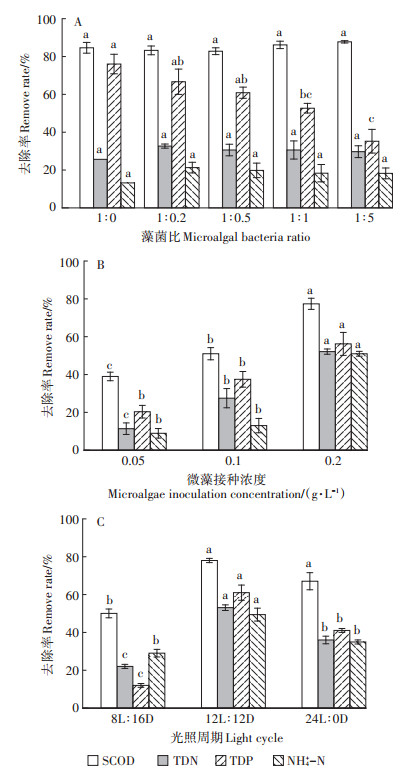
2.2 藻菌共生体系关键工艺参数对污染物去除率的影响微藻纯培养系统中SCOD的去除率为85%,而藻菌比1∶5系统中SCOD的去除率达90%(图 3A)。从氮的去除上来看,在藻菌比1∶0条件下,TDN和NH4+ -N的去除率最低,分别为25.7%和13.2%,藻菌比1∶0.2条件下TDN和NH4+ -N的去除率最大,分别为32.7% 和21.3%。分析认为,藻菌共生系统中的微生物将有机氮转化为氨,有利于藻类同化[22],并且在藻菌比1∶ 0.2条件下生物量最高(0.83 g·L-1),提高了氮的同化量。但是,在藻菌比1∶5时,大量细菌的呼吸作用导致系统中溶解氧浓度不足1 mg·L-1,生成的NH4+ -N不能有效地转化成NO3- -N及NO2--N,使得系统中仍有较高浓度的NH4+ -N。体系中TDP的去除与微藻的同化和微生物的活动有关[23]。有研究表明,1 g藻类细胞的生长需要0.009 g磷[24],但是在本实验中收获最少生物量的微藻纯培养系统中,TDP的去除率最高达76%,表明除了藻类的同化作用,还存在其他的去除途径。通过对体系pH的监测发现,微藻纯培养系统中pH值高于藻菌共生系统,达到9.4,适宜磷酸盐的析出[25],这可能是其去除率较高的原因。
|
不同小写字母表示处理间差异显著(P < 0.05) Different letters indicate significant differences among treatments(P < 0.05) 图 3 不同工艺条件下SCOD、TDN、TDP和NH4+ -N去除率 Figure 3 Removal rates of SCOD, TDN, TDP and NH4+ -N under different operational conditions |
图 3B、图 3C显示了不同微藻接种浓度和光照周期条件下污染物的去除率。污染物的去除率与微藻生物量的变化趋势一致。其中,TDP的去除率受光照周期的影响较大。随着光照时间的增加,TDP的去除率从12% 增加至61% 后下降到41%,这与微藻光合作用产氧造成体系内厌氧/好氧环境的交替有关。聚磷菌只有在厌氧/好氧交替的环境下才能完成释磷- 吸磷机制[26]。持续的光照使得体系一直处于好氧状态,聚磷菌无法在厌氧状态下有效释磷并储存胞内能源物质[27-28],导致其不能从环境中吸收溶解态的正磷酸盐,TDP的去除率反而变低。综上所述,在微藻接种浓度0.2 g·L-1、藻菌比1∶0.2、光照周期12L∶12D时,能够获得较大的微藻生物量,同时能够有效去除养猪废水消化液中的有机物和营养元素。
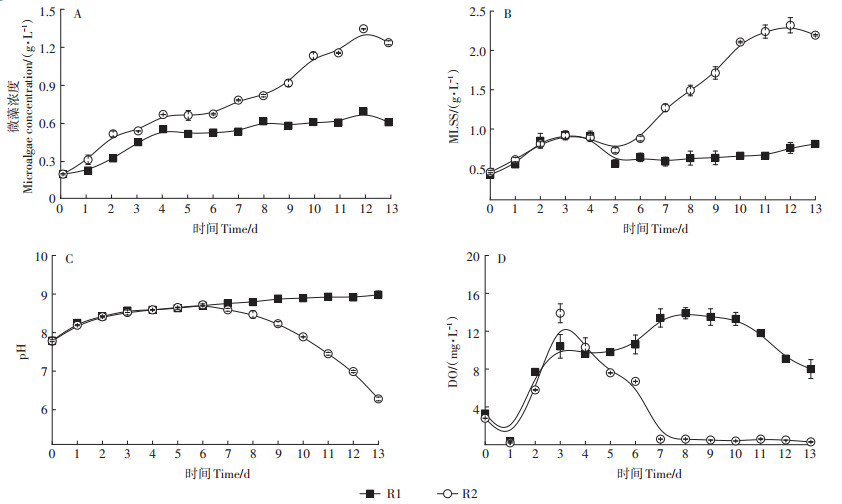
2.3 反应器运行机制及藻菌共生体系特性 2.3.1 反应器中微藻生物量变化分析微生物菌群的投加提高了微藻的生长上限,藻菌共生体系具有更高的微藻产出。微藻纯培养反应器R1和藻菌共生反应器R2中微藻生长情况如图 4A所示。R1、R2反应器中微藻浓度在运行第5 d分别达到了0.52 g·L-1和0.66 g·L-1。从第6 d开始R2中微藻开始二次生长,达到1.37 g·L-1。微藻的生长受多种因素的影响,反应器中的溶解氧浓度、pH值、碳源等均是微藻增殖的重要限制因素[29-31]。R1和R2中污泥和微藻的混合浓度(以MLSS表示,图 4B)在前5 d保持一致。微藻在进行光合作用的过程中,吸收CO2、释放OH-和O2,从而提高反应器中pH和DO的水平[32]。R1在运行全过程中pH值和溶解氧浓度随着反应时间的推移而不断增加,如图 4C、图 4D所示。由于藻类对营养物的亲和力较高,能在培养基中存在高浓度有机物的情况下抑制细菌的生长[21],因此在反应前期,R2中微藻占据竞争优势。在反应中期,微藻生长趋于稳定,产生氧气供好氧细菌繁殖积累,进而降低了反应器中溶解氧的浓度以及pH值,微藻利用CO2等碳源完成自身增殖[33],呈现二次增长,形成良好的互惠共生关系,最终获得了更高的微藻产量,证明了该类型反应器的资源化优势。
|
图 4 运行全过程反应器中微藻浓度、MLSS、pH及DO Figure 4 Microalgae concentration, MLSS, pH and DO in the reactor during the whole operation process |
微藻纯培养反应器R1和藻菌共生反应器R2处理养猪废水厌氧消化液的运行过程中反应器内污染物指标的变化情况如图 5所示。由于13 d后微藻有明显的衰亡现象,因此实验全过程监测时间为13 d。R1和R2对SCOD的去除效果相差较大,R1中SCOD有明显的积累现象,最终去除率仅为24.4%。而R2中SCOD最终去除率达到81.0%。并且R2对TDN、NH4+ -N和TDP的去除体现出明显的优势。R2中TDN、NH4+ -N的去除率在前6 d与R1反应器相似,之后随着微藻的二次生长,R2中氮的含量迅速减少,TDN和NH4+ -N去除率最终达47.5% 和78.7%。R2中TDP的去除率可达72.1%。投加微生物菌群构建的藻菌共生反应器,能在提高微藻生物量的同时强化对氮磷等营养物质的回收与利用,更好地实现养猪废水厌氧消化液的资源化回收利用。
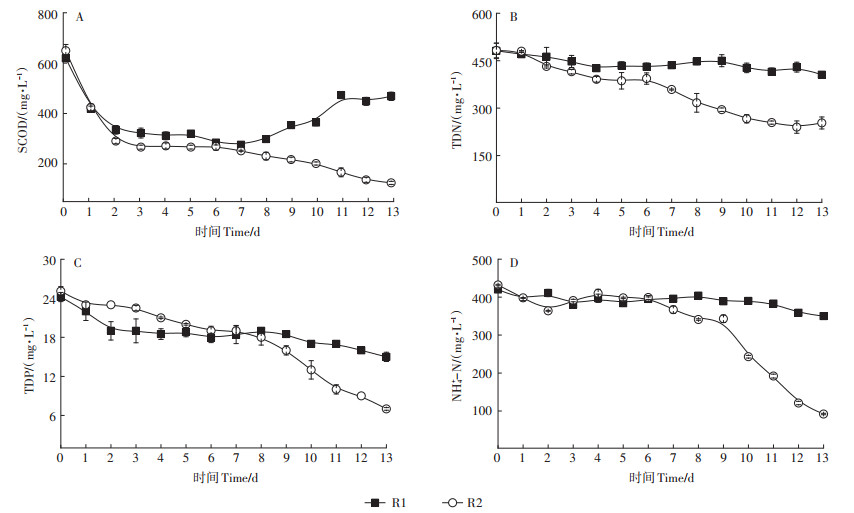
|
图 5 反应器R1和R2中SCOD、TDN、NH4+-N和TDP去除效果 Figure 5 Removal performance of SCOD, TDN, NH4+-N and TDP in R1 and R2 reactor |
对反应器中微藻平均生长速率进行分析发现,微藻纯培养反应器中在第4 d时最大(0.09 g·L-1·d-1),而藻菌共生反应器中在第2 d时最大(0.16 g·L-1 · d-1)。因此,为了高效地收获微藻,运用藻菌共生反应器可以提高微藻的生长速率和生长上限,收获周期可设定为2 d。考虑到污染物的高效去除,可以设置HRT为12 d,此时SCOD、TDN、TDP和NH4+ -N的去除率分别为85.0%、50.2%、72.1%和78.7%。
3 结论(1)相对于微藻纯培养,投加适宜比例的菌群,构建互惠共生的藻菌共生体系,有利于提高微藻产量。
(2)在优化的工艺条件下运行微藻纯培养反应器与藻菌共生反应器,发现藻菌共生体系有利于提供微藻生长所需的无机碳源和有机小分子碳源,维持反应器酸碱环境,进而提高微藻生长速率和产量上限,微藻最高生长量比微藻纯培养系统中提高了1倍,达1.4 g·L-1。
(3)藻菌共生反应器对溶解性化学需氧量、氮和磷的去除效果优于微藻纯培养反应器。
| [1] |
秦贵信. 现代规模养猪生产粪污处理问题[J]. 饲料与畜牧, 2018(3): 34-36. QIN G X. Treatment of manure in modern scale pig production[J]. Feed and Animal Husbandry, 2018(3): 34-36. |
| [2] |
CORDELL D, DRANGERT J O, WHITE S. The story of phosphorus: Global food security and food for thought[J]. Global Environmental Change, 2009, 19(2): 292-305. DOI:10.1016/j.gloenvcha.2008.10.009 |
| [3] |
TEYMOURI A, KUMAR S, BARBERA E, et al. Integration of biofuels intermediates production and nutrients recycling in the processing of a marine algae[J]. Aiche Journal, 2017, 63(5): 1494-1502. DOI:10.1002/aic.15537 |
| [4] |
SANTOS M, PIRES J C M. Nutrient recovery from wastewaters by microalgae and its potential application as biochar[J]. Bioresource Technology, 2018, 267: 725-731. DOI:10.1016/j.biortech.2018.07.119 |
| [5] |
汪宴廷. 绿狐尾藻蛋白饲料对川藏黑猪产子性能的影响研究[J]. 甘肃畜牧兽医, 2016, 46(21): 93-94. WANG Y T. Study on the effect of Myriophyllum elatinoides feed on the performance of Sichuan Tibet black pig[J]. Gansu Animal Husbandry and Veterinary, 2016, 46(21): 93-94. DOI:10.3969/j.issn.1006-799X.2016.21.046 |
| [6] |
CHEW K W, YAP J Y, SHOW P L, et al. Microalgae biorefinery: High value products perspectives[J]. Bioresource Technology, 2017, 229: 53-62. DOI:10.1016/j.biortech.2017.01.006 |
| [7] |
LI Y C, CHEN Y F, P C, et al. Characterization of a microalga Chlorella sp. well adapted to highly concentrated municipal wastewater for nutrient removal and biodiesel production[J]. Bioresource Technology, 2011, 102(8): 5138-5144. DOI:10.1016/j.biortech.2011.01.091 |
| [8] |
CHENG D L, NGO H H, GUO W S, et al. Microalgae biomass from swine wastewater and its conversion to bioenergy[J]. Bioresource Technology, 2019, 275: 109-122. DOI:10.1016/j.biortech.2018.12.019 |
| [9] |
NAM K, LEE H, HEO S W, et al. Cultivation of Chlorella vulgaris with swine wastewater and potential for algal biodiesel production[J]. Journal of Applied Phycology, 2017, 29(3): 1171-1178. DOI:10.1007/s10811-016-0987-0 |
| [10] |
WANG M Z, YANG Y, CHEN Z H, et al. Removal of nutrients from undiluted anaerobically treated piggery wastewater by improved microalgae[J]. Bioresource Technology, 2016, 222: 130-138. DOI:10.1016/j.biortech.2016.09.128 |
| [11] |
POSADAS E, GARCÍA-ENCINA P A, SOLTAU A, et al. Carbon and nutrient removal from centrates and domestic wastewater using algal– bacterial biofilm bioreactors[J]. Bioresource Technology, 2013, 139: 50-58. DOI:10.1016/j.biortech.2013.04.008 |
| [12] |
KIM J D, KIM B, LEE C G. Alga-lytic activity of Pseudomonas fluorescens against the red tide causing marine alga Heterosigma akashiwo (Raphidophyceae)[J]. Biological Control, 2007, 41(3): 296-303. DOI:10.1016/j.biocontrol.2007.02.010 |
| [13] |
WANG L, LIU T, ZHAO Q, et al. Comparative study of wastewater treatment and nutrient recycle via activated sludge, microalgae and combination systems[J]. Bioresource Technology, 2016, 311: 1-5. |
| [14] |
陈香元. 小球藻与平菇共生体系的构建及其在养猪沼液净化中的应用研究[D]. 南昌: 南昌大学, 2014. CHEN X Y. Constrution of Chlorella sp. and Pleurotus ostreatus symbiont for swine farm biogas slurry treatment[D]. Nanchang: Nanchang University, 2014. |
| [15] |
国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京: 中国环境科学出版社, 2002: 701-731. State Environmental Protection Administration. Methods for monitoring and analysis of water and wastewater[M]. 4th Edition. Beijing: China Environmental Science Press, 2002: 701-731. |
| [16] |
YE J F, LIANG J Y, WANG L, et al. Operation optimization of a photo-sequencing batch reactor for wastewater treatment: Study on influencing factors and impact on symbiotic microbial ecology[J]. Bioresource Technology, 2017, 252: 7-13. |
| [17] |
MARTIN T C, ANDREW D L, EVELYNE R D, et al. Algae acquire vitamin B12 through a symbiotic relationship with bacteria[J]. Nature, 2005, 438(7064): 90-93. DOI:10.1038/nature04056 |
| [18] |
FERGOLA P, CERASUOLO M, POLLIO A, et al. Allelopathy and competition between Chlorella vulgaris and Pseudokirchneriella subcapitata: Experiments and mathematical model[J]. Ecological Modelling, 2007, 208(2): 205-214. |
| [19] |
刘乐然. 藻菌共生系统深度处理二级出水的条件优化研究[D]. 济南: 山东建筑大学, 2020. LIU L R. Study on the condition optimization of advanced treatment of secondary effluent by algae bacterial symbiosis system[D]. Jinan: Shandong Jianzhu University, 2020. |
| [20] |
方洁琼, 孙诗清, 沈栋, 等. 光周期对人工藻菌共生体提纯沼气效果研究[J]. 绿色科技, 2017(22): 100-102. FANG J Q, SUN S Q, SHEN D, et al. Effect of ligh/dark photoperiod on biogas purification by artificial algae symbiosis[J]. Journal of Green Science and Technology, 2017(22): 100-102. |
| [21] |
STRAKA L, RITTMANN B E. Light attenuation changes with photoacclimation in a culture of Synechocystis sp. PCC 6803[J]. Algal Research, 2017, 21: 223-226. DOI:10.1016/j.algal.2016.11.024 |
| [22] |
DE-BASHAN L E, MORENO M, HERNANDEZ J P, et al. Removal of ammonium and phosphorus ions from synthetic wastewater by the microalgae Chlorella vulgaris coimmobilized in alginate beads with the microalgae growth-promoting bacterium Azospirillum brasilense[J]. Water Research, 2002, 36(12): 2941-2948. DOI:10.1016/S0043-1354(01)00522-X |
| [23] |
UDAIYAPPAN A F M, HASAN H A, Takriff M S, et al. Microalgaebacteria interaction in palm oil mill effluent treatment[J]. Journal of Water Process Engineering, 2020, 35: 101203. DOI:10.1016/j.jwpe.2020.101203 |
| [24] |
ZHANG Y L, SU H Y, ZHONG Y N, et al. The effect of bacterial contamination on the heterotrophic cultivation of Chlorella pyrenoidosa in wastewater from the production of soybean products[J]. Water Research, 2012, 46(17): 5509-5516. DOI:10.1016/j.watres.2012.07.025 |
| [25] |
WAYNE C K, REEN C S, LOKE S P, et al. Effects of water culture medium, cultivation systems and growth modes for microalgae cultivation: A review[J]. Journal of the Taiwan Institute of Chemical Engineers, 2018, 91: 332-334. DOI:10.1016/j.jtice.2018.05.039 |
| [26] |
王军一, 李伟光. 反硝化除磷工艺研究进展[J]. 山东建筑大学学报, 2015, 30(3): 271-276. WANG J Y, LI W G. Technology and research progress of denitrifying dephosphataion[J]. Journal of Shandong Jianzhu University, 2015, 30(3): 271-276. DOI:10.3969/j.issn.1673-7644.2015.03.011 |
| [27] |
叶丽红, 李冬, 张杰, 等. 亚硝化-反硝化除磷技术研究进展[J]. 北京工业大学学报, 2016, 42(4): 585-593. YE L H, LI D, ZHANG J, et al. Advance of research on the technology of nitrite-denitrifying phosphorus removal[J]. Journal of Beijing University of Technology, 2016, 42(4): 585-593. |
| [28] |
章璋, 朱易春, 王佳琪, 等. 短程反硝化除磷的影响因素分析[J]. 江西理工大学学报, 2019, 40(1): 46-53. ZHANG Z, ZHU Y C, WANG J Q, et al. Analysis of influential factors of partial denitrifying dephosphatation[J]. Journal of Jiangxi University of Science and Technology, 2019, 40(1): 46-53. |
| [29] |
LI J, ZHENG X Q, LIU K C, et al. Effect of tetracycline on the growth and nutrient removal capacity of Chlamydomonas reinhardtii in simulated effluent from wastewater treatment plants[J]. Bioresource Technology, 2016, 218: 1163-1169. DOI:10.1016/j.biortech.2016.07.080 |
| [30] |
KRYSTIAN M, WALDEMAR I, CLAIRE R, et al. Effect of metals, metalloids and metallic nanoparticles on microalgae growth and industrial product biosynthesis: A review[J]. International Journal of Molecular Sciences, 2015, 16(10): 23929-23969. DOI:10.3390/ijms161023929 |
| [31] |
SCHNURR P J, ALLEN D G. Factors affecting algae biofilm growth and lipid production: A review[J]. Renewable & Sustainable Energy Reviews, 2015, 52: 418-429. |
| [32] |
MASSÉ D, SAADY N, GILBERT Y. Potential of biological processes to eliminate antibiotics in livestock manure: An overview[J]. Animals, 2014, 4(2): 146-163. DOI:10.3390/ani4020146 |
| [33] |
HUANG G H, CHEN F, WEI D, et al. Biodiesel production by microalgal biotechnology[J]. Applied Energy, 2010, 87(1): 38-46. DOI:10.1016/j.apenergy.2009.06.016 |
 2021, Vol. 40
2021, Vol. 40


