2. 内蒙古自治区作物栽培与遗传改良重点实验室, 呼和浩特 010019;
3. 内蒙古农业大学园艺与植保学院, 呼和浩特 010019;
4. 内蒙古农业大学职业技术学院, 包头 014100
2. Key Laboratory of Crop Cultivation and Genetic Improvement in Inner Mongolia Autonomous Region, Hohhot 010019, China;
3. Horticulture and Plant Protection College, Inner Mongolia Agricultural University, Hohhot 010019, China;
4. Vocational and Technical College, Inner Mongolia Agricultural University, Baotou 014100, China
作物秸秆是一种高效、经济、具有丰富营养元素的可再生有机资源[1]。据统计,我国作物秸秆年产量近8.5亿t,其中玉米秸秆产量最大,约为2.8亿t[2-3],有研究表明,长期秸秆还田可以增加土壤有机碳,改善土壤理化性质[4];秸秆还田还可以使秸秆中的矿质营养返还到土壤中,促进养分平衡[5],但秸秆中含有纤维素、半纤维素、木质素等物质形成的坚固复杂的组织,使秸秆天然降解难度高[6-7]。我国北方地区低温持续时间长,大量农作物秸秆未能得到及时有效的利用,造成资源的浪费[8]。目前,木质纤维素类物质的处理方法主要有物理方法、化学方法和生物降解,其中生物降解具有降解率高、安全环保、成本低、可再生等优点。因而,微生物降解技术成为提高低温地区还田玉米秸秆快速、高效腐解的有效措施之一[9-10],而筛选低温玉米秸秆降解菌是添加外源微生物促进秸秆原位腐化的关键。自然界中广泛存在具有高效降解木质纤维素酶系统的微生物,如王春芳等[11]以堆肥为菌源采用外淘汰方法获得的复合菌系F1在40 ℃条件下培养10 d后秸秆总降解率为52.55%,其中Bacillus、Petrimonas、Pusillimonas 为秸秆降解关键物种;WANG等[12]从芦苇池塘污泥中获得的复合菌系LDC培养15 d后,芦苇秸秆木质素降解率达60.9%,半纤维素降解率达43.0%;苏鑫等[13]通过限制性富集培养技术从腐烂芦苇秸秆根部土壤中筛选获得木质素降解复合菌系LDC,在32 ℃条件下培养7 d,木质素最大降解率为44.5%,其优势菌种为Pseudomonas、Pannonibacter、Thauera。
本团队长期从事玉米秸秆低温高效降解微生物筛选研究,前期筛选出的复合菌系GF-20以滤纸作为碳源进行筛选,玉米秸秆降解率达32.29%[14],具有良好的稳定性[15],对纤维素和半纤维素降解效果较好,但对木质素组分的降解效果不理想。且内蒙古地区秋冬季气温低,周期长,中高温菌及其酶的应用受到了较大限制,因此本研究在前人研究基础上,将玉米秸秆作为碳源,以内蒙古不同地区多年秸秆还田土壤、牛羊粪等菌源样品为材料,经多层次递进式筛选获得玉米秸秆低温高效降解菌系,并对获得的复合菌系进行玉米秸秆降解效率和菌种组成多样性分析,旨在为原位还田玉米秸秆低温腐解提供功能菌系,促进玉米秸秆的合理利用及耕地保护和生态安全,实现农业废弃物秸秆的资源化利用和农业可持续发展。
1 材料与方法 1.1 试验材料试验于2018—2019年在内蒙古农业大学玉米中心微生物实验室(内蒙古自治区包头市土默特右旗沟门镇)进行。供试菌源样品为实验室4 ℃下保存的采集自内蒙古自治区呼伦贝尔、兴安盟、通辽和赤峰地区多年秸秆还田土壤、牛羊粪、森林腐殖质等57份菌源材料,供秸秆降解菌的筛选。对照复合菌GF-20为本团队以简单纤维素材料滤纸为碳源筛选获得的低温降解菌,主要由Cellvibrio mixtus subsp.、Azospira oryzae、Arcobacter defluyii、Bacillus sp.等组成,10 ℃下培养15 d秸秆降解率为32.29%[14]。
玉米秸秆取自内蒙古农业大学玉米中心试验田(内蒙古自治区包头市土默特右旗沟门镇北只图村)收获的玉米秸秆(纤维素、半纤维素和木质素含量分别为53.46%、27.32% 和11.71%),挑选粗细、大小适中的玉米秸秆,取回后用流水冲洗干净,在65 ℃的烘箱中烘至恒质量,烘干后的玉米秸秆再剪成2~3 cm的小段,灭菌备用。
1.2 培养基基础培养基(AO培养基):尿素0.2 g、(NH3)2 SO4 0.8 g、K2HPO4 0.5 g、CaCO3 1.0 g、NaCl 0.1 g、MgSO40.025 g、500 mL蒸馏水,pH值6.5。
蛋白胨纤维素培养基(PCS培养基):蛋白胨5.0 g、酵母粉5.0 g、NaCl 5.0 g、CaCl2 2.0 g、K2HPO4 0.5 g、MgSO4·7H2O 0.5 g、1 L蒸馏水,pH值6.7。
Mandels培养基(M培养基):K2HPO4 3.0 g、NaNO3 3.0 g、CaCl2 0.5 g、MgSO4 ·7H2O 0.5 g、Fe2SO4 · 7H2O 7.5 mg、MnSO4·H2O 2.5 mg、ZnSO4 2.0 mg、CoCl2 3.0 mg、1 L蒸馏水,pH值6.8。
产酶培养基:尿素0.6 g、蛋白胨0.5 g、(NH3)2 SO4 2.0 g、K2HPO4 1.0 g、MgSO4·7H2O 0.05 g、MnSO4·7H2O 0.016 g、ZnSO4·7H2O 0.017 g、CaCl2 0.02 g、NaCl 0.2 g、蒸馏水1 L。
于100 mL三角瓶中加入40 mL培养液和1.0 g玉米秸秆,121 ℃灭菌20 min,备用。
1.3 试验设计 1.3.1 复合菌系的筛选初筛:分别称取2 g菌源样品接种到装有玉米秸秆的M培养基、PCS培养基和AO培养基中,置于20 ℃恒温培养箱中进行富集培养,当三角瓶中液体变浑浊、玉米秸秆出现腐解现象时开始转接,如此转接2代。
复筛:吸取F2代培养液按5%(V/V)的接种量重新转接到M培养基、PCS培养基和AO培养基中,且秸秆降解表现稳定时每转接一代温度降低1 ℃,直至降低到15 ℃。在限制性继代培养低温驯化过程中,淘汰分解能力减弱的样品,如此连续培养8代。根据不同培养代数秸秆降解率判断复合菌系秸秆降解能力,选取降解效果好的复合菌系进行下一步研究。
1.3.2 复合菌系玉米秸秆降解性能检测将复筛获得的复合菌系以5%(V∶V)的接种量接入产酶培养基和M培养基中,在15 ℃恒温条件下静置培养,第1、5、10、15、20 d测定纤维素、半纤维素、木质素酶活性以及玉米秸秆降解率及木质纤维素降解率,明确复合菌系降解特性。
1.4 测定指标与方法 1.4.1 酶活性的测定将复合菌系接种于产酶培养基中,15 ℃下分别在培养第1、5、10、15、20 d时取各复合菌系发酵液10 mL,4 ℃、5 000 r·min-1条件下离心10 min,取上清液(粗酶液)5 mL,测定酶活性。采用《纤维素酶制剂》(QB/T 2583—2003)中DNS法测定滤纸酶活性和内切-1,4-β-葡聚糖酶活性;采用《饲料添加剂木聚糖酶活力的测定分光光度法》(GB/T 23874—2009)中DNS法测定木聚糖酶活性;采用ABTS法[16]测定漆酶的活性,藜芦醇法[16]测定木素过氧化物酶活性,3次重复。
1.4.2 玉米秸秆降解率的测定接种后第1、5、10、15、20 d取出秸秆,用水洗净,于65 ℃烘箱中烘干至恒质量,采用下列公式计算玉米秸秆降解率,3次重复。

|
式中:W0为接种前培养基中的秸秆质量,g;W1为培养结束烘干后降解剩余的秸秆质量,g;W2为玉米秸秆降解率,%。
1.4.3 玉米秸秆木质纤维素含量的测定接种后第1、5、10、15、20 d取出秸秆,用蒸馏水洗净,将降解后的秸秆烘干粉粹后过1 mm筛,采用纤维素分析仪(ANKOM A200i)测定木质素、纤维素、半纤维的含量,并计算木质纤维素降解率,3次重复。
1.4.4 复合菌系微生物组成多样性分析将供试菌系15 ℃静置培养21 d后取发酵液5 mL,4 ℃、5 000 r·min-1离心10 min,弃上清液,留沉淀,如此反复多次,确保已完全沉淀,后交由上海美吉生物医药科技有限公司进行16S rRNA基因测序,PCR引物为338F(5′-ACTCCTACGGGAGGCAGCAG- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),GF-20由北京奥维森基因科技有限公司完成MiSeq高通量测序[15]。
1.5 数据处理理化特性数据采用SPSS 22.0软件进行方差分析,采用SigmaPlot 12.5作图。微生物菌种组成测序数据采用RDP classifier贝叶斯算法(Version 2.2,http://sourceforge.net/projects/rdp-classifier/),在Qiime平台(http://qiime.org/scripts/assign_taxonomy.ht⁃ml)下,以0.7为置信度阈值,将OTU代表序列与Silva数据库(Release128,http://www.arb-silva.de)进行比对,获得OTU代表序列的分类学信息。
2 结果与分析 2.1 玉米秸秆低温高效降解复合菌系的筛选57份菌源材料经富集培养和初筛,获得22份可高效降解玉米秸秆的材料,并对其进一步低温驯化和限制性培养后,获得9份降解玉米秸秆的复合菌系,分别为M44、M14、M2、P22、A14、M1、M36、M38和M55。
各复合菌系不同代数秸秆降解率如图 1所示,菌系M44、M14和M2在各培养代数中秸秆降解率均显著高于其他菌系,15 ℃培养20 d,F11代秸秆降解率分别为34.89%、34.77%和34.44%。培养至F9、F10和F11代时,菌系M44、M14和M2的秸秆降解率趋于稳定,各代数降解率无显著差异。各复合菌系酶活性如表 1所示,复合菌M44的内切葡聚糖酶活性为1.90 U·mL-1,与M14和M2无显著差异,但显著高于其他菌系;滤纸酶活性表现为M44、M14、M2、P22间无显著差异,但均显著高于除A14外的其他菌系,酶活性分别为2.74、2.44、2.43 U·mL-1和2.58 U·mL-1;木聚糖酶活性表现为M44、M14、M2、P22、M1和M36间无显著差异,但与M38差异显著,其中M44酶活性最高,为10.40 U·mL-1;漆酶的活性表现为M44与M14间差异不显著,但均显著高于除P22外的其他菌系,酶活性分别为57.19 U·L-1和61.77 U·L-1;木素过氧化物酶活性表现为P22和M14显著高于其他菌系,酶活性分别为97.16 U·L-1和93.71 U·L-1。

|
不同小写字母代表各菌系间差异显著。下同 Different lowercase letters indicate significant differences among strains. The same below 图 1 复合菌系不同代数玉米秸秆降解率 Figure 1 The corn straw degradation ratio of complex strains in different algebraics |
|
|
表 1 复合菌系酶活性分析 Table 1 Enzyme activity analysis of complex strains |
根据秸秆降解率及酶活性指标进行复筛,对复合菌系M44、M14和M2进一步分析,并以团队之前筛选获得的复合菌系GF-20为对照。供试菌系来源见表 2。
|
|
表 2 供试菌系来源 Table 2 Strains collecting site |
由图 2可知,各复合菌系纤维素酶活性均随培养时间呈先升高后降低的单峰曲线变化。其中,各复合菌系滤纸酶活性在培养5 d或10 d时达到峰值,M44的最高酶活性显著高于其他菌系,为2.53 U·mL-1,较GF-20高出6.72%。在培养5 d时复合菌系M44和GF-20的内切葡聚糖酶活性均表现最高,酶活性分别为2.33 U·mL-1和2.29 U·mL-1,无显著差异。

|
图 2 复合菌系滤纸酶、内切葡聚糖酶活性动态 Figure 2 Dynamics of filter paper enzyme and endoglucanase activity of complex strains |
由图 3可知,各复合菌系木聚糖酶活性呈先升高后降低的单峰曲线变化。在培养5 d时,各复合菌系达到最高值,其中复合菌M44的木聚糖酶活性最高,为4.08 U·mL-1,较GF-20高13.97%。
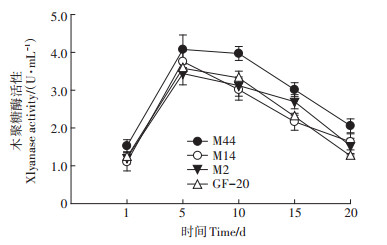
|
图 3 复合菌系木聚糖酶活性动态 Figure 3 Dynamics of xylanase activity of complex strains |
各复合菌系漆酶活性如图 4所示,漆酶活性与木聚糖酶活性变化一致。酶活性于培养第5 d时达到峰值,复合菌M44、M14和M2漆酶活性分别为126.94、117.82、113.28 U·L-1,其中,复合菌M44酶活性较GF-20高17.88%,且差异显著。

|
图 4 复合菌系漆酶活性动态 Figure 4 Dynamics of laccase activity of complex strains |
各复合菌玉米秸秆降解率如图 5所示,随培养时间的增加,秸秆降解率呈增加趋势,各复合菌系从培养1 d到5 d的秸秆降解率增幅最大,培养5 d后降解速率减缓。培养20 d时,复合菌M44、M14、M2和GF-20的秸秆降解率分别为35.33%、33.34%、31.33% 和31.48%,M44降解率较GF-20显著高出3.85个百分点。
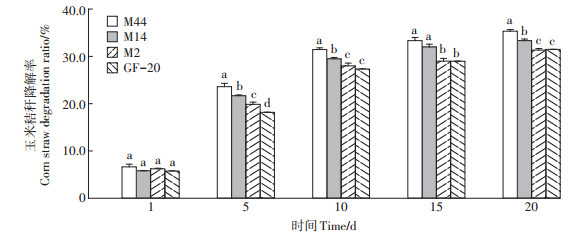
|
图 5 复合菌系玉米秸秆降解率变化动态 Figure 5 Dynamics change of corn straw degradation ratio of complex strains |
由图 6可知,随着玉米秸秆的分解,各复合菌系的木质纤维素组分含量逐渐降低,且纤维素降解率显著高于半纤维素和木质素降解率。从培养1 d到20 d,GF-20处理的秸秆纤维素降解率增加了39.69个百分点,显著高于其他菌系;M44和GF-20处理的秸秆半纤维素降解率分别为30.34%和28.77%,高于菌系M14和M2;菌系M44处理的木质素降解率增加了14.63个百分点,较GF-20高3.28个百分点,且差异显著。

|
图 6 复合菌系木质纤维素降解率变化动态 Figure 6 Dynamics change of lignocellulosic degradation ratio of complex strains |
由玉米秸秆降解特性数据可知,筛选驯化所得的复合菌具有较强的玉米秸秆降解能力,为了进一步明确该复合菌系的优势菌种,对其进行微生物组成多样性分析,结果如图 7所示。基于门分类水平(Others < 1%),各复合菌系的细菌群落主要隶属4个门,分别为Proteobacteria(变形菌门)、Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)和Actinobacteria(放线菌门)。其中,Proteobacteria是菌系中最丰富的细菌类群,在M44、M14、M2和GF-20中相对丰度分别为53.67%、60.52%、70.10%和65.48%;Firmicutes在M44中所占比例最高,为26.99%,与M2和GF-20差异极显著,与M14差异不显著;Bacteroidetes在M44、M14、M2和GF-20菌系中相对丰度分别为12.78%、9.93%、20.29%和10.67%,菌系间差异达极显著水平;Actinobacteria在菌系M44和M14中相对丰度分别为3.03% 和6.79%,在M2和GF-20中的比例接近于0。
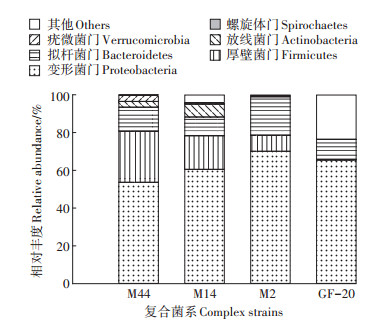
|
图 7 门分类水平上复合菌系细菌的群落组成 Figure 7 The community composition of complex bacteria at phylum level |
进一步分析复合菌系M44、M14、M2和GF-20组成细菌属水平(Others < 5%)分类(图 8)得知,菌系M44、M14、M2与GF-20在细菌群落多样性和组成丰度上均具有显著差异。菌系M44中优势菌属主要有Trichococcus(毛球菌属)和Acinetobacter(不动杆菌属),分别占细菌群落总量的19.65%和13.24%,菌系M14细菌群落结构中占比最多的是Azospirillum(固氮螺旋菌,13.23%)、Enterococcus(肠球菌属,8.27%)和Brevundimonas(短波单胞菌属,7.34%);菌系M2细菌群落组成主要包括Delftia(代尔夫特菌属,15.33%)、Sphingobacterium(鞘氨醇杆菌属,12.02%)和Brevundimonas(短波单胞菌属,7.13%);菌系GF-20细菌群落结构中占比最多的是Pseudomonas(假单胞菌属,50.84%)、Dysgonomonas(微生长单胞菌属,5.86%)、Achromobacter(无色杆菌属,4.94%)。其中,Pseudomonas 在GF-20中最丰富,显著高于其他菌系,Dysgonomonas 在菌系M44、M14、M2和GF-20细菌群落结构中占比分别为3.73%、3.51%、4.04%和5.86%,菌系间差异不显著。

|
图 8 属分类水平上复合菌系细菌的群落组成 Figure 8 The community composition of complex bacteria at genus level |
为提高低温地区还田作物秸秆腐解速率,低温秸秆降解菌的筛选研究逐渐成为热点。王春芳等[11]从秸秆堆肥样品中获得复合菌系F2,40 ℃下培养10 d,秸秆降解率为40.95%;郭夏丽等[17]复配获得的秸秆降解复合菌在30 ℃培养14 d,玉米秸秆降解率为45.7%;刘尧等[18]筛选的复合菌系22 ℃培养16 d,玉米秸秆降解率达38.5%;杨梦雅等[19]从腐叶土中筛选出的复合菌系PLC-8,在20 ℃下培养30 d,玉米秸秆的降解率为43.65%。近年来有关低温降解菌的报道较多,萨如拉等[20]从腐烂树叶和高原腐烂锯末中筛选出两组低温玉米秸秆降解菌系1号和8号,15 ℃培养15 d,玉米秸秆降解率分别为30.21%和32.21%;胡海红等[10]研究表明复合菌系GF-S72在10 ℃条件下培养15 d,玉米秸秆降解率为25.6%。本研究在QINGGEER等[14]的试验基础上,将碳源由简单纤维素材料滤纸替换为天然木质纤维素材料玉米秸秆,增加了筛选的针对性和准确性,缩短了筛选时间。其中,从内蒙古呼伦贝尔风干羊粪中筛选获得一组低温秸秆降解菌M44,15 ℃培养15 d后秸秆降解率为33.33%,较中、高温菌具有更强的低温降解秸秆能力,且在同等低温条件(15 ℃下培养15 d)下,较前人研究的秸秆降解率高出3.47%~10.32%,为低温地区还田玉米秸秆的快速腐解提供优良的菌系资源。秸秆中木质素是由聚合的芳香醇构成的物质[21],不易被分解,本研究中复合菌M44在15 ℃时漆酶活性较高,且培养20 d木质素降解率达17.44%,在降解木质纤维素类物质方面具有明显优势,具有进一步开发利用的价值。
3.2 复合菌系微生物组成多样性分析基于门分类水平,菌系M44主要由Proteobacteria、Firmicutes、Bacteroidetes等组成,研究表明,Firmicutes门是污泥堆肥和玉米秸秆堆肥中重要的细菌类群之一,能利用可发酵碳水化合物产生大量乳酸等代谢产物,并具有抵抗极端环境的能力[22];Bacteroidetes能够分解蛋白胨或葡萄糖,产生琥珀酸、乙酸、甲酸、乳酸和丙酸等秸秆中间代谢产物,具有降解纤维素的能力[23]。本研究中复合菌系M44能够在低温条件下快速高效地降解玉米秸秆,其中起主要作用的细菌可能为Trichococcus、Acinetobacter、Pseudomonas、Azospirillum、Flavobacterium、Rhizobium 和Brevundimonas 。有研究表明Trichococcus 可以在低温(低至-5 ℃)下生长,分解多糖,产生乳酸、甲酸和乙醇等,参与有机物的分解[24],为微生物生长提供所需要的营养物质。Azospirillum 是一种与根相关的固氮螺菌菌株,表现为具有单一极性的弧菌细胞,分泌过氧化氢酶、氧化酶、酪蛋白酶、羧甲基纤维素酶等[25-26];Rhizobium YS-1r具有木质素降解能力,能够降解各种木质素单体、二聚体以及柳枝草和紫花苜蓿的天然木质素,并且分泌木质素过氧化物酶(LiP)[27-28],这两种细菌相对丰度的增加,可能是菌系M44具有远高于对照菌系的秸秆降解效率和能力的原因之一。孟建宇等[29]研究表明,Arthrobacter、Flavobacterium、Rhizobium、Pseudomonas、Sphingomonas、Acinetobacter 等是内蒙古大兴安岭森林土壤中的耐低温降解纤维素细菌,菌系M44中Acinetobacter 相对丰度仅次于Trichococcus,具有高效产生胞外纤维素酶和半纤维素酶的能力,能够降解木质纤维素类物质[30-32];此外Flavobacterium johnsoniae 可以有效地降解果胶、几丁质、葡聚糖等生物大分子物质[33],与菌系中其他微生物协同降解木质纤维素,由此推断,菌系M44在15 ℃条件下具有更高的秸秆降解能力是由于耐低温降解木质纤维素细菌在群落组成中更占优势。菌系M44中还含有相对丰度较高的Brevundimonas 和Pseudomonas,这一结果与罗立津等[23]研究中耐低温降解纤维素菌群A25- 3细菌群落组成相似,均可产生纤维素酶,具有降解纤维素的能力。此外,复合菌系M44菌系组成中还有一些微生物不具有木质纤维素降解能力,但它们可能与降解纤维素的微生物之间存在协同作用,使得复合菌系能够稳定存在并且有效地降解秸秆。
4 结论(1)通过低温限制性继代培养技术从风干羊粪、鲜牛粪和草原草甸土壤中筛选出3个具有稳定降解玉米秸秆潜力的复合菌系M44、M14和M2,15 ℃条件下秸秆降解率分别为35.33%、33.34% 和31.33%。其中,复合菌系M44漆酶活性较对照GF-20高17.88%,木质素降解率高出3.28个百分点,具有良好的应用潜力。
(2)复合菌系M44中优势菌属Trichococcus、Acinetobacter、Azospirillum、Rhizobium 等能够协同降解玉米秸秆,提高秸秆降解能力。本研究为木质纤维素类生物质的转化与利用提供一定的理论指导。
| [1] |
王金武, 唐汉, 王金峰. 东北地区作物秸秆资源综合利用现状与发展分析[J]. 农业机械学报, 2017, 48(5): 1-21. Comprehensive utilization status and development analysis of crop straw resource in Northeast China[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(5): 1-21. |
| [2] |
中华人民共和国国家统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2019. National Bureau of Statistics of the People's Republic of China. China statistical yearbook[M]. Beijing: China Statistical Press, 2019. |
| [3] |
张蓓蓓. 我国生物质原料资源及能源潜力评估[D]. 北京: 中国农业大学, 2018. ZHANG B B. Assessment of raw material supply capability and energy potential of biomass resources in China[D]. Beijing: China Agricultural University, 2018. |
| [4] |
黄婷苗, 王朝辉, 侯仰毅, 等. 施氮对关中还田玉米秸秆腐解和养分释放特征的影响[J]. 应用生态学报, 2017, 28(7): 2261-2268. HUANG T M, WANG Z H, HOU Y Y, et al. Effects of nitrogen application on decomposition and nutrient release of returned maize straw in Guanzhong Plain, Northwest China[J]. Chinese Journal of Applied Ecology, 2017, 28(7): 2261-2268. |
| [5] |
LUNDELL T K, M KEL M R, HILDÉNK, et al. Lignin-modifying enzymes in filamentous basidiomycetes: Ecological, functional and phylogenetic review[J]. Journal of Basic Microbiology, 2010, 50(1): 5-20. DOI:10.1002/jobm.200900338 |
| [6] |
LI J, LI M, GAO X X, et al. Corn straw mulching affects Parthenium hysterophorus and rhizosphere organisms[J]. Crop Protection, 2018, 113: 90-96. DOI:10.1016/j.cropro.2018.08.002 |
| [7] |
ZHAO J, DONG Z H, LI J F, et al. Ensiling as pretreatment of rice straw: The effect of hemi-cellulase and Lactobacillus plantarum on hemicellulose degradation and cellulose conversion[J]. Bioresource Technology, 2018, 266: 158-165. DOI:10.1016/j.biortech.2018.06.058 |
| [8] |
张必周, 高聚林, 于晓芳, 等. 玉米秸秆低温降解菌的分离与鉴定及复配菌降解效果研究[J]. 玉米科学, 2020, 28(6): 168-175. ZHANG B Z, GAO J L, YU X F, et al. Isolation and identification of corn stover decomposing microbe under low temperature and the decomposing effect of microbial consortium[J]. Journal of Maize Sciences, 2020, 28(6): 168-175. |
| [9] |
李文杰, 李洪飞, 王维浩, 等. 响应面试验优化微波-超声协同辅助硫酸降解玉米秸秆工艺[J]. 食品科学, 2016, 37(14): 43-50. LI W J, LI H F, WANG W H, et al. Optimization of microwave/ultrasonic-assisted sulfuric acid hydrolysis of corn straw by using response surface methodology[J]. Food Science, 2016, 37(14): 43-50. DOI:10.7506/spkx1002-6630-201614008 |
| [10] |
胡海红, 孙继颖, 高聚林, 等. 低温高效降解玉米秸秆复合菌系发酵条件优化及腐解菌剂的研究[J]. 农业环境科学学报, 2016, 35(8): 1602-1609. HU H H, SUN J Y, GAO J L, et al. Optimization of fermentation conditions for low-temperature and high-efficiency composite microbial system for corn stover degradation and preliminary development of microbial inocula[J]. Journal of Agro -Environment Science, 2016, 35(8): 1602-1609. |
| [11] |
王春芳, 马诗淳, 黄艳, 等. 降解水稻秸秆的复合菌系及其微生物群落结构演替[J]. 微生物学报, 2016, 56(12): 1856-1868. WANG C F, MA S C, HUANG Y, et al. The succession of the complex bacteria and the microbial community structure of rice straw degradation[J]. Acta Microbiologica Sinica, 2016, 56(12): 1856-1868. |
| [12] |
WANG Y X, LIU Q, YAN L, et al. A novel lignin degradation bacterial consortium for efficient pulping[J]. Bioresource Technology, 2013, 139: 113-119. DOI:10.1016/j.biortech.2013.04.033 |
| [13] |
苏鑫, 王敬红, 张方政, 等. 复合菌系降解玉米秸秆过程中群落演替与秸秆降解的关系[J]. 微生物学报, 2020, 1-18. SU X, WANG J H, ZHANG F Z, et al. The relationship between community succession and straw degradation in the process of corn straw degradation by composite strains[J]. Acta Microbiologica, 2020, 1-18. |
| [14] |
QINGGEER, GAO J L, YU X F, et al. Screening of a microbial consortium with efficient corn stover degradation ability at low temperature[J]. Journal of Integrative Agriculture, 2016, 15(10): 2369-2379. DOI:10.1016/S2095-3119(15)61272-2 |
| [15] |
YU X F, BORJIGIN Q, GAO J L, et al. Exploration of the key microbes and composition stability of microbial consortium GF-20 with efficiently decomposes corn stover at low temperatures[J]. Journal of Integrative Agriculture, 2019, 18(8): 1893-1904. DOI:10.1016/S2095-3119(19)62609-2 |
| [16] |
田林双. 木质素降解相关酶类测定标准方法研究[J]. 畜牧与饲料学, 2009, 30(10): 13-15. TIAN L H. Study on the standard method for the determination of enzymes related to lignin degradation[J]. Animal Husbandry and Feed Science, 2009, 30(10): 13-15. |
| [17] |
郭夏丽, 程小平, 杨小丽, 等. 高效玉米秸秆降解菌复合系的构建[J]. 中国农学通报, 2010, 26(7): 261-266. GUO X L, CHENG X P, YANG X L, et al. Construction of composite consortia with high capacity of lignocellulose degradation[J]. Chinese Agricultural Science Bulletin, 2010, 26(7): 261-266. |
| [18] |
刘尧, 李力, 李俊, 等. 玉米秸秆高效腐解复合菌系CSS-1的选育及其组成分析[J]. 中国农业科学, 2010, 43(21): 4437-4446. LIU Y, LI L, LI J, et al. Construction and composition analysis of the complex microbial system CSS -1 of high decomposition efficiency for corn stalks[J]. Scientia Agricultura Sinica, 2010, 43(21): 4437-4446. DOI:10.3864/j.issn.0578-1752.2010.21.013 |
| [19] |
杨梦雅, 闫非凡, 闫美超, 等. 低温木质纤维素分解复合菌系PLC- 8对玉米秸秆的分解特性[J]. 中国农业科技导报, 2021, 23(1): 73-81. YANG M Y, YAN F F, YAN M C, et al. Decomposition characteristics of corn stover by microbial consortium PLC-8 with lignocellulose-degradation at low temperature[J]. Journal of Agricultural Science and Technology, 2021, 23(1): 73-81. |
| [20] |
萨如拉, 高聚林, 于晓芳, 等. 玉米秸秆低温降解复合菌系的筛选[J]. 中国农业科学, 2013, 46(19): 4082-4090. SA R L, GAO J L, YU X F, et al. Screening of low temperature maize stalk decomposition microorganism[J]. Scientia Agricultura Sinica, 2013, 46(19): 4082-4090. DOI:10.3864/j.issn.0578-1752.2013.19.014 |
| [21] |
CAMARERO S, GALLETTI G C, MARTINEZ A T. Demonstration of in situ oxidative degradation of lignin side chains by two white-rot fungi using analytical pyrolysis of methylated wheat straw[J]. Rapid Communications in Mass Spectrometry, 2015, 11: 331-334. |
| [22] |
袁楠, 亢宗静, 卢圣鄂, 等. 富集培养下的若尔盖高原湿地低温纤维素降解细菌群落结构[J]. 应用与环境生物学报, 2016, 22(3): 402-408. YUAN N, KANG Z J, LU S E, et al. Community structure of low temperature cellulose degradation bacteria in Zoige Plateau wetland under enrichment culture[J]. Journal of Application and Environmental Biology, 2016, 22(3): 402-408. |
| [23] |
罗立津, 万立, 陈宏, 等. 耐低温木质纤维素降解菌群的富集培养及其种群结构分析[J]. 农业生物技术学报, 2015, 23(6): 727-737. LUO L J, WAN L, CHEN H, et al. Enrichment culture and population structure analysis of low temperature resistant lignocellulose degradation bacteria[J]. Journal of Agricultural Biotechnology, 2015, 23(6): 727-737. |
| [24] |
PIKUTA E V. Trichococcus patagoniensis sp. nov., a facultative anaer⁃obe that grows at -5 ℃, isolated from penguin guano in Chilean Patagonia[J]. Int J Syst Evol Microbiol, 2006, 56(9): 2055-2062. DOI:10.1099/ijs.0.64225-0 |
| [25] |
RAMESHKUMAR N, SPROER C, LANG E, et al. Azospirillum ramasamyi sp. nov. a novel diazotrophic bacterium isolated from fermented bovine products[J]. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(5): 1369-1375. DOI:10.1099/ijsem.0.003320 |
| [26] |
ECKERT B, WEBER O B, KIRCHHOF G, et al. Azospirillum doebereinerae sp. nov., a nitrogen-fixing bacterium associated with the C4-grass Miscanthus[J]. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(1): 17-26. DOI:10.1099/00207713-51-1-17 |
| [27] |
JACKSON C A, COUGER M B, PRABHAKARAN M, et al. Isolation and characterization of Rhizobium sp. strain YS-1r that degrades lignin in plant biomass[J]. Journal of Applied Microbiology, 2017, 122(4): 940-952. DOI:10.1111/jam.13401 |
| [28] |
LAUS M C, VAN BRUSSEL A A N, KIJNE J W. Role of cellulose fibrils and exopolysaccharides of Rhizobium leguminosarum in attachment to and infection of Vicia sativa root hairs[J]. Molecular Plant-Microbe Interactions, 2005, 18(6): 533-538. DOI:10.1094/MPMI-18-0533 |
| [29] |
孟建宇, 冀锦华, 贾丽娟, 等. 基于三种碳源筛选低温纤维素降解菌及其复合系的降解能力分析[J]. 生物技术通报, 2019, 35(8): 77-84. MENG J Y, JI J H, JIA L J, et al. Solation of cold-adapted cellulose-degrading bacteria using three different carbon sources and analysis on the degrading ability of consortia[J]. Biotechnology Bulletin, 2019, 35(8): 77-84. |
| [30] |
LO Y C, LU W C, CHEN C Y, et al. Characterization and high level production of xylanase from an indigenous cellulolytic bacterium Acinetobacter junii F6-02 from southern Taiwan soil[J]. Biochemical Engineering Journal, 2010, 53(1): 77-84. DOI:10.1016/j.bej.2010.09.011 |
| [31] |
BERTINO-GRIMALDI D, MEDEIROS M N, VIEIRA R P, et al. Bacterial community composition shifts in the gut of Periplaneta americana fed on different lignocellulosic materials[J]. Springer Plus, 2013, 2(1): 609. DOI:10.1186/2193-1801-2-609 |
| [32] |
POOMAI N, SIRIPORNADULSIL W, SIRIPORNADULSIL S. Cellulase enzyme production from agricultural waste by Acinetobacter sp. KKU44[J]. Advanced Materials Research, 2014, 931/932: 1106-1110. DOI:10.4028/www.scientific.net/AMR.931-932.1106 |
| [33] |
KIRCHMAN D L. The ecology of Cytophaga-Flavobacteria in aquatic environments[J]. FEMS Microbiology Ecology, 2002, 39(2): 91-100. |
 2021, Vol. 40
2021, Vol. 40




