2. 中国科学院水利部水土保持研究所, 陕西 杨凌 712100
2. Institute of Soil and Water Conservation, CAS & MWR, Yangling 712100, China
依据世界温室气体数据中心(WDCGG)的监测数据[1],到2017年9月全球大气CO2浓度已经增加至403 μmol·mol-1。CO2浓度升高最为明显的影响就是导致全球气候变暖,IPCC第五次评估报告[2]指出,1880年以来全球平均气温升高了0.65~1.06 ℃;同时,IPPC认为CO2浓度和温度将持续升高,预测到2070— 2100年CO2浓度将达到524~935 μmol·mol-1,温度将升高1.1~4.8 ℃。大气CO2浓度和温度升高,势必对土壤生态系统产生复杂的影响[3-4]。
土壤酶是土壤生态系统中最活跃的组分之一[5]。土壤酶主要由土壤微生物产生,其主导土壤有机物的分解,催化土壤中碳、氮、磷养分的转化,通过降低反应活化能将聚合物(纤维素、木质素、蛋白质、磷酸酯等)分解为小分子,为植物与微生物提供养分[6-7]。土壤CO2浓度是大气CO2浓度的10~50倍;因此,许多学者认为CO2浓度升高通过影响植物生长,间接对土壤生态系统产生影响[8-9]。由于植物种类、年龄和生长季节等的不同,有关CO2浓度升高对土壤碳氮磷转化相关酶活性影响的研究结论也不尽相同,如对水稻土的研究表明,CO2浓度升高使土壤β-葡糖苷酶(βG)活性显著升高[10-11],但草地生态系统中土壤βG酶活性则对CO2浓度没有响应[12];ZHENG等[13]的研究结果显示,CO2浓度升高对温带森林土壤磷酸酶(AP)活性的影响在不同季节结果不同。一定范围内,温度升高不仅可以直接影响土壤酶促反应的反应速率,也可以通过影响土壤的物理环境、微生物群落、有机物质的矿化等因素间接影响土壤酶活性;此外,土壤碳氮磷转化相关酶活性对增温的响应也受到增温时间和降水等因素的影响[3-4, 14-15]。如MCDANIEL等[16]的研究表明,短时间增温导致βG酶和β-N-乙酰葡糖苷酶(NAG)活性减弱;而高山森林的长期增温实验结果表明,气候变暖改变了土壤碳、氮养分循环的平衡,增强了土壤βG酶和β-木糖苷酶(XYL)活性[17];然而ZUCCARINI等[18]的研究指出,只有当土壤水分充足时增温才会使土壤酶活性升高。此外,上述研究大多仅涉及单一气候因子变化对土壤酶活性的影响,但CO2浓度升高、增温、干旱等未来气候情景通常会同时存在,而多气候因子变化的相互作用对土壤酶产生的影响可能远比单气候因子变化对土壤酶活性的影响更加复杂。因此,研究气候变化对土壤酶活性的影响,需要深入了解多种气候因子交互作用下土壤酶活性的变化规律,并综合植物生长季节、植物生长状况以及土壤水分条件等多种环境条件进行系统研究。
已有关于土壤酶活性对气候变化响应的研究主要集中在森林、草原等自然生态系统[19-20],而涉及农田土壤生态系统的研究较为薄弱,且这些研究通常仅针对某个特定作物生长阶段,较少考虑作物不同生长发育阶段土壤酶活性对气候变化的响应[21-22]。在农田生态系统中,土壤碳氮磷养分状况是影响粮食生产的关键因素,研究土壤碳氮磷循环相关酶活性对气候变化的响应将加深理解未来气候变化对土壤养分循环过程的影响[10]。因此,本研究通过盆栽控制试验,利用人工气候室控制CO2浓度和环境温度,研究CO2浓度升高和增温对C4作物谷子(Setaria italica)各生育期土壤碳氮磷循环相关酶活性的影响,研究结果可为减缓气候变化对作物生产影响策略的制定提供科学依据,也为预估未来气候变化对C4作物生长过程中土壤质量的影响提供基础数据。
1 材料与方法 1.1 试验材料试验于2019年4—9月在西北农林科技大学人工气候室进行。供试作物为黄土高原典型旱作作物谷子,品种为晋谷21,全生育期120~140 d。供试土壤为陕西杨凌区农田表层0~20 cm土壤,土壤类型为埋娄土。土壤有机质(重铬酸钾外加热法)、全氮(凯氏定氮法)、全磷(H2SO4 -HClO4法)含量分别为31.03、1.51、0.97 g·kg-1,速效磷(NaHCO3法)含量为26.59 mg·kg-1。土壤pH值(复合电极法,土水比1∶2.5)为8.3,土壤容重(环刀法)为1.26 g·cm-3,土壤田间持水量为26%质量含水量。
盆栽器皿为圆柱形,底部无孔,其内径和深度分别为21 cm和27 cm。供试土壤采回后自然风干,过5 mm筛以去除石块和植物残体并混匀以确保肥力一致,根据测定的土壤容重(1.26 g·cm-3)和田间耕层深度(20 cm)计算得到每盆装土质量为7.00 kg(干土),每盆施入700 mg氮(尿素)作为底肥,将底肥与土壤充分混匀后装盆,静置24 h后进行第一次供水。根据试验土壤田间持水量(26.0% 质量含水量)和所测定试验土壤含水量(4.0% 质量含水量)的差值,计算每盆试验土壤达到田间持水量时所需要添加的水量进行供水,最后播种并封上保鲜膜以防止水分散失直至出苗。
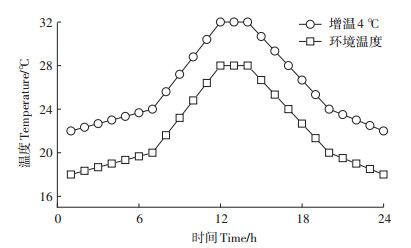
1.2 试验设计及依据盆栽试验共设6种处理:3种气候条件(对照、CO2浓度升高、CO2浓度升高和增温),2个水分条件(充分供水和轻度干旱)(表 1)。对于6种试验处理,分别在开花期(S1)、开花后10 d(S2)、灌浆期(S3)、成熟期(S4)4个谷子生育期测定土壤碳氮磷循环相关酶活性,每个生育期设置4个重复,共计96盆。气候条件利用人工气候室进行模拟,除CO2浓度和温度外,其余环境条件一致,光周期设置为12 h/12 h,光照时间为8:00—20:00,最大光强为600 μmol·m-2∙s-1,相对湿度为60%,CO2浓度由系统自动控制为恒定值,温度以24 h为周期进行变温控制(图 1);土壤水分条件通过人为控水进行模拟。
|
|
表 1 试验处理 Table 1 The experimental treatments |
|
图 1 试验期间人工气候室24 h温度设定 Figure 1 Temperature setting of artificial climate chamber in 24 h during the experimental period |
CO2浓度设定的依据分别为WDCGG在2017年9月的大气CO2浓度监测数据(400 μmol·mol-1)[1]和IPPC CMIP5[2]预测21世纪后期的全球大气CO2浓度(700 μmol·mol-1);环境温度的依据为国家气象科学数据中心(武功站)[23] 1981—2010年6—9月的累年日平均气温(日均温22 ℃),增温4 ℃的依据为IPPC CMIP5[2]预测21世纪后期的增温幅度(日均温26 ℃);充分供水和轻度干旱两个水分梯度的设定是依据前人的研究结果[24-25],分别设置70%田间持水量(18.0%土壤含水量)和50%田间持水量(13.0%土壤含水量),利用称质量的方法控制土壤含水量;同时,每间隔1个谷子生育期称量一部分盆栽的地上植株鲜质量,以此校正植株自身质量造成的土壤含水量误差。
1.3 试验步骤谷子播种时间为2019年4月19日,每盆5~7穴,每穴1~2粒;在谷子三叶期间苗,保留长势大小相近的3株幼苗,并使其在盆内均匀分布。盆栽在播种至拔节期放置于室外培养,所有盆栽土壤水分保持一致,即为60%田间持水量(15.6%质量含水量),精细管理,避免病虫害及小气候影响。谷子进入拔节期后,于2019年6月5日转移至人工模拟气候室进行气候情景模拟试验。具体为:对盆栽进行随机分组,即平均分成3组,分别放入3个气候室中,第一组为对照处理(CO2浓度为400 μmol · mol-1和日均温度为22 ℃),第二组为CO2浓度升高处理(CO2浓度为700 μmol·mol-1和日均温度为22 ℃),第三组为CO2浓度和温度升高组合处理(CO2浓度为700 μmol·mol-1和日均温度为26 ℃)。对同一气候室内盆栽再随机分为两组,分别设置充分供水(70%FC)和轻度干旱50%FC,且每日采用称质量的方法控制盆栽的土壤含水量,同时每周调换盆栽位置,避免由于局部光照、温度、湿度差异产生的影响,直至2019年9月收获。
1.4 土壤样品采集在谷子4个生育期(开花期、开花后10 d、灌浆期、成熟期),分别对不同CO2浓度、温度和水分处理的盆栽采集土壤样品。由于CO2浓度、温度和供水条件的不同,试验处理间谷子各生育期存在一定差别,故而土壤采样时间也存在一定差异。谷子生育期的划分标准参考《谷子规模化高效栽培技术研究》[26],具体采样时间见表 2。在采集完盆栽地上部分后,将土体完整从盆中取出,筛出根系,然后将盆栽土壤均匀混合后过2 mm筛,其中一部分新鲜样品保存于4 ℃冰箱中并在采样后14 d内测定土壤碳氮磷循环相关酶活性,另一部分土壤样品风干后测定土壤基本性质和pH值。
|
|
表 2 土壤样品采样时间 Table 2 Date of sampling |
土壤βG、NAG、LAP和ALP活性的测定采用SINSABAUGH等[27]的荧光酶标法并做部分修改。以Tris-HCl溶液为缓冲液,缓冲液pH值与土壤样品pH值保持一致,均为8.3。酶标板加样后在25 ℃恒温培养箱下培养相应时间后,在多功能酶标仪中以365 nm激发波长和450 nm发射波长测量荧光值并计算酶活性,各土壤酶对应酶底物及培养时间见表 3。
|
|
表 3 土壤酶活性测定的底物和培养时间 Table 3 Soil enzymes, their substrates, and incubation time |
土壤pH值测定采用国标法(NY/T 1377—2007),使用雷磁E-201型复合电极测定,土水比1∶2.5。
1.6 数据分析数据整理采用Microsoft office excel 2019,采用SAS 9.4统计软件进行重复测量方差分析(Repeated measures ANOVA),对交互作用显著的结果进一步进行简单效应分析。谷子各生育期不同处理间的差异性检验通过Duncan法进行多重比较,显著性水平检验(P < 0.05),采用Origin 2018绘图。
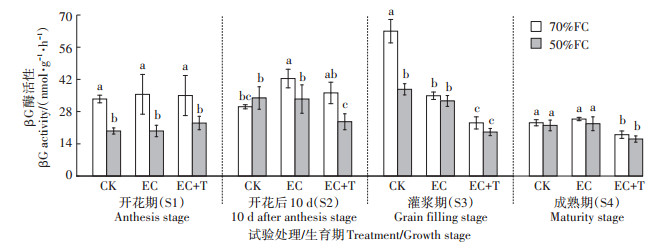
2 结果与分析 2.1 对土壤碳氮磷循环相关酶活性的影响 2.1.1 对土壤βG酶活性的影响由图 2可知,CO2浓度升高(由400 μmol·mol-1升至700 μmol·mol-1)对土壤βG酶活性的影响在两种土壤水分条件下存在显著差异。在70%FC条件下,与CK相比,EC处理使谷子S2生长阶段的土壤βG酶活性显著增加40.65%(P < 0.05),使谷子S3生长阶段土壤βG酶活性显著降低44.59%(P < 0.05)。在50%FC条件下,与CK相比,EC处理对土壤βG酶活无显著影响(P > 0.05)。在两种水分处理下,增温4 ℃(由22 ℃升至26 ℃)都对土壤βG酶活性具有抑制作用;在70%FC条件下,EC+T处理使土壤βG酶活性较之EC处理在S2、S3和S4生长阶段分别降低14.70%、33.80%(P < 0.05)和27.45%(P < 0.05);在50%FC条件下,土壤βG酶活性在S2、S3和S4生长阶段分别显著降低29.49%、41.42%和29.28%(P < 0.05)。
|
同一生育期内不同小写字母表示不同处理间差异显著(P < 0.05)。下同 Different lowercase letters in the same growth stage mean significant difference among different treatments at the 0.05 level. The same below 图 2 CO2浓度升高和增温对谷子各生育期土壤βG酶活性的影响 Figure 2 Effects of elevated CO2 and warming on soil βG activities at different growth stages of millet |
由图 3可知,CO2浓度升高对土壤NAG酶活性的影响在两种土壤水分条件下基本相同,但对70%FC处理下的土壤NAG酶活性的影响更显著。在70%FC条件下,与CK相比,EC处理使土壤NAG酶活性在S1、S2和S4生长阶段分别显著增加49.43%、37.88% 和34.58%(P < 0.05)。在50%FC条件下,与CK相比,EC处理使土壤NAG酶活性在S4生长阶段显著增加47.68%(P < 0.05),在S2生长阶段显著降低22.67%(P < 0.05),而在S1和S3生长阶段变化不显著。增温对土壤NAG酶活性的影响在两种土壤水分条件下存在差异。在70%FC条件下,EC+T处理较EC处理使土壤NAG酶活性在S4生长阶段显著降低46.21%(P < 0.05),而在其他3个生育期呈不显著的降低趋势(P > 0.05);在50%FC条件下,EC+T处理的土壤NAG酶活性较EC处理在S1和S2生长阶段显著增加52.52%和46.93%(P < 0.05),但在S3和S4生长阶段显著降低41.51%和54.96%(P < 0.05)。

|
图 3 CO2浓度升高和增温对谷子各生育期土壤NAG酶活性的影响 Figure 3 Effects of elevated CO2 and warming on soil NAG activities at different growth stages of millet |
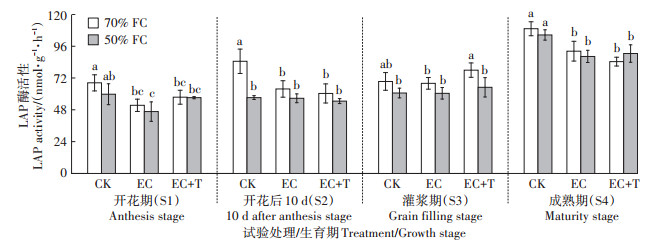
由图 4可知,CO2浓度升高在谷子4个生育期都表现出对土壤LAP酶活性的抑制作用。在70%FC条件下,与CK相比,EC处理使土壤LAP酶活性在S1、S2和S4生长阶段分别显著降低24.80%、24.60% 和15.52%(P < 0.05);在50%FC条件下,与CK相比,EC处理使土壤LAP酶活性在S1和S4生长阶段分别降低21.94%和15.52%(P < 0.05)。增温4 ℃使土壤LAP酶活性呈现不显著的增加趋势(P > 0.05)。
|
图 4 CO2浓度升高和增温对谷子各生育期土壤LAP酶活性的影响 Figure 4 Effects of elevated CO2 and warming on soil LAP activities at different growth stages of millet |
由图 5可知,CO2浓度升高对土壤ALP酶活性的影响在两种土壤水分条件下存在明显差异。在70%FC条件下,与CK相比,EC处理使土壤ALP酶活性在S2和S4生长阶段分别增加10.07% 和28.85%(P < 0.05),而在S3生长阶段显著降低22.20%(P < 0.05);在50%FC条件下,土壤ALP酶活性只在S3和S4生长阶段显著增加8.82% 和50.67%(P < 0.05)。增温一定程度上抑制了土壤ALP酶活性。在70%FC条件下,EC+T处理较EC处理使土壤ALP酶活性在S2和S4生长阶段分别显著降低17.05%和26.95%(P < 0.05);在50%FC条件下,EC+T处理较EC处理使土壤ALP酶活性在S3和S4生长阶段分别显著降低12.89%和35.72%(P < 0.05)。

|
图 5 CO2浓度升高和增温对谷子各生育期土壤ALP酶活性的影响 Figure 5 Effects of elevated CO2 and warming on soil ALP activities at different growth stages of millet |
重复测量方差分析结果(表 4)显示,4种土壤碳氮磷循环相关酶活性在谷子不同生育期均表现出极显著差异(P < 0.01)。两种土壤水分条件下CO2浓度升高、增温和生育期的交互作用对谷子土壤酶活性的影响存在较大差异。在70%FC条件下,CO2浓度升高与增温交互作用对4种土壤酶活性均有显著影响(P < 0.05),且二者交互作用对土壤βG和ALP酶活性具有极显著影响(P < 0.01);CO2浓度升高与生育期的交互作用在70%FC对4种土壤酶活性均有显著影响(P < 0.05);增温与生育期的交互作用对4种土壤酶活性均无显著影响;CO2浓度升高、增温与生育期三者的交互作用对土壤βG、NAG和LAP酶活性均有极显著影响(P < 0.01)。在50%FC条件下,CO2浓度升高与增温的交互作用仅对土壤βG酶活性具有极显著影响(P < 0.01);CO2浓度升高与生育期的交互作用对土壤NAG、LAP、ALP酶活性均有显著影响(P < 0.05);增温与生育期的交互作用仅对土壤βG和NAG酶活性具有极显著影响(P < 0.01)。CO2、温度与生育期的交互作用对土壤βG、NAG、LAP酶具有显著影响(P < 0.05),其中其对土壤βG和NAG两种酶活性具有极显著影响(P < 0.01)。
|
|
表 4 CO2、温度和谷子生育期对土壤碳氮磷循环相关酶活性影响的重复测量方差分析 Table 4 Repeated measures ANOVA for the effects of CO2, temperature, growth stage, and their interaction on soil carbon, nitrogen, and phosphorus transformation-linked enzyme activities |
在重复测量方差分析的基础上,再对CO2浓度升高、增温和生育期交互作用对土壤酶活性的影响进行简单效应分析(见附表 1~附表 8,扫描文章首页OSID码浏览)。结果显示:对于土壤βG酶,在70%FC条件下,EC+T处理的土壤βG酶活性仅在S3生长阶段极显著低于CK处理(P < 0.01),而在其他生育期差异不显著(P > 0.05);在50%FC条件下,与CK和EC处理相比,EC+T处理的土壤βG酶活性在S2、S3和S4生长阶段均显著低降(P < 0.05),表明增温对土壤βG酶活性的抑制作用在50%FC条件下更显著。对于土壤NAG酶,在70%FC条件下,EC处理的土壤NAG酶活性在S1和S2生长阶段显著高于CK处理(P < 0.05),EC+T处理的土壤NAG酶活性在S1和S2生长阶段极显著高于CK处理(P < 0.01),但其在S3和S4生长阶段则极显著低于CK处理(P < 0.01);在50%FC条件下,EC与CK处理的土壤NAG酶活性在谷子4个生育期均无显著差异(P > 0.05),EC+T处理的土壤NAG酶活性在S1生长阶段显著高于CK和EC处理(P < 0.05),但在S3生长阶段显著低于CK处理(P < 0.05),表明CO2浓度升高对土壤NAG酶活性的影响仅在土壤水分充足时具有促进作用,且其促进作用随谷子生长呈逐渐减弱的变化趋势;在50%FC条件下,增温对土壤NAG酶活性的影响在S1和S2生长阶段有一定的促进作用,而在S3和S4生长阶段转变为抑制作用。对于土壤LAP酶,在70%FC条件下,EC处理的土壤LAP酶活性在S1、S2和S4生长阶段均显著低于CK处理(P < 0.05),EC+ T处理的土壤酶活性在S2和S4生长阶段显著低于CK处理(P < 0.05);在50%FC条件下,EC处理的土壤LAP酶活性在S1和S4生长阶段均极显著低于CK处理(P < 0.01),EC+T处理的土壤酶活性在S4生长阶段显著低于CK处理(P < 0.05),表明CO2浓度升高在大多数谷子生育期抑制土壤LAP酶活性,而增温对LAP酶活性无显著影响。对于土壤ALP酶,在70%FC条件下,EC与CK处理的土壤ALP酶活性在4个生育期均无显著差异(P > 0.05);在50%FC条件下,EC处理的土壤ALP酶活性在S1和S4生长阶段显著高于CK处理(P < 0.05),表明CO2浓度升高仅在干旱条件下对土壤ALP酶活性有一定的促进作用。
3 讨论土壤中大分子有机物水解为可利用的小分子物质的过程需要多种酶的参与,本研究所选择的βG、NAG、LAP和ALP酶是催化纤维素、几丁质、蛋白质和有机磷水解末端单体产生的酶,能够有效表征土壤中碳、氮、磷的分解和循环,是目前陆地生态学研究最多的几种酶[27-30]。已有研究表明,CO2浓度和温度的变化能够直接或者间接影响这4种土壤碳氮磷循环相关酶活性[4]。
3.1 CO2浓度升高对土壤碳氮磷循环相关酶的影响普遍认为CO2浓度升高是通过影响植物生理生化过程,间接改变土壤微生物群落的组成与活性,从而对土壤酶活性产生影响[31-32]。虽然在谷子灌浆期,EC处理可使土壤βG酶活性有所降低,但总体变化不显著,这可能与谷子的生理特性有关。谷子是一种C4作物,C4植物光合时会先在维管束鞘细胞中富集CO2,因此大气CO2浓度升高理论上不会对C4植物光合作用产生影响[33]。如LEAKEY等[34]的研究表明,在非干旱条件下CO2升高对C4植物光合作用、生物量以及碳氮代谢指标均无显著影响。本研究中,70%FC条件下,EC处理可使土壤NAG酶活性显著升高,而使土壤LAP酶活性显著降低,该结果与阿尔卑斯山区高山草地的研究结果一致[12]。这可能是由于当水分充足时,CO2浓度升高改变了土壤微生物氮的获取策略,使土壤微生物开始利用更难以分解的几丁质中的氮[32]。土壤ALP酶活性对于CO2升高的响应受土壤水分条件影响,在70%FC条件下,土壤ALP酶活性受CO2升高的影响不显著;而在50%FC条件下,土壤ALP酶活性出现显著的增加趋势。这可能是因为土壤磷元素受水分因素影响较大,而CO2浓度升高会降低谷子植株的蒸腾速率,提高水分利用效率,一定程度上改善土壤水分状况[35]。WANG等[36]的研究结果也显示,土壤酶活性受到干旱的显著影响,而CO2浓度升高能够一定程度地改善干旱对土壤酶活性的抑制作用。
3.2 增温对土壤碳氮磷循环相关酶的影响温度是影响土壤酶活性的一个重要因子,增温通过直接影响土壤酶促反应速率和间接影响土壤物理环境、土壤微生物群落、有机物质矿化等因素对土壤酶活性产生影响[3, 15]。本研究中,与EC处理相比,增温4 ℃可使土壤βG和ALP酶活性显著降低。LOOBY等[19]的研究发现,在热带森林中土壤βG酶活性在0~ 2 ℃的增温下呈升高趋势,而当增温高于2 ℃后开始呈下降趋势,表明在较高的增温条件下,土壤酶活性可能受到抑制。本研究表明,增温对土壤LAP酶活性影响不显著,但其在两种水分条件之间存在差异;在70%FC条件下,增温对土壤NAG酶活性的影响在S2~S4生长阶段均显著降低,而在50%FC条件下,其从S1到S2生长阶段呈增加趋势,但从S3到S4生长阶段呈降低趋势,此现象说明土壤中与氮循环相关酶活性对增温的响应受制于土壤水分条件,这与CUSACK等[37]和KARDOL等[38]的研究结果相一致。本研究还表明,在70%FC条件下增温4 ℃对土壤βG和ALP酶活性的影响程度小于50%FC条件。ZHOU等[39]的研究也显示,增温对土壤ALP酶活性的影响很可能是通过影响土壤水分条件来实现的。
3.3 CO2浓度升高和增温交互作用对土壤碳氮磷循环相关酶的影响CO2浓度升高与增温的交互作用主要通过对微生物群落和植物生长的影响进而对土壤酶活性产生影响[40]。本研究中,在70%FC条件下,CO2浓度升高仅对NAG和LAP酶活性有显著影响,而CO2浓度升高与增温的交互作用对4种土壤碳氮磷循环相关酶活性均具有显著影响,这表明与仅CO2浓度升高相比,CO2浓度升高与增温的交互作用对土壤酶活性的影响更强烈,这一结果与刘远等[41]在小麦田中的研究结果相一致。
3.4 谷子生育期与气候因子交互作用对土壤碳氮磷循环相关酶的影响土壤酶活性与植物生理活动密切相关,而谷子光合生理在不同生育期对大气环境变化的响应不同[42],这与周娅等[43]和李奕霏等[11]在玉米及水稻土壤中的研究结果相一致。在本研究中生育期对4种土壤碳氮磷循环相关酶活性均具有极显著影响,谷子生育期与CO2升高的交互作用对4种土壤酶活性均具有显著影响,生育期、CO2浓度升高与增温的交互作用对土壤βG、NAG和LAP酶活性均产生显著影响,这表明作物不同生育期的生理活动会影响土壤酶活性对大气环境变化的响应。本研究还发现,CO2浓度升高与增温直接导致了谷子生育期缩短,这与已有的大多数实验结果相一致[44-45],而作物生育期时长的变化能够影响作物对土壤养分的获取,进而导致土壤酶活性发生改变[43, 46]。
4 结论(1)CO2浓度升高对土壤βG酶活性的影响整体上不显著,但增温显著抑制土壤βG酶活性,且抑制作用在灌浆期达到最大,此后呈降低趋势,轻度干旱加剧了增温对土壤βG酶活性的抑制作用。
(2)在充分供水条件下,CO2浓度升高增加了土壤NAG酶活性,而增温对土壤NAG酶活性产生抑制作用;在轻度干旱条件下,CO2浓度升高对土壤NAG酶活性无显著影响,而增温对土壤NAG酶活性在开花-灌浆期有促进作用,但在灌浆-收获期有抑制作用。(3)在两种水分条件下,土壤LAP酶活性在4个谷子生育期均受到CO2浓度升高的抑制作用,而增温对土壤LAP酶活性无显著影响。
(4)CO2浓度升高,在充分供水条件下对土壤ALP酶活性影响不显著;但在轻度干旱条件下CO2浓度升高显著增加了土壤ALP酶活性。在两种水分条件下,增温均显著抑制土壤ALP酶活性。
| [1] |
World Data Centre for Greenhouse Gases[EB/OL]. (2019-02-19)[2020-03-30]. https://gaw.kishou.go.jp/.
|
| [2] |
IPCC 2014: Climate change 2014: Synthesis report. Contribution of Working Groups Ⅰ, Ⅱ and Ⅲ to the fifth assessment report of the intergovernmental panel on climate change[R]. IPCC, Geneva, Switzerland, 2014.
|
| [3] |
TSCHERKO D, KANDELER E, JONES T H. Effect of temperature on below-ground N-dynamics in a weedy model ecosystem at ambient and elevated atmospheric CO2 levels[J]. Soil Biology and Biochemistry, 2001, 33(4/5): 491-501. |
| [4] |
吴秀臣, 孙辉, 杨万勤. 土壤酶活性对温度和CO2浓度升高的响应研究[J]. 土壤, 2007, 39(3): 358-363. WU X C, SUN H, YANG W Q. Effects of elevated temperature and atmospheric carbon dioxide on activity of soil enzymes[J]. Soils, 2007, 39(3): 358-363. DOI:10.3321/j.issn:0253-9829.2007.03.006 |
| [5] |
CUI Y X, FANG L C, GUO X B, et al. Ecoenzymatic stoichiometry and microbial nutrient limitation in rhizosphere soil in the arid area of the northern Loess Plateau, China[J]. Soil Biology and Biochemistry, 2018, 116: 11-21. DOI:10.1016/j.soilbio.2017.09.025 |
| [6] |
ALLISON V J, CONDRON L M, PELTZER D A, et al. Changes in enzyme activities and soil microbial community composition along carbon and nutrient gradients at the Franz Josef chronosequence, New Zealand[J]. Soil Biology and Biochemistry, 2007, 39(7): 1770-1781. DOI:10.1016/j.soilbio.2007.02.006 |
| [7] |
SINSABAUGH R L, HILL B H, SHAH J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798. DOI:10.1038/nature08632 |
| [8] |
BRUCE K D, JONES T H, BEZEMER T M, et al. The effect of elevated atmospheric carbon dioxide levels on soil bacterial communities[J]. Global Change Biology, 2000, 6(4): 427-434. DOI:10.1046/j.1365-2486.2000.00320.x |
| [9] |
REDDY A R, RASINENI G K, RAGHAVENDRA A S. The impact of global elevated CO2 concentration on photosynthesis and plant productivity[J]. Current Science, 2010, 99(1): 46-57. |
| [10] |
DAS S, BHATTACHARYYA P, ADHYA T K. Interaction effects of elevated CO2 and temperature on microbial biomass and enzyme activities in tropical rice soils[J]. Environ Monit Assess, 2011, 182(1/2/3/4): 555-569. |
| [11] |
李奕霏, 肖谋良, 袁红朝, 等. CO2倍增对稻田土壤碳氮水解酶活性的影响[J]. 中国环境科学, 2018, 38(9): 3474-3480. LI Y F, XIAO M L, YUAN H C, et al. Effects of doubled concentration of CO2 on soil hydrolase activities related to turnover of soil C and N in a rice-cropping system[J]. China Environmental Science, 2018, 38(9): 3474-3480. DOI:10.3969/j.issn.1000-6923.2018.09.034 |
| [12] |
MAYR C, MILLER M, INSAM H. Elevated CO2 alters community-level physiological profiles and enzyme activities in alpine grassland[J]. Journal of Microbiological Methods, 1999, 36(1/2): 35-43. |
| [13] |
ZHENG J Q, HAN S J, ZHOU Y M, et al. Microbial activity in a temperate forest soil as affected by elevated atmospheric CO2[J]. Pedosphere, 2010, 20(4): 427-435. DOI:10.1016/S1002-0160(10)60032-X |
| [14] |
KANG H J, KIM S Y, FENNER N, et al. Shifts of soil enzyme activities in wetlands exposed to elevated CO2[J]. Science of the Total Environment, 2005, 337(1/2/3): 207-212. |
| [15] |
林娜, 刘勇, 李国雷, 等. 森林土壤酶研究进展[J]. 世界林业研究, 2010, 23(4): 21-25. LIN N, LIU Y, LI G L, et al. Research progress on forest soil enzyme[J]. World Forestry Reasearch, 2010, 23(4): 21-25. |
| [16] |
MCDANIEL M D, KAYE J P, KAYE M W. Increased temperature and precipitation had limited effects on soil extracellular enzyme activities in a post-harvest forest[J]. Soil Biology and Biochemistry, 2013, 56: 90-98. DOI:10.1016/j.soilbio.2012.02.026 |
| [17] |
SOUZA R C, SOLLY E F, DAWES M A, et al. Responses of soil extracellular enzyme activities to experimental warming and CO2 enrichment at the alpine treeline[J]. Plant and Soil, 2017, 416(1/2): 527-537. |
| [18] |
ZUCCARINI P, ASENSIO D, OGAYA R, et al. Effects of seasonal and decadal warming on soil enzymatic activity in a P-deficient Mediterranean shrubland[J]. Global Change Biology, 2020, 26(6): 3698-3714. DOI:10.1111/gcb.15077 |
| [19] |
LOOBY C I, TRESEDER K K. Shifts in soil fungi and extracellular enzyme activity with simulated climate change in a tropical montane cloud forest[J]. Soil Biology and Biochemistry, 2018, 117: 87-96. DOI:10.1016/j.soilbio.2017.11.014 |
| [20] |
STARK S, YLÄNNE H, TOLVANEN A. Long-term warming alters soil and enzymatic N∶P stoichiometry in subarctic tundra[J]. Soil Biology and Biochemistry, 2018, 124: 184-188. DOI:10.1016/j.soilbio.2018.06.016 |
| [21] |
赵杏. 不同植茶年限土壤碳氮养分、胞外酶活性及微生物多样性对极端气候的响应[D]. 杭州: 浙江大学, 2016: 26-38. ZHAO X. Responses of soil carbon and nitrogen nutrients, enzyme activities and microbial communities to extreme climate in various cultivation ages from tea orchards[D]. Hangzhou: Zhejiang University, 2016: 26-38. |
| [22] |
PAPP R, MARINARI S, MOSCATELLI M C, et al. Short-term changes in soil biochemical properties as affected by subsidiary crop cultivation in four European pedo-climatic zones[J]. Soil and Tillage Research, 2018, 180: 126-136. DOI:10.1016/j.still.2018.02.019 |
| [23] |
国家气象科学数据中心. 地面气象资料[EB/OL]. http://data.cma.cn/order/list/show_value/normal.html. China Meteorological Data Service Center, National Meteorological Information Centre. Surface date[EB/OL]. http://data.cma.cn/order/list/show_value/normal.html. |
| [24] |
王永丽, 王珏, 杜金哲, 等. 不同时期干旱胁迫对谷子农艺性状的影响[J]. 华北农学报, 2012, 27(6): 125-129. WANG Y L, WANG Y, DU J Z, et al. Effects of drought stress at different periods on agronomic traits of millet[J]. Acta Agriculturae Boreali-Sinica, 2012, 27(6): 125-129. |
| [25] |
袁蕊, 郝兴宇, 胡晓雪, 等. 干旱对谷子灌浆期光合生理及生长发育的影响[J]. 山西农业大学学报(自然科学版), 2017, 37(6): 396-401. YUAN R, HAO X Y, HU X X, et al. Effects of drought on photosynthetic physiology and growth of millet during grain filling[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2017, 37(6): 396-401. DOI:10.3969/j.issn.1671-8151.2017.06.005 |
| [26] |
李明哲, 郝洪波, 崔海英. 谷子规模化高效栽培技术研究[M]. 北京: 中国农业科学技术出版社, 2016: 15-17. LI M Z, HAO H B, CUI H Y. Research on the large-scale and efficient cultivation techniques of millet[M]. Beijing: China Agricultural Science and Technology Press, 2016: 15-17. |
| [27] |
SINSABAUGH R L, LAUBER C L, WEINTRAUB M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264. DOI:10.1111/j.1461-0248.2008.01245.x |
| [28] |
SCHIMEL J P, WEINTRAUB M N. The implications of exoenzyme activity on microbial carbon and nitrogen limitation in soil: A theoretical model[J]. Soil Biology and Biochemistry, 2003, 35(4): 549-563. DOI:10.1016/S0038-0717(03)00015-4 |
| [29] |
HILL B H, ELONEN C M, JICHA T M, et al. Sediment microbial enzyme activity as an indicator of nutrient limitation in Great Lakes coastal wetlands[J]. Freshwater Biology, 2006, 51(9): 1670-1683. DOI:10.1111/j.1365-2427.2006.01606.x |
| [30] |
MOORHEAD D L, SINSABAUGH R L. A theoretical model of litter decay and microbial interaction[J]. Ecological Monographs, 2006, 76(2): 151-174. DOI:10.1890/0012-9615(2006)076[0151:ATMOLD]2.0.CO;2 |
| [31] |
PHILLIPS R L, ZAK D R, HOLMES W E, et al. Microbial community composition and function beneath temperate trees exposed to elevated atmospheric carbon dioxide and ozone[J]. Oecologia, 2002, 131(2): 236-244. DOI:10.1007/s00442-002-0868-x |
| [32] |
KELLEY A M, FAY P A, POLLEY H W, et al. Atmospheric CO2 and soil extracellular enzyme activity: A meta-analysis and CO2 gradient experiment[J]. Ecosphere, 2011, 2(8). |
| [33] |
WAND S J E, MIDGLEY G F, JONES M H, et al. Responses of wild C4 and C3 grass(Poaceae)species to elevated atmospheric CO2 concentration: A meta-analytic test of current theories and perceptions[J]. Global Change Biology, 1999, 5(6): 723-741. DOI:10.1046/j.1365-2486.1999.00265.x |
| [34] |
LEAKEY A D B, URIBELARREA M, AINSWORTH E A, et al. Photosynthesis, productivity, and yield of maize are not affected by openair elevation of CO2 concentration in the absence of drought[J]. Plant Physiology, 2006, 140(2): 779-790. DOI:10.1104/pp.105.073957 |
| [35] |
ZHANG D, LI A, LAM S K, et al. Increased carbon uptake under elevated CO2 concentration enhances water-use efficiency of C4 broomcorn millet under drought[J]. Agricultural Water Management, 2020, 245: 106631. |
| [36] |
WANG Y, YAN D, WANG J, et al. Effects of elevated CO2 and drought on plant physiology, soil carbon and soil enzyme activities[J]. Pedosphere, 2017, 27(5): 846-855. DOI:10.1016/S1002-0160(17)60458-2 |
| [37] |
CUSACK D F, TORN M S, MCDOWELL W H, et al. The response of heterotrophic activity and carbon cycling to nitrogen additions and warming in two tropical soils[J]. Global Change Biology, 2010, 16(9): 2555-2572. |
| [38] |
KARDOL P, CREGGER M A, CAMPANY C E, et al. Soil ecosystem functioning under climate change: Plant species and community effects[J]. Ecology, 2010, 91(3): 767-781. DOI:10.1890/09-0135.1 |
| [39] |
ZHOU X Q, CHEN C R, WANG Y F, et al. Warming and increased precipitation have differential effects on soil extracellular enzyme activities in a temperate grassland[J]. Science of the Total Environment, 2013, 444: 552-558. DOI:10.1016/j.scitotenv.2012.12.023 |
| [40] |
冯瑞芳, 杨万勤, 张健, 等. 模拟大气CO2浓度和温度升高对亚高山冷杉(Abies faxoniana)林土壤酶活性的影响[J]. 生态学报, 2007, 27(10): 4019-4026. FENG R F, YANG W Q, ZHANG J, et al. Effects of simulated elevated atmospheric CO2 concentration and temperature on soil enzyme activity in the subalpine fir forest[J]. Acta Ecologica Sinca, 2007, 27(10): 4019-4026. |
| [41] |
刘远, 潘根兴, 张辉, 等. 大气CO2浓度和温度升高对麦田土壤呼吸和酶活性的影响[J]. 农业环境科学学报, 2017, 36(8): 1484-1491. LIU Y, PAN G X, ZHANG H, et al. Effects of elevated atmospheric CO2 concentration and temperature on soil respiration and enzyme activity in a wheat field[J]. Journal of Agro-Environment Science, 2017, 36(8): 1484-1491. |
| [42] |
胡晓雪. CO2浓度升高和干旱交互作用对谷子生长与光合生理的影响[D]. 晋中: 山西农业大学, 2017: 11-18. HU X X. Effect of elevated CO2 on growth and photosynthetic physiology of foxtail millet under different water conditions[D]. Jinzhong: Shanxi Agricultural University, 2017: 11-18. |
| [43] |
周娅, 冯倩, 王玉, 等. 覆膜玉米不同生育期土壤酶活性对大气CO2浓度升高的响应[J]. 农业环境科学学报, 2019, 38(5): 1185-1192. ZHOU Y, FENG Q, WANG Y, et al. Effects of elevated CO2 on soil enzyme activities at different growth stages of maize grown with plastic film mulching[J]. Journal of Agro -Environment Science, 2019, 38(5): 1185-1192. |
| [44] |
侯雯嘉, 耿婷, 陈群, 等. 近20年气候变暖对东北水稻生育期和产量的影响[J]. 应用生态学报, 2015, 26(1): 249-259. HOU W J, GENG T, CHEN Q, et al. Impacts of climate warming on growth period and yield of rice in northeast China during recent two decades[J]. Chinese Journal of Applied Ecology, 2015, 26(1): 249-259. |
| [45] |
赵彦茜, 肖登攀, 柏会子, 等. 中国作物物候对气候变化的响应与适应研究进展[J]. 地理科学进展, 2019, 38(2): 224-235. ZHAO Y X, XIAO D P, BAI H Z, et al. Research progress on the response and adaptation of crop phenology to climate change in China[J]. Progress in Geography, 2019, 38(2): 224-235. |
| [46] |
银敏华, 李援农, 李昊, 等. 覆盖模式对农田土壤环境与冬小麦生长的影响[J]. 农业机械学报, 2016, 47(4): 127-135, 227. YIN M H, LI Y N, LI H, et al. Effects of mulching patterns on farmland soil environment and winter wheat growth[J]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(4): 127-135, 227. |
 2021, Vol. 40
2021, Vol. 40