2. 河北农业大学资源与环境科学学院, 河北 保定 071000;
3. 北京市昌平区土肥站, 北京 102200
2. College of Resource and Environmental Sciences, Hebei Agricultural University, Baoding 071000, China;
3. Soil Fertilizer Station of Changping District, Beijing 102200, China
CO2、CH4和N2O作为3种主要的温室气体(Greenhouse gas,GHG),其排放量的日益增加成为全球气候变暖的重要驱动力之一[1]。农田生态系统作为陆地生态系统的重要组成部分,该系统中CO2、N2O和CH4排放分别占到了人为温室气体排放量的23%、60%和50%,占到全球温室气体排放总量的21%~37%,农田土壤成为最主要的排放源之一[2-3]。随着我国蔬菜需求量的刚性增长,城郊区的粮田逐渐转换为设施蔬菜产地,这导致我国设施蔬菜种植面积逐年增加。到2018年设施菜地面积达400万hm2,占蔬菜种植面积的19.1%(2019年国家统计局网),成为我国农业生态系统主要组成部分,其温室气体排放动态对全球气候变化具有重要影响。
目前关于设施菜田土壤温室气体排放研究主要侧重于其对水肥管理措施变化的响应[4-7],众多研究均证实合理水肥管理可有效提高作物养分利用率而减少设施土壤养分累积[4, 6, 8],且可以改善微生物群落组成[7],进而减少土壤温室气体排放。在实际生产中,我国设施菜田长时间连续种植,且种植中长期不合理的水肥投入和管理,导致其成为我国农业温室气体排放的重要排放源。随种植年限增加,设施系统凸现出土壤酸化、次生盐渍化、硝酸盐盈余、重金属积累[9-11]及微生物多样性降低、连作障碍等[12-13]一系列生态环境问题,且这些方面均已引起国内外学者的广泛关注和报道。但涉及到不同种植年限温室中土壤温室气体排放以及其影响因素的研究还较为缺乏。当前关于种植年限对设施土壤温室气体排放的影响多集中在单个年限,且大多针对N2O排放研究[5, 14-16],导致目前对我国设施菜田土壤温室气体排放总体认识不足。众多研究证实不同种植年限设施土壤pH和有机质、NH4+ -N、NO3- -N含量等土壤理化性质[4, 9-10, 14]以及土壤酶活性和微生物组成[12, 17]等差异较大。这些因素改变可直接或者间接影响土壤温室气体的产生,进而造成不同种植年限设施菜地温室气体排放的差异。因而,了解设施菜地土壤温室气体排放规律及影响因素,对科学指导设施菜田温室气体减排意义重大。
北京作为都市农业的典范,设施农业是北京的主体农业,其设施蔬菜也同样有不同种植年限。鉴于此,本研究在京郊选取种植年限为5、10、15、20 a的日光温室为研究对象,同步原位测定CO2、N2O和CH4 3种温室气体排放通量,同时分析相关环境因子(土壤理化性质、酶活性)变化,以期揭示不同种植年限日光温室土壤温室气体排放特征以及其影响因素。结合温室气体排放总量、综合增温潜势、排放强度结果对温室气体排放总体状态加以评价,以便为综合评价种植年限对设施菜地土壤生态系统的影响提供数据支撑,也为该地区日光温室的科学管理以及设施菜田温室气体减排提供相关的理论依据。
1 材料与方法 1.1 试验地概况试验样地选择在北京大兴区农业技术示范站(39°39′47″N,116°33′40″E)。该地域属大陆性季风气候,年均降水量477.2 mm,年平均气温8 ℃,年日照2 800 h,供试土壤为褐土。
1.2 研究方法 1.2.1 试验设置以温室棚间菜地为对照(CK),种植作物5 a(Y5)、10 a(Y10)、15 a(Y15)、20 a(Y20)的温室(长80 m、宽8 m)各1个,每个温棚的土壤质地和管理措施一致。4个温棚的种植模式一致,均为春夏茬种植番茄,秋冬茬种植油麦菜和菠菜。设施菜地施肥方式均为有机-无机配施模式,基肥兼施有机肥,化肥主要施用氮磷钾复合肥和水溶肥,灌溉方式为滴灌。4个温棚肥料用量如下:氮磷钾复合肥750 kg·hm-2(NP2O5-K2O=15-15-15,N主要形式是尿素态氮和少部分铵态氮),有机肥3×104 kg·hm-2,在番茄定植后的第42、60 d和83 d分3次追施水溶肥300 kg·hm-2(NP2O5-K2O=30-10-10,N主要形态是铵态氮及少部分硝态氮);棚间按照露天蔬菜种植管理,基肥施用复合肥750 kg·hm-2(N-P2O5-K2O=15-15-15),有机肥3× 104 kg·hm-2,分3次追施水溶肥150 kg·hm-2(N-P2O5-K2O=30-10-10)。温室(近5 a)在8月中旬进行15 d闷棚处理。供试样地2018年均种植番茄(春夏茬),定植时间为4月10日,种植时间与施肥方式均保持一致。
1.2.2 土壤温室气体取样与测定采用常规静态箱法-气相色谱法。于番茄定植后进行设施菜地CO2、CH4和N2O排放通量测定,测定时间均为上午9:00—11:00。基肥后12 d内,每3 d取样1次;追肥后,每2 d取样1次,连续取3次;其余时段12 d取样测定1次。每个温棚和对照样地均选择5个5 m×5 m样地,作为5个重复。静态箱采用不透明的PVC板制作,其规格为内径320 mm、高200 mm。测定前24 h将水槽底座插入土壤中5 cm,取样时将其置于水槽底座中形成密闭空间,分别在0、5、15、30 min后用密封气瓶收集箱内气体。使用气相色谱仪(HP6890N,Agilent公司)测定温室气体浓度,CO2和CH4浓度采用氢火焰离子检测器(FID),测定温度为200 ℃,色谱柱为Porpak Q填充柱,柱温70 ℃;N2O浓度采用电子捕获检测器(ECD),测定温度为330 ℃,色谱柱为Porpak Q填充柱,柱温70 ℃。
温室气体排放通量(F)的计算公式为:
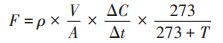
|
(1) |
式中:F 表示CO2排放通量(mg·m-2·h-1)或N2O、CH4排放通量(μg·m-2·h-1);ρ 表示标准状态下CO2、CH4和N2O的密度,mg·cm-3;V 为采样箱体积,m3;A 为采样底座内土壤表面积,m2;ΔC/Δt 表示气体的排放速率,μL·L-1·h-1;T 为采样箱内温度,℃。
温室气体排放总量计算:用生长季观测数据对番茄生长季温室气体排放总量进行估算,公式为:
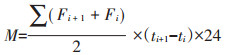
|
(2) |
式中:M为温室气体累积通量,kg·hm-2;Fi和Fi+1分别为第i 次和第i+1次取样气体通量,mg·m-2·h-1或μg· m-2·h-1;ti和ti+1分别为第i 次和第i+1次取样日期。
综合温室效应(Global warming potential,GWP):表示不同温室气体排放的综合指标,一般以CO2为标准,用CO2当量(CO2e)表示。计算公式为:
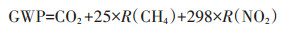
|
(3) |
式中:GWP为作物生长季温室气体的综合温室效应,kg CO2e·hm-2;R(CH4)和R(N2O)分别为生长季CH4和N2O的排放总量,kg·hm-2。
温室气体排放强度(Greenhouse gas intensity,GHGI)是单位产量的全球增温潜势,其计算公式为:
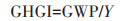
|
(4) |
式中:GHGI为温室气体排放强度,kg CO2e·kg-1;Y 为番茄产量,kg·hm-2。
1.2.3 土壤取样与测定土样取样。于番茄定植后35 d(0~37 d,生长初期即底肥期)、70 d(38~80 d,生长中期,第1次和第2次追肥)、105 d(81~105 d,生长末期,第3次追肥)取样。每个温室在5个小区随机取样,用直径3.0 cm土钻取0~30 cm土壤,每个小区取10钻,充分混匀后作为1个样品。土壤样品一部分风干用于土壤理化性状分析,一部分在4 ℃冰箱保存用于土壤酶活性分析。
土壤理化性质测定。土壤温度采用温度记录仪(TPJ-21-G,浙江托普云农科技股份有限公司)测定;土壤含水量采用质量法测定;电导率(EC)用电导仪测定(水土比5∶1);土壤pH利用酸度计(水土比2.5∶ 1)测定;土壤总氮(TN)和有机碳(SOC)采用元素分析仪(Vario EI,Elementar,德国)测定;NH4+ -N和NO3- -N含量采用流动分析仪(AA3,Bran+Luebbe,德国)检测分析。
土壤酶活性分析。α-葡糖苷酶(alpha-glucosidase,AG)、β-葡糖苷酶(betaglucosidase,BG)、纤维二糖水解酶(cellobiosidase,CBH)、β-1,4-N-乙酰基氨基葡萄糖苷酶(β-1,4-N-acetyl-glucosaminidase,NAG)和β-1,4-木糖苷酶(β-1,4-xylosidase,βX)活性采用微孔板荧光法测定。原理是利用底物与酶水解释放4-甲基伞形酮酰(4-methylumbelliferyl,4-MUB)进行荧光检测。具体步骤为:(1)土壤均质样品悬浊液制备;(2)在96孔微孔板中,分别在样品、空白、阴性对照、淬火标准和参考标准微孔中加入对应的物质和底物[18-19];(3)微孔板于25 ℃黑暗条件下孵育4 h,然后在每孔中加入10 μL 0.5 mol·L-1的NaOH结束反应,反应1 min后用酶标仪测定荧光值,4-MUB的荧光激发光和检测光波长分别在365 nm和450 nm处[18-19];(4)土壤酶活性计算。土壤脲酶(Urease,UR)活性采用靛酚蓝比色法测定,硝酸还原酶(Nitrate reductase,NRA)与亚硝酸还原酶(Nitrous reductase,NR)采用试剂盒(南京建成生物工程研究所)检测。
1.3 数据统计分析利用SPSS 22.0软件对数据进行统计分析,运用单因素方差分析,比较不同种植年限3种温室气体排放通量、总量、土壤理化性质、酶活性等差异,差异显著性水平为0.05。文中数据均为平均数±标准误,采用Origin 2020作图。运用CANOCA5.0进行环境因子与温室气体排放通量之间的冗余分析(Redundancy analysis,RDA)。
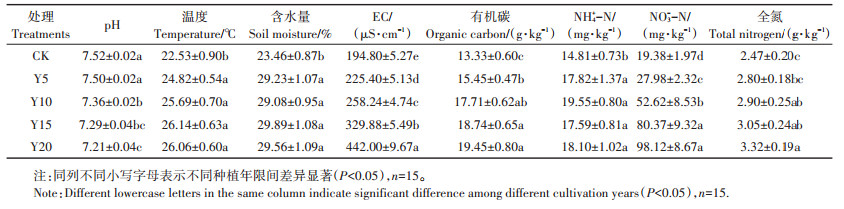
2 结果与分析 2.1 种植年限对土壤理化性质及土壤酶活性的影响随种植年限的增加,土壤pH逐渐降低(表 1),与CK相比,Y20菜地显著降低了0.31个单位(P < 0.05);而土壤EC表现出相反趋势,与CK相比,各处理EC值均显著增加(P < 0.05)。随种植年限的增加,土壤温度、含水量、有机碳、NO3- -N和全氮含量逐渐增加,NH+ 4-N含量变化不显著,与CK相比,各处理均显著增加了土壤温度、含水量、有机碳与NO3- -N含量(P < 0.05)。因此,种植年限改变了土壤物理性质,同时促进土壤养分的积累。
|
|
表 1 不同种植年限下设施土壤理化性质(平均值±标准误) Table 1 Properties of soil physical and chemical in greenhouse of soil different cultivation years(mean±SE) |
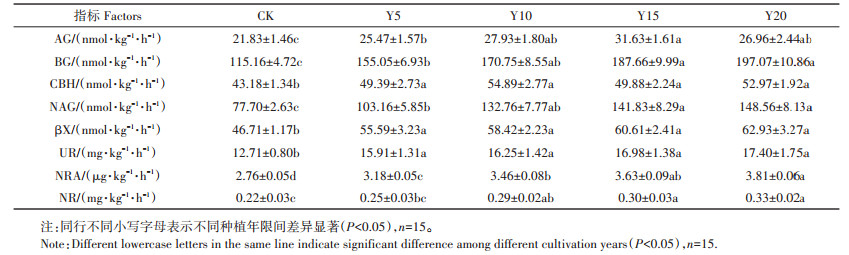
种植年限显著增加了设施菜地8种酶的活性(P < 0.05),但不同酶活性对种植年限的响应趋势不同(表 2)。Y15菜地AG显著高于Y5(P < 0.05),而与Y10、Y20相比差异不显著;Y20菜地BG显著高于Y5(P < 0.05),与Y10、Y15相比差异不显著;不同种植年限间CBH与βX差异不显著。Y20与Y15菜地NAG显著高于Y5(P < 0.05),与Y10相比差异不显著。UR、NRA、NR活性均随种植年限增加呈增加趋势,其中UR不同种植年限之间差异不显著;Y20菜地NRA显著高于Y5、Y10(P < 0.05),Y15菜地显著高于Y5(P < 0.05);Y20与Y15菜地NR显著高于Y5(P < 0.05)。
|
|
表 2 不同种植年限下设施土壤酶活性(平均值±标准误) Table 2 Soil enzyme activities of greenhouse soil in different cultivation years(mean±SE) |
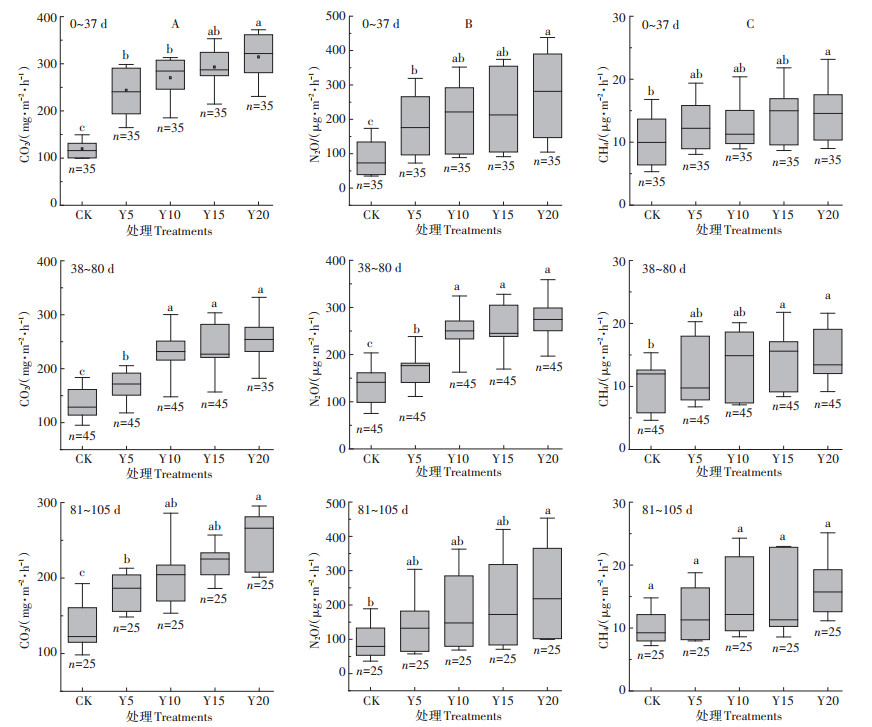
不同种植年限设施番茄土壤温室气体排放通量动态变化如图 1所示。设施土壤CO2排放通量为75.23~368.67 mg·m-2·h-1,排放峰值分别出现为基肥后的10~12 d和追肥后的4~7 d,其峰值有随种植年限增加而增加的趋势。番茄生长季CO2排放通量基本上也呈现出随种植年限增加而增加的趋势(图 1A)。设施土壤N2O排放通量为36.28~532.29 μg·m-2·h-1,排放峰值分别出现在基肥后的7~10 d和追肥后的3~ 5 d,其峰值和排放通量均表现出明显的随种植年限增加而增加的趋势(图 1B)。设施土壤CH4排放通量为3.82~29.13 μg·m-2·h-1,排放峰出现时间与N2O基本一致,但最高排放峰出现在第3次追肥后,CH4排放通量对种植年限响应趋势不明显(图 1C)。不同种植年限设施菜地CH4排放通量如图 2C所示。种植年限对设施菜地土壤CH4排放通量影响无规律性,且排放通量较低。与CK相比,3个生长阶段Y20菜地均显著增加了CH4排放通量(P < 0.05),但种植年限之间差异不显著,且不同生长期土壤CH4排放通量变化趋势也不一致。
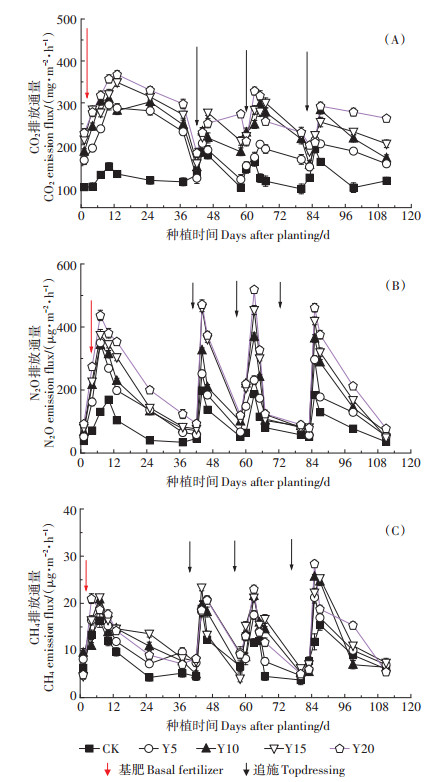
|
图 1 不同种植年限设施番茄土壤CO2、N2O和CH4排放通量动态变化 Figure 1 Dynamic changes of soil CO2, N2O and CH4 emission fluxes in greenhouse tomato of different cultivation years |
|
不同小写字母表示不同种植年限间差异显著(P < 0.05) Different lowercase letters indicate significant difference among different cultivation years(P < 0.05) 图 2 不同种植年限设施番茄3个生长期土壤CO2、N2O和CH4排放通量 Figure 2 Soil CO2, N2O and CH4 emission flux of greenhouse tomato at three growth stages with different cultivation years |
3个生长阶段设施土壤CO2排放通量均呈现出CK < 5Y < 10Y < 15Y < 20Y,且CK与不同种植年限之间差异显著(P < 0.05)(图 2A)。由此可知,种植年限显著影响土壤CO2排放通量,且随年限增加其排放通量有逐渐增加的趋势。番茄生长初期(0~37 d),Y20菜地CO2排放通量显著高于Y5(P < 0.01)和Y10(P < 0.05),分别增加了29.07%和16.32%。生长中期(38~ 80 d),Y20、Y15、Y10菜地CO2排放通量显著高于Y5(P < 0.05),分别增加了51.45%、44.25%和36.04%。生长末期(81~105 d),Y20菜地CO2排放通量显著高于Y5(P < 0.05),增加了37.82%。由此可知,种植年限与生长期均对设施土壤CO2排放通量产生影响。
3个生长阶段设施菜地N2O排放通量如图 2B所示。土壤N2O排放通量亦呈现出随种植年限增加而增加的趋势,与CK相比,各处理菜地N2O排放通量显著增加(P < 0.05)。生长初期(0~37 d),Y20样地土壤N2O排放通量显著高于Y5(P < 0.01),增加了51.39%。生长中期(38~80 d),Y20菜地N2O排放通量显著高于Y5(P < 0.01),增加了63.14%;Y15与Y10土壤N2O排放通量显著高于Y5(P < 0.05),分别增加了55.39%和43.72%。生长末期(81~105 d),不同种植年限间菜地N2O排放通量差异不显著。由此可知,种植年限影响设施菜地土壤N2O排放通量。
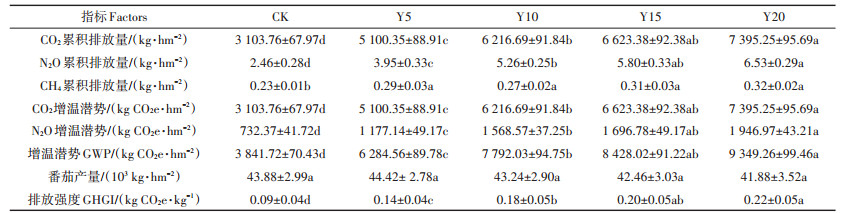
设施菜地温室气体排放总量、GWP、番茄产量与GHGI对种植年限的响应如表 3所示。3种气体排放总量对种植年限的响应趋势一致,均呈现为CK < Y5 < Y10 < Y15 < Y20,与CK相比,各处理土壤CO2、N2O、CH4排放总量均显著增加(P < 0.05)。对CO2和N2O而言,Y20菜地其排放总量显著高于Y10(P < 0.05)与Y5(P < 0.01),分别增加CO2排放总量18.94%和44.97%,增加N2O排放总量24.12%和65.39%;Y15和Y10菜地排放总量显著高于Y5(P < 0.01),分别增加CO2排放总量29.86% 和21.88%,增加N2O排放总量44.14% 和33.25%;对CH4排放总量而言,不同年限之间差异不显著。不同种植年限间番茄产量差异不显著。GWP与GHGI均呈现出随种植年限增加而增加的趋势,与CK相比,Y5、Y10、Y15、Y20菜地GWP分别显著增加了63.58%、102.83%、119.38%、143.36%(P < 0.05),而GHGI分别显著增加了55.56%、100.03%、122.22%、144.44%(P < 0.05)。Y20菜地GWP与GHGI显著高于Y10(P < 0.05)与Y5(P < 0.01),分别增加GWP 19.98% 和48.77%,增加GHGI 23.88%和57.79%,Y15显著高于Y5(P < 0.01),分别增加了34.10% 和42.86%。CO2和N2O对GWP的贡献率分别为79.01%~81.16% 和18.73%~21.02%,且N2O贡献率有随种植年限增加而增加的趋势。总体而言,设施菜地CO2、N2O、CH4排放总量、GWP、GHGI随种植年限增加而显著增加。
|
|
表 3 不同种植年限设施菜地温室气体累积排放量、番茄产量、全球增温潜势和排放强度 Table 3 Cumulative emissions and GWP of greenhouse gases, tomato yield and GHGI from greenhouse vegetable field under different cultivation years |
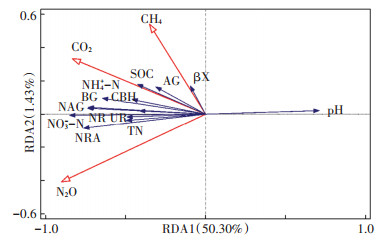
冗余分析表明,土壤养分与酶活性变化是导致土壤温室气体在不同种植年限存在差异的重要原因(图 3)。13个环境因子总解释率为51.73%,其中第一轴和第二轴的解释率为50.30% 和1.43%。土壤CO2排放通量与CBH、NAG、AG、BG、SOC、NH4+ -N、NO3- -N、UR之间呈现正相关关系;CH4排放通量与βX、AG、SOC之间呈现正相关关系;土壤N2O排放通量与土壤TN、NO3- -N、UR、NRA、NR之间呈现正相关关系。土壤CO2、CH4与N2O排放通量与土壤pH之间为显著负相关关系。由蒙特卡罗检验结果可知,NAG(F=16.6,P < 0.001)、NO3- -N(F=7.6,P < 0.05)、pH(F=5.8,P < 0.05)和NRA(F=5.5,P<0.05)对土壤温室气体排放的影响达到显著水平。由此可知,土壤NAG、NO3- -N、NRA、SOC、pH是决定设施菜地温室气体排放的关键因子,不同种植年限通过改变土壤理化性质与酶活性进而影响设施土壤温室气体排放通量。
|
图 3 土壤温室气体排放通量与土壤理化性质、酶活性的关系 Figure 3 Relationship between soil greenhouse gas emission flux and properties of soil physical, chemical and enzyme activities |
土壤理化性质是农业土壤可持续利用的基础,众多研究均证实设施菜地土壤理化性质变化与种植年限密切相关[9-10]。本研究结果显示,随着种植年限的增加,北京设施菜地0~30 cm土壤EC、SOC、NO3- -N含量均逐渐升高,土壤pH不断降低,这与LI等[9]对北方设施菜地和SHI等[10]对西南设施菜地的研究结果一致,土壤养分和EC随着种植年限的增加逐渐增加,且土壤酸化加剧。究其原因是设施蔬菜生产活动中,大量投入无机和有机肥,而蔬菜对养分的利用率相对较低,再加上设施环境的封闭性及节水滴灌措施导致淋洗程度低,使得氮、磷、钾养分和NO3-、SO24-等离子残留于土壤中并逐年累积,造成土壤次生盐渍化与酸化。
土壤酶参与土壤内的物质循环和能量传递,作为土壤肥力评价的指标,其活性可表征土壤养分供应能力[20]。本研究表明设施土壤涉C循环的AG、BG、CBH、NAG、βX 5种酶及参与N循环的UR、NRA、NR对种植年限的响应趋势不同,但与CK相比,各种植年限均显著增加了这8种酶的活性。这与SHEN等[21]关于不同种植年限对设施土壤酶活性影响的结果不一致。首要原因是本研究所选的日光温室每年施入大量有机肥,不仅为微生物的活动提供了能源物质,而且给土壤带来了大量的外源酶类及微生物,固能极大地提高土壤酶活性[22]。其次,本研究中日光温室采用果-菜轮作种植模式,轮作可以有效促进土壤的生物化学过程,提高土壤酶的活性[23]。
3.2 种植年限对设施菜地土壤温室气体排放的影响农田生态系统中土壤CO2排放主要来源于土壤中微生物呼吸及作物根呼吸两个过程[24]。本研究通过对4个种植年限温室番茄土壤CO2排放的原位观测,发现CO2排放通量随着种植年限增加而逐渐增加,种植20 a设施菜地的排放通量最高。造成这种现象的原因在于以下3个方面:首先,温室每年施入的大量有机肥(30~45 t·hm-2)导致温室土壤有机质含量逐年增加(表 1),为菜地土壤微生物提供了充足碳源,从而提高了其活性和呼吸作用,促进土壤CO2排放。这也可以通过RDA分析得出的土壤CO2排放通量与SOC呈显著正相关关系加以证实。其次,随种植年限增加,参与土壤有机质分解的CBH、NAG、AG、BG涉C酶活性增加,因而导致土壤CO2排放通量呈现随种植年限增加而增加的趋势。与露天菜地相比,温室菜地常年保持高温高湿状态(表 1),较高的土壤温湿度能增强土壤酶活性和酶对底物的亲和力,提高土壤有机质分解,促进设施土壤CO2排放[25-26]。最后,轮作种植模式有助于维持土壤微生物的群落多样性与活性,在一定程度上促进土壤CO2排放[27-28]。因此,随温室种植年限增加,土壤有机质含量,涉C酶活性均得到一定程度的提升,直接和间接的促进了温室土壤CO2排放通量增加。
本研究中设施土壤CO2排放峰出现在基肥施加后的10~12 d和追肥后的4~7 d,其峰值有随种植年限增加而增加的趋势(图 1A),其排放通量在不同生长时期有所差异,但总体变化趋势差异不显著(图 2A)。这是由于在生长初期,底肥中的有机质为微生物活动提供了充足的能量,维持较高的微生物呼吸,导致此阶段土壤CO2排放较高并出现排放峰值;在生长中期与末期,作物根系生长旺盛,根呼吸能力强,导致此阶段土壤CO2排放较高,滴灌追肥后,设施内保持较高的温湿度(湿度25%~28%、温度28~34 ℃),也促进了CO2排放。
土壤N2O是硝化和反硝化的产物,土壤通气状况、反应底物浓度、氮转化微生物及酶活性是影响农田N2O排放的主要因素[29-31]。本研究表明随种植年限增加,设施土壤N2O排放通量逐渐增加,种植20 a菜地N2O排放量最高(图 2B)。这是由于长时间设施种植会导致菜地土壤TN、NO3- -N(氮素盈余)的累积[10],氮素的大量累积为微生物提供丰富的氮源,增加了氨氧化细菌和反硝化细菌的活性,从而增强硝化和反硝化作用。此外,菜地土壤频繁的耕作和灌溉也有利于土壤硝化作用的发生,促进N2O排放[30, 32]。同时有机肥施加和有机质积累可以为微生物提供碳源与其他营养元素,从而提高了nirK 和nirS 型反硝化微生物的丰度及其活性,对N2O排放起到积极作用[4, 12, 21]。众多研究显示,UR、NRA、NR这3类重要的氮转化关键酶与土壤N2O生成密切相关[30, 33]。随种植年限增加3类酶活性逐渐增强,亦可一定程度上解释N2O排放通量增加的原因。因此,随着种植年限增加,土壤有机质、TN、NO3- -N含量不断积累,充足的底物促进了硝化或反硝化细菌活动,同时提升了UR、NRA、NR的活性,故N2O排放量逐渐增加。
本研究中设施土壤N2O排放峰出现在基肥施加后的7~10 d和追肥后的3~5 d,其排放通量在不同生长时期有所差异,但其峰值和通量均有随种植年限增加而增加的趋势(图 1B)。在基肥期(番茄生长初期),番茄幼苗需氮量少,基肥中氮肥(尿素态氮)为涉氮功能微生物提供了充足的底物,导致此阶段土壤N2O排放通量较高,出现排放峰[12, 33]。在番茄生长中期与末期(6月到7月),追施含氮水溶肥(NH4+ -N),加上此阶段设施内高温高湿环境(湿度25%~28%、温度28~34 ℃)有助于硝化与反硝化反应发生,促进土壤N2O排放[30],导致追肥后出现N2O排放峰。
土壤CH4排放是产甲烷菌和甲烷氧化菌综合作用的结果,也受土壤含水量、通气性和易分解有机物含量的影响[34-35]。与CK相比,种植年限一定程度上增加了CH4排放通量(图 1C和图 2C)。原因之一可能是有机物质增加,增加了甲烷细菌的反应底物,促进CH4的排放[36]。原因之二可能是设施土壤含水率较高(表 1),有助于产甲烷菌活动,促进CH4的产生。由于旱地土壤大部分时间处于有氧环境,土壤CH4很容易被甲烷氧化菌氧化生成CO2,因此设施土壤中CH4的排放通量较低(最高29.13 μg·m-2·h-1)[36],在设施温室气体研究中几乎不用考虑。
3.3 土壤温室气体排放增温潜势与排放强度京郊设施4个种植年限番茄生长季土壤温室气体GWP分布在6 284.56~9 349.26 kg CO2e·hm-2,与LI等[37]和JIA等[38]对设施菜地GWP的研究结果相近。本研究显示设施菜地土壤CO2对GWP的贡献率在78%以上,占据土壤温室气体GWP的优势地位。土壤N2O对GWP的贡献率为18.73%~21.02%,占土壤温室气体GWP的次要地位,并随种植年限增加其贡献率也逐渐增加。CH4对GWP平均贡献率不足0.1%,可忽略不计。在好氧条件下,GWP主要由土壤释放的CO2和N2O构成[6, 38-39],但本研究中N2O对GWP的贡献比例较高[6, 39],因此,减少与控制N2O排放在设施温室气体减排中的作用也不容忽视。
GHGI是评价环境效益与作物经济效益的综合指标[40]。本研究中,CK样地GHGI为0.09 kg CO2e·kg-1,种植5 a的GHGI为0.14 kg CO2e·kg-1,这与杜世宇等[6]研究结果差异较小,而种植20 a后GHGI为0.22 kg CO2e·kg-1,与其差异明显。随种植年限增加GHGI逐渐增加,这表明种植年限增加,不利于设施菜地环境效益与经济效益之间的平衡。因此,采取合理管理措施,降低GWP,有助于保障设施农业可持续发展。
4 结论(1)种植年限对设施土壤温室气体CO2、N2O、CH4排放通量的影响各异。种植年限显著影响CO2、N2O排放通量,呈现出随种植年限的增加而增加的趋势,种植20 a较CK菜地能显著提高CO2、N2O排放通量,种植年限对CH4排放通量影响不显著。
(2)种植年限延长显著增加了3种温室气体排放总量、GWP和GHGI,且种植20 a增加更明显。
(3)土壤pH的不断降低,土壤SOC含量及CBH、AG、NAG、BG酶活性的增加促使CO2排放通量随种植年限增加而逐渐增加;土壤SOC、全氮、NO3- -N含量不断增加及UR、NR和NRA活性的提升,导致N2O排放通量随种植年限增加而逐渐增加。因此,采取合理的管理措施,适度降低土壤养分积累,提高土壤pH,对京郊设施菜地土壤温室气体减排具有积极意义。
| [1] |
LASHOF D A, AHUJA D R. Relative contributions of greenhouse gas emissions to global warming[J]. Nature, 1990, 344(6266): 529-531. DOI:10.1038/344529a0 |
| [2] |
RAVISHANKARA A R, DANIEL J S, PORTMANN R W. Nitrous oxide(N2O): The dominant ozone-depleting substance emitted in the 21st Century[J]. Science, 2009, 326: 123-125. DOI:10.1126/science.1176985 |
| [3] |
MARTINS C S C, MACDONALD C A, ANDERSON I C, et al. Feedback responses of soil greenhouse gas emissions to climate change are modulated by soil characteristics in dryland ecosystems[J]. Soil Biology & Biochemistry, 2016, 100: 21-32. |
| [4] |
ZHANG M, Li B, XIONG Z Q. Effects of organic fertilizer on net global warming potential under an intensively managed vegetable field in southeastern China: A three-year field study[J]. Atmos Environment, 2016, 145: 92-103. DOI:10.1016/j.atmosenv.2016.09.024 |
| [5] |
ZHANG J, LI H, WANG Y, et al. Multiple-year nitrous oxide emissions from a greenhouse vegetable field in China: Effects of nitrogen management[J]. Science of the Total Environment, 2018, 616 / 617: 1139-1148. DOI:10.1016/j.scitotenv.2017.10.206 |
| [6] |
杜世宇, 薛飞, 吴汉卿, 等. 水氮耦合对设施土壤温室气体排放的影响[J]. 农业环境科学学报, 2019, 38(2): 476-484. DU S Y, XUE F, WU H Q, et al. Interactive effect of irrigation and nitrogen fertilization on greenhouse gas emissions from greenhouse soil[J]. Journal of Agro-Environment Science, 2019, 38(2): 476-484. |
| [7] |
曹文超, 宋贺, 陈吉吉, 等. 水分和有机肥投入对设施菜田土壤N2O, N2和CO2排放及产物比的影响[J]. 土壤通报, 2018, 49(2): 469-477. CAO W C, SONG H, CHEN J J, et al. Effects of manure application and irrigation on N2O, N2, and CO2 production and emission from a greenhouse vegetable soil[J]. Chinese Journal of Soil Science, 2018, 49(2): 469-477. |
| [8] |
YE X H, HAN B, LI W, et al. Effects of different irrigation methods on nitrous oxide emissions and ammonia oxidizers microorganisms in greenhouse tomato fields[J]. Agricultural Water Management, 2018, 203: 115-123. DOI:10.1016/j.agwat.2018.03.012 |
| [9] |
LI J G, WAN X, LIU X X, et al. Changes in soil physical and chemical characteristics in intensively cultivated greenhouse vegetable fields in North China[J]. Soil and Tillage Research, 2019, 195: 104366. DOI:10.1016/j.still.2019.104366 |
| [10] |
SHI W M, YAO J, YAN F. Vegetable cultivation under greenhouse conditions leads to rapid accumulation of nutrients, acidification and salinity of soils and ground-water contamination in South -Eastern China[J]. Nutrient Cycling in Agroecosystems, 2009, 83: 73-84. DOI:10.1007/s10705-008-9201-3 |
| [11] |
贾丽, 乔玉辉, 陈清, 等. 我国设施菜田土壤重金属含量特征与影响因素[J]. 农业环境科学学报, 2020, 39(2): 263-274. JIA L, QIAO Y H, CHEN Q, et al. Characteristics and affecting factors of heavy metals content in greenhouse vegetable soils in China[J]. Journal of Agro-Environment Science, 2020, 39(2): 263-274. |
| [12] |
HAN J, SHI J, ZENG L, et al. Impacts of continuous excessive fertilization on soil potential nitrification activity and nitrifying microbial community dynamics in greenhouse system[J]. Journal of Soils & Sediments, 2016, 17: 471-480. DOI:10.1007%2Fs11368-016-1525-z/metrics |
| [13] |
ZHOU X, WU F. Dynamics of the diversity of fungal and Fusarium communities during continuous cropping of cucumber in the greenhouse[J]. FEMS Microbiology Ecology, 2012, 80(2): 469-478. DOI:10.1111/j.1574-6941.2012.01312.x |
| [14] |
陶宝先, 刘晨阳. 寿光设施菜地土壤N2O排放规律及其影响因素[J]. 环境化学, 2018, 37(1): 154-163. TAO B X, LIU C Y. N2O emission from the greenhouse soils in Shouguang City, Northern China[J]. Environmental Chemistry, 2018, 37(1): 154-163. |
| [15] |
谢海宽, 江雨倩, 李虎, 等. 北京设施菜地N2O和NO排放特征及滴灌优化施肥的减排效果[J]. 植物营养与肥料学报, 2019, 25(4): 591-600. XIE H K, JIANG Y Q, LI H, et al. N2O and NO emissions from greenhouse vegetable fields and the mitigation efficacy of the optimized fertigation in Beijing[J]. Plant Nutrition and Fertilizer Science, 2019, 25(4): 591-600. |
| [16] |
DUAN P, WU Z, ZHANG Q, et al. Thermodynamic responses of ammonia-oxidizing archaea and bacteria explain N2O production from greenhouse vegetable soils[J]. Soil Biology & Biochemistry, 2018, 120: 37-47. |
| [17] |
YANG T, LI F, ZHOU X, et al. Impact of nitrogen fertilizer, greenhouse, and crop species on yield-scaled nitrous oxide emission from vegetable crops: A meta-analysis[J]. Ecological Indicators, 2019, 105: 717-726. DOI:10.1016/j.ecolind.2019.02.001 |
| [18] |
范淼珍, 尹昌, 范分良, 等. 长期不同施肥对红壤碳、氮、磷循环相关酶活性的影响[J]. 应用生态学报, 2015, 26(3): 833-838. FAN M Z, YIN C, FAN F L, et al. Effects of different long-term fertilization on the activities of enzymes related to carbon, nitrogen, and phosphorus cycles in a red soil[J]. Chinese Journal of Applied Ecology, 2015, 26(3): 833-838. |
| [19] |
DEFOREST J L. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and L-DOPA[J]. Soil Biology & Biochemistry, 2009, 41(6): 1180-1186. |
| [20] |
NICOLAS F, STEPHAN H, NATHALIE F. Litter fingerprint on microbial biomass, activity, and community structure in the underlying soil[J]. Plant and Soil, 2014, 379(1): 79-91. |
| [21] |
SHEN W S, LIN X G, SHI W M, et al. Higher rates of nitrogen fertilization decrease soil enzyme activities, microbial functional diversity and nitrification capacity in a Chinese polytunnel greenhouse vegetable land[J]. Plant and Soil, 2010, 337(1/2): 137-150. DOI:10.1007/s11104-010-0511-2 |
| [22] |
王文锋, 李春花, 黄绍文, 等. 不同施肥模式对设施菜田土壤酶活性的影响[J]. 应用生态学报, 2016, 27(3): 873-882. WANG W F, LI C H, HUANG S W, et al. Effects of different fertilization patterns on soil enzyme activities in greenhouse vegetable field[J]. Chinese Journal of Applied Ecology, 2016, 27(3): 873-882. |
| [23] |
DU L, HUANG B, DU N, et al. Effects of garlic/cucumber relay intercropping on soil enzyme activities and the microbial environment in continuous cropping[J]. Hortscience A Publication of the American Society for Horticultural Science, 2017, 52(1): 78-84. |
| [24] |
KUZYAKOV Y. Sources of CO2 efflux from soil and review of partitioning methods[J]. Soil Biology & Biochemistry, 2006, 38(3): 425-448. |
| [25] |
BURAGIENE S, SARAUSKIS E, ROMANECKAS K, et al. Relationship between CO2 emissions and soil properties of differently tilled soils[J]. Science of the Total Environment, 2019, 662: 786-795. DOI:10.1016/j.scitotenv.2019.01.236 |
| [26] |
SMITH K A, BALL T, CONEN F, et al. Exchange of greenhouse gases between soil and atmosphere: Interactions of soil physical factors and biological processes[J]. European Journal of Soil Science, 2003, 54(4): 779-791. DOI:10.1046/j.1351-0754.2003.0567.x |
| [27] |
李戌清, 张雅, 田忠玲, 等. 茄子连作与轮作土壤养分、酶活性及微生物群落结构差异分析[J]. 浙江大学学报(农业与生命科学版), 2017, 43(5): 561-569. LI X Q, ZHANG Y, TIAN Z L, et al. Difference analysis of soil nutrients, enzymatic activities and microbial community structure between eggplant continuous cropping and rotation[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2017, 43(5): 561-569. |
| [28] |
BEHNKE G D, ZUBER S M, PITTELKOW C M, et al. Long-term crop rotation and tillage effects on soil greenhouse gas emissions and crop production in Illinois, USA[J]. Agriculture, Ecosystems & Environment, 2018, 261: 62-70. |
| [29] |
JUNG J, YEOM J, KIM J, et al. Change in gene abundance in the nitrogen biogeochemical cycle with temperature and nitrogen addition in antarctic soils[J]. Research in Microbiology, 2011, 162(10): 1018-1026. DOI:10.1016/j.resmic.2011.07.007 |
| [30] |
WANG J, ZHANG J, MÜLLER C, et al. The mechanisms of high N2O emissions from greenhouse vegetable field soils[J]. Clean-Soil, Air, Water, 2017, 45(10): 1600210. DOI:10.1002/clen.201600210 |
| [31] |
HÉNAULT C, BOURENNANE H, AYZAC A, et al. Management of soil pH promotes nitrous oxide reduction and thus mitigates soil emissions of this greenhouse gas[J]. Scientific Reports, 2019, 9(1): 20182. DOI:10.1038/s41598-019-56694-3 |
| [32] |
GEISSELER D, HORWATH W R, JOERGENSEN R G, et al. Pathways of nitrogen utilization by soil microorganisms: A review[J]. Soil Biology & Biochemistry, 2010, 42(12): 2058-2067. |
| [33] |
CHEN Q H, FENG Y, ZHANG Y P, et al. Short-term responses of nitrogen mineralization and microbial community to moisture regimes in greenhouse vegetable soils[J]. Pedosphere, 2012, 22(2): 263-272. DOI:10.1016/S1002-0160(12)60013-7 |
| [34] |
XIONG Z Q, XING G X, ZHU Z L, et al. Nitrous oxide and methane emissions as affected by water, soil and nitrogen[J]. Pedosphere, 2007, 17(2): 146-155. DOI:10.1016/S1002-0160(07)60020-4 |
| [35] |
YUAN J, YUAN Y, ZHU Y, et al. Effects of different fertilizers on methane emissions and methanogenic community structures in paddy rhizosphere soil[J]. Science of the Total Environment, 2018, 627: 770-781. DOI:10.1016/j.scitotenv.2018.01.233 |
| [36] |
YU R, XIE J L, XU X Y, et al. Warmer and drier conditions and nitrogen fertilizer application altered methanotroph abundance and methane emissions in a vegetable soil[J]. Environmental Science and Pollution Research International, 2017, 24(3): 2770-2780. DOI:10.1007/s11356-016-8027-9 |
| [37] |
LI B, FAN C H, ZHANG H, et al. Combined effects of nitrogen fertilization and biochar on the net global warming potential, greenhouse gas intensity and net ecosystem economic budget in intensive vegetable agriculture in southeastern China[J]. Atmospheric Environment, 2015, 100: 10-19. DOI:10.1016/j.atmosenv.2014.10.034 |
| [38] |
JIA J X, MA Y C, XIONG Z Q. Net ecosystem carbon budget, net global warming potential and greenhouse gas intensity in intensive vegetable ecosystems in China[J]. Agriculture Ecosystems & Environment, 2012, 150: 27-37. |
| [39] |
MIN J, LU K, SUN H, et al. Global warming potential in an intensive vegetable cropping system as affected by crop rotation and nitrogen rate[J]. Clean-Soil, Air, Water, 2016, 44(7): 766-774. DOI:10.1002/clen.201400785 |
| [40] |
王斌, 李玉娥, 万运帆, 等. 控释肥和添加剂对双季稻温室气体排放影响和减排评价[J]. 中国农业科学, 2014, 47(2): 314-323. WANG B, LI Y E, WAN Y F, et al. Effect and assessment of controlled release fertilizer and additive treatments on greenhouse gases emission from a double rice field[J]. Scientia Agricultura Sinica, 2014, 47(2): 314-323. |
 2021, Vol. 40
2021, Vol. 40