2. 环境污染过程与基准教育部重点实验室, 天津 300350;
3. 天津市城市生态环境修复与污染防治重点实验室, 天津 300350
2. Key Laboratory Processes and Environmental Criteria(Ministry of Education), Tianjin 300350, China;
3. Tianjin Key Laboratory of Environmental Remediation and Pollution Control, Tianjin 300350, China
六溴环十二烷(Hexabromocyclododecane,HBCD) 是世界范围内使用最广泛的添加型阻燃剂之一[1]。2011年我国HBCD的年产量达到18 000 t,占世界总产量的64%,成为全球最大的HBCD生产国[2]。工业级的HBCD中主要有α-HBCD、β-HBCD、γ-HBCD 3种同分异构体,其中γ-HBCD的占比最大(一般为75%~89%),其次为α-HBCD(占比10%~13%)和β- HBCD(占比1%~12%)[3]。由于HBCD具有毒性、持久性、生物积累性、可远距离迁移性等特性[4],在2014年11月26日,HBCD作为新型持久性有机污染物(POPs)被列入斯德哥尔摩公约附录A[5]。尽管我国在2016年7月2日审议批准《〈关于持久性有机污染物的斯德哥尔摩公约〉新增列六溴环十二烷修正案》并禁止HBCD的生产、使用和进出口[6],但是研究人员仍在日常用品[7]、土壤[8-10]、底泥[11-12]、水体[13]、空气[9, 14]、活性污泥[15-16]等多种环境介质,以及不同生物体[17-20]甚至母乳[21-22]中检测到不同浓度水平的HBCD。HBCD具有较强的神经毒性[23-24],其能够对神经信号的传递、神经元的发育和成熟[25-26]、神经营养因子[27]起到破坏作用。HBCD还会对细胞产生类激素的影响[28],对生物体内激素的合成造成干扰[29],存在诱发肥胖的风险[30]。HBCD非对映异构体与对映异构体在生物体内的蓄积和代谢效应存在差异,能够对不同类型生物体,甚至相同类型生物体的不同组织造成不同的影响[31]。
HBCD不会被直接施用于土壤,但由于其在环境中的持久性和可远距离传输的能力,很容易在土壤环境中赋存,使土壤成为HBCD的一个重要环境归宿,对土壤环境造成不良影响,并通过植物进入陆生生态系统,威胁人类健康[32]。土壤以及土壤中存在的生物,在全球气候变化、元素循环[33-36]等诸多生态过程中都起到了调控作用,尤其是农田土壤质量关乎粮食安全和人体健康[37]。针对进入农田土壤中HBCD的环境行为以及修复方法的研究,能够对未进入农田土壤的HBCD进行阻控,对受到HBCD污染的农田土壤进行有效修复,维护农田土壤环境质量,保障粮食安全。目前已有很多技术应用于环境中HBCD的去除,包括物理吸附法[38]、机械研磨法[39]、光降解法[40-42]、热降解法[43]、化学还原法[44]、生物降解法[45]等。物理和化学降解方法所需要的设备和材料价格较高,降解过程中向环境中添加的物质以及产生的降解产物可能会对环境产生二次污染[45-46],而生物修复主要通过生物对有机物的吸收和代谢,对环境中的污染物进行降解或去毒,具有更高的环境安全性,成本较低,能够进行原位修复且对环境结构的破坏较小,因此在土壤修复中具有巨大的优势和潜力。
本文主要针对HBCD进入土壤,特别是农田土壤的污染过程进行总结和预测,对HBCD在土壤这种多介质复杂环境中的行为进行梳理和分析,以及对目前土壤中HBCD的生物修复方法进行汇总归纳,对更加安全、高效、可持续的综合修复方法进行展望。
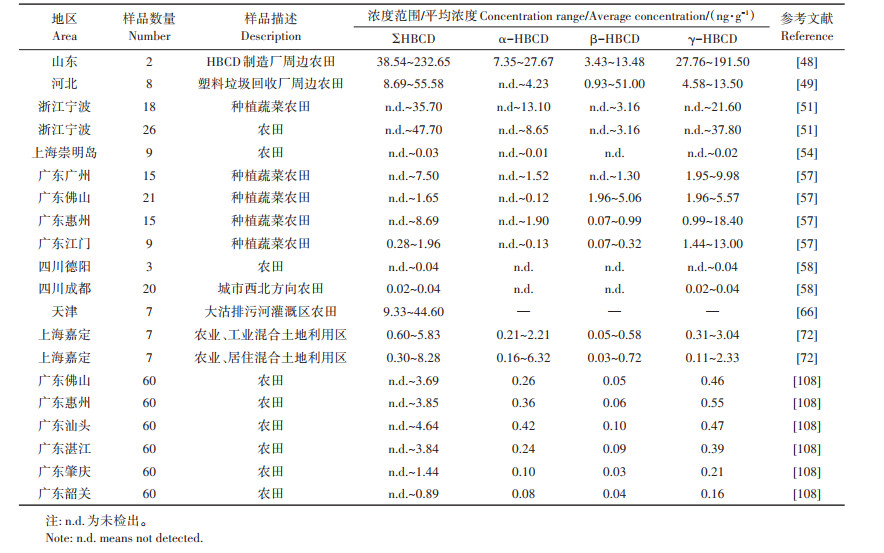
1 农田土壤中HBCD的污染过程 1.1 HBCD污染源 1.1.1 工业生产等污染源针对HBCD生产工厂、电子垃圾拆解地、城市垃圾堆放场等典型污染源周边土壤污染已有诸多文献报道,此类污染源对周边农田土壤环境造成巨大影响(表 1),与其他类型污染源周边农田土壤相比,HBCD的浓度要高出1~2个数量级。在瑞典一家HBCD生产厂附近土壤中,HBCD的浓度高达23 200 ng·g-1 [47];山东某HBCD生产厂周围土壤中HBCD的最高浓度为11 700 ng·g-1,周边农田土壤中HBCD浓度为38.54~232.65 ng · g-1 [48];中国北方某塑料垃圾回收场地土壤中HBCD的浓度为11.0~624.0 ng·g-1,周边区域农田土壤中HBCD的浓度为8.69~55.50 ng·g-1[49]。需要注意的是,随着扬尘和土壤中HBCD的挥发,并随降水形成地表径流以后,此类污染较重的土壤会从“汇”向“源”进行转变,成为周围环境的二次污染源[2]。
|
|
表 1 部分地区农田土壤中HBCD浓度 Table 1 Concentrations of HBCDs in agricultural soils from different regions in China |
LI等[50]发现胶州湾HBCD生产工厂附近土壤中α-HBCD、β-HBCD、γ-HBCD 3种异构体的占比分别为20.4%、12.3%、67.3%。一项对中国东部某工业区表层土壤中HBCD的调查发现,γ-HBCD是最主要的异构体,其次为α-HBCD和β-HBCD[51]。此类污染源传播路径较短,污染土壤中HBCD 3种异构体的占比与工业级HBCD中3种异构体的占比近似,因此也有学者认为高占比的γ-HBCD可以作为新污染源输入的判断依据[52-53]。
1.1.2 远距离扩散源由于HBCD具有较高的辛醇水分配系数,因此空气中的HBCD很容易被吸附在空气颗粒物表面[14],随着大气的传输以及沉降,对农田土壤环境造成影响(图 1)。MENG等[54]对崇明岛土壤环境中的HBCD进行检测发现,尽管崇明岛没有任何工业活动,农田中仍检测出一定量的HBCD(浓度范围:n.d.~29.1 pg·g-1),由于HBCD在崇明岛多种土地利用类型的土壤中广泛分布,因此推测HBCD通过大气传输进入该地区。ZHU等[55] 发现青藏高原土壤环境也受到了HBCD的污染,由于青藏高原没有任何已知污染源,推测主要是大气传输和残留的二次污染源造成的。此外,对辽河流域[56]、珠江三角洲流域[57]以及四川省部分地区[58]进行农田土壤HBCD污染调查后发现(表 1),HBCD浓度较高的取样点多分布在该区域发达城市周围,且距离城市越远污染程度越低,说明该区域发达城市为HBCD的主要排放源。除工业排放外,在建筑物的新建[59]和拆除[60]过程中,以及日常生活中对含有HBCD产品的使用和处置过程中[51]均存在释放HBCD的可能。区域内发达城市会通过大气传输对较大范围内的农田土壤造成影响[53],且根据最新研究显示,城市繁荣指数越高、人类活动越频繁,对土壤环境的影响也就越大[61]。

|
图 1 农田土壤HBCD污染过程 Figure 1 The pollution process of HBCD in agricultural soil |
对远距离扩散源污染的土壤调查研究显示,HBCD异构体组成中α-HBCD的占比增加[54],造成该类现象的可能原因是在远距离传输过程中发生了由γ-HBCD向α-HBCD异构体的转化[62],同时与其他两种异构体相比α-HBCD具有更长的半衰期,热稳定性更强,使其在环境中保留时间更长,易造成更大危害[63-65]。
1.1.3 其他污染源(1)污水和活性污泥的施用
农田中污水和活性污泥施用,是很多污染物进入农田土壤的途径(图 1)。张艳伟等[66]对天津大沽排污河污灌区的农田土壤进行检测, 发现污灌区农田土壤中HBCD的浓度范围为9.33~44.60 ng·g-1,而同期调查的电子产品拆解区的土壤中HBCD浓度范围为1.57~3.76 ng·g-1,大沽排污河污灌导致农田土壤受到HBCD严重污染(表 1)。污水处理厂中的污水以及活性污泥常被检测出有一定浓度的HBCD,是因为含有阻燃剂的产品在进入污水中后被长期浸泡和磨损,导致其将HBCD释放进入污水中[67],而目前的污水处理过程并不能有效去除HBCD,最终都会被活性污泥吸附和积累[2]。目前,活性污泥的主要利用方式仍是施用于农田、道路地基和园林绿化[68],为活性污泥中的HBCD重新分配到土壤环境和进入食物链中提供了可能。向楠等[69]对上海市通过污泥进入环境中的HBCD年排放量进行计算,约为1.5 kg,其中α-HBCD与γ-HBCD均为0.7 kg,β-HBCD为0.1 kg。若将含有此浓度HBCD的活性污泥在农田土壤中连续施用10 a,土壤中残留的HBCD浓度将达到800 pg·g-1,累积效果明显。
向楠等[69] 对上海市污水处理厂活性污泥中HBCD的调查显示(共27个样品),有17个污泥样品中γ-HBCD占比最高(44.7%~76.3%),另外10个样品中α-HBCD含量最高(49.6%~90.6%)。在一项对澳大利亚活性污泥的调查中[68],α-HBCD与γ-HBCD是主要的异构体,分别占总HBCD的40%和56%。相较于其他两种异构体,α-HBCD具有较高的亲水性,易从含HBCD的产品释放进入污水中,是α-HBCD在污水以及活性污泥中所占比例较高的主要原因[15]。且有研究认为3种异构体的生物代谢速率以及异构化难易程度也会导致污水以及活性污泥中异构体的组成发生改变[53]。
(2) 道路扬尘
随着我国城市化的快速推进,机动车保有量激增,交通排放(包括尾气、轮胎碎屑和沥青路面)会对农田土壤环境造成威胁[70]。有研究显示道路扬尘中的HBCD浓度是土壤中浓度的10倍左右,道路扬尘颗粒更细,具有更大的比表面积,是HBCD等具有半挥发性质化合物的良好储藏库,靠近道路的农田会因道路扬尘的沉降而受到HBCD的污染(表 1)[71]。WU等[72]对上海嘉定区多土地利用类型区域进行调查后发现,在居住区和工业区、居住区和商业区道路扬尘中含有较高浓度的HBCD(4.11~382.00、8.46~508.00 ng·g-1),尽管农业区和工业区、居住区和农业区道路扬尘中的HBCD浓度相对较低(6.36~61.90、5.14~ 32.00 ng·g-1),但该浓度比同地区土壤中HBCD的浓度(0.60~5.83、0.30~8.28 ng·g-1)高出一个数量级左右。道路扬尘会作为靠近道路农田的主要HBCD污染源,对农田土壤造成影响(图 1)。
对重庆地区道路扬尘中HBCD异构体的分布调查显示,住宅区A、住宅区B、工业区、商业区、公园和农村地区道路扬尘样品中α-HBCD为主要异构体(>60%),远高于其在工业级HBCD中的占比范围(10%~13%)[71]。WU等[72]对上海地区道路扬尘中异构体的调查也显示了同样的结果,α-HBCD为主要异构体,占比为66%,而γ-HBCD占比仅为22%。α- HBCD具有更高的挥发性[9],更容易进入空气中被道路扬尘捕获,且光照情况下扬尘颗粒中吸附的γ- HBCD能够被异构化为α-HBCD[73],使道路扬尘中α- HBCD的占比显著提升。
1.2 土壤中HBCD的环境行为 1.2.1 HBCD的挥发和沉降与其他半挥发性有机化合物类似,HBCD能够通过挥发从农田土壤中逸出,也能够通过空气颗粒物的迁移沉降进入土壤环境,地区表层土壤与大气之间存在着污染物的交换过程[74],两种环境介质中的HBCD的浓度具有一定的相关性[53]。气温、风速、气压、相对湿度和日照时间等气候因素能够对HBCD的挥发、沉降、传输和后续命运造成影响,其中气温和风速是影响HBCD浓度的主要因素[75],较高的气温和风速能够增强HBCD的挥发行为,使HBCD浓度在环境中的分布出现分季现象[14]。HBCD的蒸气压为6.26×10-5 Pa,亨利系数为0.75 Pa·m3·mol-1,进入空气中的HBCD易吸附在空气悬浮颗粒物上,随空气颗粒物进行传输扩散并最终沉降[76],而这种远距离的大气传输和沉降是清洁地区土壤受到HBCD污染的主要途径[71]。ZHU等[77]研究发现,小麦能够通过叶片吸收空气中的HBCD,对HBCD的沉降造成影响,从而降低表层土壤中HBCD的浓度,因此植被以及农作物的种植同样能够影响土壤与大气之间HBCD的传输和迁移,对HBCD的分布造成影响。
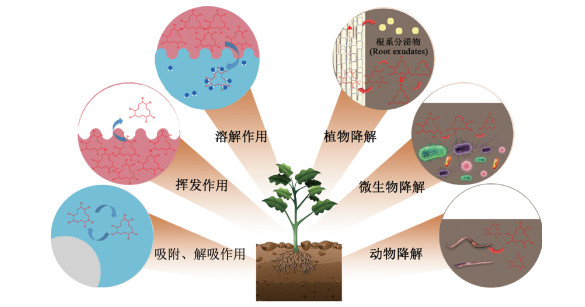
1.2.2 HBCD的吸附和解吸污染物在土壤组分中的吸附和解吸对污染物在环境中的运输和归趋起重要作用,HBCD具有较高的辛醇水分配系数,是一种高疏水性且容易被土壤有机碳吸附的污染物[53]。被吸附在土壤有机组分中后,污染物的生物有效性会下降,生态风险将会降低[78](图 2)。有机污染物在土壤中的吸附和解吸过程可以发生在矿物、有机矿物或有机颗粒表面,考虑到土壤复杂的组成和结构,有机化合物的整体吸附实际上是许多特定表面相互作用及发生复合作用的结果[79]。土壤中的组分以及土壤特性,特别是黏土含量、TOC、氧化还原电位以及pH能够影响有机物的吸附,从而对HBCD在土壤中的环境行为造成影响[61]。植物根系分泌物以及根际菌群能将被稳定吸附在土壤组分中的惰性HBCD解吸并进行吸收和降解[32],尽管土壤中HBCD的浓度会降低,但这种环境行为会增加HBCD的生物有效性,从而使人类暴露风险升高[32]。
|
图 2 HBCD在土壤中的环境行为及修复方法 Figure 2 Environmental behaviors and biodegradation methods of HBCD in agricultural soils |
由于广泛使用的工业级HBCD主要由α-HBCD、β-HBCD和γ-HBCD组成,因此土壤环境中检测出的HBCD主要为上述3种异构体。当温度在160 ℃以上时,HBCD会发生热重排,此时3种异构体的组成会转变成α-HBCD占比78%、β-HBCD占比13%、γ-HBCD占比9%[43],因此经过高温处理的HBCD产品在加工、使用和处置过程中会向环境中释放以α-HBCD为主要异构体的HBCD[80]。进入环境中的HBCD可以通过HBr基团的连续丢失而发生生物或非生物过程的异构体转化,导致实际环境中的样品和工业级HBCD中异构体的组成并不相同[63]。α-HBCD被认为是环境中最容易累积的异构体,除了其生物毒性较大不易被降解的原因以外,β-HBCD以及γ-HBCD能够通过异构体转化改变立体化学结构,也会使环境中α-HBCD的占比增多[77, 81-82]。此外,HBCD 3种立体异构体的结构差异使它们的极性、偶极矩、水溶性以及光学特性存在一定的差异[4, 65],在分配、吸附和解吸、挥发和沉降等诸多环境行为上具有一定的区别[53],导致异构体具有不同的生物吸收和代谢速率[31]。厌氧微生物降解条件下,土壤中α-HBCD、β-HBCD、γ- HBCD 3种异构体的半衰期存在差异,α-HBCD要比其他两种异构体的半衰期高出一倍以上[64]。HUANG等[83]通过水培实验发现(-)α-HBCD、(-)β-HBCD和(+)γ-HBCD对映体在玉米中的积累水平显著高于其对映的异构体,植物对异构体的富集和积累的差异也会导致土壤环境中HBCD的异构体组成发生变化。因此,以上多种因素的结合都会导致农田土壤环境中异构体的差异分布。
2 土壤中HBCD的生物修复方法进入农田土壤中的HBCD无法短期内实现“自净”,从而对粮食健康以及人类造成威胁,因此已有多种技术应用于降解环境中的HBCD[41, 84-85]。其中,生物修复法经济高效且环境友好,符合农田土壤绿色发展的目标导向,能够实现对土壤中HBCD安全有效的去除(表 2),本文主要针对此类修复方法的研究进展进行分析归纳。
|
|
表 2 HBCD污染土壤的生物修复方法及效率 Table 2 Bioremediation methods and efficiency of soils contaminated with HBCD |
土壤微生物修复技术是一种利用土著微生物或人工筛选的具有特定功能的微生物,通过自身的代谢作用(图 2)降低土壤中有害污染物活性或降解成无害物质的修复技术[86]。目前已有许多菌株以及菌群被证实具有HBCD的降解能力,在厌氧微生物降解条件下HBCD的半衰期为0.7~9.6 d[64, 87],而在好氧条件下微生物降解的半衰期会更长,为11~63 d[88]。厌氧环境下,HBCD的还原脱卤是微生物降解过程的关键步骤,通过相邻碳原子上溴的两两去除并形成双键实现HBCD的逐级脱溴,生成四溴环十二碳烯(Tetrabro⁃ mocyclododecene,TBCD)、二溴环十二碳烯(Dibromo⁃ cyclododecadiene,DBCD)、环十二碳三烯(Cyclodode⁃ catriene,CDT),最终开环形成链状烯烃后被完全碳化[81, 87, 89]。好氧环境下,微生物对HBCD的降解途径更加多样化[90],包括生成单羟基化五溴环十二烷(PBCD- ols)、单羟基化四溴环十二碳烯(TeBCDeols)、三羟基化三溴环十二烷(TrBCD-triols)等羟基化产物[84, 91],以及生成氧化产物环氧环癸二烯(Epoxycyclodecadiene,ECDD)等[92-93],从而实现对HBCD的降解。HUANG等[94]将土壤中分离筛选出的HBCD降解菌株铜绿假单胞菌HS9应用于HBCD的降解,该菌株能够在14 d内将浓度为1.7 mg·L-1的HBCD去除69%以上。LI等[92]研究发现土壤菌群能够在4 d内对HBCD的降解率达到60%以上,主要的降解机制为脱溴和氧化。
由于微生物对HBCD具有高效降解能力,微生物修复已被应用在土壤中HBCD的降解当中。LE等[95] 的研究表明土壤中的HBCD能够被土著微生物菌群以及烟草根际菌群吸收和代谢,厌氧条件下,含腐植酸的根际菌群能够在21 d内将土壤中的HBCD总量减少34%,而非根际菌群能够将土壤中的HBCD减少35%;在好氧条件下,含腐植酸的根际菌群能够在40 d内将土壤中的HBCD总量减少29%,而非根际菌群能够将土壤中的HBCD减少57%~60%,并且实验还发现在外加碳源的情况下,土壤中土著菌群的数量和种类都会增加,从而使土壤中HBCD的去除效率更高。DEMIRTEPE等[96]研究了生物刺激(Biostimula⁃ tion)以及生物投加(Bioaugmentation)对底泥中的γ-HBCD去除的作用效果,结果表明氯霉素脱卤菌DF-1的添加对HBCD的衰减并没有起到促进作用,但甲酸钠和乙醇的添加能够为降解过程提供电子供体,使HBCD的降解效率提高3倍以上。
微生物修复方法同样存在一定局限。菌株的生长受环境条件影响较大,因此土壤环境的温度、pH、含水量以及HBCD的初始浓度都会影响微生物对HBCD的降解效果[84, 87, 89]。且由于细菌分泌的作用酶具有特异性,因此微生物降解一般只针对单一污染。多功能高效基因工程菌的设计和组建能够使微生物降解在复合污染环境的修复工作中发挥更大的作用。真菌相较于细菌能够耐受更加极端的环境条件,并具有非特异性的高效胞外降解酶[97],具有较大的应用潜力。利用土壤微生物组从污染环境中去除有毒污染物或降低其毒性是保持土壤健康的一种重要生物手段[98],以上近期研究表明,微生物在针对受HBCD污染土壤修复的实际应用上具有较大潜力。但在HBCD降解过程中,微生物对HBCD的识别机理、对非对映异构体以及手性异构体的差异修复等相关机理需要进一步的研究。
2.2 植物修复植物修复在自然衰减和修复工程中都被认为是清除土壤污染物的有效方法[99]。植物对HBCD污染土壤的修复主要依靠植株对污染物的吸收、富集和代谢,从而降低土壤中HBCD的浓度[45]。小麦能够通过叶片和根系两种途径吸收空气以及土壤中的HBCD,从而降低土壤中污染物浓度,3种异构体在小麦根和茎中的生物富集系数排序为:α-HBCD>β-HBCD>γ- HBCD,可能与3种异构体的辛醇水系数存在的差异有关[77]。与小麦根和茎对HBCD异构体差异累积结果不同,玉米根部和茎秆对3种异构体的富集能力存在差异,其中根部积累顺序为:β-HBCD>α-HBCD> γ-HBCD,茎秆积累顺序为:β-HBCD>γ-HBCD>α- HBCD[100]。因此在土壤植物修复工程中,可根据土壤中异构体的分布占比情况选择植物类型,以达到最佳降解效果。HUANG等[83]在玉米中检测到五溴环十二碳烯(PBCDe)和四溴环十二碳烯(TBCDe)等HBCD的代谢产物,说明玉米能够对HBCD进行吸收和代谢转化,实验还发现玉米中HBCD异构体的代谢速率差异是由于HBCD异构体和CYP71C3v2酶的活性位点进行结合时的难易程度不同,从而导致(+)α-HBCD、(-)β-HBCD、(-)γ-HBCD相较于其对映异构体更容易水解。ZHU等[78]对黑麦草吸收降解土壤中HBCD进行研究后发现,植物的吸收和代谢作用对土壤中污染物的消除只占0.566%~3.150%,而土壤颗粒对HBCD的吸收和固定作用占96.9%~99.4%,这说明黑麦草并不是去除土壤中HBCD的最佳植物。最新研究发现无论是内源还是外源的黄酮醇都能够通过调节氨基酸、辅助因子和维生素的代谢参与拟南芥的植物防御系统,对抗HBCD胁迫引起的氧化损伤,这也为植物修复土壤中的HBCD提供了新的思路[101]。同时,如图 2中植物降解原理图所示,植物根系分泌物中的单糖、P-蛋白、苹果酸和其他低分子有机酸能够增加植物对持久性有机物的吸收[102],并对根际菌群起到促进作用,而这些菌群能够分泌一些非特异性氧化酶降解土壤中的污染物[32],因此根系能够大量分泌此类物质的植物有望对土壤中的HBCD污染进行高效修复。此外,经实验发现,萝卜和白菜两种植物混种的情况下,植物表现出对HBCD更高的吸收和积累能力[32],植物之间的竞争可能会改变根系分泌物的产生,而分泌物任何数量或质量上的变化都可能通过改变对土壤颗粒的吸附或通过影响微生物群落的组成和活性而间接改变HBCD在土壤颗粒上的吸附,从而最终导致土壤环境中HBCD的浓度变化。自然环境中,植物群落通常由两种或两种以上的植物组成,因此多种植物混种在土壤中HBCD污染修复方面也具有巨大的应用潜力。
近期,植物修复与其他修复方法相结合来修复受HBCD污染的土壤也有所报道。LE等[103]使用Pd/Fe纳米颗粒和烟草联合降解土壤中的HBCD,降解率能够达到41%,研究还发现添加腐植酸后,烟草对受HBCD污染土壤的植物修复效率有一定提升(从13% 上升到15%),而Pd/Fe纳米颗粒和烟草的联合修复方法效率反而降低到27%,腐植酸能够促进土壤中HBCD的扩散传质,提升其生物可利用性,但能够降低金属纳米颗粒的反应活性和可移动性,因此在选择联合降解方案时应考虑降解方案之间的影响。HUANG等[94]使用筛选分离得到的HBCD降解菌铜绿假单胞菌HS9与玉米联合降解土壤中的HBCD,菌株添加后土壤中HBCD含量降低了87.5%,菌株HS9能够通过影响根际土壤菌群、提高植物有益菌的相对丰度来促进玉米的生长代谢,从而使土壤中HBCD浓度降低。
目前HBCD富集植物的种类还不够丰富,需要对更多类型的植物及混种方案进行研究,使植物修复在土壤HBCD修复中展示出更大的应用前景。另外,富集HBCD的植物若不能得到正确处理,也会成为新的污染源,但研究表明植物修复过程中功能菌株的加入不仅能够降低土壤中的HBCD,同样能够降低植物中HBCD的浓度[94],降低植物修复可能存在的环境风险,因此微生物与植物联合修复方法具有很高的研究和应用价值。
2.3 动物修复目前,土壤中HBCD的动物修复方法比较少见,仅报道了通过蚯蚓来进行土壤中HBCD的降解(图 2)。LI等[104]发现,蚯蚓可以通过摄入土壤颗粒,在体内对HBCD进行富集从而降低土壤中HBCD的浓度,起到修复土壤的作用。蚯蚓对土壤中的HBCD异构体同样存在选择性吸收和代谢,对(-)α-HBCD、(-)β-HBCD、(-)γ-HBCD有更强的生物富集能力。研究人员还发现,生物炭和碳纳米管的加入会导致土壤中HBCD的生物可利用性降低,从而减弱蚯蚓对土壤中HBCD的吸收和富集[105]。另外,蚯蚓能够摄取存在于土壤中含有HBCD的聚苯乙烯泡沫颗粒,从而对HBCD进行富集,且富集能力高于其对同等污染程度土壤中HBCD的富集能力,说明以蚯蚓为主的土壤动物修复方法还可以降低微塑料带来的HBCD污染风险[106]。HBCD对土壤中线虫的毒理效应以及相关机制已有所报道[107],但目前没有文献报道将线虫应用到受HBCD污染土壤的修复中。
3 总结与展望HBCD能够通过HBCD生产工厂和电子垃圾拆解地等典型污染源、远距离扩散源、含有HBCD的污水以及活性污泥的施用、道路扬尘的沉降等途径进入农田生态系统。进入土壤环境中的HBCD会发生挥发和沉降、吸附和解吸等环境行为,且由于HBCD异构体之间物理化学性质存在差异,环境行为和分布规律存在区别,导致环境中的异构体组成发生变化。进入土壤环境中的HBCD能够通过植物进入陆生生态系统,威胁人类健康,因此目前已有大量生物修复方法应用于土壤中HBCD的降解,包括微生物修复、植物修复以及动物修复。其中,微生物修复主要是通过人工驯化和筛选HBCD高效降解菌或从自然环境中直接获取的微生物菌群用于污染土壤的修复,能够起到较好效果,但不同菌属以及菌群对异构体的降解偏好性存在差异;应用于HBCD污染土壤修复的植物主要有玉米、烟草、萝卜以及洋白菜,以上植物均表现出对HBCD的有效富集,不同植物类型以及相同植物的不同器官对异构体的富集能力存在区别;尽管目前并没有动物修复应用于土壤中HBCD的去除,但已有实验研究证明土壤中的HBCD能够被蚯蚓吞食从而从土壤中移除。针对土壤中HBCD的环境行为以及生物修复方法展望如下:
(1) 除污水和活性污泥的施用外,其他污染源进入农田土壤环境的最终途径为大气沉降,为削弱HBCD向农田生态系统中的输入,应做好城镇规划,将农田聚集区域布置于污染源上风向,同时种植HBCD高效富集植物或接种降解菌株,推动HBCD在农田中的循环过程,从而有效去除污染土壤中的HBCD。
(2) 进入环境中的HBCD浓度和异构体组成会发生改变,在自然衰减下HBCD产生的降解产物可能会对环境造成更大的威胁,各个阶段的潜在风险将会发生变化。农田土壤的环境质量关乎粮食安全,因此针对进入农田土壤中HBCD造成的环境风险应进行全面的分析,并尽快确定环境阈值,建立规范的预警机制。
(3) 在实际农田土壤环境中,可能同时存在多种溴代阻燃剂(例如:HBCD、PBDEs、TBBPA)以及重金属复合污染的情况,多种污染物之间存在相互作用,因此,应对复合污染的安全阈值以及对应的复合污染修复方法与机理进行更加深入的研究。
(4) HBCD在土壤多种介质及各个界面上的环境行为,以及人类干预造成的农田土壤组成和基本性质的变化对HBCD归趋的影响机制或将成为未来研究的重点。
(5) 目前针对土壤中HBCD污染的联合修复方法鲜有报道,化学、物理修复与生物修复联合的修复方法可以适应更多的环境类型,在HBCD污染土壤修复领域有着不可取代的优势,能够为区域环境修复和治理提供方法基础。
| [1] |
ZHANG Y Q, LU Y L, WANG P, et al. Biomagnification of hexabromo-cyclododecane(HBCD) in a coastal ecosystem near a large producer in China: Human exposure implication through food web transfer[J]. Science of the Total Environment, 2018, 624: 1213-1220. DOI:10.1016/j.scitotenv.2017.12.153 |
| [2] |
CAO X H, LU Y L, ZHANG Y Q, et al. An overview of hexabromocy-clododecane(HBCDs) in environmental media with focus on their potential risk and management in China[J]. Environmental Pollution, 2018, 236: 283-295. DOI:10.1016/j.envpol.2018.01.040 |
| [3] |
KOCH C, SCHMIDT-KÖTTERS T, RUPP R, et al. Review of hexabro-mocyclododecane(HBCD) with a focus on legislation and recent publications concerning toxicokinetics and dynamics[J]. Environmental Pollution, 2015, 199: 26-34. DOI:10.1016/j.envpol.2015.01.011 |
| [4] |
COVACI A, GERECKE A C, LAW R J, et al. Hexabromocyclododecanes(HBCDs) in the environment and humans: A review[J]. Environmental Science & Technology, 2006, 40(12): 3679-3688. |
| [5] |
SINDIKU O, BABAYEMI J, OSIBANJO O, et al. Polybrominated diphenyl ethers listed as Stockholm Convention POPs, other brominated flame retardants and heavy metals in e-waste polymers in Nigeria[J]. Environmental Science and Pollution Research, 2015, 22(19): 14489-14501. DOI:10.1007/s11356-014-3266-0 |
| [6] |
全国人大常委会关于批准《〈关于持久性有机污染物的斯德哥尔摩公约〉新增列六溴环十二烷修正案》的决定[N]. 人民日报, 2016-07-03(4). Decision of the Standing Committee of the National People's Congresson ratification of the new regulations on the hexabromo-cyclododecane in the Stockholm Convention on persistent organic pollutants[N]. People's Daily, 2016-07-03(4). |
| [7] |
LI Y, CHANG Q M, DUAN H B, et al. Occurrence, levels and profiles of brominated flame retardants in daily-use consumer products on the Chinese market[J]. Environmental Science Processes and Impacts, 2019, 21(3): 446-455. DOI:10.1039/C8EM00483H |
| [8] |
OKONSKI K, MELYMUK L, KOHOUTEK J, et al. Hexabromocyclodo-decane: Concentrations and isomer profiles from sources to environmental sinks[J]. Environmental Science and Pollution Research, 2018, 25(36): 36624-36635. DOI:10.1007/s11356-018-3381-4 |
| [9] |
JEON J W, KIM C S, KIM L, et al. Distribution and diastereoisomeric profiles of hexabromocyclododecanes in air, water, soil, and sediment samples in South Korea: Application of an optimized analytical method[J]. Ecotoxicology and Environmental Safety, 2019, 181: 321-329. DOI:10.1016/j.ecoenv.2019.06.015 |
| [10] |
程鑫, 孙秀梅, 金衍健, 等. 不同类型土壤中六溴环十二烷的浓度调查及分布特征比较[J]. 浙江大学学报(理学版), 2018, 45(4): 476-483. CHENG X, SUN X M, JIN Y J, et al. Concentration levels and compositional characteristics of hexabromocyclododecane in soils of different areas[J]. Journal of Zhejiang University(Science Edition), 2018, 45(4): 476-483. |
| [11] |
ICHIHARA M, YAMAMOTO A, KAKUTANI N, et al. Hexabromocy-clododecane in riverine and estuarine sediments from Osaka, Japan: Spatial distribution and concentration variability within identical samples[J]. Environmental Science and Pollution Research, 2020, 27(28): 35782-35791. DOI:10.1007/s11356-020-09856-0 |
| [12] |
WANG X L, YUAN X Y, YANG S K, et al. Concentrations, distributions, and risk assessment of HBCD in sediment in the Weihe river basin in northwest China[J]. International Journal of Environmental Research and Public Health, 2018, 15(11): 2340-2351. DOI:10.3390/ijerph15112340 |
| [13] |
WANG W T, CHOO G J, CHO H S, et al. The occurrence and distribution of hexabromocyclododecanes in freshwater systems, focusing on tissue-specific bioaccumulation in crucian carp[J]. Science of the Total Environment, 2018, 635: 470-478. DOI:10.1016/j.scitotenv.2018.03.262 |
| [14] |
LI Y, ZHU X H, WANG L X, et al. Levels and gas-particle partitioning of hexabromocyclododecanes in the urban air of Dalian, China[J]. Environmental Science and Pollution Research, 2018, 25(27): 27514-27523. DOI:10.1007/s11356-018-2793-5 |
| [15] |
RUAN Y F, ZHANG K, LAM J C W, et al. Stereoisomer-specific occurrence, distribution, and fate of chiral brominated flame retardants in different wastewater treatment systems in Hong Kong[J]. Journal of Hazardous Materials, 2019, 374: 211-218. DOI:10.1016/j.jhazmat.2019.04.041 |
| [16] |
GORGA M, MARTINEZ E, GINEBREDA A, et al. Determination of PBDEs, HBB, PBEB, DBDPE, HBCD, TBBPA and related compounds in sewage sludge from Catalonia(Spain)[J]. Science of the Total Environment, 2013, 444: 51-59. DOI:10.1016/j.scitotenv.2012.11.066 |
| [17] |
DREYER A, NICKEL S, SCHRÖEDER W. (Persistent) Organic pollutants in Germany: Results from a pilot study within the 2015 moss survey[J]. Environmental Sciences Europe, 2018, 30: 43. DOI:10.1186/s12302-018-0172-y |
| [18] |
JANAK K, SELLSTROM U, JOHANSSON A K, et al. Enantiomerspecific accumulation of hexabromocyclododecanes in eggs of predatory birds[J]. Chemosphere, 2008, 73(1): 193-200. DOI:10.1016/j.chemosphere.2007.03.077 |
| [19] |
SON M H, KIM J, SHIN E S, et al. Diastereoisomerand species-specific distribution of hexabromocyclododecane(HBCD) in fish and marine invertebrates[J]. Journal of Hazardous Materials, 2015, 300: 114-120. DOI:10.1016/j.jhazmat.2015.06.023 |
| [20] |
VALENZUELA-SANCHEZ I S, ZAPATA-PEREZ O, GARZAGISHOLT E, et al. Polybrominated diphenyl ethers(PBDE) and hexabromocyclododecane(HBCD) in liver of checkered puffer(Sphoeroides testudineus) from Ria Lagartos, Yucatan, Mexico[J]. Marine Pollution Bulletin, 2019, 146: 488-492. DOI:10.1016/j.marpolbul.2019.06.052 |
| [21] |
HUANG M R, LI J, XIAO Z X, et al. Tetrabromobisphenol A and hexabromocyclododecane isomers in breast milk from the general population in Beijing, China: Contamination levels, temporal trends, nursing infant's daily intake, and risk assessment[J]. Chemosphere, 2020, 244: 125524. DOI:10.1016/j.chemosphere.2019.125524 |
| [22] |
FUJII Y, KATO Y, MASUDA N, et al. Contamination trends and factors affecting the transfer of hexabromocyclododecane diastereomers, tetrabromobisphenol A, and 2, 4, 6-tribromophenol to breast milk in Japan[J]. Environmental Pollution, 2018, 237: 936-943. DOI:10.1016/j.envpol.2018.03.015 |
| [23] |
AL-MOUSA F, MICHELANGELI F. The sarcoplasmic-endoplasmic reticulum Ca2+-ATPase(SERCA) is the likely molecular target for the acute toxicity of the brominated flame retardant hexabromocyclodo-decane (HBCD)[J]. Chemico-Biological Interactions, 2014, 207: 1-6. DOI:10.1016/j.cbi.2013.10.021 |
| [24] |
AL-MOUSA F, MICHELANGELI F. Some commonly used brominated flame retardants cause Ca2+-ATPase inhibition, beta-amyloid peptide release and apoptosis in SH-SY5Y neuronal cells[J]. PLoS One, 2012, 7(4): e33059. DOI:10.1371/journal.pone.0033059 |
| [25] |
SAEGUSA Y, FUJIMOTO H, WOO G H, et al. Transient aberration of neuronal development in the hippocampal dentate gyrus after developmental exposure to brominated flame retardants in rats[J]. Archives of Toxicology, 2012, 86(9): 1431-1442. DOI:10.1007/s00204-012-0824-4 |
| [26] |
IBHAZEHIEBO K, IWASAKI T, SHIMOKAWA N, et al. 1, 2, 5, 6, 9, 10-alpha hexabromocyclododecane(HBCD) impairs thyroid hormone-induced dendrite arborization of purkinje cells and suppresses thyroid hormone receptor-mediated transcription[J]. Cerebellum, 2011, 10(1): 22-31. DOI:10.1007/s12311-010-0218-1 |
| [27] |
IBHAZEHIEBO K, IWASAKI T, XU M, et al. Brain-derived neurotrophic factor(BDNF) ameliorates the suppression of thyroid hormone-induced granule cell neurite extension by hexabromocyclodo-decane (HBCD)[J]. Neuroscience Letters, 2011, 493(1/2): 1-7. |
| [28] |
DOROSH A, DED L, ELZEINOVA F, et al. Assessing oestrogenic effects of brominated flame retardants hexabromocyclododecane and tetrabromobisphenol A on MCF-7 cells[J]. Folia Biologica, 2011, 57(1): 35-39. |
| [29] |
ZHEN G, ZHANG L J, LIU X Y, et al. The enrichment and purification of hexabromocyclododecanes and its effects on thyroid in zebrafish[J]. Ecotoxicology and Environmental Safety, 2019, 185. |
| [30] |
YANAGISAWA R, KOIKE E, WIN-SHWE T T, et al. Impaired lipid and glucose homeostasis in hexabromocyclododecane-exposed mice fed a high-fat diet[J]. Environmental Health Perspectives, 2014, 122(3): 277-283. DOI:10.1289/ehp.1307421 |
| [31] |
耿金瑶, 王莹莹. 六溴环十二烷异构体的毒理效应及其在生物体内的代谢转化过程研究进展[J]. 环境化学, 2017, 36(12): 2558-2566. GENG J Y, WANG Y Y. Toxicological effects and metabolic transformation of hexabromocyclodo decane isomers in organisms: A review[J]. Environmental Chemistry, 2017, 36(12): 2558-2566. DOI:10.7524/j.issn.0254-6108.2017041204 |
| [32] |
LI Y N, ZHOU Q X, WANG Y Y, et al. Fate of tetrabromobisphenol A and hexabromocyclododecane brominated flame retardants in soil and uptake by plants[J]. Chemosphere, 2011, 82(2): 204-209. DOI:10.1016/j.chemosphere.2010.10.021 |
| [33] |
VAUGHN L J S, TORN M S. C-14 evidence that millennial and fastcycling soil carbon are equally sensitive to warming[J]. Nature Climate Change, 2019, 9(6): 467-471. DOI:10.1038/s41558-019-0468-y |
| [34] |
JIANG M K, MEDLYN B E, DRAKE J E, et al. The fate of carbon in a mature forest under carbon dioxide enrichment[J]. Nature, 2020, 580(7802): 227-231. DOI:10.1038/s41586-020-2128-9 |
| [35] |
DONG S K, LI Y, GANJURJAV H, et al. Grazing promoted soil microbial functional genes for regulating C and N cycling in alpine meadow of the Qinghai-Tibetan Plateau[J]. Agriculture Ecosystems and Environment, 2020, 303: 107111. DOI:10.1016/j.agee.2020.107111 |
| [36] |
NOTTINGHAM A T, MEIR P, VELASQUEZ E, et al. Soil carbon loss by experimental warming in a tropical forest[J]. Nature, 2020, 584(7820): 234-237. DOI:10.1038/s41586-020-2566-4 |
| [37] |
ZHAO F J, WANG P. Arsenic and cadmium accumulation in rice and mitigation strategies[J]. Plant and Soil, 2020, 446(1/2): 1-21. DOI:10.1007/s11104-019-04374-6 |
| [38] |
LI X, LIU H L, JIA X S, et al. Novel approach for removing brominated flame retardant from aquatic environments using Cu/Fe-based metal-organic frameworks: A case of hexabromocyclododecane(HBCD)[J]. Science of the Total Environment, 2018, 621: 1533-1541. DOI:10.1016/j.scitotenv.2017.10.075 |
| [39] |
ZHANG K L, HUANG J, WANG H Z, et al. Mechanochemical degradation of hexabromocyclododecane and approaches for the remediation of its contaminated soil[J]. Chemosphere, 2014, 116: 40-45. DOI:10.1016/j.chemosphere.2014.02.006 |
| [40] |
刘青青. 典型溴代阻燃剂物质的光降解技术研究[D]. 杭州: 浙江大学, 2014: 22-32. LIU Q Q. Study on the photodegradation of selected brominated flame retardants[D]. Hangzhou: Zhejiang University, 2014: 22-32. |
| [41] |
ZHOU D N, WU Y, FENG X N, et al. Photodegradation of hexabromo-cyclododecane(HBCD) by Fe(Ⅲ) complexes/H2O2 under simulated sunlight[J]. Environmental Science and Pollution Research, 2014, 21(9): 6228-6233. DOI:10.1007/s11356-014-2553-0 |
| [42] |
刘文彬, 倪涛涛, 雷荣荣, 等. 利用石墨相氮化碳降解六溴环十二烷的方法: CN111644131A[P]. 2020-09-11. LIU W B, NI T T, LEI R R, et al. Degradation of hexabromocyclododecane by graphite phase carbon nitride: CN111644131A[P]. 2020-09-11. |
| [43] |
BARONTINI F, COZZANI V, PETARCA L. Thermal stability and decomposition products of hexabromocyclododecane[J]. Industrial & Engineering Chemistry Research, 2001, 40(15): 3270-3280. |
| [44] |
UKISU Y. Complete catalytic debromination of hexabromocyclododecane using a silica-supported palladium catalyst in alkaline 2-propanol[J]. Chemosphere, 2017, 179: 179-184. DOI:10.1016/j.chemosphere.2017.03.111 |
| [45] |
HUANG L, SHAH S B, HU H Y, et al. Pollution and biodegradation of hexabromocyclododecanes: A review[J]. Frontiers of Environmental Science & Engineering, 2020, 14(1): 34-41. DOI:10.1007/s11783-019-1190-8 |
| [46] |
PENG Y H, CHEN Y J, CHANG M, et al. The effect of zerovalent iron on the microbial degradation of hexabromocyclododecane[J]. Chemosphere, 2018, 200: 419-426. DOI:10.1016/j.chemosphere.2018.02.123 |
| [47] |
REMBERGER M, STERNBECK J, PALM A, et al. The environmental occurrence of hexabromocyclododecane in Sweden[J]. Chemosphere, 2004, 54(1): 9-21. DOI:10.1016/S0045-6535(03)00758-6 |
| [48] |
ZHANG Y Q, LU Y L, WANG P, et al. Transport of hexabromocy-clododecane(HBCD) into the soil, water and sediment from a large producer in China[J]. Science of the Total Environment, 2018, 610: 94-100. |
| [49] |
HUANG H L, WANG D, WAN W N, et al. Hexabromocyclododecanes in soils and plants from a plastic waste treatment area in north China: Occurrence, diastereomer-and enantiomer-specific profiles, and metabolization[J]. Environmental Science Pollution Research, 2017, 24(27): 21625-21635. DOI:10.1007/s11356-017-9792-9 |
| [50] |
LI H H, ZHANG Q H, WANG P, et al. Levels and distribution of hexabromocyclododecane(HBCD) in environmental samples near manufacturing facilities in Laizhou Bay area, east China[J]. Journal of Environmental Monitoring, 2012, 14(10): 2591-2597. DOI:10.1039/c2em30231d |
| [51] |
TANG J F, FENG J Y, LIA X H, et al. Levels of flame retardants HBCD, TBBPA and TBC in surface soils from an industrialized region of east China[J]. Environmental Science Processes and Impacts, 2014, 16(5): 1015-1021. DOI:10.1039/C3EM00656E |
| [52] |
ZHANG Y W, RUAN Y F, SUN H W, et al. Hexabromocyclododecanes in surface sediments and a sediment core from rivers and harbor in the northern Chinese city of Tianjin[J]. Chemosphere, 2013, 90(5): 1610-1616. DOI:10.1016/j.chemosphere.2012.08.037 |
| [53] |
JO H, SON M H, SEO S H, et al. Matrix-specific distribution and diastereomeric profiles of hexabromocyclododecane(HBCD) in a multi-media environment: Air, soil, sludge, sediment, and fish[J]. Environmental Pollution, 2017, 226: 515-522. DOI:10.1016/j.envpol.2017.04.093 |
| [54] |
MENG X Z, DUAN Y P, YANG C, et al. Occurrence, sources, and inventory of hexabromocyclododecanes(HBCDs) in soils from Chongming Island, the Yangtze River Delta(YRD)[J]. Chemosphere, 2011, 82(5): 725-731. DOI:10.1016/j.chemosphere.2010.10.091 |
| [55] |
ZHU N L, SCHRAMM K W, WANG T, et al. Lichen, moss and soil in resolving the occurrence of semi-volatile organic compounds on the southeastern Tibetan Plateau, China[J]. Science of the Total Environment, 2015, 518: 328-336. |
| [56] |
LI F, JIN J, TAN D Q, et al. Hexabromocyclododecane and tetrabromobisphenol A in sediments and paddy soils from Liaohe River Basin, China: Levels, distribution and mass inventory[J]. Journal of Environmental Sciences, 2016, 48: 209-217. DOI:10.1016/j.jes.2016.03.018 |
| [57] |
LU H X, MA X J, HUANG X J, et al. Distribution, diastereomer-specific accumulation and associated health risks of hexabromocyclodo-decanes(HBCDs) in soil-vegetable system of the Pearl River Delta region, south China[J]. Journal of Environmental Management, 2019, 248: 109321. DOI:10.1016/j.jenvman.2019.109321 |
| [58] |
李红华, 商红涛, 王璞, 等. 四川省部分地区土壤中六溴环十二烷的分布特征[J]. 环境化学, 2014, 33(9): 1439-1444. LI H H, SHANG H T, WANG P, et al. Distribution of hexabromocyclododecane (HBCD) in surface soils from some regions of Sichuan Province in China[J]. Environmental Chemistry, 2014, 33(9): 1439-1444. |
| [59] |
DUAN H, YU D F, ZUO J, et al. Characterization of brominated flame retardants in construction and demolition waste components: HBCD and PBDEs[J]. Science of the Total Environment, 2016, 572: 77-85. DOI:10.1016/j.scitotenv.2016.07.165 |
| [60] |
NIE Z Q, YANG Z L, FANG Y Y, et al. Environmental risks of HBCDD from construction and demolition waste: A contemporary and future issue[J]. Environmental Science and Pollution Research, 2015, 22(21): 17249-17252. DOI:10.1007/s11356-015-5487-2 |
| [61] |
GAO C J, XIA L L, WU C C, et al. The effects of prosperity indices and land use indicators of an urban conurbation on the occurrence of hexabromocyclododecanes and tetrabromobisphenol A in surface soil in south China[J]. Environmental Pollution, 2019, 252: 1810-1818. DOI:10.1016/j.envpol.2019.06.128 |
| [62] |
ROOSENS L, ABDALLAH M A E, HARRAD S, et al. Exposure to hexabromocyclododecanes(HBCDs) via dust ingestion, but not diet, correlates with concentrations in human serum: Preliminary results[J]. Environmental Health Perspectives, 2009, 117(11): 1707-1712. DOI:10.1289/ehp.0900869 |
| [63] |
DAVIS J W, GONSIOR S J, MARKHAM D A, et al. Biodegradation and product identification of C-14 hexabromocyclododecane in waste-water sludge and freshwater aquatic sediment[J]. Environmental Science & Technology, 2006, 40(17): 5395-5401. |
| [64] |
GERECKE A C, GIGER W, HARTMANN P C, et al. Anaerobic degradation of brominated flame retardants in sewage sludge[J]. Chemosphere, 2006, 64(2): 311-317. DOI:10.1016/j.chemosphere.2005.12.016 |
| [65] |
ZHAO Y Y, ZHANG X H, SOJINU O S S. Thermodynamics and photochemical properties of alpha, beta, and gamma-hexabromocyclodo-decanes: A theoretical study[J]. Chemosphere, 2010, 80(2): 150-156. DOI:10.1016/j.chemosphere.2010.04.002 |
| [66] |
张艳伟, 阮悦斐, 赵立杰, 等. 六溴环十二烷在不同用途土壤中的污染特征[J]. 农业环境科学学报, 2013, 32(1): 63-68. ZHANG Y W, RUAN Y F, ZHAO L J, et al. Distribution of hexabromocyclodo-decanes in soils for different uses: Concentration, diastereomeric and enantiomeric profiles[J]. Journal of Agro-Environment Science, 2013, 32(1): 63-68. |
| [67] |
RUAN Y F, ZHANG K, WU C X, et al. A preliminary screening of HBCD enantiomers transported by microplastics in wastewater treatment plants[J]. Science of the Total Environment, 2019, 674: 171-178. DOI:10.1016/j.scitotenv.2019.04.007 |
| [68] |
GALLEN C, DRAGE D, KASERZON S, et al. Occurrence and distribution of brominated flame retardants and perfluoroalkyl substances in Australian landfill leachate and biosolids[J]. Journal of Hazardous Materials, 2016, 312: 55-64. DOI:10.1016/j.jhazmat.2016.03.031 |
| [69] |
向楠, 孟祥周, 陈玲. 上海城市污泥中HBCD的浓度及土地施用累积水平[J]. 中国给水排水, 2012, 28(5): 88-92. XIANG N, MENG X Z, CHEN L. Concentration distribution of HBCD in sewage sludge and accumulative effect of land application in Shanghai[J]. China Water & Wastewater, 2012, 28(5): 88-92. DOI:10.3969/j.issn.1000-4602.2012.05.025 |
| [70] |
张希, 杨静, 刘敏, 等. 上海交通沿线农田土壤中PAHs分布特征及源解析[J]. 中国环境科学, 2019, 39(2): 741-749. ZHANG X, YANG J, LIU M, et al. Distribution characteristics and source analysis of PAHs in farmland soils along Shanghai traffic artery[J]. China Environmental Science, 2019, 39(2): 741-749. DOI:10.3969/j.issn.1000-6923.2019.02.037 |
| [71] |
LU J F, HE M J, YANG Z H, et al. Occurrence of tetrabromobisphenol a(TBBPA) and hexabromocyclododecane(HBCD) in soil and road dust in Chongqing, western China, with emphasis on diastereoisomer profiles, particle size distribution, and human exposure[J]. Environmental Pollution, 2018, 242: 219-228. DOI:10.1016/j.envpol.2018.06.087 |
| [72] |
WU M H, HAN T, XU G, et al. Occurrence of hexabromocyclododecane in soil and road dust from mixed-land-use areas of Shanghai, China, and its implications for human exposure[J]. Science of the Total Environment, 2016, 559: 282-290. DOI:10.1016/j.scitotenv.2016.03.166 |
| [73] |
ABDALLAH M A E, IBARRA C, NEELS H, et al. Comparative evaluation of liquid chromatography-mass spectrometry versus gas chromatography-mass spectrometry for the determination of hexabromocyclododecanes and their degradation products in indoor dust[J]. Journal of Chromatography A, 2008, 1190(1/2): 333-341. |
| [74] |
李文龙. 亚洲五国土壤和大气中溴代阻燃剂的时空分布和健康风险[D]. 哈尔滨: 哈尔滨工业大学, 2016: 53-63. LI W L. Spatiotemporal variations and human health risks of brominated flame retardants in soil and air of five Asian countries[D]. Harbin: Harbin Institute of Technology, 2016: 53-63. |
| [75] |
WANG X L, SUN R R, CHEN Y D, et al. Temporal-spatial distribution and diastereoisomer pattern of hexabromocyclododecane in the vicinity of a chemical plant[J]. Journal of Environmental Sciences, 2019, 82: 203-212. DOI:10.1016/j.jes.2019.03.010 |
| [76] |
NI H G, ZENG H. HBCD and TBBPA in particulate phase of indoor air in Shenzhen, China[J]. Science of the Total Environment, 2013, 458: 15-19. |
| [77] |
ZHU H K, SUN H W, ZHANG Y W, et al. Uptake pathway, translocation, and isomerization of hexabromocyclododecane diastereoisomers by wheat in closed chambers[J]. Environmental Science & Technology, 2016, 50(5): 2652-2659. |
| [78] |
ZHU H K, SUN H W, YAO Y M, et al. Fate and adverse effects of hexabromocyclododecane diastereoisomers(HBCDDs) in a soil-ryegrass pot system[J]. Chemosphere, 2017, 184: 452-459. DOI:10.1016/j.chemosphere.2017.05.166 |
| [79] |
WU S C, GSCHWEND P M. Sorption kinetics of hydrophobic organic compounds to natural sediments and soils[J]. Environmental Science & Technology, 1986, 20(7): 717-725. |
| [80] |
HEEB N V, GRAF H, SCHWEIZER W B, et al. Thermally-induced transformation of hexabromocyclododecanes and isobutoxypenta bromocyclododecanes in flame-proofed polystyrene materials[J]. Chemosphere, 2010, 80(7): 701-708. DOI:10.1016/j.chemosphere.2010.05.034 |
| [81] |
PENG X X, WEI D Y, HUANG Q Y, et al. Debromination of hexabro-mocyclododecane by anaerobic consortium and characterization of functional bacteria[J]. Frontiers in Microbiology, 2018, 9: 1515. DOI:10.3389/fmicb.2018.01515 |
| [82] |
JANAK K, COVACI A, VOORSPOELS S, et al. Hexabromocyclodo-decane in marine species from the Western Scheldt Estuary: Diaste-reoisomer-and enantiomer-specific accumulation[J]. Environmental Science & Technology, 2005, 39(7): 1987-1994. |
| [83] |
HUANG H L, ZHANG S Z, LV J T, et al. Experimental and theoretical evidence for diastereomer- and enantiomer-specific accumulation and biotransformation of HBCD in maize roots[J]. Environmental Science & Technology, 2016, 50(22): 12205-12213. |
| [84] |
CHANG T H, WANG R B, PENG Y H, et al. Biodegradation of hexabromocyclododecane by Rhodopseudomonas palustris YSC3 strain: A free-living nitrogen-fixing bacterium isolated in Taiwan[J]. Chemosphere, 2020, 246: 125621. DOI:10.1016/j.chemosphere.2019.125621 |
| [85] |
ZHONG Y, WANG H L, YU Z Q, et al. Diastereoisomer-specific biotransformation of hexabromocyclododecanes by a mixed culture containing Dehalococcoides mccartyi Strain 195[J]. Frontiers in Microbiology, 2018, 9: 1713. DOI:10.3389/fmicb.2018.01713 |
| [86] |
李冬, 范晓琳. 生物修复技术在土壤污染治理中的应用[J]. 节能与环保, 2019(7): 109-110. LI D, FAN X L. Application of bioremediation technology in soil pollution control[J]. Energy Conservation & Environmental Protection, 2019(7): 109-110. DOI:10.3969/j.issn.1009-539X.2019.07.049 |
| [87] |
PENG X X, HUANG X Y, JING F, et al. Study of novel pure culture HBCD-1, effectively degrading hexabromocyclododecane, isolated from an anaerobic reactor[J]. Bioresource Technology, 2015, 185: 218-224. DOI:10.1016/j.biortech.2015.02.093 |
| [88] |
DAVIS J W, GONSIOR S, MARTY G, et al. The transformation of hexabromocyclododecane in aerobic and anaerobic soils and aquatic sediments[J]. Water Research, 2005, 39(6): 1075-1084. DOI:10.1016/j.watres.2004.11.024 |
| [89] |
SHAH S B, HUANG L, HU H Y, et al. Characterization of environmentally friendly degradation of hexabromocyclododecane by a Bacillus strain HBCD-sjtu[J]. International Biodeterioration & Biodegradation, 2019, 145: 104794. |
| [90] |
GENG J Y, HAN M, YANG X, et al. Different biotransformation of three hexabromocyclododecane diastereoisomers by Pseudomonas sp. under aerobic conditions[J]. Chemical Engineering Journal, 2019, 374: 870-879. DOI:10.1016/j.cej.2019.05.232 |
| [91] |
王莹莹, 耿金瑶, 张娅迪, 等. 一株假单胞菌GJY及其在六溴环十二烷异构体降解中的应用: CN109456923B[P]. 2021-04-20. WANG Y Y, GENG J Y, ZHANG Y D, et al. The degradation of hexabromocyclodode cane isomers by a strain of Pseudomonas GJY: CN109456923B[P]. 2021-04-20. |
| [92] |
LI Y J, LI M H, SHIH Y H. Aerobic degradation and the effect of hexabromocyclododecane by soil microbial communities in Taiwan[J]. Environment International, 2020, 145: 106128. DOI:10.1016/j.envint.2020.106128 |
| [93] |
唐鸿志, 赛义德·比拉·沙哈, 许平, 等. 一种降解六溴环十二烷的菌株筛选方法及其应用: CN109652343A[P]. 2019-04-19. TANG H Z, SAIYIDE B S, XU P, et al. A hexabromocyclododecane degrading strains isolate method and its application: CN109652343A[P]. 2019-04-19. |
| [94] |
HUANG L, WANG W W, SHAH S B, et al. The HBCDs biodegradation using a Pseudomonas strain and its application in soil phytoreme-diation[J]. Journal of Hazardous Materials, 2019, 380: 120833. DOI:10.1016/j.jhazmat.2019.120833 |
| [95] |
LE T T, SON M H, NAM I H, et al. Transformation of hexabromocy-clododecane in contaminated soil in association with microbial diversity[J]. Journal of Hazardous Materials, 2017, 325: 82-89. DOI:10.1016/j.jhazmat.2016.11.058 |
| [96] |
DEMIRTEPE H, IMAMOGLU I. Biostimulation enhanced the biotic degradation of hexabromocyclododecane in sediments[J]. Journal of Soils and Sediments, 2019, 19(6): 2859-2868. DOI:10.1007/s11368-019-02280-z |
| [97] |
ANASONYE F, WINQUIST E, KLUCZEK-TURPEINEN B, et al. Fungal enzyme production and biodegradation of polychlorinated dibenzo-p-dioxins and dibenzofurans in contaminated sawmill soil[J]. Chemosphere, 2014, 110: 85-90. DOI:10.1016/j.chemosphere.2014.03.079 |
| [98] |
朱永官, 彭静静, 韦中, 等. 土壤微生物组与土壤健康[J]. 中国科学: 生命科学, 2020, 50: 1-11. ZHU Y G, PENG J J, WEI Z, et al. Linking the soil microbiome to soil health[J]. Scientia Sinica Vitae, 2020, 50: 1-11. |
| [99] |
LUNNEY A I, ZEEB B A, REINER K J. Uptake of weathered DDT in vascular plants: Potential for phytoremediation[J]. Environmental Science & Technology, 2004, 38(22): 6147-6154. |
| [100] |
WU T, WANG S, HUANG H L, et al. Diastereomer-specific uptake, translocation, and toxicity of hexabromocyclododecane diastereoisomers to maize[J]. Journal of Agricultural and Food Chemistry, 2012, 60(34): 8528-8534. DOI:10.1021/jf302682p |
| [101] |
ZHANG X, HERGER A G, REN Z, et al. Resistance effect of flavonols and toxicology analysis of hexabromocyclododecane based on soil-microbe-plant system[J]. Chemosphere, 2020, 257: 127248. DOI:10.1016/j.chemosphere.2020.127248 |
| [102] |
WHITE J C, KOTTLER B D. Citrate-mediated increase in the uptake of weathered 2, 2-bis(p-chlorophenyl) 1, 1-dichloroethylene residues by plants[J]. Environmental Toxicology and Chemistry, 2002, 21(3): 550-556. DOI:10.1002/etc.5620210312 |
| [103] |
LE T T, YOON H, SON M H, et al. Treatability of hexabromocy-clododecane using Pd/Fe nanoparticles in the soil-plant system: Effects of humic acids[J]. Science of the Total Environment, 2019, 689: 444-450. DOI:10.1016/j.scitotenv.2019.06.290 |
| [104] |
LI B, CHEN H, SUN H W, et al. Distribution, isomerization and enantiomer selectivity of hexabromocyclododecane(HBCD) diastereoisomers in different tissue and subcellular fractions of earthworms[J]. Ecotoxicology Environmental Safety, 2017, 139: 326-334. DOI:10.1016/j.ecoenv.2017.01.004 |
| [105] |
LI B, ZHU H K, SUN H W, et al. Effects of the amendment of biochars and carbon nanotubes on the bioavailability of hexabromocy-clododecanes(HBCDs) in soil to ecologically different species of earthworms[J]. Environmental Pollution, 2017, 222: 191-200. DOI:10.1016/j.envpol.2016.12.057 |
| [106] |
LI B, LAN Z H, WANG L, et al. The release and earthworm bioaccumulation of endogenous hexabromocyclododecanes(HBCDDs) from expanded polystyrene foam microparticles[J]. Environmental Pollution, 2019, 255: 113163. DOI:10.1016/j.envpol.2019.113163 |
| [107] |
WANG X L, YANG J, LI H, et al. Chronic toxicity of hexabromocy-clododecane(HBCD) induced by oxidative stress and cell apoptosis on nematode Caenorhabditis elegans[J]. Chemosphere, 2018, 208: 31-39. DOI:10.1016/j.chemosphere.2018.05.147 |
| [108] |
夏炎, 韩伟立, 马安德. 广东省农耕土壤中四溴双酚A与六溴环十二烷的含量调查及其蓄积水平估算[J]. 环境化学, 2017, 36(6): 1328-1334. XIA Y, HAN W L, MA A D. Contents, distribution and composition of tetrabromobisphenol A and hexabromocy-clododecane in agricultural soils of Guangdong[J]. Environmental Chemistry, 2017, 36(6): 1328-1334. |
 2021, Vol. 40
2021, Vol. 40