2. 浙江省农业科学院环境资源与土壤肥料研究所, 杭州 310021;
3. 浙江省生物炭工程技术研究中心, 杭州 310021
2. Institute of Environment, Resource, Soil and Fertilizer, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;
3. Engineering Research Center of Biochar of Zhejiang Province, Hangzhou 310021, China
在我国,农业生产每年会产生大量农作物秸秆。据2015统计数据显示,我国秸秆年总产量约为6亿t[1],而在2021最新统计中,我国秸秆年总产量已增加至9亿t[2],成为世界最大秸秆生产国。这些秸秆大部分被丢弃或焚烧,导致了极大资源浪费,且由于秸秆焚烧会产生CO、CO2、SO2、非甲烷碳氢化合物以及氮氧化物等,将造成严重空气污染[1]。因此,目前迫切需要开发一种合适的农作物秸秆处理方法。生物炭是指生物质材料在限氧条件下经高温热裂解产生的一种富碳固体材料[3-4],其通常作为一种土壤改良剂被用于农业生产和土壤环境修复等领域。近年来,将废弃生物质原料高温炭化制备生物炭已成为相关研究热点。
生物炭具有重金属吸附、有机污染物降解、土壤改良等诸多优良功能[4-7]。生物炭的高度稳定性是其抵抗自然氧化和微生物降解的基础。相关研究表明,生物炭在环境中的平均留存时间可达千万年之久[8-10],但最终仍会自然氧化或被微生物分解。生物炭的稳定性受到原料类型、炭化温度等众多因素的影响,前人对此已有大量研究报道。除此之外,外源矿物添加也能显著改变生物炭的稳定性,改变其抵抗自然氧化与微生物降解能力。REN等[11]使用Ca(OH)2对污泥生物炭进行改性处理,发现Ca(OH)2可显著增加污泥生物炭的碳素持留率,同时显著降低污泥生物炭的氧化损失率。通过改性处理,300 ℃生物炭的碳素持留率从71.6% 提高到75.2%,600 ℃生物炭的碳素持留率从45.5% 提高到50.7%。300 ℃和700 ℃改性生物炭的碳素氧化损失率(H2O2法)分别降低了68.9% 和38.6%。GUO等[12]研究发现,Si元素可能与水稻秸秆生物炭的碳元素以某种方式形成一种致密的包封保护结构,这种致密的包封保护结构可以帮助生物炭抵抗外界环境的氧化作用,提高水稻秸秆生物炭稳定性。此外,这种保护结构可能受炭化温度影响,且在500 ℃的炭化条件下最为稳定。另有研究表明,铁、铝、硒、钙等元素可与生物炭表面发生复杂的聚合反应生成有机矿物复合体,从而保护生物炭免受环境的侵袭,增强生物炭在环境中的稳定性[13-14]。蛭石的分子式为(Mg,Fe,Al)3([Si,Al)4O10(OH)2]·4H2O,是一种成本低廉、环境友好且应用广泛的矿物材料,富含铁、铝、硅等元素,这使其有望成为增强生物炭稳定性的理想材料。目前关于蛭石改性对生物炭在环境中稳定性的影响研究鲜见报道,相关机理仍不明确[15],因此,相关研究有待进一步开展。
生物炭通常是被添加至土壤中得以应用,因此,研究生物炭的功能特性通常离不开土壤环境因素。生物炭在土壤中的降解除受其自身稳定性制约外,还受土壤类型、土壤水分状况等因素影响。STEINBEISS等[16]研究了酵母生物炭在不同土壤中的降解特征,结果表明,相比于森林土壤,耕作土壤中生物炭的矿化速率更快。NGUYEN等[17]研究发现,玉米秸秆生物炭在不同淹水条件下矿化速率为6%~21%。由此可见,不同土壤环境条件下生物炭降解特征并不一致。以往研究表明,生物炭的快速降解通常发生在培养开始后的0~14 d内,且7~14 d是生物炭在土壤中发生降解的关键时期[18-20],随着培养时间的延长,生物炭的降解速率趋近于0。因此,阐明生物炭在土壤中的短期(14 d以内)降解情况对于深入理解生物炭的降解特征尤为重要。
鉴于此,本研究以水稻秸秆和蛭石为供试材料制备蛭石改性水稻秸秆生物炭,并对其基本理化性质进行表征和分析;通过实验室恒温培养试验模拟红壤、水稻土环境条件,研究改性和未改性生物炭在不同土壤环境条件下的短期降解情况,以期明确蛭石改性水稻秸秆生物炭在干旱和淹水土壤中的降解特征。本研究结果对于深入了解生物炭在土壤中的稳定性及其环境效应具有指导意义。
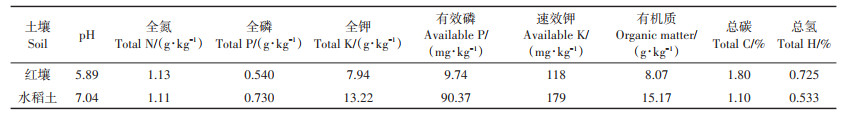
1 材料与方法 1.1 供试土壤本研究选取了红壤和水稻土两种类型土壤。红壤采自浙江省金华市兰溪农场(119°13′30″E,29°01′ 20″ N)。水稻土采自浙江省杭州市浙江省农科院科研基地。土壤样品按照“S”形多点混合法采集,采集后自然风干,过2 mm筛备用。供试土壤基本理化性质如表 1所示。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic physical and chemical properties of soils |
本研究选用水稻秸秆作为制备生物炭的原材料,其来源为杭州市浙江省农业科学院科研基地。选取蛭石(分析纯)作为生物炭的矿物改性材料。水稻秸秆生物炭(BC)使用实验室可编程管式炭化反应器(杭州蓝天仪器有限公司)将水稻秸秆炭化制备。升温程序为:初温50 ℃,升温速率15 ℃·min-1,最高炭化温度分别为300、400、500、600 ℃和700 ℃,炭化时间90 min。制得的未改性生物炭分别标记为BC300、BC400、BC500、BC600和BC700。蛭石改性水稻秸秆生物炭(MBC)是将蛭石与水稻秸秆按1∶4(m∶m)的比例混合后,将其放入炭化反应器中进行炭化制得。采用1∶4是因为在该比例条件下可形成均匀的炭化混合物[21]。制备蛭石改性生物炭的升温程序与未改性生物炭相同,制得的改性生物炭分别标记为MBC300、MBC400、MBC500、MBC600和MBC700。
1.3 基本理化指标测定生物炭pH的测定:将生物炭与去离子水按1∶20(m∶V)混合,140 r·min-1振荡10 min,过滤取滤液,使用pH计(PHS-3B型,北京仪电科学仪器股份有限公司)测定滤液pH。将生物炭置于马弗炉中750 ℃恒温4 h,以残留物的质量占样品原质量的百分数作为生物炭灰分含量。采用CHNS元素分析仪(VarioEL/micro cube,Elementar,Germany)测定生物炭样品中碳、氢元素含量。氧元素含量采用差减法计算得出。将土壤/生物炭与0.5 mol∙L−1 K2SO4按1∶5固液比混合并以140 r·min-1振荡16 h,将混合液通过0.45 μm滤膜,使用总有机碳(TOC)分析仪(multi N/C 3100,Germany)测定滤液中溶解性有机碳(DOC)含量。使用BET表面积分析仪(ASAP 2020,Micromeritics,USA)测定生物炭的比表面积(SSA)和孔体积(PV)。热重分析的操作步骤:将过0.15 mm筛的5~10 mg生物炭样品置于氧化铝坩埚中,调整天平至平衡;设置升温速率为20 ℃·min-1,最高温度为800 ℃,介质为高纯氮气(99.999%),分析生物炭质量随温度上升的变化。含碳官能团化学位移归属的确定:使用Varian Unity Inova 400NMR光谱仪(AVANCEIII 400,Bruker,Switzerland)在100.62 MHz的频率下获得生物炭的核磁共振波谱,再通过MestReNova软件对核磁共振波谱进行积分计算。
1.4 培养试验降解试验在室内恒温培养箱中进行。设置土壤类型(红壤与水稻土,分别记为R、P)、水分条件(干旱与淹水,分别记为D、F)、蛭石改性(改性与未改性)3个影响因素。各处理中土壤质量为10 g,生物炭添加量为5%,每个处理重复3次,同时设置不添加生物炭的纯培养作为对照。具体操作:首先,将生物炭与土壤置入250 mL培养装置中并混合均匀,干旱土壤培养试验不添加去离子水以保持干燥,淹水土壤培养试验中添加10 mL去离子水保证淹水条件。然后,将培养装置置于温度25 ℃、湿度30% 条件下连续培养14 d。待培养结束后破坏性采集添加生物炭处理的土壤样品,将所采集的土壤样品在室温([25±1)℃]条件下进行风干处理,后将风干土壤样品通过0.15 mm筛备用。利用元素分析仪(VarioEL/micro cube,Elementar,Germany)测定样品的碳元素含量。
1.5 数据处理与分析使用Excel软件进行数据处理。采用SPSS 16.0软件,使用LSD检验法对不同炭化温度生物炭处理碳含量变化数据进行单因素方差分析(显著性水平P= 0.05),并以土壤类型、水分条件和蛭石改性为自变量进行一般线性模型单变量方差分析。使用SigmaPlot 10.0软件进行绘图。
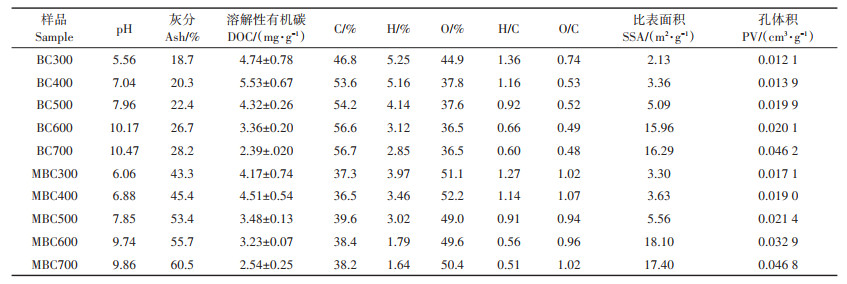
2 结果与讨论 2.1 蛭石改性和未改性生物炭的基本理化特性各处理生物炭的pH、灰分含量、元素分析、DOC、孔隙结构等理化特性如表 2所示。由表 2可以看出,随着炭化温度从300 ℃增加至700 ℃,未改性生物炭的pH从5.56增加到10.47。此结果表明,随着炭化温度的升高,生物炭逐渐由酸性转变为碱性。REN等[11]研究结果显示300~700 ℃条件下制备的污泥生物炭pH分别为6.55~8.51。pH增加的主要原因是随着炭化温度的升高,生物炭中的酸性官能团和挥发性有机化合物减少[22]。此外,随着炭化温度增加,改性生物炭pH从6.06增加到9.86,此结果介于未改性生物炭pH范围之间,这可能是由于蛭石具有缓冲pH的作用。从表 2可以看出,不同炭化温度制备的生物炭灰分含量随着炭化温度升高也呈增加趋势。改性生物炭灰分含量显著高于未改性生物炭,这主要是因为蛭石耐火温度为1 300~1 350 ℃,本研究制备生物炭的炭化温度为300~700 ℃,这不足以使蛭石完全分解,仍有部分蛭石得以存留在生物炭当中。随炭化温度升高,未改性生物炭碳元素含量升高,相比于300 ℃制备的生物炭,700 ℃制备的生物炭碳元素含量增加21.2%。蛭石改性降低了所有生物炭的碳元素含量,降低范围为20.3%~32.7%。随炭化温度升高,生物炭DOC先增加后降低,在400 ℃时达到最大值(表 2),这主要是由于有机物(纤维素、半纤维素和木质素)的分解[23]。蛭石改性降低了所有生物炭的DOC含量。随炭化温度升高,未改性生物炭H元素和O元素含量逐渐下降,H/C与O/C也随之下降。此外,所有改性生物炭的H/C均低于未改性生物炭,这表明蛭石改性提高了水稻秸秆生物炭的芳香化程度,增强了生物炭的稳定性。随着炭化温度升高,改性和未改性生物炭的比表面积(SSA)和孔体积(PV)逐渐增大,这与前人研究结果一致[24-25]。这可能是由于炭化过程中挥发性物质的释放[26]。在相同的炭化温度下,改性生物炭的SSA、PV值均高于未改性。REN等[11]和CARNEIRO等[21]的研究均表明,矿物改性会增加生物炭的比表面积和丰富生物炭的孔隙结构,这是由于矿物附着在生物炭表面。
|
|
表 2 不同炭化温度条件下制备的BC和MBC的理化特性 Table 2 Basic properties of BC and MBC prepared at different temperatures |
各处理生物炭的热重曲线如图 1所示。随着热解温度升高,所有生物炭的热重曲线表现出相同趋势。热重曲线的第1阶段为初始温度至100 ℃,此阶段主要为水分等低沸点物质挥发阶段;第2阶段为330 ℃至800 ℃,热重曲线表现为快速降低,此阶段主要是纤维素与半纤维素以及脂肪族化合物和芳香族化合物的分解阶段。

|
图 1 不同温度下制备的BC和MBC的热重曲线 Figure 1 Thermogravimetric curves of BC and MBC prepared at different temperatures |
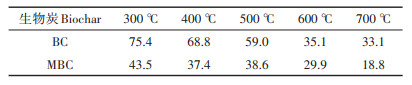
各处理生物炭的热损失量如表 3所示。当热解温度升高至800 ℃,未改性与改性生物炭的热损失量分别为33.1%~75.4% 和18.8%~43.5%,且随着炭化温度升高表现出明显下降趋势。这说明随着炭化温度升高,生物炭热稳定性明显增加。相比于300 ℃制备的生物炭,700 ℃制备的未改性和改性生物炭的热损失量分别减少42.3和24.7个百分点。这主要是由于随着炭化温度升高,生物炭中含氧官能团减少,疏水性增强,形成了更加稳定的芳香碳结构[6]。此外,经蛭石改性后,生物炭的热损失量下降5.2~31.9个百分点。这表明蛭石改性增加了水稻秸秆生物炭的热稳定性。这可能是由于蛭石本身具有良好的吸热能力,可对生物炭起到一定的保护作用。
|
|
表 3 不同炭化温度的BC和MBC热损失质量(%) Table 3 Thermal loss mass of BC and MBC with different temperatures(%) |
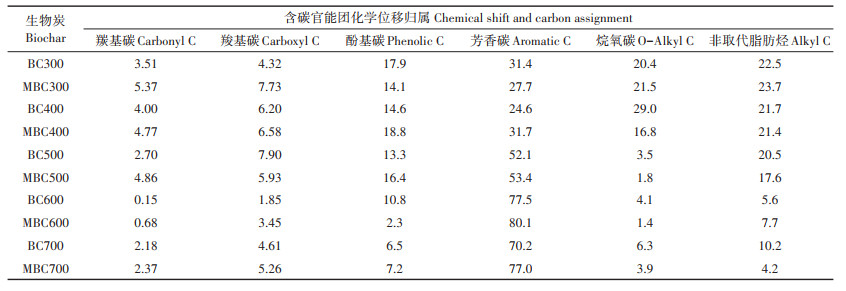
各处理生物炭的含碳官能团化学位移归属如表 4所示。不同生物炭样品的含碳官能团类别与含量趋于一致,均主要由芳香碳(109~145 μmol·mol-1)、烷氧碳(50~109 μmol · mol-1)与非取代脂肪烃(0~50 μmol·mol-1)组成,且芳香碳含量最高。这说明生物炭具有高度芳香化结构。随炭化温度增加,生物炭中的芳香碳含量表现为增加趋势。烷氧碳与非取代脂肪烃则表现为下降趋势。这说明了随着炭化温度的升高,生物炭的芳香化程度增加,稳定性增强。这主要是由于在较低炭化温度(0~300 ℃)条件下,固体生物质中大分子含量降低,芳香化结构形成。随着炭化温度进一步升高(300~600 ℃),芳香化结构进一步累积,最终形成涡轮层状微晶结构[27]。蛭石改性增加了大多数生物炭中芳香碳的含量而降低了烷氧碳与非取代脂肪烃的含量,这也说明蛭石改性增加了生物炭的稳定性。
|
|
表 4 不同炭化温度的BC和MBC的含碳官能团化学位移归属(%) Table 4 Chemical shift and carbon assignment of BC and MBC with different temperatures(%) |
不同炭化温度条件下制备的生物炭在土壤中的降解情况如图 2所示。相比于在300~700 ℃条件下制备的未改性生物炭,蛭石改性生物炭的碳含量显著降低(P<0.05)。这主要与原始生物炭的碳含量相关[26]。经蛭石改性处理后,生物炭的碳含量有所降低,其H/C原子比在蛭石改性后同样有所降低(表 2),说明生物炭碳素稳定性有所增强,在土壤中的降解速度更为缓慢。热重分析与核磁共振的结果也证明蛭石改性增加了生物炭的稳定性(表 3、表 4)。此外,生物炭自身对土壤微生物的毒性作用以及生物炭添加导致土壤有机-无机复合体的形成都将抑制生物炭的降解[28-29]。另一方面,生物炭添加至土壤后会引发土壤微生物产生共代谢作用,从而促进生物炭的降解[30]。与未改性生物炭相比,蛭石改性生物炭的DOC含量更低(表 2),而DOC含量的降低将导致共代谢作用的减弱,进而减缓生物炭的降解。LIU等[15]对蛭石改性与炭化温度对水稻秸秆生物炭理化特性的影响开展研究,证实蛭石改性显著增加了生物炭的稳定性。通过蛭石改性,生物炭表面的Fe—O与Si—O键显著增加,这些结构在生物炭表面起到保护作用,从而减缓生物炭在土壤中的降解速率。LIU等[31]研究了滨海湿地中矿物离子改性与未改性芦苇秸秆生物炭的降解情况,结果表明大多数矿物离子改性生物炭的碳矿化水平显著低于未改性生物炭。不同矿物材料改性生物炭在土壤中的降解行为存在差异,相关研究有待进一步深入开展。
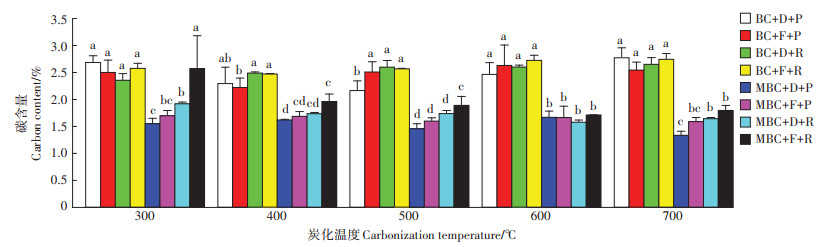
|
不同小写字母表示相同炭化温度内不同处理之间差异显著(P<0.05)。D和F分别表示干旱和淹水;R和P分别表示红壤和水稻土。 Different lowercase letters indicate significant differences among treatments within the same carbonization temperature(P<0.05). D and F represent dry and flooded, R and P represent red soil and paddy soil, respectively 图 2 生物炭在不同土壤环境条件下的碳含量 Figure 2 Carbon content of biochar under different soil conditions |
不同土壤类型与水分条件均未对BC300的碳含量变化产生显著影响(P>0.05)。与干旱条件下水稻土中的MBC300相比,淹水条件下红壤中的MBC300碳含量显著增加(P<0.05)。此结果表明淹水条件下红壤中的MBC300稳定性更高,降解速度更低。这主要是由于淹水条件阻碍了土壤与大气交互,从而减缓了生物炭的自然氧化与微生物有氧分解过程。LI等[32]研究发现土壤水分能显著影响土壤微生物活性,改变生物炭的降解速率。这可能也与原始土壤特性相关。本研究结果显示,水稻土的全磷、全钾、有效磷、速效钾和有机质含量均高于红壤(表 1),这些营养元素可为微生物的生长繁殖提供更多营养[33]。土壤微生物活性和数量的增加促进了水稻土中生物炭的碳降解。
与红壤相比,淹水条件下水稻土中BC400的碳含量显著降低(P<0.05)。这表明淹水条件下水稻土中BC400的稳定性较弱,碳损失量较多。这主要与土壤特性相关,水稻土的全磷、全钾、有效磷、速效钾和有机质含量均高于红壤(表 1),这增加了水稻土中BC400的降解。此外,水稻土pH较高,呈中性,适宜微生物的生长繁殖,较高的土壤微生物活性与数量促进了生物炭的降解。以往研究也表明土壤类型是影响生物炭降解的关键因素。SHENG等[34]开展了在浙江铁铝土以及黑龙江黑土中水稻秸秆生物炭的碳降解研究,结果显示铁铝土中碳矿化量较高。这主要与不同土壤类型的pH不同有关,土壤pH通过影响土壤微生物种群结构进一步影响碳降解。LI等[35]研究了水稻秸秆及水稻秸秆生物炭在5种典型土壤中的碳降解,发现其在不同土壤中的碳降解量不同,表现为江苏常熟土>陕西安塞土>吉林松原土>河南封丘土>江西鹰潭土,说明土壤类型对生物炭在土壤中的降解行为产生显著影响。FANG等[36]研究了不同炭化温度制备的木材生物炭在4种土壤中的降解,结果显示相同生物炭在不同土壤中的降解情况均不一致。在MBC400处理土壤中,干旱条件下水稻土中生物炭的碳含量显著低于淹水条件下红壤中MBC400的碳含量(P<0.05)。这与MBC300处理土壤结果相似。
在BC500处理土壤中,相比于其他3组处理,干旱条件下水稻土中生物炭的碳含量显著降低(P<0.05)。在MBC500处理土壤中,与淹水条件下红壤中的MBC500相比,干旱条件下水稻土中MBC500碳含量显著降低(P<0.05),说明其稳定性较弱,碳损失量更多。这可能主要是由于水稻土中丰富的营养元素与适宜的pH(表 1)。相比于淹水条件,干旱土壤透气度更高,促进了生物炭的氧化降解[37]。不同土壤类型与水分条件均未对BC600、MBC600和BC700的碳含量变化产生显著影响(P>0.05)。与淹水条件下红壤中的MBC700相比,干旱条件下水稻土中的MBC700碳含量显著降低(P<0.05),说明其稳定性更低,降解速度更快。此结果与MBC500处理土壤中生物炭的碳含量变化规律一致。综上所述,虽然不同生物炭处理土壤中生物炭的碳含量变化有所差异,但综合来讲,在水稻土与干旱条件下生物炭的碳含量较低,碳损失量更多,稳定性更弱。
除了土壤类型和水分条件外,培养温度也是显著影响生物炭降解的关键因素。FANG等[36]研究发现20 ℃与40 ℃温度条件下培养的土壤-生物炭混合物中生物炭矿化率分别为0.30%~1.14% 和0.97%~ 2.71%。NGUYEN等[38]开展了玉米残渣与橡木生物炭在4、10、20、30、45 ℃和60 ℃条件下连续一年的生物炭降解实验,结果表明,当培养温度从4 ℃升至60 ℃时,炭化温度为350 ℃制备的玉米残渣生物炭的碳损失率从10% 增加到20%,600 ℃制备的玉米残渣生物炭的碳损失率从4% 增加到20%,350 ℃制备的橡木生物炭的碳损失率从2.3%增加到15%,而600 ℃制备的橡木生物炭的碳损失率从1.5% 增加到14%,说明无论炭化温度和原料类型,生物炭的降解均随培养温度的升高而增加。FANG等[39]研究了在不同培养温度(20、40、60 ℃)条件下木材生物炭对土壤有机碳矿化的影响,结果表明,在为期2年的培养实验中,土壤有机碳的矿化速率和生物炭的降解速率均随培养温度的升高而呈增加趋势。
2.3 不同生物炭处理碳含量变化的影响因素分析生物炭的碳含量变化在土壤类型、水分条件和蛭石改性3个因素作用下的单变量方差分析结果见表 5。从表 5可以看出,将300~700 ℃制备的水稻秸秆生物炭施加至不同处理土壤后,蛭石改性对生物炭的碳含量变化均表现为显著影响(P<0.001);除了600 ℃生物炭,土壤类型对300、400、500 ℃和700 ℃制备的生物炭的碳含量变化均表现为显著影响(分别为P<0.01、P<0.001、P<0.001和P<0.001)。水分条件对300、500 ℃和600 ℃制备的生物炭在土壤中的碳含量变化表现为显著影响,但对400 ℃与700 ℃制备的生物炭的影响则不显著(P>0.05)。
|
|
表 5 不同炭化温度生物炭的碳含量变化的单变量方差分析 Table 5 Univariate ANOVA of carbon content in different biochar treatments |
对土壤类型与水分条件进行交互分析,两者交互作用对300 ℃和500 ℃制备的生物炭的碳含量变化均产生显著影响(分别为P<0.01和P<0.05),而对其余生物炭处理组则均未表现出显著影响(P>0.05)。对土壤类型与蛭石改性进行交互分析,两者交互作用对300 ℃与700 ℃制备的生物炭的碳含量变化表现为显著影响(分别为P<0.001和P<0.01),而对其余生物炭处理组均未表现出显著影响(P>0.05)。对水分条件与蛭石改性进行交互分析,两者交互作用对300、400 ℃和700 ℃制备的生物炭的碳含量变化表现为显著影响(分别为P<0.05、P<0.05和P<0.001),而对其余生物炭处理组的影响不显著(P>0.05)。通过对以上三因素交互作用分析可以看出,只有500 ℃(P<0.05)和700 ℃(P<0.01)制备的生物炭处理组表现出显著性差异,其余生物炭处理组均无显著性(P>0.05)。此结果表明,在不同生物炭处理的土壤中,土壤类型、水分条件和蛭石改性综合作用会对较高温度制备生物炭的碳降解产生显著的影响。综合来讲,蛭石改性为影响生物炭在土壤中碳含量变化进而影响其降解行为的主要因素,土壤类型与水分条件为次要因素。
3 结论(1)随着炭化温度升高,生物炭的碳含量逐渐增加,DOC含量呈先增加后降低趋势,其中400 ℃制备的生物炭DOC含量最高,而700 ℃制备的生物炭DOC含量最低。蛭石改性降低了生物炭的碳含量和DOC含量。随着炭化温度升高,生物炭的热损失率逐渐下降,含碳官能团趋向于形成更稳定的芳香碳结构。蛭石改性降低了生物炭的热损失率,增加了生物炭中芳香碳的含量,降低了烷氧碳与非取代脂肪烃的含量。生物炭的H/C随炭化温度升高而降低,且经蛭石改性后有所降低。
(2)与红壤相比,水稻土中生物炭的碳含量较低,碳损失量更多,表明生物炭在水稻土中的稳定性更弱,降解速度更快;与淹水条件相比,干旱条件下生物炭的碳含量较低,碳损失量更多,表明生物炭在干旱条件下稳定性更弱,降解速度更快。
(3)对生物炭在土壤中的短期降解行为进行综合评价,蛭石改性为显著影响生物炭在土壤中发生碳素降解的主要因素,其次为土壤类型,而土壤水分状况的影响相对较弱。
| [1] |
WANG J, LI J, WEI J. Adsorption characteristics of noble metal ions onto modified straw bearing amine and thiol groups[J]. Journal Materials Chemistry A, 2015, 3: 18163-18170. DOI:10.1039/C5TA05371D |
| [2] |
LIU S C, XIE Z L, ZHU Y T, et al. Adsorption characteristics of modified rice straw biochar for Zn and in-situ remediation of Zn contaminated soil[J]. Environmental Technology Innovation, 2021, 22: 101388. DOI:10.1016/j.eti.2021.101388 |
| [3] |
BAMMINGER C, POLL C, MARHAN S. Offsetting global warming-induced elevated greenhouse gas emissions from an arable soil by biochar application[J]. Global Change Biology, 2017, 24: 318-334. |
| [4] |
QU X, FU H, MAO J, et al. Chemical and structural properties of dissolved black carbon released from biochars[J]. Carbon, 2016, 95: 759-767. |
| [5] |
XIAO X, CHEN B, CHEN Z, et al. Insight into multiple and multilevel structures of biochars and their potential environmental applications: A critical review[J]. Environmental Science Technology, 2018, 52: 50275047. |
| [6] |
LENG L, HANG H. An overview of the effect of pyrolysis process parameters on biochar stability[J]. Bioresource Technology, 2018, 270: 627-642. DOI:10.1016/j.biortech.2018.09.030 |
| [7] |
LENG L, HUANG H, LI H, et al. Biochar stability assessment methods: A review[J]. Science of the Total Environment, 2019, 647: 210-222. DOI:10.1016/j.scitotenv.2018.07.402 |
| [8] |
GAVIN G D, BRUBAKER B L, LERTZMAN P K. Holocene fire history of a coastal temperate rain forest based on soil charcoal radiocarbon dates[J]. Ecology, 2003, 84: 186-201. DOI:10.1890/0012-9658(2003)084[0186:HFHOAC]2.0.CO;2 |
| [9] |
SCHMIDT M W, SKJEMSTAD J, JAGER C. Carbon isotope geochemistry and nanomorphology of soil black carbon: Black chernozemic soils in central Europe originate from ancient biomass burning[J]. Global Biogeochemical Cycles, 2002, 16: 70-78. |
| [10] |
MASIELLO C A, DRUFFEL E R M. Black carbon in deepsea sediments[J]. Science, 1998, 280: 1911-1913. DOI:10.1126/science.280.5371.1911 |
| [11] |
REN N, TANG Y, LI M. Mineral additive enhanced carbon retention and stabilization in sewage sludge-derived biochar[J]. Process Safety and Environmental Protection, 2017, 115: 70-80. |
| [12] |
GUO J, CHEN B. Insights on the molecular mechanism for the recalcitrance of biochars: Interactive effects of carbon and silicon components[J]. Environmental Science Technology, 2014, 48: 9103-9012. DOI:10.1021/es405647e |
| [13] |
LIN Y, MUNROE P, JOSEPH S, et al. Nanoscale organo-mineral reactions of biochars in ferrosol: An investigation using microscopy[J]. Plant and Soil, 2012, 357: 369-380. DOI:10.1007/s11104-012-1169-8 |
| [14] |
JOSEPH S D, CAMPS-ARBESTAIN M, LIN Y, et al. An investigation into the reactions of biochar in soil[J]. Australian Journal of Soil Research, 2010, 48: 501-515. DOI:10.1071/SR10009 |
| [15] |
LIU Y, GAO C, WANG Y, et al. Vermiculite modification increases carbon retention and stability of rice straw biochar at different carbonization temperatures[J]. Journal of Cleaner Production, 2020, 254: 124111. |
| [16] |
STEINBEISS S, GLEIXNER G, ANTONIETTI M. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Biochemistry, 2009, 41: 1301-1310. DOI:10.1016/j.soilbio.2009.03.016 |
| [17] |
NGUYEN B T, LEHMANN J. Black carbon decomposition under varying water regimes[J]. Organic Geochemistry, 2009, 40: 846-853. DOI:10.1016/j.orggeochem.2009.05.004 |
| [18] |
EL-MAHROUKY M, EL-NAGGAR A H, USMAN A R. Dynamics of CO2 emission and biochemical properties of a sandy calcareous soil amended with conocarpus waste and biochar[J]. Pedosphere, 2015, 25: 46-56. DOI:10.1016/S1002-0160(14)60075-8 |
| [19] |
HAWTHORNE I, JOHNSON M S, JASSAL R S, et al. Application of biochar and nitrogen influences fluxes of CO2, CH4 and N2O in a forest soil[J]. Journal of Environmental Management, 2017, 192: 203-214. |
| [20] |
LI F, CAO X, ZHAO L, et al. Effects of mineral additives on biochar formation: Carbon retention, stability, and properties[J]. Environmental Science Technology, 2014, 48: 11211-11217. DOI:10.1021/es501885n |
| [21] |
CARNERIO J S D S, LUSTOSA F J F, BÁRBARA O N, et al. Carbon stability of engineered biochar-based phosphate fertilizers[J]. ACS Sustainable Chemistry & Engineering, 2018, 6: 14203-14212. |
| [22] |
MUKHERJEE A, ZIMMERMAN A R, HARRIS W. Surface chemistry variations among a series of laboratory-produced biochars[J]. Geoderma, 2011, 163: 247-255. DOI:10.1016/j.geoderma.2011.04.021 |
| [23] |
VASSILEV S, BAXTER D, ANDERSEN L K, et al. An overview of the chemical composition of biomass[J]. Fuel, 2010, 89: 913-933. DOI:10.1016/j.fuel.2009.10.022 |
| [24] |
SONG X D, XUE X Y, CHEN D Z, et al. Application of biochar from sewage sludge to plant cultivation: Influence of pyrolysis temperature and biochar-to-soil ratio on yield and heavy metal accumulation[J]. Chemosphere, 2014, 109: 213-220. DOI:10.1016/j.chemosphere.2014.01.070 |
| [25] |
YUAN H, LU T, HUANG H, et al. Influence of pyrolysis temperature on physical and chemical properties of biochar made from sewage sludge[J]. Journal of Analytical and Applied Pyrolysis, 2015, 112: 284-289. DOI:10.1016/j.jaap.2015.01.010 |
| [26] |
LUO Y, DURENKAMP M, NOBILI M, et al. Microbial biomass growth, following incorporation of biochars produced at 350℃ or 700℃, in a silty-clay loam soil of high and low pH[J]. Soil Biology Biochemistry, 2013, 57: 513-523. DOI:10.1016/j.soilbio.2012.10.033 |
| [27] |
ALLER M F. Biochar properties: Transport, fate, and impact[J]. Critical Reviews in Environmental Science Technology, 2016, 46: 1183-1296. DOI:10.1080/10643389.2016.1212368 |
| [28] |
JASTROW J D, AMONETTE J E, BAILEY V L. Mechanisms controlling soil carbon turnover and their potential application for enhancing carbon sequestration[J]. Climatic Change, 2006, 80: 5-23. |
| [29] |
JEFFERY S, BASTOS A C, VAN DER VELDE M, et al. Biochar application to soils: A critical scientific review of effects on soil properties, processes and functions[J]. Soil Biology Biochemistry, 2010, 48: 335-343. |
| [30] |
KUZYAKOV Y, FRIEDEL J K, STAHR K. Review of mechanisms and quantification of priming effects[J]. Soil Biology Biochemistry, 2000, 32: 1485-1498. DOI:10.1016/S0038-0717(00)00084-5 |
| [31] |
LIU S H, KONG F L, LI Y, et al. Mineral-ions modified biochars enhance the stability of soil aggregate and soil carbon sequestration in a coastal wetland soil[J]. Catena, 2020, 93: 104618. |
| [32] |
LI Y, LI Y, CHANG S, et al. Biochar reduces soil heterotrophic respiration in a subtropical plantation through increasing soil organic carbon recalcitrancy and decreasing carbon-degrading microbial activity[J]. Soil Biology Biochemistry, 2018, 122: 173-185. DOI:10.1016/j.soilbio.2018.04.019 |
| [33] |
ZHU X, CHEN B, ZHU L, et al. Effects and mechanisms of biocharmicrobe interactions in soil improvement and pollution remediation: A review[J]. Environment Pollution, 2017, 227: 98-115. DOI:10.1016/j.envpol.2017.04.032 |
| [34] |
SHENG Y, ZHU L. Biochar alters microbial community and carbon sequestration potential across different soil pH[J]. Science of the Total Environment, 2018, 622: 1391-1399. |
| [35] |
LI F, CAO X, ZHAO L, et al. Short-term effects of raw rice straw and its derived biochar on greenhouse gas emission in five typical soils in China[J]. Soil Science and Plant Nutrition, 2013, 59: 800-811. DOI:10.1080/00380768.2013.821391 |
| [36] |
FANG Y, SINGH B, SINGH B P, et al. Biochar carbon stability in four contrasting soils[J]. European Journal of Soil Science, 2014, 1: 60-71. |
| [37] |
TROY S M, LAWLOR P G, FLYNN C J O, et al. Impact of biochar addition to soil on greenhouse gas emissions following pig manure application[J]. Soil Biology Biochemistry, 2013, 60: 173-181. DOI:10.1016/j.soilbio.2013.01.019 |
| [38] |
NGUYEN B T, LEHMANN J, HOCKADAY W C, et al. Temperature sensitivity of black carbon decomposition and oxidation[J]. Environmental Science Technology, 2010, 9: 3324-3331. |
| [39] |
FANG Y, SINGH B, SINGH B P. Effect of temperature on biochar priming effects and its stability in soils[J]. Soil Biology Biochemistry, 2015, 80: 136-145. DOI:10.1016/j.soilbio.2014.10.006 |
 2021, Vol. 40
2021, Vol. 40