专家/团队介绍: 吴永红,男,为“万人计划”领军人才,科技部“创新人才推进计划”中青年科技领军人才。长期从事“相界面过程与效应”研究,服务于农田养分调控、面源污染控制、生态系统修复。主持国家杰青、国家优青、国家青年973等项目。获国际生物过程学会(IBA)青年科学家奖、中国青年科技奖、中国土壤学会科技奖一等奖(第1完成人)等荣誉。获授权发明专利14件,5件已转让。发表论文100余篇,应Elsevier邀请,出版英文专著1部;多次应Trends Biotechnology(IF=19.536)、Bioresource Technology(IF= 9.642)等主流期刊邀请,撰写系列综述文章。
所在研究团队为中国科学院创新交叉团队,拥有国家杰青、国家优青、中国科学院百人计划等高层次人才多名。团队主要从事基于微生物聚集体(比如周丛生物或自然生物膜)的土-水界面生态过程与调控研究,重点解决(或阐释)稻田等湿地中养分或污染物在“土-生-水”三相界面的行为过程与效应,研究基于微生物聚集体的养分调控、污染控制、受损生态系统修复技术与理论,主要方向包括:(1)面源污染监测与生物控制技术;(2)微生物聚集体群落生态;(3)受损生态系统修复;(4)相界面过程与效应。近年承担(或参加)的项目包括国家重点研究项目、金砖国家国际合作、“一带一路”国际合作、中科院“0到1原始创新”等项目。发起和召集了国际会议“International Conference on Non-point Source Pollution Control and Aquatic Ecosystem Protection”(两年举办一届)。
2. 湖北秭归三峡库区生态系统水利部野外科学观测研究站, 湖北 宜昌 443605;
3. 中国科学院大学资源环境学院, 北京 100049
2. Zigui Three Gorges Reservoir Ecosystem, Observation and Research Station of Ministry of Water Resources of the People's Republic of China, Yichang 443605, China;
3. College of Resource and Environment, University of Chinese Academy of Sciences, Beijing 100049, China
磷是一种生物圈内广泛存在的、生物体所必需的基本元素,在有机体的生命活动中起着至关重要的作用[1-2]。磷主要通过岩石的风化侵蚀、矿石的开采等自然或人为途径移出而进入生态系统,并参与地球各圈层内部或层间生物地球化学循环[3]。作为一种不可再生和替代的元素,有限的磷矿被开采用于人类的生产生活,包括制造磷肥、农药、洗涤剂等化工产业[4-5]。并在随后参与的环境-生物-人体的循环过程中逐渐向土壤和海洋沉积,过量磷的输入将造成土壤污染、水体富营养化和水生生态系统服务功能恶化,并最终危害生态环境,限制经济发展[6-7]。
周丛生物作为一种自然界广泛存在的环境友好型生物磷捕获微生态系统[8-9],具有一定的环境适应性和自我恢复能力[10],是水生食物网的重要环节,影响着系统内的营养盐循环和能量流动及其在水体-沉积物两相界面的迁移[11-12]。周丛生物是生长于土壤、岩石、秸秆等淹水基质表面[13],由自养和异养微生物群落、微型动物及其表面裹挟着的胞外聚合物等非生物物质组成,是有着复杂三维结构的微生物聚集体[14-15]。特别是光合作用微生物作为周丛生物重要的微生物组成,影响着周丛生物捕获和富集磷的能力。自然周丛生物有限的磷富集能力,难以实现其对污水中磷的持续去除。
斜生栅藻是广泛存在的淡水藻类,能够产生较多的胞外聚合物增强藻细胞表面的黏附性,易附着于其他生物表面,具有较高的污水磷去除能力[16-19]。因此,为提高周丛生物富集磷的能力,本研究将斜生栅藻与周丛生物共培养,以形成新型的具有高效富集磷能力的人工周丛生物,并进一步探究其高效捕获富集磷的机制及新型人工周丛生物的特征。本研究的目的在于为含磷污水提供一种新型、高效的磷去除技术,为削减水体中磷的负荷服务,为农业面源污染和水体富养化的治理提供新的思路。
1 材料与方法 1.1 试验材料斜生栅藻(Tetradesmus obliquus)购自中国科学院水生生物研究所淡水藻种库。培养基为BG11,培养条件:温度25 ℃、光照强度2 000 lx。原种分离来源:1960年湖北黄石卫校。
1.2 试验方法 1.2.1 人工周丛生物构建斜生栅藻培养液离心收集藻细胞,于Wood Hold培养基(WC)中培养至指数生长期,用无菌水按照ycell=(191.92×OD680-0.954 5)×105的吸光度与细胞浓度的关系,配制成浓度为1.5×108 cell·mL-1的藻细胞悬液;同时选取周丛生物约1 g置于新鲜的灭菌的WC培养液中,另按照1∶100(V/V)接种处于指数生长期的斜生栅藻悬液于培养装置内共培养,光照强度1 800 lx,温度(25±1)℃;待载体表面的周丛生物成片取下时,即形成新型的周丛生物。同时,取适量周丛生物与人工周丛生物,利用三维荧光光谱(3D-EEM,Three-Dimension excitation emission)和傅里叶红外光谱(FTIR,Fourier transform infrared)测定其胞外聚合物(EPS)的特征。
1.2.2 磷富集试验人工周丛生物进行一周短期的磷富集试验,探究人工周丛生物富集磷含量的变化。高磷培养液的配制:以WC培养基为基础,将其K2HPO4浓度提高至5 mg·L-1。原周丛生物与人工周丛生物均设置3个平行(1 g周丛生物溶于100 mL培养液)。一周的富集期间,每隔24 h取样1次,将取得的培养液经0.45 μm的滤膜过滤后,进行磷浓度测定,并拟合周丛生物磷吸附曲线。通过光学显微镜、扫描电子显微镜(SEM,Scanning electron microscope)、X射线能谱分析(EDX,Energy dispersive X-ray spectroscopy)分析周丛生物表面的结构和磷素分布,同时选取原周丛生物为对照。
1.3 样品测定水体磷含量测定采用钼锑钪比色法。使用土壤DNA提取试剂盒(Omega Bio-tek,Norcross,GA,U.S. A.)进行DNA提取,然后由第三方测序公司完成周丛生物16S rRNA与18S rRNA的测序。周丛生物中EPS采用阳离子交换树脂(CER,Cation exchange resin)提取,并采用蒽酮比色法和考马斯亮蓝法测定其胞外多糖和蛋白的含量[20]。3D-EEM采用三维荧光分光光度计(Hitachi F-7000,日本)分析测定,扫描范围为激发波长(Excitation,Ex)200~450 nm,扫描间隔为5 nm,发射波长(Emission,Em)为250~600 nm,扫描间隔为1 nm,扫描速率为2 400 nm·min-1。将透析后的EPS溶液冷冻干燥,取适量干燥样品压片,采用傅里叶红外光谱仪(Nicolet iS50,Thermo Fisher,美国)分析测定,FTIR测定条件为:测试范围200~450 cm-1,分辨率4 cm-1,扫描次数32次。同时,使用超高效液相色谱仪(Vanquish,Thermo Fisher,美国)进行非靶向代谢组学测定。
1.4 数据分析试验数据均采用3次重复的平均值±标准误差的形式表示。水体磷含量数据分析由Excel 2013完成。3D-EEM接近拉曼峰和瑞利散射区域的数据的校正及周丛生物群落结构分析由R 4.0.3完成,并由MATLAB 2015完成三维可视化。FTIR及代谢组学数据由R 4.0.3完成并进行可视化。采用单因素方差分析(ANOVA)进行显著性差异分析,P < 0.05表示具有显著差异。
2 结果与讨论 2.1 周丛生物富集磷含量的变化周丛生物富集磷含量的变化如图 1所示,与原周丛生物相比,人工周丛生物磷富集能力显著提高。7 d的磷富集试验中,第1 d,对比原周丛生物(0.74± 0.09)mg·g-1的磷富集能力,人工周丛生物富集磷的含量为(2.48±0.22)mg·g-1;第7 d,相较于原周丛生物(2.26±0.14)mg·g-1的磷富集含量,人工周丛生物富集磷的含量提高到(6.79±0.45)mg·g-1。此结果表明,斜生栅藻构建的人工周丛生物对磷的富集能力优于原周丛生物,可以用于污水中磷的去除。
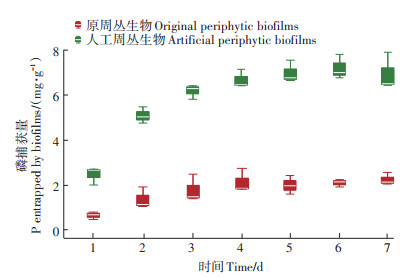
|
图 1 原周丛生物和人工周丛生物7 d磷富集含量变化 Figure 1 Phosphorus(P)enrichment content by original and artificial periphytic biofilms during seven days |
斜生栅藻的加入改变了周丛生物微生物群落的结构和组成,如图 2(a)所示,周丛生物中原核生物主要由蓝细菌、变形杆菌、拟杆菌及厌氧绳菌组成。与原周丛生物相比,人工周丛生物明显提高了蓝细菌和α-变形菌的相对丰度。蓝细菌作为周丛生物主要的光合作用微生物,在以太阳光为能量进行生长、繁殖的光合作用过程中可以大量吸收和同化水体中的磷,具有较高的磷富集能力。以上结果说明,蓝细菌相对丰度的提高,可以提升人工周丛生物群落富集磷的能力[21]。
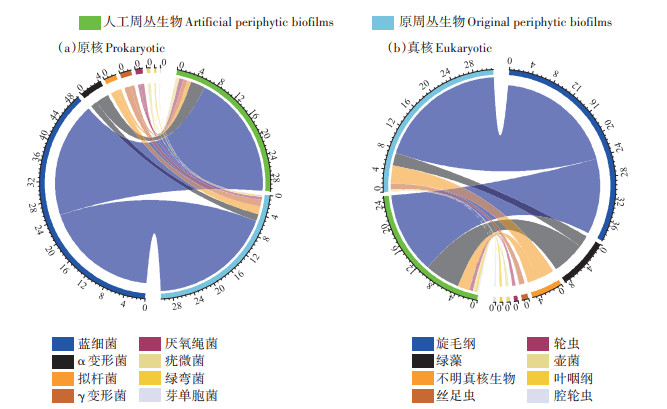
|
图 2 人工周丛生物与原周丛生物微生物群落的组成及相对丰度 Figure 2 Relative abundance and composition of prokaryotic and eukaryotic microorganisms of artificial and original periphytic biofilms |
图 2(b)中原周丛生物与人工周丛生物的真核生物群落组成和丰度显示,旋毛纲和绿藻为主要真核生物。与原周丛生物相比,人工周丛生物中绿藻纲相对丰度显著提高了177.6%。在周丛生物中,蓝细菌和绿藻这类光合作用生物可自身“奢侈”吸收磷,其光合作用会提高水体pH值,并促进周丛生物表面碳酸钙沉淀,诱导钙磷共沉积,从而表面富集磷[22]。此外,周丛生物中光合作用生物代谢和光合过程产生的氧气、有机物为细菌的生长和繁殖提供氧气及营养物质,而细菌则为光合生物提供其生长所需要的碳源和维生素[23]。由此,人工周丛生物通过提高其光合作用生物的相对丰度增强其对磷的捕获,同时还可以促进周丛生物群落内部生物之间的相互作用关系,增强周丛生物体系对磷的富集能力[24]。
2.3 周丛生物空间结构特征采用光学显微镜、扫描电子显微镜及X射线能谱仪(SEM-EDX)观察周丛生物表面结构及其元素分布,探究高效富集磷的人工周丛生物较原周丛生物表面形态学特征的变化。如图 3所示,原周丛生物表面较为光滑,细胞排列疏松,且以丝状藻细胞为主。而人工周丛生物表面较为粗糙,丝状藻细胞周围镶嵌着其他藻细胞,细胞排列较为紧密,三维网状孔隙度高,表面磷元素含量高且元素分布更加均匀。光学显微镜及SEM-EDX的结果表明,人工周丛生物更为复杂的表面细胞结构、更高的三维孔隙度、更多胞外聚合物的分布,为周丛生物提供了更多的捕获磷的结合位点[25]。
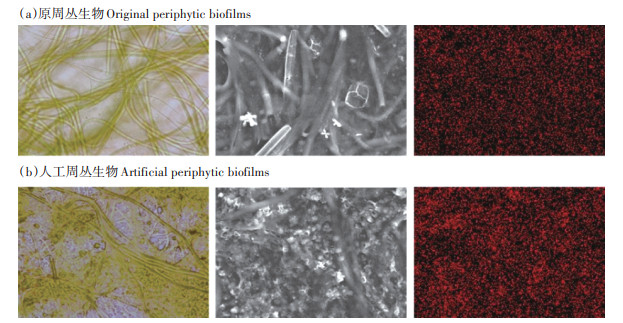
|
图 3 扫描电子显微镜与X射线能谱图 Figure 3 SEM-EDX images of original periphytic biofilms and artificial periphy |
EPS在周丛生物磷捕获中发挥着重要作用,是胞外磷捕获的主要地点,可通过胞外多糖中部分带电的糖残基及胞外蛋白中一些带电基团的相互作用捕获和富集磷[26]。如图 4所示,与原周丛生物相比,具有高效富集磷能力的人工周丛生物的EPS中蛋白含量显著提高了84.6%,而胞外多糖含量变化幅度较小,提高了23.7%。与周丛生物吸附磷能力的变化一致,人工周丛生物EPS中磷含量也显著增加。这说明人工周丛生物大幅提高了EPS的含量,从而提高了磷捕获能力。

|
图 4 原周丛生物和人工周丛生物胞外聚合物(EPS)组分和含量 Figure 4 Concentration of polysaccharide, protein and phosphate in extracellular polymeric substances(EPS)of original and artificial periphytic biofilms |
周丛生物EPS中天然存在来自蛋白质或腐植酸的荧光类物质,因此可利用EPS中天然荧光探针表征其与磷元素的分子间作用。如图 5(a)和图 5(b)所示,周丛生物EPS的3D-EEM光谱有A、B、C 3个特征峰,Ex/Em分别为260 nm/366 nm、230 nm/340 nm、225 nm/297 nm,主要是来源于蛋白质中色氨酸和酪氨酸残基[26-27]。从荧光强度可以判断周丛生物EPS的3DEEM光谱A峰表征了色氨酸物质,相较于B峰和C峰表征的酪氨酸类物质含量更高。高效富集磷的人工周丛生物,其A、B、C特征峰的荧光强度较原周丛生物均有不同程度的增强,峰A、B、C分别提高了6.4%、6.6% 和3.7%,说明人工周丛生物可以通过提升胞外蛋白中色氨酸类物质与酪氨酸类物质的含量提升其对磷的捕获与吸附能力。
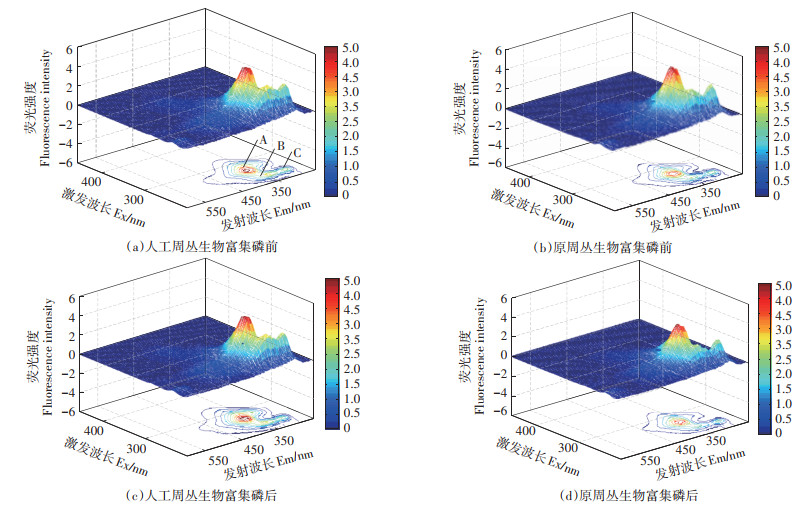
|
图 5 胞外聚合物(EPS)的三维荧光光谱(3D-EEM)图 Figure 5 Extracellular Polymeric Substances(EPS)and Three-Dimension Excitation Emission(3D-EEM)of biofilms constructed by artificial periphytic biofilms before and after P accumulation, and original periphytic biofilms before and after P accumulation |
如图 5(c)和图 5(d)所示,原周丛生物和人工周丛生物与5 mg·L-1磷溶液混合振荡反应后,均不同程度地降低了A、B、C特征峰的荧光强度,说明EPS与磷相互作用能诱导荧光猝灭。原周丛生物和人工周丛生物荧光的谱峰A、峰B和峰C分别下降了22.2%、37.8%、29.1% 和14.2%、16.1%、19.6%,说明磷与周丛生物EPS形成了非荧光类络合物[28]。另外,荧光谱峰A、B、C的位置在磷的作用下也发生了小幅的红移,特别是峰A的Ex/Em由原来的225 nm/297 nm红移到230 nm/296 nm。综上所述,与原周丛生物相比,人工周丛生物通过提升胞外蛋白中色氨酸类物质与酪氨酸类物质的含量提升其对磷的捕获与吸附能力。
3D-EEM光谱证实了周丛生物EPS中色氨酸类物质和酪氨酸类物质的残基参与了EPS与磷元素的相互作用。已知色氨酸类和酪氨酸类物质残基中存在官能团—NH2和—COOH,因此结合FTIR技术进一步揭示周丛生物EPS中与磷相互作用的色氨酸类和酪氨酸类物质残基的关键结合位点。如图 6所示,周丛生物EPS在3 377 cm-1处的宽吸收峰,主要是EPS中纤维素上羟基(—OH)的伸缩振动;2 927 cm-1与2 873 cm-1处的吸收峰则来自于饱和碳链上—CH2—的反对称伸缩振动和对称伸缩振动;1 655 cm-1和1 540 cm-1处的吸收峰分别来自典型的蛋白质酰胺Ⅰ带和Ⅱ带中C=O和—NH2的伸缩振动;1 074 cm-1处的吸收峰与多糖衍生物中C—O、C—O—C有关,该峰与1 655 cm-1和1 540 cm-1的峰同时存在,表明周丛生物EPS中含有大量的羧基功能团[29]。综上,在周丛生物EPS与磷元素的结合过程中发挥关键作用的活性官能团为—NH2、—COOH和—OH。

|
图 6 原周丛生物和人工周丛生物EPS的红外光谱图 Figure 6 FTIR spectra for EPS of original and artificial periphytic biofilms |
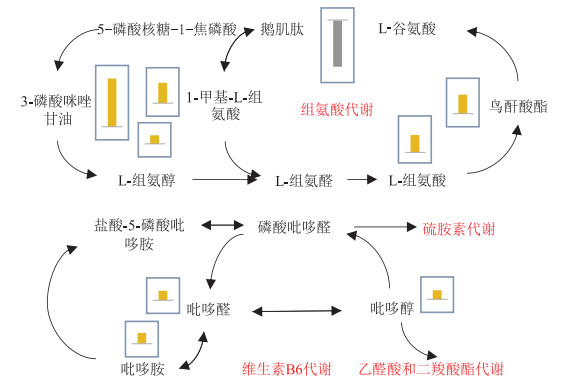
为了进一步探明人工周丛生物相比于原周丛生物具有更高效捕获和吸收磷机制的原因,利用代谢组学对原周丛生物及人工周丛生物的代谢产物进行了定量分析。如图 7所示,在检测到的510多种代谢物中,9种涉及到组氨酸代谢、硫氨酸代谢、维生素B6代谢的关键代谢物含量发生了明显的变化,除代谢物鹅肌肽含量发生下调外,其他8种代谢物(3-磷酸咪唑甘油、L-组氨醛、1-甲基-L-组氨酸、L-组氨酸、鸟酐酸酯、吡哆胺、吡哆醛和吡哆醇)含量均发生了上调。
|
图 7 人工周丛生物相关代谢路径图 Figure 7 Metabolomic fold changes for artificial periphytic biofilms displayed for relevant pathways |
根据前人的研究成果,周丛生物作为典型的藻菌共生体,藻菌关系的有益作用可改善整体群落功能。维生素B6是细菌为藻类提供生长以及维持形态的关键代谢物[30]。在周丛生物差异代谢路径的分析中发现,与原周丛生物相比,人工周丛生物涉及维生素B6代谢路径中的吡哆胺、吡哆醛和吡哆醇的含量均发生了上调。以上结果说明,人工周丛生物通过上调维生素B6代谢,以增强细菌与藻类之间的相互作用关系,进而提高周丛生物对磷的捕获和吸收能力。
在藻菌关系中,藻类为细菌提供生长所需的碳水化合物、氨基酸等营养物质,并通过释放这些物质吸引细菌,以增强周丛生物中细菌和藻类的交流与合作,建立密切的相互关系[31-32]。同时,藻类还可以分泌相关物质,增加其生物膜的形成能力,进而维持周丛生物中细菌与藻类之间的互作关系[11]。如图 7所示,与原周丛生物相比,高效富集磷的人工周丛生物涉及组氨酸代谢中的仅有鹅肌肽含量发生了下调,3-磷酸咪唑甘油、L-组氨醛、1-甲基-L-组氨酸、L-组氨酸、鸟酐酸酯的含量均发生了上调。综上所述,与原周丛生物相比,人工周丛生物通过上调组氨酸代谢、硫氨酸代谢和维生素B6代谢,调节细菌与藻类之间的相互作用关系,进而提高其对磷的捕获和富集能力。
3 结论(1)以斜生栅藻构建的新型人工周丛生物,显著提高了原周丛生物对磷的捕获和富集能力。在7 d的磷富集试验中,人工周丛生物的磷捕获能力提高了200%。
(2)在影响周丛生物磷捕获能力的相关因素中,人工周丛生物的绿藻相对丰度提高了177.6%,EPS中胞外蛋白含量提高了84.6%;胞外多糖和蛋白中的活性官能团—COOH、—OH和—NH参与了EPS与磷元素的结合。
(3)人工周丛生物通过提高影响细菌与藻类之间相互作用的氨基酸和维生素代谢物质的含量表达,增强其对环境中磷的捕获能力。
| [1] |
HUANG Y Y, CIAIS P, GOLL D S, et al. The shift of phosphorus transfers in global fisheries and aquaculture[J]. Nature Communication, 2020, 11(1): 10. DOI:10.1038/s41467-019-13807-w |
| [2] |
MACINTOSH K A, MAYER B K, MCDOWELL R W, et al. Managing diffuse phosphorus at the source versus at the sink[J]. Environmental Science & Technology, 2018, 52(21): 11995-12009. |
| [3] |
彭淑娴, 陈登鹏, 王嘉伟, 等. 全球变化背景下磷生物地球化学循环研究进展[J]. 环境生态学, 2020, 2(12): 1-7. PENG S X, CHEN D P, WANG J W, et al. Progress in phosphorus biogeochemical cycle under global changes[J]. Environmental Ecology, 2020, 2(12): 1-7. |
| [4] |
孙静亚, 韩厚锋, 张萍, 等. 基于物质流分析的我国磷资源开发利用研究[J]. 国土与自然资源研究, 2020(5): 68-71. SUN Y J, HAN H F, ZHANG P, et al. Phosphorus cycling in China based on material flow analysis[J]. Territory & Natural Resources Study, 2020(5): 68-71. DOI:10.3969/j.issn.1003-7853.2020.05.021 |
| [5] |
WONG P Y, CHENG K Y, KAKSONEN A H, et al. A novel post denitrification configuration for phosphorus recovery using polyphosphate accumulating organisms[J]. Water Research, 2013, 47(17): 6488-6495. DOI:10.1016/j.watres.2013.08.023 |
| [6] |
RITTMANN B E, MAYER B, WESTERHOFF P, et al. Capturing the lost phosphorus[J]. Chemosphere, 2011, 84(6): 846-853. DOI:10.1016/j.chemosphere.2011.02.001 |
| [7] |
PENUELAS J, POULTER B, SARDANS J, et al. Human-induced nitrogen-phosphorus imbalances alter natural and managed ecosystems across the globe[J]. Nature Communication, 2013, 4: 2934. DOI:10.1038/ncomms3934 |
| [8] |
WU Y H, LIU J Z, RENE E R. Periphytic biofilms: A promising nutrient utilization regulator in wetlands[J]. Bioresource Technology, 2018, 248: 44-48. DOI:10.1016/j.biortech.2017.07.081 |
| [9] |
LU H Y, WAN J J, LI J Y, et al. Periphytic biofilm: A buffer for phosphorus precipitation and release between sediment sandwater[J]. Chemosphere, 2016, 144: 2058-2064. DOI:10.1016/j.chemosphere.2015.10.129 |
| [10] |
SABATER S, GUASCH H, RICART M, et al. Monitoring the effect of chemicals on biological communities. The biofilm as an interface[J]. Anal Bioanal Chem, 2007, 387(4): 1425-1434. DOI:10.1007/s00216-006-1051-8 |
| [11] |
XIONG J Q, KURADE M B, JEON B H. Can microalgae remove pharmaceutical contaminants from water?[J]. Trends Biotechnology, 2018, 36(1): 30-44. DOI:10.1016/j.tibtech.2017.09.003 |
| [12] |
OEHMEN A, LEMOS P C, CARVLHO G, et al. Advances in enhanced biological phosphorus removal: From micro to macro scale[J]. Water Research, 2007, 41(11): 2271-2300. DOI:10.1016/j.watres.2007.02.030 |
| [13] |
LARNED S T. A prospectus for periphyton: Recent and future ecological research[J]. J N Am Benthol Soc, 2010, 29(1): 182-206. DOI:10.1899/08-063.1 |
| [14] |
WU Y H. Periphyton: Functions and application in environmental remediation[M]. Holland: Elsevier Publisher, 2016.
|
| [15] |
BONDAR-KUNZE E, MAIER S, SCHOENAUER D, et al. Antagonistic and synergistic effects on a stream periphyton community under the influence of pulsed flow velocity increase and nutrient enrichment[J]. Science Total Environment, 2016, 573: 594-602. DOI:10.1016/j.scitotenv.2016.08.158 |
| [16] |
ZHANG E D, WANG B, WANG Q H, et al. Ammonia-nitrogen and orthophosphate removal by immobilized Scenedesmus sp. isolated from municipal wastewater for potential use in tertiary treatment[J]. Bioresource Technology, 2008, 99(9): 3787-3793. DOI:10.1016/j.biortech.2007.07.011 |
| [17] |
张恩栋, 王冰, 王起华, 等. 固定化的栅藻深度脱氮和除磷能[J]. 植物生理学通讯, 2006, 42(6): 1037-1040. ZHANG E D, WANG B, WANG Q H, et al. Capacity of ammonia-nitrogen and orthophosphate removal by immobilized Scenedesmus sp.[J]. Plant Physiology Journal, 2006, 42(6): 1037-1040. |
| [18] |
LI X, HU H Y, GAN K, et al. Effects of different nitrogen and phosphorus concentrations on the growth, nutrient uptake, and lipid accumulation of a freshwater microalga Scenedesmus sp.[J]. Bioresour Technology, 2010, 101(14): 5494-5500. DOI:10.1016/j.biortech.2010.02.016 |
| [19] |
MA X, CHEN Y, LIU F, et al. Enhanced tolerance and resistance characteristics of Scenedesmus obliquus FACHB-12 with K3 carrier in cadmium polluted water[J]. Algal Research, 2021, 55: 102267. DOI:10.1016/j.algal.2021.102267 |
| [20] |
龙向宇, 龙腾锐, 唐然, 等. 阳离子交换树脂提取活性污泥胞外聚合物的研究[J]. 中国给水排水, 2008, 24(3): 29-33, 38. LONG X Y, LONG T R, TANG R, et al. Study on extraction of extracellular polymeric substance from activated sludge using cation exchange resin[J]. China Water & Wastewater, 2008, 24(3): 29-33, 38. DOI:10.3321/j.issn:1000-4602.2008.03.008 |
| [21] |
LIU J, DANNEELS B, VANORMELINGEN P, et al. Nutrient removal from horticultural wastewater by benthic filamentous algae Klebsormidium sp., Stigeoclonium spp. and their communities: From laboratory flask to outdoor Algal Turf Scrubber(ATS)[J]. Water Research, 2016, 92: 61-68. DOI:10.1016/j.watres.2016.01.049 |
| [22] |
马军, 雷国元. 水绵(Spirogyra) 的除磷特性及其对微藻生长的抑制作用[J]. 环境科学学报, 2008, 28(3): 476-483. MA J, LEI G Y. Characeristics of phosphorus removal and growth inhibition of microalgal species by Spirogyra[J]. Acta Science Circumstantiae, 2008, 28(3): 476-483. DOI:10.3321/j.issn:0253-2468.2008.03.011 |
| [23] |
TANG C C, TIAN Y, HE Z W, et al. Performance and mechanism of a novel algal-bacterial symbiosis system based on sequencing batch suspended biofilm reactor treating domestic wastewater[J]. Bioresource Technology, 2018, 265: 422-431. DOI:10.1016/j.biortech.2018.06.033 |
| [24] |
LIU J Z, SUN P F, SUN R, et al. Carbon-nutrient stoichiometry drives phosphorus immobilization in phototrophic biofilms at the soil-water interface in paddy fields[J]. Water Research, 2019, 167: 115129. DOI:10.1016/j.watres.2019.115129 |
| [25] |
XU Y, WU Y, ESQUIVEL-ELIZONDO S, et al. Using microbial aggregates to entrap aqueous phosphorus[J]. Trends Biotechnology, 2020, 38(11): 1292-1303. DOI:10.1016/j.tibtech.2020.03.012 |
| [26] |
LI W W, ZHANG H L, SHENG G P, et al. Roles of extracellular polymeric substances in enhanced biological phosphorus removal process[J]. Water Research, 2015, 86: 85-95. DOI:10.1016/j.watres.2015.06.034 |
| [27] |
CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. |
| [28] |
XU H C, CAI H Y, YU G H, et al. Insights into extracellular polymeric substances of cyanobacterium microcystis aeruginosa using fractionation procedure and parallel factor analysis[J]. Water Research, 2013, 47(6): 2005-2014. DOI:10.1016/j.watres.2013.01.019 |
| [29] |
SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review[J]. Biotechnology Advances, 2010, 28(6): 882-894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [30] |
HUGUET A, VACHER L, SAUBUSSE S, et al. New insights into the size distribution of fluorescent dissolved organic matter in estuarine waters[J]. Organic Geochemistry, 2010, 41(6): 595-610. DOI:10.1016/j.orggeochem.2010.02.006 |
| [31] |
DE-BASHAN L E, HERNANDEZ J P, MOREY T, et al. Microalgae growth-promoting bacteria as "helpers" for microalgae: A novel approach for removing ammonium and phosphorus from municipal wastewater[J]. Water Research, 2004, 38(2): 466-674. DOI:10.1016/j.watres.2003.09.022 |
| [32] |
HUO S H, KONG M, ZHU F F, et al. Co-culture of Chlorella and wastewater-borne bacteria in vinegar production wastewater: Enhancement of nutrients removal and influence of algal biomass generation[J]. Algal Research, 2020, 45: 101744. DOI:10.1016/j.algal.2019.101744 |
 2021, Vol. 40
2021, Vol. 40


