2. 广西环境污染控制理论与技术重点实验室, 广西 桂林 541004;
3. 岩溶地区水污染控制与用水安全保障协同创新中心, 广西 桂林 541004;
4. 中国有色桂林矿产地质研究院有限公司, 广西 桂林 541004
2. Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology, Guilin 541004, China;
3. Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area, Guilin University of Technology, Guilin 541004, China;
4. China Nonferrous Metals(Guilin) Geology and Mining Co., Ltd., Guilin 541004, China
20世纪70年代以来,有机磷农药(Organophosphorus pesticides,OPs)因具有高效致毒、快速降解等特性取代了有机氯农药(OCPs),被广泛用于农业生产中[1]。仅在2010年,我国农药的施用量就达到302 700 t,其中72% 为OPs[2]。虽然近年来OPs的施用量有所下降,但毒死蜱、乐果、敌敌畏和辛硫磷等10种OPs的年施用量仍达到4 033.31 t[3]。有关研究表明,OPs施用后仅有10%~20%发挥效用[4],其余大部分会以原药的形式残留在土壤或空气中,并通过降雨、大气沉降以及地表径流等途径迁移,最终在土壤、沉积物、地表水和地下水中富集[5-7]。理论上,自然环境中的OPs可以被降解为无害的无机磷,但随着不同环境介质中OPs被相继检出,说明OPs将成为新一类持久性污染物[8]。
桂林会仙岩溶湿地作为世界上最大的岩溶湿地系统,其不仅衔接漓江和洛清江两大水系,还为脆弱的岩溶地下水环境提供了天然屏障[9]。然而近几十年来,人类对湿地无节制的开发,大量天然湖泊被改造为人工鱼塘,退化的湿地逐渐变为耕地,导致农业面源污染问题突显。符鑫等[10]调查研究了会仙湿地地表水和地下水中OCPs的污染状况,结果显示研究区域内共有15种OCPs被检出,平均检出浓度为104.23 ng·L-1。彭聪等[11]调查了会仙湿地富营养化状况,发现湿地内水体富营养呈现上升趋势,部分区域NO2-和NH4+出现超标现象。因此,会仙岩溶湿地的农业面源污染问题值得人们关注。
近年来,学者们主要集中关注会仙湿地中重金属、抗生素和OCPs等污染问题[10, 12-13],但对OPs复合污染特征及其生态风险关注较少。而湿地周边分布有大面积的农田和众多村落,内部水系纵横交错,这都为OPs通过地表径流、土壤渗透等途径从农田向湿地内迁移提供了有利条件[14]。因此,本文以会仙岩溶湿地为研究对象,分析不同水期下湿地湖泊水和农田沟渠水中16种OPs的残留与分布特征,并通过风险商值法进行复合污染生态风险评估,为会仙湿地OPs的阻控和风险管理提供理论依据和数据支持。
1 材料与方法 1.1 标准品与试剂16种OPs:敌敌畏、氧乐果、乐果、甲胺磷、乙酰甲胺磷、久效磷、灭线磷、辛硫磷、对硫磷、敌百虫、水胺硫磷、杀扑磷、杀唑磷、氯唑磷、马拉硫磷和毒死蜱,混合标准溶液购于美国o2si公司;丙酮、二氯甲烷、乙酸乙酯、乙腈均为色谱纯,购于美国Fisher公司;甲醇为色谱纯,购于德国Merck公司;甲酸为色谱纯,购于美国阿拉丁公司;乙酸铵、盐酸均为国产分析纯。
1.2 样品采集本文以桂林会仙岩溶湿地为研究对象,使用GPS现场定点,分别于2018年8月(丰水期)、2018年10月(平水期)和2019年1月(枯水期)采集水样。采样点的布设和水样的采集均依据《水质采样方案设计技术规定》(HJ 95—2009)进行。湿地湖泊采样点主要是沿湿地内河流走向在码头、干流和支流上布设(共18个,S1~S18),河岸周边耕地多以玉米、蔬菜和花生等短期旱种作物为主,湿地内部的耕种区较为零散,而码头周围多为村落聚集地;丰水期湿地周边大量地表径流汇入湿地湖泊,枯水期湿地湖泊水则以地下径流的方式向周围扩散。农田沟渠采样点选择在湿地周边农田沟渠布设(共6个,D1~D6),农田每年耕种两季水稻,休耕期时部分农田会种植蔬菜。具体采样点分布见图 1。每个采样点采集1 L水样置于棕色玻璃瓶中,现场在瓶中加入5 mL甲醇助溶,用盐酸调节pH为3~5。采样完成后,立即将样品运回实验室,在4 ℃冰箱中避光保存,并于48 h内完成前处理。

|
图 1 会仙湿地采样点示意图 Figure 1 Map of the sampling sites in Huixian wetland |
将水样用0.45 μm玻璃纤维滤膜进行抽滤,取500 mL滤后水样,采用HLB-AC串联柱进行固相萃取(HLB柱在上,AC柱在下)。样品过柱前,依次用10 mL二氯甲烷/丙酮(V∶V,1∶4)、10 mL 5 mmol·L-1乙酸铵甲醇溶液和10 mL超纯水活化萃取柱,上样流速控制在3~5 mL·min-1。样品过完后,用10 mL超纯水淋洗萃取柱,在氮气下干燥40 min。将两柱拆开,用12 mL二氯甲烷/丙酮(V∶V,1∶4)洗脱HLB柱,用12 mL 5 mmol·L-1乙酸铵甲醇溶液洗脱AC柱,分3次洗脱,最后将洗脱液混合,于35 ℃下用氮气吹至近干,加入0.1% 甲酸水溶液-甲醇(V∶V,1∶3)混合溶液复溶,定容至1 mL,过0.22 μm滤膜后,置于棕色进样瓶中,待上机测定。
1.4 仪器分析采用超高效液相色谱串联三重四极杆质谱仪(UPLC-MS/MS)分析测定水样。色谱条件:色谱柱采用ACQUIT BEH C18柱(2.1 mm×100 mm,1.7 μm),进样量2 μL,流速0.3 mL·min-1,柱温40 ℃。流动相A为0.1%甲酸水溶液,流动相B为甲醇,梯度洗脱程序为:0~2 min,20% B;2~4.5 min,20%~86% B;4.5~8 min,86%~90% B;8~9 min,90%~20% B;9~11 min,20% B。质谱条件:采用正离子扫描(ESI+),多反应监测模式(MRM);毛细管电压0.5 kV,离子源温度150 ℃,脱溶剂温度600 ℃,脱溶剂气流速1 000 L·h-1。
1.5 质量保证与质量控制采用外标法进行定量分析,16种目标物在1~100 μg·L-1范围内线性关系良好,相关系数R2>0.99。分别用3倍信噪比和10倍信噪比对应标样浓度估算方法检出限、定量限,其中检出限为0.004~0.238 ng·L-1,定量限为0.020~0.794 ng·L-1。样品处理过程中同时分析实验室空白、现场空白、样品平行和空白加标平行样(n=5)。其中,空白加标样中16种目标物的加标回收率为55.5%~109.7%,相对标准偏差(RSD)小于13.9%。
1.6 复合污染生态风险评估现阶段,研究者对水生生态中污染物的风险评价多集中于单一物质[15],忽略了低浓度下可能存在的复合毒性效应,导致实际风险被低估。而在现实农业生产中,针对不同作物和病虫害情况经常是多种农药同时使用进行防治,环境中的农药残留也多以混合物的形式存在[16],因此开展混合物复合风险评价更具有现实意义。本文参照BACKHAUS等[17]提出的化学混合物风险评估方法对研究区域内不同季节下各采样点的OPs混合物进行风险评估。公式如下:
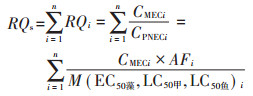
|
式中:CMECi为化合物i在环境中的实测浓度,ng·L-1;CPNECi为化合物i预测无效应浓度,ng·L-1;RQi为化合物i的单一风险商值;RQs为混合物风险商值;M (EC50藻, LC50甲, LC50鱼) i为化合物i对藻类半数效应浓度和鱼类、甲壳类的半数致死浓度;AFi为风险因子,取值为100。
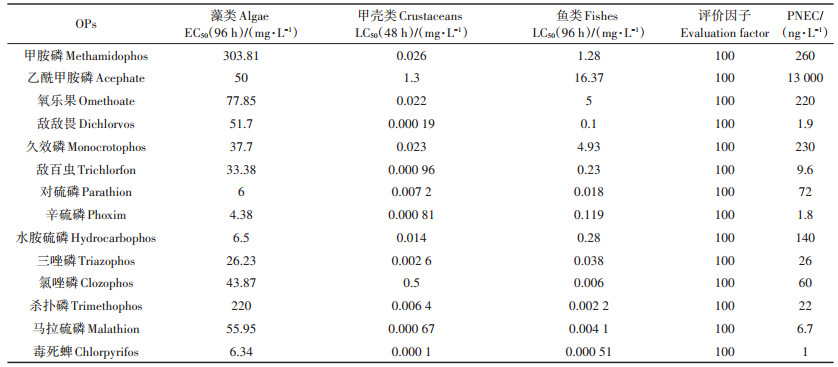
根据HERNANDO等[18]提出的RQs分类方法评估生态风险等级:低风险,RQs < 0.1;中等风险,0.1 < RQs < 1;高风险,RQs>1。本文中的毒理数据来自于北美行动网络PANNA农药毒性数据库[19]、英国PPDB农药属性数据库[20]、美国环境保护局(US EPA)的ECOTOX数据库[21]以及相关文献[22-23],具体数据见表 1。
|
|
表 1 14种OPs对藻类的半数效应浓度(EC50)、对甲壳类和鱼类的半数致死浓度(LC50)以及预测无效应浓度(PNEC) Table 1 Half effective concentration(EC50)for algae and crustaceans as well as half lethal concentration(LC50)for fish, and predicted no effect concentration(PNEC)values for 14 organophosphorus pesticides |
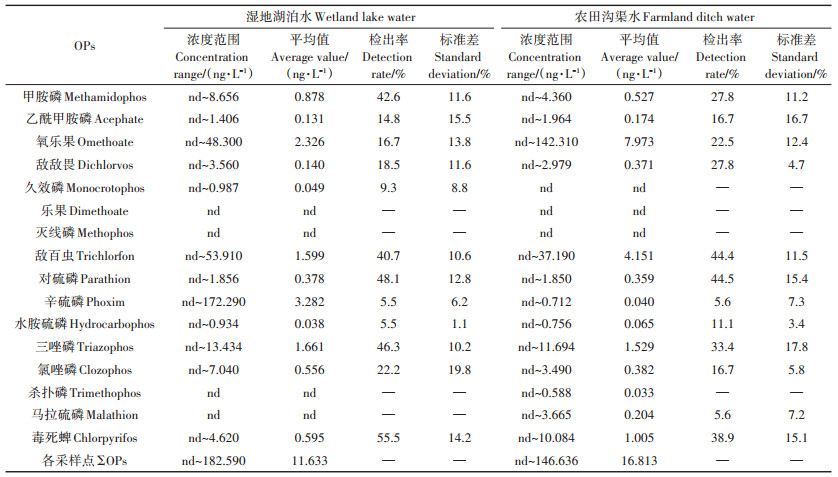
14种OPs在湿地湖泊水和农田沟渠水中残留状况如表 2所示。在会仙湿地水体中共检出14种OPs,其中湿地湖泊水中检出12种,农田沟渠水中检出13种。两种水体中均未检出乐果和灭线磷,湿地湖泊水中未检出杀扑磷和马拉硫磷,农田沟渠水中未检出久效磷。
|
|
表 2 会仙湿地不同水体中OPs的残留状况 Table 2 OPs residues in different water bodies of Huixian wetland |
湿地湖泊水中OPs总检出浓度为nd~182.590 ng·L-1,平均浓度为11.633 ng·L-1。其中氧乐果、敌百虫、辛硫磷和三唑磷检出浓度较高,分别为2.326、1.599、3.282 ng·L-1和1.661 ng·L-1,它们占总平均残留浓度的75% 以上。检出率最高的是毒死蜱,为55.5%;其次是对硫磷和三唑磷,分别为48.1%和46.3%;再次是甲胺磷和敌百虫,分别为42.6%和40.7%;其余OPs检出率均低于25.0%。在农田沟渠水中OPs检出浓度为nd~146.636 ng·L-1,平均浓度为16.813 ng·L-1。沟渠水样与湿地湖泊水检出结果相似,氧乐果、敌百虫和对硫磷为主要OPs污染物,占总平均检出浓度的80%以上。其中检出率最高的是对硫磷,44.5%,其次是敌百虫,44.4%,其余各种OPs均低于40.0%。各OPs检出浓度呈现显著差异,一方面可能与其施用量和施用频率有关,氧乐果、敌百虫和毒死蜱对稻螟虫、螨、蚜等病虫害有良好的防治效果,且价格低廉,常被使用在水稻的病虫害防治中,而久效磷、灭线磷等因高毒性而在农业生产中被限制,使用量减少。另一方面可能与其物理化学特性有关,氧乐果、甲胺磷、敌百虫有较高的水溶性,易于从土壤向水体迁移,因而在各类水体中均有较高的检出浓度,而敌敌畏、灭线磷、氯唑磷的蒸汽压高,易于从水体或土壤向大气中挥发,因而总体检出率偏低。
总体而言,与我国《地表水环境质量标准》(GB 3838—2002)中的阈值相比,本研究区内OPs的残留水平均低于限值(马拉硫磷 < 0.05 mg·L-1、乐果 < 0.08 mg·L-1、敌敌畏 < 0.05 mg·L-1、敌百虫 < 0.05 mg·L-1)。但该标准仅考虑单一物质毒性,并未涉及混合污染物低剂量浓度下的相互作用。张亚旦等[24]对《生活饮用水质量标准》(GB 5749—2006)中14种限制检出物进行多元毒性实验,发现尽管所有目标物的浓度均低于国家标准,但共存时的联合毒性仍十分显著。这与曾莎莎等[23]的研究结果相似,低浓度下多种OPs对水生生物多呈现为加和作用。另外有关研究表明,长期暴露于低剂量OPs环境中或长时间通过食物链摄入低剂量的OPs,不仅会使OPs在人体中富集,造成慢性中毒,而且会有致癌致突变的风险[25-26]。因此,会仙湿地中所检出的14种OPs残留水平虽未超出国家规定限值,但仍不能排除其混合物对环境造成的潜在污染风险。
2.2 有机磷农药在湿地湖泊水和沟渠水中的时空分布研究区域内各采样点OPs季节性变化特征如图 2所示。不同水期下OPs残留浓度存在显著差异,湿地湖泊水与农田沟渠水均表现为丰水期>枯水期>平水期。对于农田沟渠水,其原因一方面可能与农业生产活动周期密切相关,在传统农耕中,8月多为农药施用季,农药的施用量和种类均明显增加;10月为晚稻的收获季,农药的施用量显著减少;而1月虽然为水稻休耕期,但村民一般会在农田中小规模种植蔬菜、玉米等短期作物,相较于10月的平水期OPs的施用量有所增加,使得枯水期OPs残留浓度高于平水期。另一方面可能由于丰水期降雨量大,残留于农田土壤中的OPs易随地表径流进入沟渠和湿地湖泊中,而平水期和枯水期降雨稀少,难以在农田土壤表面形成有效径流,加之此时农田排灌强度低,吸附于农田土壤中的OPs不易被冲刷至沟渠中。对于湿地湖泊水,丰水期高强度降雨致使周边农田沟渠水向湿地内部汇集,导致该时期OPs残留水平偏高;而枯水期和平水期湿地内部水体流速缓慢,加上OPs本身易降解的特性,这些均为OPs沉降于沉积物中或直接被生物降解创造了有利条件;而枯水期与平水期相比,由于短期作物的灌溉,湿地湖泊水和沟渠水被反复扰动,吸附于沉积物中的OPs被重新释放到水体中,与此同时枯水期中水体的蒸发量远高于补充量,OPs被进一步浓缩,最终导致枯水期的OPs残留水平高于平水期。

|
图 2 会仙湿地两种水体总OPs季节性变化特征 Figure 2 Seasonal variations of the total OPs in the two water sources from Huixian wetland |
研究区域内水体OPs空间分布如图 3所示。对于湿地湖泊水,OPs残留水平分布特征呈现沿水流方向减少的趋势。采样点S17的辛硫磷残留浓度异常,推测其原因可能是在采样期间,当地村民粉碎清理河道中水葫芦,导致植物体内富集的OPs向水体中释放[27]。S12位于两河交汇处下游,同时接纳了上游来水和会仙河来水的农药残留,致使浓度残留高于上游。S1~S9位于湿地内部,水体流动缓慢、水网细密,这为水生植物根系吸收、沉积物吸附以及微生物的降解提供了有利条件。而S14~S18位于农业生产区和村落附近,农业活动频繁,大量生活污水和农业排水的输入,导致该区域内OPs残留浓度相对较高。对于农田沟渠,D2、D3周边为大面积稻田,沟渠间相互贯通,村民多于此清洗农具或稀释农药,因此该区域内检出OPs种类较多。D6为一条封闭沟渠,流量小,缺乏有效的迁入源,因此该点OPs残留浓度最低。D1、D2、D3与D4、D5、D6分别为两块不同的水稻种植区,其中D1、D2、D3采样点以甲胺磷、三唑磷、氯唑磷以及毒死蜱残留为主,而D4、D5、D6采样点以敌敌畏、氧乐果和敌百虫残留为主,分别占所在区域内总残留浓度的74.5%和94.8%,这说明OPs残留特征可能与其施用习惯有关。

|
图 3 会仙湿地两种水体中OPs的空间分布特征 Figure 3 Spatial distribution characteristics of OPs in two water bodies of Huixian wetland |
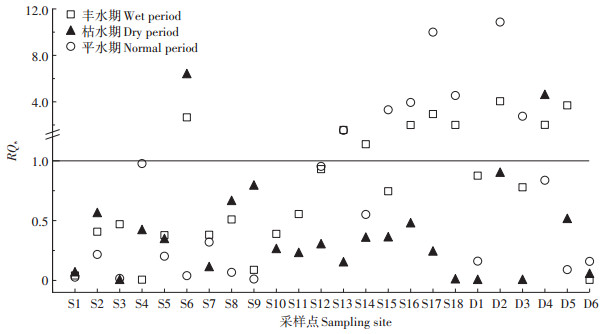
根据RQs值计算公式,各采样点不同水期下OPs混合物的RQs值详见图 4。在全部72个水样中,存在高风险的水样有20个,占总水样的27.8%,其中丰水期和平水期各9个、枯水期2个;中等风险的水样有32个,占总水样的44.4%,其中丰水期有9个、平水期9个、枯水期14个。与OPs残留浓度季节性变化不同,平水期中处于高风险的点位显著多于枯水期,其可能原因是虽然平水期各样点中总OPs检出浓度低于枯水期,但生态毒性较大的组分(如敌敌畏、毒死蜱和辛硫磷等)所占比例较高,而枯水期虽然总OPs浓度高于平水期,但各样点中生态毒性较大的组分所占比例较低。在18个农田沟渠水样中,处于高风险的水样高达7个,高风险率近40%,而在湿地湖泊水中高风险点位也多集中在农业生产区和村落聚集区附近,这说明农业生产活动是造成会仙岩溶湿地OPs污染的主要原因。
|
图 4 会仙湿地两种水体中OPs的空间分布特征 Figure 4 Spatial distribution characteristics of OPs in two water bodies of Huixian wetland |
总体而言,研究区域两种水体OPs存在的生态风险多集中在丰水期和平水期中农业活动频繁的区域内,湿地内部虽然多表现为中等风险或低风险,但较多点位接近高风险,因此对于湿地内部OPs的生态风险仍不能忽视。由此可见,会仙湿地研究区域内OPs混合物存在一定的生态风险。针对此现象提出治理措施:第一,可在区域内推行稻-鸭-油种养模式,减少农药施用量;优化水肥管理,以减少病虫害的发生。第二,大力推广低毒、高效、低残留农药,提高农药利用率,积极开展病虫害抗药性检测工作。第三,培养专业技术人员,定期深入一线开展农民培训工作。
3 结论(1)会仙湿地研究区域中共有14种OPs被不同程度地检出。湿地湖泊水检出浓度范围为nd~ 182.590 ng·L-1,总平均浓度为11.633 ng·L-1,其中辛硫磷的残留浓度最高,毒死蜱的检出率最高;农田沟渠水中检出浓度范围为nd~146.636 ng·L-1,总平均浓度为16.813 ng·L-1,其中氧乐果的残留浓度最高,对硫磷的检出率最高。
(2)水体OPs残留具有明显的季节性变化,表现为丰水期>枯水期>平水期。研究区域内,OPs空间分布呈现为沿水流方向减少的趋势,靠近农业生产区和村落聚集区的水体OPs残留浓度明显高于其他区域。
(3)72个水样中有20个水样处于高风险,占总水样的27.8%,有32个水样处于中等风险,占总水样的44.4%。高风险水样多位于丰水期和平水期的农业生产频繁区域。
| [1] |
PEHKONEN S O, ZHANG Q. The degradation of organophosphorus pesticides in natural waters: A critical review[J]. Critical Reviews in Environmental Science and Technology, 2002, 32(1): 17-72. DOI:10.1080/10643380290813444 |
| [2] |
LI H, MEHLER W T, LYDY M J, et al. Occurrence and distribution of sediment-associated insecticides in urban waterways in the Pearl River delta, China[J]. Chemosphere, 2011, 82(10): 1373-1379. DOI:10.1016/j.chemosphere.2010.11.074 |
| [3] |
束放, 李永平, 魏启文. 2018年种植业农药使用情况及2019年需求分析[J]. 中国植保导刊, 2019, 39(4): 73-76. SHU F, LI Y P, WEI Q W. Pesticide use in planting industry in 2018 and demand analysis in 2019[J]. China Plant Protection, 2019, 39(4): 73-76. |
| [4] |
赵润德, 杨桂朋, 吴萍, 等. 水体中有机磷农药分析方法述评[J]. 海洋科学, 2003, 27(6): 42-45. ZHAO R D, YANG G P, WU P, et al. Analysis methods of OPPs in water: A review[J]. Marine Sciences, 2003, 27(6): 42-45. |
| [5] |
张娜娜, 姜博, 邢奕, 等. 有机磷农药污染土壤的微生物降解研究进展[J]. 土壤, 2018, 50(4): 645-655. ZHANG N N, JIANG B, XING Y, et al. Microbial degradation of organophosphorus pesticide contaminated soils[J]. Soils, 2018, 50(4): 645-655. |
| [6] |
ALLINSON G, ZHANG P, BUI A, et al. Pesticide and trace metal occurrence and aquatic benchmark exceedances in surface waters and sediments of urban wetlands and retention ponds in Melbourne, Australia[J]. Environmental Science and Pollution Research, 2015, 22(13): 10214-10226. DOI:10.1007/s11356-015-4206-3 |
| [7] |
WEE S Y, OMAR T F T, ARIS A Z, et al. Surface water organophosphorus pesticides concentration and distribution in the Langat River, Selangor, Malaysia[J]. Exposure and Health, 2016, 8(4): 497-511. DOI:10.1007/s12403-016-0214-x |
| [8] |
JONES K C, VOOGT P. Persistent organic pollutants(POPs): State of the science[J]. Environmental Pollution, 1999, 100(1/2/3): 209-221. |
| [9] |
彭聪, 巴俊杰, 胡芬, 等. 广西会仙岩溶湿地典型抗生素污染特征及生态风险评估[J]. 环境科学学报, 2019, 39(7): 2207-2217. PENG C, BA J J, HU F, et al. Typical antibiotic pollution characteristics and ecological risk assessment of Huixian Karst wetland in Guangxi, China[J]. Acta Scientiae Circumstantiae, 2019, 39(7): 2207-2217. |
| [10] |
符鑫, 梁延鹏, 覃礼堂, 等. 桂林会仙岩溶湿地水体中有机氯农药分布特征及混合物环境风险评估[J]. 农业环境科学学报, 2018, 37(5): 974-983. FU X, LIANG Y P, QIN L T, et al. Distribution of organochlorine pesticides(OCPs)in water body from Huixian karst wetland of Guilin and environmental risk assessment of mixtures[J]. Journal of Agro-Environment Science, 2018, 37(5): 974-983. |
| [11] |
彭聪, 潘晓东, 焦友军, 等. 多种同位素手段的硝酸盐污染源解析: 以会仙湿地为例[J]. 环境科学, 2018, 39(12): 5410-5417. PENG C, PAN X D, JIANG Y J, et al. Identification of nitrate pollution sources through various isotopic methods: A case study of the Huixian wetland[J]. Environmental Science, 2018, 39(12): 5410-5417. |
| [12] |
QIN L T, PANG X R, LIANG Y P, et al. Ecological and human health risk of sulfonamides in surface water and groundwater of Huixian karst wetland in Guilin, China[J]. Science of the Total Environment, 2020, 708: 134552. DOI:10.1016/j.scitotenv.2019.134552 |
| [13] |
徐莉, 黄亮亮, 吴志强, 等. 广西会仙湿地土壤重金属分布特征及风险评估[J]. 安徽农业科学, 2016, 44(29): 35-38. XU L, HUANG L L, WU Z Q, et al. Distribution characteristics and risk assessment of heavy metals in Huixian wetland of Guangxi Province[J]. Journal of Anhui Agricultural Sciences, 2016, 44(29): 35-38. |
| [14] |
KÖHNE J M, KÖHNE S, ŠIMůNEK J. A review of model applications for structured soils: B)Pesticide transport[J]. Journal of Contaminant Hydrology, 2009, 104(1/2/3/4): 36-60. |
| [15] |
CCANCCAPA A, MASIA A, NAVARRO-ORTEGA A, et al. Pesticides in the Ebro River basin: Occurrence and risk assessment[J]. Environment Pollution, 2016, 211: 414-424. |
| [16] |
GUSTAVSSON M, KREUGER J, BUNDSCHUH M, et al. Pesticide mixtures in the Swedish streams: Environmental risks, contributions of individual compounds and consequences of single-substance oriented risk mitigation[J]. Science of the Total Environment, 2017, 598: 973-983. |
| [17] |
BACKHAUS T, FAUST M. Predictive environmental risk assessment of chemical mixtures: A conceptual framework[J]. Environmental Science & Technology, 2012, 46(5): 2564-2573. |
| [18] |
HERNANDO M D, MEZCUA M, FERNÁNDEZ-ALBA A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments[J]. Talanta, 2006, 69(2): 334-342. |
| [19] |
Pesticide Action Network(PAN)North America. PAN pesticide database[DB/OL]. [2021-02-10]. http://www.pesticideinfo.org/search_chemicals.jsp.
|
| [20] |
International Union of Pure and Applied Chemistry. PPDB: Pesticide properties database[DB/OL]. [2021-02-10]. http://sitem.herts.ac.uk/aeru/ppdb/en/index.htm.
|
| [21] |
United States Environmental Protection Agency. OPP pesticide ecotoxicity database[DB/OL]. [2021-02-10]. https://ecotox.ipmcenters.org/index.cfm.
|
| [22] |
王娜, 刘莉莉, 孙凯峰, 等. 有机磷农药的构效关系及其对浮游生物的毒性效应[J]. 生态环境学报, 2012, 21(1): 118-123. WANG N, LIU L L, SUN K F, et al. Analysis of structure -activity relationship and toxicity of organophosphorus pesticide to plankton[J]. Ecology and Environmental Sciences, 2012, 21(1): 118-123. |
| [23] |
曾莎莎, 梁延鹏, 覃礼堂, 等. 有机磷农药对蛋白核小球藻的毒性相互作用研究[J]. 生态毒理学报, 2019, 14(4): 121-129. ZENG S S, LIANG Y P, QIN L T, et al. Toxicological interactions of organophosphorus pesticides mixtures to chlorella pyrenoidosa[J]. Asian Journal of Ecotoxicology, 2019, 14(4): 121-129. |
| [24] |
张亚旦, 徐亚同, 朱文杰. 饮用水水质标准中14种限制物质综合毒性研究[J]. 安全与环境学报, 2009, 9(2): 106-111. ZHANG Y D, XU Y T, ZHU W J. Analysis of joint toxicity effects on limiting the 14 substances in accordance with the healthy drinking water quality standards[J]. Journal of Safety and Environment, 2009, 9(2): 106-111. |
| [25] |
文一, 潘家荣. 有机磷农药的联合毒性研究进展[J]. 环境与健康杂志, 2007, 24(7): 553-556. WEN Y, PAN J R. Progress in studies on interactive toxicity of organophosphorus insecticides[J]. Journal of Environment and Health, 2007, 24(7): 553-556. |
| [26] |
张思远, 方琪, 焦必宁. 果品中有机磷农药联合毒性研究进展[J]. 果树学报, 2017, 34(1): 94-105. ZHANG S Y, FANG Q, JIANG B N. Research progress of combined toxicity induced by organophosphorus pesticides in fruits[J]. Journal of Fruit Science, 2017, 34(1): 94-105. |
| [27] |
江洪涛, 张红梅. 国内外水葫芦防治研究综述[J]. 中国农业科技导报, 2003, 5(3): 72-75. JIANG H T, ZHANG H M. A review of controlling common water hyacinth at home and abroad[J]. Journal of Agricultural Science and Technology, 2003, 5(3): 72-75. |
 2021, Vol. 40
2021, Vol. 40