2. 中国农业科学院油料作物研究所,武 汉 430062
2. Oil Crops Research Institute of the Chinese Academy of Agricultural Sciences, Wuhan 430062, China
铬具有良好的抗氧化和防腐蚀能力,常用于各种合金制造、印染纺织和皮革鞣制等行业。随着我国工业化进程的不断推进,涉铬行业快速发展,大量的铬污染物排放到水体、土壤等环境中,影响植物生长,危害人体健康[1-3]。
环境中的铬主要以Cr(Ⅵ)和Cr(Ⅲ)两种氧化态形式稳定存在。Cr(Ⅵ)污染会破坏土壤微生物群落[4],损伤植物根系,降低叶绿素含量,干扰作物养分吸收,限制作物生长[3, 5-7]。Cr(Ⅵ)不易被土壤胶体吸附,具有较高的活性;而Cr(Ⅲ)能与Fe3+、OH-、SO42-等离子形成沉淀,降低生物有效性,且毒性较Cr(Ⅵ)低[8-10]。因此,将环境中的Cr(Ⅵ)还原成Cr(Ⅲ)是铬污染治理过程中的重要思路和有效途径[11]。
由2014年公布的《全国土壤污染状况调查公报》可知,我国铬点位超标率达1.1%,Cr(Ⅵ)是耕地主要的无机污染物。通过向土壤环境施加电场,将Cr(Ⅵ)还原成Cr(Ⅲ),集中处理阴极Cr(Ⅲ)可高效降低Cr(Ⅵ)污染。但这种电化学法除Cr(Ⅵ)效果受水溶液pH的影响,且阴极Cr(Ⅲ)易与溶液中的胶体、OH-、SO42-形成沉淀,影响电极使用寿命[12]。向溶液中添加普通还原剂,如Na2SO3、FeSO4、铁粉等,使Cr(Ⅵ)还原成Cr(Ⅲ),沉淀后进行分离是铬废水的经典处理方法[13-15],该反应速度慢,在复杂的土壤环境中可能难以充分发挥还原剂的效果,且还原剂回收困难,给环境带来额外负担[16]。光催化剂是一种用于加快反应物发生反应的媒介,光催化还原是基于光激发电子和半导体空穴在光照下促进氧化还原的反应,因其快速、高效、安全、可回收、操作简单、不借助额外设施等优点而日益受到重视。常用的光催化剂有TiO2、ZnO等[17-19],但这些催化剂仍存在催化效率低、回收率低的问题。
铁酸镍是具有强磁性的可见光响应光催化剂,具有强磁性、良好的热稳定性和化学稳定性、无毒易回收等优点,且成本低、制备方法简单,通常采用水热、溶剂热等方法制备纳米铁酸镍。本研究通过溶胶-凝胶法制备纳米级铁酸镍材料,评价了可见光照射条件下铁酸镍处理含Cr(Ⅵ)营养液对水稻生长的影响,以期为稻田灌溉水铬污染治理提供新的思路和手段。
1 材料与方法 1.1 试验材料试验所用催化剂为铁酸镍光催化剂,由硝酸铁、硝酸镍和柠檬酸通过溶胶-凝胶法制成,其可在可见光(λ>420 nm)照射下发生催化反应,将Cr(Ⅵ)还原成Cr(Ⅲ)。高分辨扫描电镜(SEM)和透射电镜(TEM)对纳米铁酸镍的微观形貌的表征表明(图 1),所制备的纳米铁酸镍形貌均一,呈纳米棒状,平均长度约为100 nm;纳米铁酸镍具有清晰的晶格条纹,对应(311)晶面的晶格条纹间距约为0.25 nm。

|
图a和b分别表示扫描电镜200 nm和100 nm标尺下的扫描图,图c和d分别表示透射电镜200 nm和5 nm下的扫描图 Figure a and b represent SEM map at 200 nm and 100 nm scales, respectively. Figure c and d represent TEM map at 200 nm and 5 nm scales, respectively 图 1 纳米铁酸镍的SEM图及TEM图 Figure 1 SEM and TEM map of nickel ferrate nanoparticle |
X-射线电子衍射(XRD)对铁酸镍纳米材料晶体结构的分析表明(图 2),所制备的纳米铁酸镍的XRD图谱对应标准卡片为JCPDS# 10-0325,其为典型的单斜相结构,特征衍射峰位于18.5°、30.2°、35.6°、37.4°、43.2°、53.9°、57.2°及63.1°,分别与(111)、(220)、(311)、(222)、(400)、(422)、(511)和(440)晶面相对应。在含1 mmol·L-1的Cr(Ⅵ)培养液中处理80 min,Cr(Ⅵ)的还原率达到61%。通过以上材料表征说明纳米铁酸镍制备成功,且具备较好的还原Cr(Ⅵ)的性能。

|
图 2 纳米铁酸镍的XRD图谱 Figure 2 XRD map of nickel ferrate nanoparticles |
水稻水培试验共设置3种培养液处理:对照处理,不加K2Cr2O7和催化剂;Cr(Ⅵ)胁迫处理,只加K2Cr2O7,添加量为1 mmol·L-1;光催化处理,加1 mmol·L-1 K2Cr2O7和1.0 g·L-1铁酸镍光催化剂,在氙灯光照(波长为420~780 nm)下,以200 r·min-1速度均匀搅拌,以保证催化剂均匀分散,光催化时间为80 min,光照强度为5 500 lx,催化结束后用强力磁铁和高速离心机去除铁酸镍催化剂。Cr(Ⅵ)胁迫浓度由预试验确定,以确保试验设置的Cr(Ⅵ)胁迫浓度在短时间内可以抑制水稻幼苗的生长,但不会导致水稻植株死亡。
本试验于2020年8—11月开展,选取两个水稻品种——7优88和7优370(审定编号分别为鄂审稻20200012和鄂审稻2019023,由湖北大学水稻育种团队提供)大小一致的水稻种子,使用1%的NaClO杀菌处理10 min;用蒸馏水将种子表面冲洗干净后,37 ℃下用超纯水(<18.25 MΩ·cm)浸泡催芽。催芽后的种子分别置于不同处理营养液中培养21 d。培养箱采用塑料盒,上覆消毒纱布,每盒装营养液800 mL,种植水稻50株。水稻于光照培养箱中培养,培养箱温度为37 ℃,光照周期为16 h(光照)/8 h(黑暗),光照强度为5 500 lx,相对湿度为60%~80%。营养液组成采用国际水稻研究所(IRRI)的Yoshida水稻营养液配制[20]。于每日上午9:00和下午16:00更换营养液,各处理营养液加入量相同,营养液pH维持在5.8。
1.3 指标测定与方法 1.3.1 苗长和根长动态测定分别于不同处理营养液培养9、12、15、18、21 d后取水稻植株,用直尺测量苗长和根长,每个处理随机选取5株测定,取平均值。植株测定后不放回。
1.3.2 叶绿素含量测定于培养21 d后取水稻地上部倒二叶,用吸水纸擦净叶片表面后,采用不锈钢剪刀将叶片剪碎(避开主叶脉)。取0.5 g剪碎的叶片样品放入乙醇-丙酮混合液,黑暗条件下浸提24 h(叶片呈白色),采用紫外分光光度计分别在663 nm和645 nm波长下测定浸提液吸光值,分别计算得到叶绿素a和叶绿素b含量[21]。
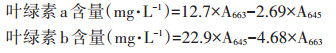
|
培养21 d后各处理随机选取10株水稻植株,自来水清洗3次,去离子水漂洗3次,并吸干水分,按地上部和根系分开称取质量。新鲜样品先于105 ℃烘箱中杀青30 min,然后再置于80 ℃下烘干至质量恒定,得到各部位干物质量。烘干样品磨细过筛,称取约0.2 g植株样品于100 mL消解罐中,加5 mL浓硝酸、2 mL过氧化氢和2 mL水后,轻轻摇匀,静置消解2 h。将消解罐放于微波消解仪中消解1 h,消解结束后,待罐体温度降至室温后将消解罐取出,用水少量多次洗涤消解罐,洗液合并于50 mL容量瓶中,定容至刻度后混匀;同时作试剂空白,蒸馏水定容后,分取10 mL溶液,电热板上赶酸至0.5 mL左右,用纯水定容至10 mL,采用原子吸收法测定总铬含量[22]。称取植物样0.2 g于玻璃管中,加10 mL浓硝酸没过植株样品,浸泡一夜,过滤,取滤液在8 000 r·min-1下离心2 min,取上清液加水稀释至30 mL,用1 mol·L-1氢氧化钠调节pH至2,加入0.1 g二苯碳酰二肼显色剂定容后显色,待溶液30 s内不褪色后,在540 nm下用紫外分光光度计测定Cr(Ⅵ)含量[23]。总铬含量和Cr(Ⅵ)含量的差值即为Cr(Ⅲ)含量。
铬积累量=铬含量×干物质量
铬转移系数=地上部总铬含量/根系总铬含量
1.3.4 抗氧化酶活性和丙二醛含量测定取培养21 d的水稻地上部鲜样,洗净后用液氮保存。采用试剂盒法分别测定超氧化物歧化酶(SOD)、过氧化物酶(POD)活性和丙二醛(MDA)含量[24]。酶活性均采用鲜样测定。
1.4 数据统计与分析采用SPSS 18.0软件进行数据统计和方差分析,结果表示为平均值±标准差。利用Origin Pro 8对数据进行绘图。
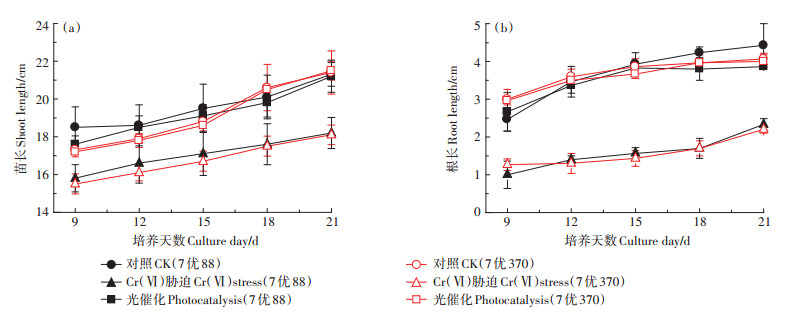
2 结果与分析 2.1 铁酸镍光催化还原Cr(Ⅵ)对水稻苗长和根长动态变化的影响由图 3可知,随培养时间延长,水稻苗长和根长均逐渐增长。Cr(Ⅵ)胁迫处理在水稻培养第9 d即受到显著影响,与对照处理相比,7优88和7优370的苗长分别降低了14.6% 和10.4%,根长分别降低了59.5%和57.8%,根长降低幅度大于苗长,表明根系受到的影响更大。至培养后21 d,Cr(Ⅵ)胁迫处理7优88和7优370的苗长分别比对照处理降低14.6% 和15.4%,根长分别比对照降低47.4% 和45.9%。光催化剂处理含Cr(Ⅵ)营养液后,水稻生长胁迫得到缓解,与Cr(Ⅵ)胁迫处理相比,培养21 d后光催化处理苗长平均增加17.6%,根长平均增长73.8%;与对照处理相比,光催化处理培养21 d后的水稻苗长没有差异,但7优88的根长降低12.8%。光催化处理可以缓解Cr(Ⅵ)对水稻苗长和根长的胁迫。
|
图 3 不同处理对两个水稻品种苗长和根长动态变化的影响 Figure 3 Effects of different treatments on dynamics of rice shoot length and root length of the both varieties |
Cr(Ⅵ)胁迫显著降低水稻叶绿素含量(图 4),与对照处理相比,7优88和7优370在Cr(Ⅵ)胁迫处理下叶绿素含量分别降低了42.6% 和38.4%,其中,7优88受到的影响更大。与Cr(Ⅵ)胁迫处理相比,两个水稻品种光催化处理下的叶绿素含量分别增加了70.6%和60.7%。光催化处理与对照处理叶绿素含量没有差异。

|
不同小写字母表示同一品种不同处理间差异显著(P<0.05)。下同 Different lowercase letters indicate significant differences among treatments of the same variety. The same below 图 4 不同处理对两个水稻品种培养21 d后叶绿素含量的影响 Figure 4 Effects of different treatments on rice chlorophyll content of both rice varieties at 21th day after culture |
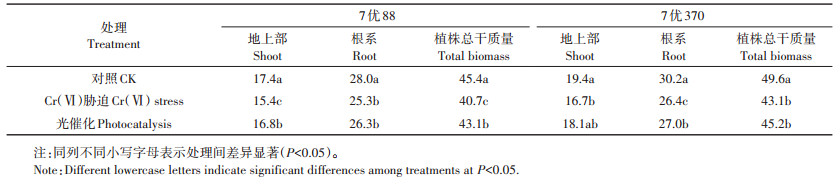
两个水稻品种在不同处理营养液中培养21 d后各部位干物质量差异显著(表 1)。地上部、根系及植株总干质量均表现为Cr(Ⅵ)胁迫处理<光催化处理<对照处理。与对照处理相比,Cr(Ⅵ)胁迫处理下7优88地上部、根系及植株总干质量分别降低了11.5%、9.6% 和10.4%,7优370各部位分别降低了13.9%、12.6% 和13.1%。施用光催化剂后,不同部位干物质量有所增加,但均显著低于对照处理。与Cr(Ⅵ)胁迫处理相比,光催化处理7优88地上部、根系及植株总干质量分别增加了9.1%、4.0% 和5.9%,7优370分别增加了8.4%、2.3% 和4.9%。光催化剂可以一定程度缓解Cr(Ⅵ)胁迫。7优370各部位干物质量均显著高于7优88,受Cr(Ⅵ)胁迫时干物质降幅也大于7优88。
|
|
表 1 不同处理对两个水稻品种培养21 d后各部位干物质量的影响(mg·株-1) Table 1 Effects of different treatments on rice dry biomass weight of different tissues of both rice varieties at 21th day after culture (mg·plant-1) |
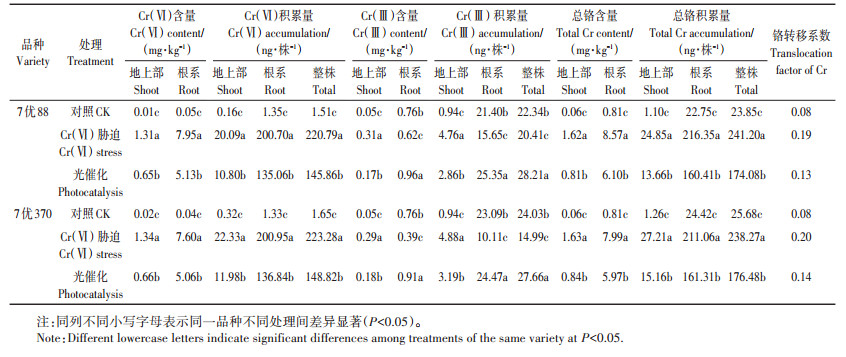
对照处理下,水稻植株地上部和根系铬含量均较低,植株总铬积累量仅为23.85~25.68 ng·株-1,且主要集中在根系,铬转移系数为0.08(表 2)。营养液中存在Cr(Ⅵ)胁迫时,水稻各部位Cr(Ⅵ)含量显著增加,与对照相比,7优88地上部和根系Cr(Ⅵ)含量分别增加了130倍和158倍,7优370分别增加了66倍和189倍;地上部Cr(Ⅲ)含量也有一定程度增加,7优88和7优370水稻地上部Cr(Ⅲ)含量均比对照处理增加了约5倍,而根系Cr(Ⅲ)含量较对照处理降低。Cr(Ⅵ)胁迫处理的铬转移系数显著增加至0.19和0.20。
|
|
表 2 不同处理对两个水稻品种培养21 d后各部位铬含量和积累量的影响 Table 2 Effects of different treatments on Cr content and accumulation of different tissues of both rice varieties at 21 day after culture |
使用光催化剂处理含Cr(Ⅵ)营养液,水稻地上部和根系Cr(Ⅵ)含量显著降低。与Cr(Ⅵ)胁迫处理相比,光催化处理的7优88和7优370地上部Cr(Ⅵ)含量分别降低了50.4%和50.6%,铬转移系数降低,总铬积累量减少27.8%~25.9%。不同水稻品种间Cr(Ⅵ)含量和积累量没有差异(表 3)。
|
|
表 3 各参数方差分析 Table 3 ANOVA analysis between different treatments and varieties of different parameters |
由图 5可知,Cr(Ⅵ)胁迫处理SOD活性较对照处理显著降低,POD活性显著提高,可见,Cr(Ⅵ)胁迫引起了水稻植株活性氧损伤,使植株活性氧清除受到影响。与对照处理相比,Cr(Ⅵ)胁迫处理7优88和7优370 MDA含量分别增加了82.9%和86.6%。光催化处理可缓解活性氧损伤,与Cr(Ⅵ)胁迫处理相比,两个水稻品种SOD活性平均增加14.0%,POD活性平均降低10.0%,MDA含量平均降低29.7%。

|
图 5 不同处理对两个水稻品种培养21 d后超氧化物歧化酶、过氧化物酶活性和丙二醛含量的影响 Figure 5 Effects of different treatments on SOD, POD activities and MDA content of both rice varieties at 21 day after culture |
重金属在植株体内,尤其是在地上部的过量积累是植株受损的重要原因,土壤环境中的重金属超过安全阈值不仅影响农作物正常生长,还会引起农产品安全问题,危害人类健康。减少重金属向环境的排放是减少重金属污染的根本途径,然而当环境中存在污染时,尽量降低其对作物和人类的影响也是需要我们积极解决的问题。
铬存在多种形态,其中Cr(Ⅵ)是铬污染治理的重点。本研究发现,在1 mmol·L-1 Cr(Ⅵ)生长条件下,水稻在短时间(9 d)即受到影响,表现为苗长、根长降低,至培养21 d后,水稻叶片下垂、叶色变黄、干物质积累减慢,生长受到显著抑制。前人研究发现,低浓度Cr(Ⅵ)胁迫下,植株SOD活性升高,但存在高浓度Cr(Ⅵ)时,SOD活性降低[5, 9]。本研究Cr(Ⅵ)浓度偏高,属于高铬胁迫水平,与对照相比,Cr(Ⅵ)胁迫处理的SOD活性显著降低,表明植株活性氧清除系统受到影响,因此,Cr(Ⅵ)胁迫植株的MDA含量显著增加。
铁酸镍光催化处理可以有效降低Cr(Ⅵ)含量,缓解Cr(Ⅵ)胁迫。与Cr(Ⅵ)胁迫处理相比,光催化处理水稻各部位Cr(Ⅵ)含量和总铬含量显著降低,SOD活性升高,活性氧损伤降低,MDA含量减少,干物质积累显著增加。至培养21 d后,光催化处理叶色与对照处理没有差异。可见,铁酸镍光催化处理可有效缓解重度铬胁迫,然而,由于铁酸镍复合材料的催化效率并不能达到100%,并不能完全消除Cr(Ⅵ)胁迫的影响。因此,水稻植株体内Cr(Ⅵ)含量和总铬含量较对照处理显著升高,干物质积累量降低。作为单一催化材料,铁酸镍性质稳定、磁性强,易于回收可重复利用,能减轻环境负担,且节约成本,未来可与其他催化剂联合使用,进一步提高催化效率[25]。
曾凡荣[5]研究138份水稻材料对铬的吸收发现,不同基因型水稻品种籽粒铬含量存在显著差异,基因型和铬污染程度对植株籽粒中的铬存在显著的互作效应,高铬污染下,不同基因型水稻籽粒铬含量差异比低铬污染水平下的小,可见,在铬污染程度严重时,不同水稻的铬吸收能力差异变小。本研究中的两个水稻品种在1 mmol·L-1 Cr(Ⅵ)胁迫下,植株Cr(Ⅵ)含量没有差异,这可能与Cr(Ⅵ)胁迫程度高有关。然而,7优370受Cr(Ⅵ)胁迫时干物质降幅大于7优88,表明其受到的毒害作用更强。铬在水稻组织和亚细胞水平上的分布与其对植株的毒害作用密切相关[26],7优88和7优370体内铬的分布可能存在差异,导致其对相同的Cr(Ⅵ)含量毒害作用不同,但铬在两个水稻品种体内的分布及7优88更耐铬毒害的其他可能机制还有待进一步研究。
在没有作物种植条件下,催化环境稳定且均一,可保持催化剂较理想的催化环境。如TiO2在pH较低时(酸性环境下)催化效果好,改变pH则会降低催化效果[27]。然而,无论是工业废水,还是农田体系,其催化环境均复杂;其中,农田体系受植物生长、土壤动物和微生物活动的影响,环境时刻变化,且土壤具有较强的缓冲能力,难以调控土壤环境pH维持在酸性条件。本研究研制的光催化剂催化条件pH偏中性,在可见光下即可进行反应,且易于回收再利用,成本低、污染小,未来有希望在重金属污染农田中应用。光催化快速、高效、安全、可回收、操作简单等优势,因此开展农田催化剂缓解重金属胁迫相关研究对提高农田重金属治理效率、降低治理成本具有重要的实践意义。
4 结论(1)1 mmol·L-1 Cr(Ⅵ)胁迫导致7优88和7优370两个水稻品种地上部和根系Cr(Ⅵ)含量分别增加66~130倍和158~189倍,苗长、根长、叶绿素含量均降低,导致植株干物质降低10.4%~13.1%,严重阻碍了水稻生长发育。
(2)铁酸镍光催化剂显著缓解了水稻植株的Cr(Ⅵ)胁迫。与没有施用光催化剂相比,使用铁酸镍光催化剂后水稻地上部Cr(Ⅵ)含量平均降低了50.5%,且铬转移系数降低至0.13,叶绿素恢复至对照水平,植株干物质量平均增加4.9%~5.9%,但其干物质量仍低于无Cr(Ⅵ)胁迫的对照处理。
| [1] |
孟亚男. 制革工业中含铬废水的处理技术研究现状[J]. 山东化工, 2018(9): 187-189. MENG Y N. Research status of treatment technology of chromium containing wastewater in tannery industry[J]. Shandong Chemical Industry, 2018(9): 187-189. DOI:10.3969/j.issn.1008-021X.2018.09.082 |
| [2] |
JOBBY R, JHA P, YADAV A K, et al. Biosorption and biotransformation of hexavalent chromium[Cr(Ⅵ)]: A comprehensive review[J]. Chemosphere, 2018, 207: 255-266. DOI:10.1016/j.chemosphere.2018.05.050 |
| [3] |
钟旻依, 张新全, 杨昕颖, 等. 植物对重金属铬胁迫响应机制的研究进展[J]. 草业科学, 2019, 36(8): 1962-1975. ZHONG M Y, ZHANG X Q, YANG X Y, et al. Recent advances in plant response to chromium stress[J]. Pratacultural Science, 2019, 36(8): 1962-1975. |
| [4] |
徐成斌, 孟雪莲, 马溪平, 等. 铬污染对土壤环境质量生物特征指标的影响研究[J]. 环境科学与管理, 2012, 37(8): 1-3. XU C B, MENG X L, MA X P, et al. Research on influence of Cr pollution on index for biological characteristics of soil quality[J]. Environmental Science and Management, 2012, 37(8): 1-3. |
| [5] |
曾凡荣. 水稻铬毒害和耐性的生理与分子机理研究[D]. 杭州: 浙江大学, 2010: 41 - 87. ZENG F R. Physiology and molecular mechanism chromium stress and tolerance in rice[D]. Hangzhou: Zhejiang University, 2010: 41-87. |
| [6] |
王爱云, 钟国锋, 徐刚标, 等. 铬胁迫对芥菜型油菜生理特性和铬富集的影响[J]. 环境科学, 2011, 32(6): 1717-1725. WANG A Y, ZHONG G F, XU G B, et al. Effects of Cr(Ⅵ)stress on physiological characteristics of Brassica juncea and its Cr uptake[J]. Environmental Science, 2011, 32(6): 1717-1725. |
| [7] |
徐芬芬. 铬胁迫对水稻幼苗生长和生理特性的影响[J]. 杂交水稻, 2012, 27(3): 76-78. XU F F. Effects of chromium stress on growth and physiological characters of rice seedlings[J]. Hybrid Rice, 2012, 27(3): 76-78. |
| [8] |
CHOPPALA G, BOLAN N, LAMB D, et al. Comparative sorption and mobility of Cr(Ⅲ) and Cr(Ⅵ)species in a range of soils: Implication of bioavalability[J]. Water Air and Soil Pollution, 2013, 224: 1699. DOI:10.1007/s11270-013-1699-6 |
| [9] |
朱四喜, 王凤友, 刘冬, 等. 不同浓度铬(Ⅵ)胁迫对菖蒲生理生化特性的影响[J]. 北方园艺, 2014(3): 54-59. ZHU S X, WANG F Y, LIU D, et al. Effect of Cr(Ⅵ)stress on physiological and biochemical characters of Acorus calamus[J]. Northern Horticulture, 2014(3): 54-59. |
| [10] |
余忆玄. 铜, 铬对PFOS在沉积物上吸附行为的影响规律研究[D]. 大连: 大连海事大学, 2013: 50-68. YU Y X. Influence of copper and chromium to the sorption of PFOS on sediment[D]. Dalian: Dalian Maritime University, 2013: 50-68. |
| [11] |
DHAL B, THATOI H N, DAS N N, et al. Chemical and microbial remediation of hexavalent chromium from contaminated soil and mining/metallurgical solid waster: A review[J]. Journal of Hazardous Materials, 2013, 250/251: 272-291. DOI:10.1016/j.jhazmat.2013.01.048 |
| [12] |
时军, 马晓鹤, 孔美玲. 电去离子法(EDI)处理电镀含铬废水[J]. 电镀与涂饰, 2012, 31(10): 45-47. SHI J, MA X H, KONG M L. Treatment of chromium - containing wastewater from electroplating by electrodeionization(EDI)method[J]. Electroplating & Finishing, 2012, 31(10): 45-47. |
| [13] |
MAK M, LO I. Influences of redox transformation, metal complexation and aggregation of fulvic acid and humic acid on Cr(Ⅵ)and As(Ⅴ) removal by zero-valent iron[J]. Chemosphere, 2011, 84(2): 234-240. DOI:10.1016/j.chemosphere.2011.04.024 |
| [14] |
张亚莉, 杨杰文. 零价铁粉对水稻土中六价铬的还原作用及其影响因素研究[J]. 广东农业科学, 2019, 46(4): 51-57. ZHANG Y L, YANG J W. Study on the reduction effect of zero - valent iron on Cr(Ⅵ)in paddy soil and its influencing factors[J]. Guangdong Agricultural Sciences, 2019, 46(4): 51-57. |
| [15] |
BARRERA-DíAZ C E, LUGO-LUGO V, BILYEU B. A review of chemical, electrochemical and biological methods for aqueous Cr(Ⅵ) reduction[J]. Journal of Hazardous Materials, 2012, 223/224: 1-12. DOI:10.1016/j.jhazmat.2012.04.054 |
| [16] |
马宪梅, 黄晓飞. 土壤铬污染现状及修复方法研究[J]. 环境与发展, 2020, 32(5): 61, 63. MA X M, HUANG X F. Study on the current situation of soil chromium pollution and remediation methods[J]. Environmental and Development, 2020, 32(5): 61, 63. |
| [17] |
HUANG Q, TIAN S, ZENG D, et al. Enhanced photocatalytic activity of chemically bonded TiO2 / Graphene composites based on the effective interfacial charge transfer through the C-Ti bond[J]. ACS Catalysis, 2013, 3(7): 1477-1485. DOI:10.1021/cs400080w |
| [18] |
陈晓. 生物片状结构碳/三氧化二铁材料的合成及其光催化性能的研究[D]. 苏州: 苏州科技大学, 2019: 50-63. CHEN X. Synthesis and photocatalytic properties of carbon/ferric oxide with biological sheet structure[D]. Suzhou: Suzhou University of Science and Technology, 2019: 50-63. |
| [19] |
KHALIL L B, ROPHAEL M W, MOURAD W E. The removal of the toxic Hg(Ⅱ)salts from water by photocatalysis[J]. Applied Catalysis B: Environmental, 2002, 36: 125-130. DOI:10.1016/S0926-3373(01)00285-5 |
| [20] |
YOSHIDA S, FORNO D A, COCK J H, et al. Laboratory manual for physiological studies of rice[M]. 3rd Edition. Manila: IRRI, 1976.
|
| [21] |
PORRA R J, THOMPSON W A, KRIEDEMANN P E. Determination of accurate extinction coefficients and simultaneous-equations for assaying chlorophyll-a and chlorophyll-b extracted with 4 different solvents - verification of the concentration of chlorophyll standards by atomic-absorption spectroscopy[J]. Biochimica et Biophysica Acta Bioenergetics, 1989, 975: 384-394. DOI:10.1016/S0005-2728(89)80347-0 |
| [22] |
董薇. 微波消解-电感耦合等离子体质谱法测定植物样品中的六价铬[J]. 广州化工, 2018, 46(17): 86-87, 103. DONG W. Determination of hexavalent chromium in biological samples by inductively coupled plasma mass spectrometry with microwave digestion[J]. Guangzhou Chemical Industry, 2018, 46(17): 86-87, 103. DOI:10.3969/j.issn.1001-9677.2018.17.033 |
| [23] |
陈静洁. 二苯碳酰二肼分光光度法测定水质六价铬的方法改进[J]. 环境与发展, 2020, 32(5): 116. CHEN J J. Improvement of diphenylcarbazide spectrophotometric method for determination of hexavalent chromium in water[J]. Environment and Development, 2020, 32(5): 116. |
| [24] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. LI H S. Principles and techniques of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press, 2000. |
| [25] |
邓晓明. 基于光催化技术处理水环境中Cr的机制研究[D]. 上海: 上海师范大学, 2020: 1-16. DENG X M. Study on the mechanism of treating Cr(Ⅵ)in water environment based on photocatalysis[D]. Shanghai: Shanghai Normal University, 2020: 1-16. |
| [26] |
LIU J, DUAN C Q, ZHANG X H, et al. Subcellular distribution of chromium in accumulating plant Leersia hexandra Swartz[J]. Plant and Soil, 2009, 322: 187-195. DOI:10.1007/s11104-009-9907-2 |
| [27] |
任金秋, 凌新, 陆春海. 二氧化钛光催化剂还原六价铬的影响因素研究[J]. 山东化工, 2021, 50: 48-50, 53. REN J Q, LING X, LU C H. Affecting factors of the reduction of hexavalent chromium by titanium dioxide photocatalyst[J]. Shandong Chemical Industry, 2021, 50: 48-50, 53. |
 2022, Vol. 41
2022, Vol. 41