油田开采区多位于盐碱区域,长期的石油开采造成了大量的石油污染盐碱土壤[1],其修复治理研究备受关注。微生物修复是重要的石油烃污染土壤的修复方法,Pseudomonas、Arthrobacter、Alcaligenes、Coryne- bacterium、Flavobacterium、Achromobacter、Micrococcus、Nocardia以及Mycobacterium等高效石油烃降解菌株在以往研究中均有报道[1-2]。然而,上述微生物主要为非耐盐微生物,在盐碱环境中无法正常发挥降解作用。高盐环境中的石油烃降解只能通过耐盐或嗜盐的石油烃降解微生物来实现[3]。目前对耐盐石油烃降解菌的报道主要集中在Halomonas、Alcanivorax、Marinobacter、Haloferax、Haloarcula、Halobacterium等属中[4-5]。不同属来源的菌株对高盐的耐受及对石油烃的降解特性有较大差别,这些不同种属来源菌株的耐盐范围多集中在12%~25%[4-6],有些菌株对盐的耐受性更高[7],但降解污染物的最佳盐浓度多在5%~ 10%[4, 6],高盐会导致微生物的代谢活性降低而使降解效率下降[8]。
尽管国内外研究人员对高盐环境下石油烃的微生物降解过程进行了许多探索,但这些研究多针对石油烃的某些组分的降解[4, 9-10]。虽然也有嗜盐菌对原油降解研究的相关报道[7, 11],但未见盐度变化与嗜盐菌降解不同石油烃组分之间的相关性的研究。本文研究了胜利油田油泥中筛选出的一株盐单胞菌(Halomonas sp.1-3)的耐盐生长性能以及盐度变化对菌株降解石油烃的特性的影响,对我国部分油田的高聚、高黏石油烃降解修复具实际指导意义。
1 材料与方法 1.1 试验材料试验所用菌株分离自胜利油田孤岛采油厂产生的油泥。菌株经分离并纯化后,加入30%(V∶V)灭菌甘油,-80 ℃超低温保存。对其进行16S rDNA测序并在NCBI中通过Blast同源性比对,初步鉴定为盐单胞菌,命名为Halomonas sp.1-3。
试验用原油取自胜利油田孤岛采油厂,基本参数为:密度0.948 3 g·cm-3,运动黏度(50 ℃)309.5 mm2· s-1,蜡含量5.1%,庚烷沥青质含量3.2%。
石油烃(C10~C40)标准溶液:ρ=31 000 mg·L-1,各正构烷烃浓度均为1 000 mg·L-1,溶剂为正己烷,购自上海安谱试验科技股份有限公司。
1.2 培养基ONR7a培养基(人工模拟海水培养基)[12]:每升含NaCl 22.79 g、KCl 0.72 g、Na2SO4 3.98 g、TAPSO 1.30 g、NH4Cl 0.27 g、Na2HPO4·7H2O 0.72 g、NaBr 83 mg、NaHCO3 31 mg、H3BO3 27 mg、NaF 2.6 mg、MgCl2 · 6H2O 11.18 g、CaCl2·2H2O 1.46 g、SrCl2·6H2O 24 mg、FeSO4·7H2O 2.8 mg,其中NaCl的浓度根据1.3.2小节以及1.3.3小节的试验设计进行调整。
原油培养基:在250 mL锥形瓶中加入100 mL ONR7a培养基,添加终浓度为1%(m∶m)的原油,调节pH为7.2,121 ℃灭菌30 min。
菌种活化培养基:胰蛋白胨10 g、酵母提取物5 g、NaCl 100 g,蒸馏水定容至1 000 mL,121 ℃灭菌30 min。
1.3 试验方法 1.3.1 菌种活化从-80 ℃冰箱取出菌种,室温自然解冻后接种100 μL至100 mL灭菌的菌种活化培养基,置于30 ℃摇床中,150 r·min-1条件下活化培养48 h。
培养结束后菌液于4 ℃、8 000 r·min-1下离心5 min,弃上清液,收集菌体,再用灭菌的PBS溶液洗涤菌体2次,最后用灭菌PBS溶液重悬并稀释至OD600值为1.0(约7.2×107 CFU·mL-1),用于进行菌株的耐盐培养试验及石油烃降解试验。
1.3.2 Halomonas sp.1-3耐盐培养试验试验设置6个NaCl浓度梯度,以获取适宜菌株培养的NaCl浓度范围,调节原油培养基的NaCl终浓度分别为3%、6%、9%、12%、15%、18%,在100 mL培养基中接种5%(V∶V)活化并重悬后的菌种,30 ℃、150 r·min-1恒温摇床培养,每个处理设置3组平行,每隔12 h取样并测定600 nm波长下的吸光值。
1.3.3 Halomonas sp.1-3菌株在不同NaCl浓度条件下对石油烃的降解为研究菌株适宜降解石油烃的NaCl浓度范围,试验参照文献[13-14]选择5个NaCl浓度梯度进行。调节原油培养基的NaCl终浓度分别为1%、5%、10%、15% 和20%,100 mL培养基接入10% 活化并重悬的菌种,摇床中30 ℃、150 r·min-1条件下培养15 d,以不接菌为对照,每个处理设置3组平行,测定菌株在不同盐度条件下对石油烃的降解率及残留成分的组成。
1.3.4 Halomonas sp.1-3对石油烃表观降解率测定方法用25 mL二氯甲烷萃取降解体系中的石油烃,室温25 ℃、300 W条件下超声振荡10 min,置于分液漏斗中静置分层,取下层萃取液,上层溶液继续重复萃取2次后,混合3次萃取液并加入足量的无水硫酸钠脱水,抽滤去除硫酸钠,旋蒸至二氯甲烷完全挥发,室温放置2 d至恒质量,以不接菌的原油培养基的萃取油样为对照,质量法计算石油烃的表观降解率[15]:
降解率=(对照原油质量-处理原油质量)/对照原油质量×100%
此条件下石油烃的回收率为(98.72±0.87)%。
1.3.5 石油烃组分的测定样品按照1.3.4小节的方法萃取、脱水后,石油溶液旋蒸浓缩至约1 mL,转移至硅酸镁填料柱净化,12 mL正己烷淋洗净化柱,收集淋洗液,再次旋蒸浓缩并定容至1.0 mL。GC-MS(Agilent 7890A,美国)分析萃取液中的石油烃组分,色谱条件为:顶空进样器进样,HP-5苯基-甲基聚硅氧烷柱(30 m×0.25 mm×0.25 μm)色谱柱分离;初始柱温为50 ℃,保持2 min,然后以40 ℃·min-1的速率升至230 ℃,再以20 ℃·min-1的速率升至320 ℃保持20 min;载气(高纯N2)流速为1.5 mL·min-1,氢气流速30 mL·min-1,空气流速300 mL·min-1;进样口温度300 ℃,不分流进样;检测器温度325 ℃,进样量1 μL。按生态环境部标准《土壤和沉积物石油烃(C10-C40)的测定气相色谱法》(HJ 1021— 2019)中的方法进行结果分析和计算。
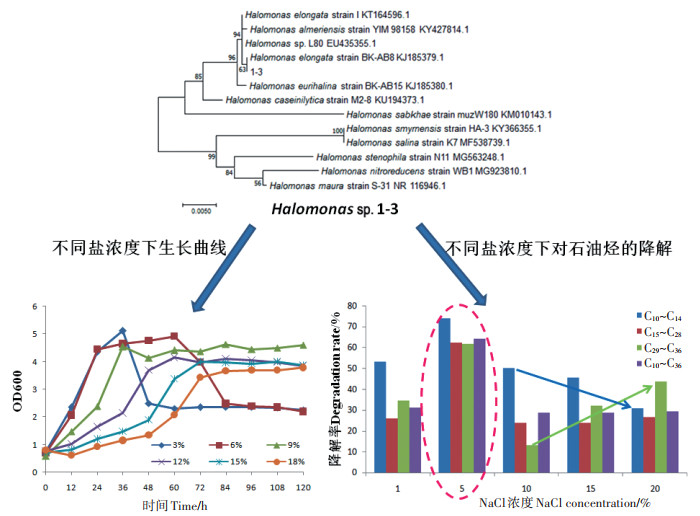
2 结果与讨论 2.1 菌株Halomonas sp.1-3耐盐生长特性利用MEGA 7.0.26软件Neighbor-joining法构建了该菌株基于16S rDNA序列同源性的系统发育树(图 1)。结果显示,与菌株序列相似性最高的为GeneBank中公布的伸长盐单胞菌Halomonas elongata strain BA-AB8KJ185379.1,初步鉴定该菌株为盐单胞菌,命名为Halomonas sp.1-3。
|
图 1 菌株Halomonas sp.1-3基于16s rDNA序列同源性构建的系统发育树 Figure 1 Phylogenetic tree of strain Halomonas sp.1-3 based on 16S rDNA sequence homology |
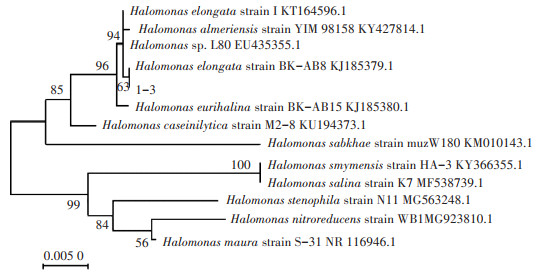
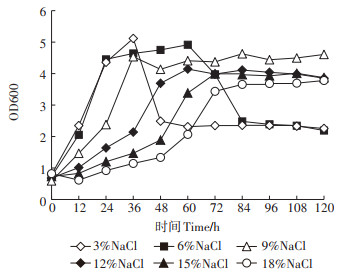
菌株Halomonas sp.1-3在不同NaCl浓度下的生长特征见图 2,由图 2可知,3% NaCl条件下培养时生长适应期较短,迅速进入对数生长期,36 h时菌体浓度达到最高,随后立即进入衰亡期,最终保持较低的菌体密度。在6%NaCl条件下,菌株在培养24~60 h时维持在稳定期,但60 h后菌密度迅速下降。从9% 开始,随着NaCl浓度的增加,延滞期逐渐延长,对数期的生长变慢,菌株培养达到稳定期的时间逐渐延长,但稳定期也更长。
|
图 2 Halomonas sp.1-3在不同NaCl浓度下的生长曲线 Figure 2 Growth curves of strain Halomonas sp. 1-3 in different NaCl concentration cultures |
嗜盐菌在低盐浓度条件下细胞内外离子浓度平衡被打破,细胞吸水膨胀,最终引起胞壁破裂,菌体自溶,细胞密度迅速下降。NEIFAR等[12]将Halomonas在10% NaCl的条件下培养,结果显示接种6 d后达到稳定期,而且稳定期能够持续较长时间,与本文结论一致。高盐度条件下细胞生理活性下降,菌体对高盐生长环境的适应期较长,延滞期延长[16]。
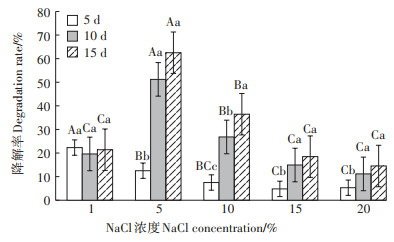
2.2 不同NaCl浓度条件下Halomonas sp.1-3对石油烃的表观降解在NaCl浓度1%~20% 范围内菌株Halomonas sp.1-3对石油烃的降解率随NaCl浓度的升高呈现先升高后降低的趋势,NaCl浓度为5% 时,15 d后的降解率最高,显著高于其他盐度和反应时间下的降解率(图 3)。NaCl浓度为1%时石油烃降解启动早,但不具有持续性,随着菌体的快速衰亡,降解过程迅速终止。NaCl浓度为5%~10% 时降解效率高,表明菌株在中盐度条件下对石油的降解效果最佳,与中等NaCl浓度条件下菌株繁殖迅速并能保持较高的细胞浓度的结果一致。黄中子等[17]也发现嗜盐菌对有机物的降解在NaCl浓度为5%左右时降解过程启动快,随着盐度的升高,降解过程启动延迟,终降解率逐渐降低。NaCl浓度大于10%时,菌株Halomonas sp.1-3对石油烃的降解率随NaCl浓度的升高而降低。高盐条件下虽然有较高的细胞浓度,但石油烃降解相关基因的表达受到抑制,导致嗜盐菌对石油烃的降解能力随着盐分的升高而降低[8]。WANG等[18]对嗜盐菌群在高盐环境下降解PAHs的研究也证明了降解代谢基因的转录水平随着盐度的增加而降低,高盐度会限制嗜盐菌群落中的微生物活性。
|
不同大写字母表示同一反应时间、不同NaCl浓度下的降解率具有显著差异,不同小写字母表示同一NaCl浓度、不同处理时间下的降解率具有显著差异(P < 0.05) Different uppercase letters indicate significant differences among treatments with different NaCl concentrations at the same time, and different lowercase letters indicate significant differences among treatments with the same NaCl concentration at different time(P < 0.05) 图 3 不同NaCl浓度条件下Halomonas sp.1-3对石油烃的降解 Figure 3 Petroleum- degradation by strain Halomonas sp.1-3 under different NaCl concentrations |
韦娜等[13]的研究结果显示,Halomonas elogata在盐度3%~25% 范围内对BRF的降解率随着盐度的升高先升后降,其中5% 盐度下的降解效果最佳,与本文结果一致。HADDADI等[14]研究Halomonas降解苯酚的性能时也得到类似结果,即7% NaCl浓度时苯酚的降解效率最高,降解率随着NaCl浓度的升高而降低,生物量也随之降低。
2.3 Halomonas sp.1-3对不同碳链长度石油烃的降解特征复杂污染场地中污染物的毒性取决于污染物的组合方式[19],因此研究菌株对石油烃不同组分的降解特性对其应用至关重要。菌株Halomonas sp.1-3在NaCl浓度为1%、5% 以及10% 条件下培养15 d后对不同碳链长度石油烃降解特性(图 4)表明,NaCl浓度为5%时石油烃中C10~C34的降解率在55%~85%,说明Halomonas sp.1-3底物范围较广,在石油污染修复方面具有较好的应用潜力。1% 和10% NaCl浓度时降解规律基本一致,对较短碳链(C10~C13)及较长碳链(C27~C32)的石油烃有较高的降解效率。MNIF等[4]研究了Halomonas对石油的降解,发现其降解范围广,中长链烃降解较完全,但中短碳链的石油烃(C14、C16、C18)有残留,与MOHAMMAD等[11]研究的Halomonas elongata对石油烃的降解特性有所差别。MOHAM- MAD等[11]发现该菌能首先完全利用短链烃(C11和C12)以及长链烃(C32和C33),中等链长的石油烃在培养过程的后期逐渐被去除。研究结果的差异可能是由于试验菌株虽然都属于盐单胞菌属,但不同的菌种来源对石油烃降解有差异。原油性质差别也可能对降解过程产生影响,本文所用石油样品黏度大、胶质含量高,对生物降解会产生不利影响。
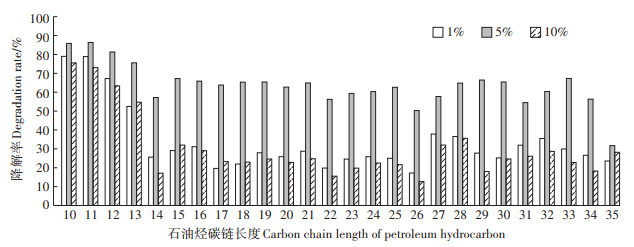
|
图 4 菌株Halomonas sp.1-3对不同碳链长度石油烃的降解特性 Figure 4 Degradation characteristics of petroleum hydrocarbons with different carbon numbers by Halomonas sp.1-3 |
另外,本研究发现,菌株Halomonas sp.1-3对石油烃降解初期会形成中间产物的明显积累,由于石油组分复杂,中间产物引起的生物毒性的变化会影响生物修复的效果,因此在应用该菌株进行生物修复时,在考虑最适宜生物处理条件的同时,还要延长修复时间,使石油烃尽可能完全降解。
2.4 Halomonas sp.1-3对石油烃不同馏分分段的降解参考美国总石油烃标准工作组对石油烃组分的划分,以及国内学者结合我国国情对石油烃污染风险控制综合因素的考虑[20],本研究对石油烃的碳链长度分段并对不同NaCl浓度下降解特性进行分析。结果显示(图 5),菌株Halomonas sp.1-3对石油烃降解15 d后,NaCl浓度为5% 时各分段石油烃的降解率均最高,显著高于其他NaCl浓度时相应碳链长度分段石油烃的降解率,总降解率达到63.5%。当NaCl在10%~20% 范围时,C10~C14较短碳链的石油烃降解率随着盐浓度的升高呈下降趋势,C15~C28中长链石油烃的降解率差异不显著,而C29~C36长链石油烃降解率呈上升趋势。文献中未见NaCl浓度升高对不同石油烃馏分分段降解影响的报道,但黄新颜等[21]研究NaCl对沥青的侵蚀时发现,高盐导致饱和分、芳香分、胶质减少,认为沥青中羧酸类和酚类等轻质含氧化合物在盐离子溶液中会发生一定的溶解和电离,羧酸与Na+、K+等碱金属离子生成的低价高级有机酸钾盐和钠盐属于典型的皂类化合物,易溶于水,导致其生物有效性提高。因此,本文中高NaCl浓度下中长碳链的石油烃的降解率升高可能与其生物有效性的提高有关。

|
不同大写字母表示同一馏分分段、不同NaCl浓度下的降解率具有显著差异,不同小写字母表示同一NaCl浓度、不同馏分分段的降解率具有显著差异(P < 0.05) Different uppercase letters indicate significant differences of same fraction under different NaCl concentrations, and different lowercase letters indicate significant differences of different fractions under the same NaCl concentration(P < 0.05) 图 5 菌株Halomonas sp.1-3对石油烃不同馏分分段降解 Figure 5 Degradation performance of petroleum hydrocarbons fractions by Halomonas sp.1-3 |
(1)为较快获得降解菌Halomonas sp.1-3且保持在培养液中的稳定性,该菌适宜在ONR7a培养基中NaCl浓度为9%~15% 条件下进行培养,培养时添加质量分数为1%的原油。
(2)降解菌Halomonas sp.1-3在NaCl浓度为5%~ 10% 时对石油烃降解效率较高,且能持续有效降解,其中NaCl浓度5%时菌株对石油烃的降解效率最高。
(3)降解菌Halomonas sp.1-3对C10~C35的石油烃均有降解能力,且随着NaCl浓度的升高,短链的石油烃(C10~C14)降解效率降低,而长链石油烃(C29~C36)的降解效率逐渐升高。
| [1] |
FATHEPURE B Z. Recent studies in microbial degradation of petroleum hydrocarbons in hypersaline environments[J]. Frontiers in Microbiology, 2014, 5: 173. |
| [2] |
DAS N, CHANDRAN P. Microbial degradation of petroleum hydrocarbon contaminants: An overview[J]. Biotechnology Research International, 2010, 2011: 941810. |
| [3] |
HAO R X, LU A H, et al. Biodegradation of heavy oils by halophilic bacterium[J]. Progress in Natural Science, 2009, 19(8): 101-105. |
| [4] |
MNIF S, CHAMKHA M, SAYADI S. Isolation and characterization of Halomonas sp. strain C2SS100, a hydrocarbon-degrading bacterium under hypersaline conditions[J]. Journal of Applied Microbiology, 2009, 107(3): 785-794. DOI:10.1111/j.1365-2672.2009.04251.x |
| [5] |
HASSANSHAHIAN M, BOROUJENI N A. Enrichment and identification of naphthalene-degrading bacteria from the Persian Gulf[J]. Marine Pollution Bulletin, 2016, 107(1): 59-65. DOI:10.1016/j.marpolbul.2016.04.020 |
| [6] |
AL-MAILEM D M, ELIYAS M, RADWAN S S. Oil-bioremediation potential of two hydrocarbonoclastic, diazotrophic Marinobacter strains from hypersaline areas along the Arabian Gulf coasts[J]. Extremophiles, 2013, 17(3): 463-470. DOI:10.1007/s00792-013-0530-z |
| [7] |
AL-MAILEM D M, SORKHOH N A, AL-AWADHI H, et al. Biodegradation of crude oil and pure hydrocarbons by extreme halophilic archaea from hypersaline coasts of the Arabian Gulf[J]. Extremophiles, 2010, 14(3): 321-328. DOI:10.1007/s00792-010-0312-9 |
| [8] |
SANTOS H F, CARMO F L, PAES J E S, et al. Bioremediation of mangroves impacted by petroleum[J]. Water, Air, & Soil Pollution, 2011, 216(1/2/3/4): 329-350. |
| [9] |
DASTGHEIB S, AMOOZEGAR M A, KHAJEH K, et al. A halotolerant Alcanivorax sp. strain with potential application in saline soil remediation[J]. Applied Microbiology & Biotechnology, 2011, 90(1): 305-312. |
| [10] |
TAPILATU Y H, GROSSI V, ACQUAVIVA M, et al. Isolation of hydrocarbon-degrading extremely halophilic archaea from an uncontaminated hypersaline pond(Camargue, France)[J]. Extremophiles, 2010, 14(2): 225-231. DOI:10.1007/s00792-010-0301-z |
| [11] |
MOHAMMAD R A, MOSLEM P. Biodegradation of crude oil by Halomonas elongata strain KWPA-12:A moderately halophilic strain detected in oil spills around Garo sulfidic springs, MIS Oilfield, Iran[J]. Energy, Ecology and Environment, 2019, 4(1): 26-36. DOI:10.1007/s40974-018-0107-x |
| [12] |
NEIFAR M, CHOUCHANE H, NAJJARI A, et al. Genome analysis provides insights into crude oil degradation and biosurfactant production by extremely halotolerant Halomonas desertis G11 isolated from Chott El-Djerid salt-lake in Tunisian desert[J]. Genomics, 2019, 111(6): 1802-1814. DOI:10.1016/j.ygeno.2018.12.003 |
| [13] |
韦娜, 张前前, 杜宗军, 等. 极端嗜盐菌Halomonas elogata的分离鉴定及其降解偶氮染料活性兰BRF的条件优化研究[J]. 环境科学学报, 2012, 32(9): 2091-2096. WEI N, ZHANG Q Q, DU Z J, et al. Isolation and identification of halophilic bacteria strain Halomonas elogata and its application on degradation of an azo dye Reactive Blue BRF[J]. Acta Scientiae Circumstantiae, 2012, 32(9): 2091-2096. |
| [14] |
HADDADI A, SHAVANDI M. Biodegradation of phenol in hypersaline conditions by Halomonas sp. strain PH2-2 isolated from saline soil[J]. International Biodeterioration & Biodegradation, 2013, 85: 29-34. |
| [15] |
WANG X, CAI Z, ZHOU Q, et al. Bioelectrochemical stimulation of petroleum hydrocarbon degradation in saline soil using U-tube microbial fuel cells[J]. Biotechnology and Bioengineering, 2012, 109(2): 426-433. DOI:10.1002/bit.23351 |
| [16] |
李向园, 杨茂华, 穆廷桢, 等. 一株嗜盐嗜碱硫氧化菌的筛选、鉴定及硫氧化特性[J]. 微生物学通报, 2020, 47(8): 2372-2381. LI X Y, YANG M H, MU T Z, et al. Screening, identification and sulfide oxidation characteristics of a haloalkaliphilic sulfur oxidizing bacterium[J]. Microbiology China, 2020, 47(8): 2372-2381. |
| [17] |
黄中子, 李辉, 刘勇弟, 等. 一株中度嗜盐菌Virgibacillu sp. PDBF2对苯酚的降解特性[J]. 环境科学与技术, 2015, 38(12): 1-5. HUANG Z Z, LI H, LIU Y D, et al. Characteristics of phenol biodegradation by a moderately halophilic bacterium Virgibacillu sp. PDB-F2[J]. Environmental Science & Technology, 2015, 38(12): 1-5. |
| [18] |
WANG C, HUANG Y, ZHANG Z, et al. Salinity effect on the metabolic pathway and microbial function in phenanthrene degradation by a halophilic consortium[J]. AMB Express, 2018, 8(1): 1-13. DOI:10.1186/s13568-017-0531-x |
| [19] |
ZHOU Q, CHENG Y, ZHANG Q, et al. Quantitative analyses of relationships between ecotoxicological effects and combined pollution[J]. Science in China Ser. C, 2004, 47(4): 332-339. DOI:10.1360/03yc0042 |
| [20] |
曹云者, 李发生. 基于风险的石油烃污染土壤环境管理与标准值确立方法[J]. 农业环境科学学报, 2010, 29(7): 1225-1231. CAO Y Z, LI F S. Risk-based environmental management of petroleum hydrocarbons contaminated soil and development of standards: A review[J]. Journal of Agro-Environment Science, 2010, 29(7): 1225-1231. |
| [21] |
黄新颜, 沙爱民, 蒋玮, 等. 盐分侵蚀对沥青和混合料性能影响及作用机理[J]. 长安大学学报(自然科学版), 2017, 37(3): 33-38, 46. HUANG X Y, SHA A M, JIANG W, et al. Effect and mechanism of salt erosion on performance of bitumen and asphalt mixtures[J]. Journal of Chang' an University(Natural Science Edition), 2017, 37(3): 33-38, 46. DOI:10.3969/j.issn.1671-8879.2017.03.005 |
 2022, Vol. 41
2022, Vol. 41


