2. 南京信息工程大学应用气象学院,南京 210044
2. School of Applied Meteorology, Nanjing University of Information Science & Technology, Nanjing 210044, China
施用氮肥是保证作物高产的必要措施,外源氮进入土壤后的形态转化过程显著影响氮肥利用率。土壤中每一种氮素形态的输入和输出有多种途径,自然条件下土壤中各种形态氮的净转化速率是控制各个氮转化过程的初级转化速率的综合结果[1-2]。测定净转化速率和初级转化速率具有不同的意义,净转化速率可以指示土壤无机氮的供应水平以及硝态氮淋溶或氨挥发的潜在风险,而初级转化速率能够阐明土壤无机氮含量变化的具体过程[3]。
已有研究表明,土壤氮素转化过程受土地利用方式、耕作措施、施肥、温度等因素的影响[4-6],这些因素通过改变土壤中与氮转化相关的微生物群落结构和活性来影响土壤氮转化速率。前期研究发现,不同水分条件下东北黑土N2O的排放差异明显[7-8],这可能是由于水分变化影响了土壤中硝化、反硝化底物的运移和氧气供应[9-11],进而影响控制N2O排放的微生物参与的硝化、反硝化过程。研究表明,非饱和水分条件下土壤初级氮矿化速率通常随着水分含量的增加而增加。NISHIO等[12]报道,农田土壤初级氮矿化速率随着土壤含水量(40%~60%WHC)的增加而增加。SUN等[13]也发现,土壤水分含量从30%WFPS(孔隙含水量)增加到60%WFPS使得林地土壤初级氮矿化速率增加了2.5倍,铵态氮固定速率增加了1.5倍。然而,也有研究报道[14-15],非饱和水分条件下土壤水分含量变化对草地土壤(65%~100%WHC)和林地土壤(30%~90%WHC)的初级氮矿化速率和初级氮固定速率没有显著影响。与非饱和水分条件相比,淹水增加了土壤pH值,土壤有机质分解速率加快[16],土壤初级氮矿化速率也随之增加。MATHIEU等[17]报道,150%WHC水分条件下农田土壤初级氮矿化速率高于75%WHC水分条件下。BURTON等[18]针对林地土壤的研究也表明,相比于65%WHC的好气条件,淹水显著提高了土壤初级氮矿化速率。硝化速率通常随土壤水分含量增加而增加,但当土壤含水量达到一定程度后,含水量的进一步增加反而会降低硝化速率[19-20]。研究发现,当土壤水分含量从30%WFPS增加到60%WFPS时,温带森林土的初级硝化速率显著增加[12],酸性农田土壤的初级硝化速率对水分含量的变化(50%~70%WFPS)具有显著正响应[21]。然而,有研究表明,在65%~100%WHC水分范围内,土壤水分含量增加对中性和碱性水稻土的初级硝化速率没有显著影响[22],高原土壤和草地土壤的初级硝化速率对土壤水分含量变化(50%~100%WHC)的响应非常微弱[23-24]。不同类型土壤初级氮转化速率对水分变化的响应差异可能与土壤所含碳源的差异有关。有研究指出[9, 13],土壤有效碳数量和质量显著影响土壤微生物的活性及由微生物参与的生物化学转化过程,在碳源丰富的土壤中,微生物可以利用的有效碳含量高,其活性不受碳源限制,如果水分条件有所改善,微生物活性进一步增强,由其参与的初级氮转化速率对水分的响应程度增大。由此可见,水分含量变化对土壤初级氮转化速率的影响可能与土壤类型有关,相关影响机制还需要进一步研究。
砂壤土是黑龙江省西部粮食主产区齐齐哈尔市的主要土壤类型之一,砂粒含量高,保水保肥性能差,土壤水分状况是限制当地农作物高产的主要因素。虽然该地区属于半干旱气候,全年大部分时间土壤水分含量低,但短期强降雨仍有可能造成低洼地区的土壤短期处于浅层淹水状态。目前关于水分含量变化对砂壤土初级氮转化速率的影响研究鲜有报道。因此,本研究以齐齐哈尔市的农田砂壤土为对象,利用15N同位素双标记技术结合FLUAZ模型开展室内培养试验,以期明确不同水分含量对土壤初级氮转化速率的影响,研究结果对于黑龙江省半干旱地区农田水分管理和合理施肥具有指导意义。
1 材料与方法 1.1 土样采集供试土壤采自黑龙江省齐齐哈尔市泰来县。齐齐哈尔市属于温带半干旱大陆性季风气候[4],耕作土壤主要为砂壤土。2019年秋季采集耕层土壤(0~20 cm),其基本理化性质为:土壤pH值为7.27,田间最大持水量为39.3%,有机碳和全氮含量分别为14.6 g·kg-1和1.13 g·kg-1,碳氮比为12.9,水溶性有机碳和水溶性有机氮含量分别为154 mg·kg-1和16.4 mg·kg-1,铵态氮和硝态氮含量分别为1.78 mg·kg-1和9.68 mg·kg-1,砂粒、粉粒和黏粒含量分别为80.5%、11.1%和8.4%。
1.2 试验设计本研究利用15N同位素双标记技术开展室内培养试验,试验设置60%WHC、100%WHC和淹水3个水分处理。分别称取30 g(烘干基)新鲜土壤于90个(3个水分处理×2个15N标记处理×3次重复×5次取样)250 mL三角瓶中,用移液管向其中45瓶土壤中均匀加入1 mL 15N标记的15NH4NO3溶液(标记丰度为5% atom),其余45瓶土壤中均匀加入1 mL 15N标记的NH415NO3溶液(标记丰度为5% atom),所添加的铵态氮和硝态氮含量均为30 mg·kg-1。两批45瓶土壤添加15N标记溶液后各分为3组,第一组土壤水分含量调至60%WHC,第二组土壤水分含量调至100%WHC,第三组加入40 mL去离子水使土壤保持淹水1 cm。将三角瓶用锡纸封口并扎5个洞以利于通气,所有土壤样品置于25 ℃恒温培养箱中黑暗培养7 d。培养期间每日去除锡纸通气30 min保持好氧状态,每隔1 d补充蒸发损失的水分以维持设定含水量。在添加15N标记溶液后的第0、1、3、5、7 d(分为d0~d1、d1~d3、d3~d5、d5~d7 4个时间段),每个水分处理及15N标记处理分别随机选取3瓶土壤作为重复,加入2 mol·L-1的KCl溶液(液土比为2.5∶1),振荡提取1 h后过滤,测定滤液中的铵态氮和硝态氮浓度及15N丰度。用去离子水洗去过滤后土壤样品中残留的KCl,土壤烘干磨细后测定有机氮含量及15N丰度。
1.3 样品分析土壤基本理化性质的测定参照文献[4, 25-26]的方法,土壤无机氮和有机氮的15N丰度采用同位素质谱仪测定[2]。
1.4 数据分析土壤初级氮转化速率采用FLUAZ模型计算得出[4, 27],采用Origin 9和SPSS 22.0软件进行绘图、数据处理和统计分析。
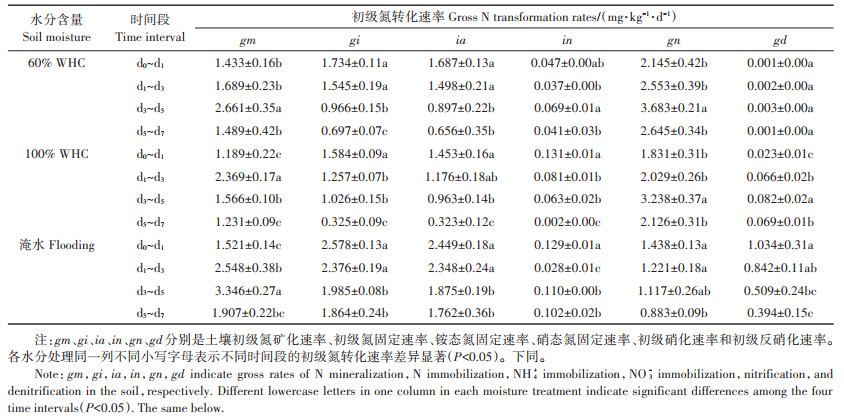
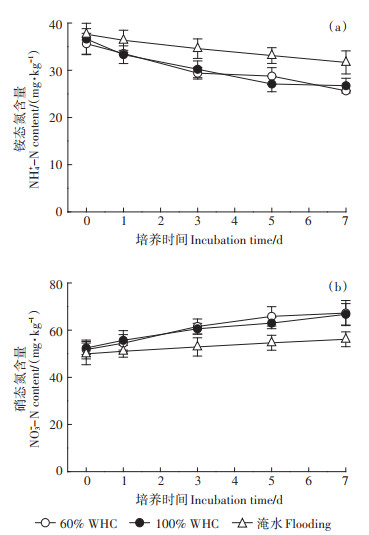
2 结果与分析 2.1 土壤中无机氮含量的动态变化不同水分含量下土壤中无机氮含量的动态变化如图 1所示。随着培养时间的推进,各水分处理的铵态氮含量逐渐下降,硝态氮含量逐渐增加。60%WHC处理与100%WHC处理下土壤铵态氮和硝态氮含量没有显著差异(P>0.05),但是淹水处理土壤铵态氮含量在各取样时间都高于60%WHC处理,硝态氮含量在各取样时间都低于60%WHC处理,这种差异在培养后第3、5、7 d达显著水平(P < 0.05)。
|
图 1 不同水分下土壤无机氮含量的动态变化 Figure 1 Dynamic changes of inorganic N contents in soil under different moisture contents |
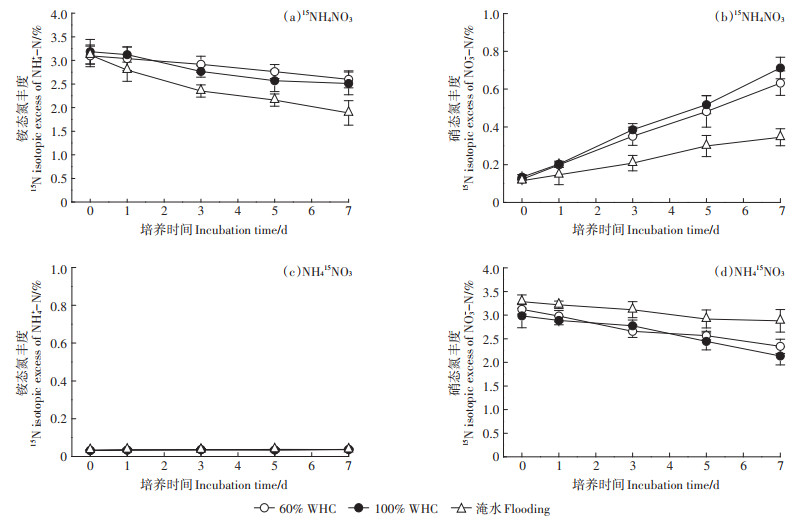
不同水分含量下土壤无机氮15N丰度的动态变化如图 2所示。15NH4NO3标记的土壤样品中,随着培养的进行,3个水分处理土壤铵态氮的15N丰度逐渐下降(图 2a),硝态氮的15N丰度逐渐增加(图 2b)。与60%WHC处理相比,100%WHC处理土壤铵态氮和硝态氮的15N丰度没有显著变化(P>0.05),随培养时间的延长,淹水处理土壤无机氮的15N丰度显著低于60%WHC和100%WHC处理(P < 0.05)。NH415NO3标记的土壤样品中,3个水分处理土壤铵态氮的15N丰度均接近自然丰度,处理间没有显著差异(P>0.05)(图 2c),各处理土壤硝态氮的15N丰度逐渐下降(图 2d),60%WHC和100%WHC处理土壤硝态氮的15N丰度没有显著差异(P>0.05),但下降幅度大于淹水处理。
|
图 2 不同水分下土壤中无机氮15N丰度的动态变化 Figure 2 Dynamic changes of 15N isotopic excess of inorganic N in soil under different moisture contents |
不同水分含量下土壤初级氮矿化速率(gm)都表现为随培养的进行先增加后下降,培养第1 d土壤初级氮固定速率(gi)就达到峰值,然后随着培养时间的延长逐渐降低(表 1)。培养7 d内,100%WHC处理的gm和gi分别为1.65、0.97 mg·kg-1·d-1(以N计,下同),与60%WHC处理的gm(1.87 mg·kg-1·d-1)和gi(1.16 mg·kg-1·d-1)没有显著差异(P>0.05)(图 3)。而淹水处理的gm和gi分别为2.45 mg·kg-1·d-1和2.15 mg· kg-1·d-1,分别是60%WHC处理的1.31倍和1.85倍(图 3)。由表 1可知,微生物主要固定土壤中的铵态氮(ia),对硝态氮的固定速率(in)很低。60%WHC和100%WHC下土壤初级硝化速率(gn)随着培养时间的进行先增加后降低,于3~5 d达到峰值,而淹水条件下gn则表现为随着培养时间的延长逐渐降低(表 1)。60%WHC和100%WHC水分处理土壤gn(2.84 mg·kg-1·d-1和2.57 mg·kg-1·d-1)间无显著差异(P> 0.05),但却显著高于淹水处理的gn(1.18 mg·kg-1·d-1)(P < 0.05)(图 3)。60%WHC和100%WHC下土壤中的反硝化作用很弱,可以忽略不计,而淹水处理促进了反硝化作用的发生,平均初级反硝化速率(gd)为0.65 mg·kg-1·d-1(表 1、图 3)。
|
|
表 1 不同水分下土壤初级氮转化速率的动态变化 Table 1 Dynamic changes of gross N transformation rates in soil under different moisture contents |
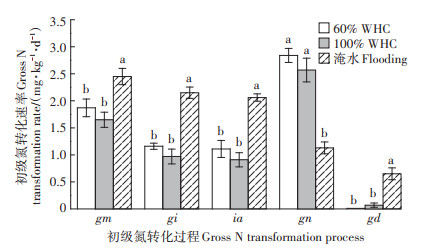
|
图中不同小写字母表示各处理间差异显著(P < 0.05)。下同 Different lowercase letters indicate significant difference among the three treatments(P < 0.05). The same below 图 3 不同水分下土壤平均初级氮转化速率 Figure 3 Average gross N transformation rates in soil under different moisture contents |
60%WHC和100%WHC处理的gn/ia值分别为2.56和2.82,两者之间无显著差异(P>0.05),而淹水处理的gn/ia值为0.55,显著低于60%WHC和100%WHC处理(P < 0.05)(图 4)。60%WHC和100%WHC处理的gm/gi值分别为1.61和1.70,两者之间无显著差异(P>0.05),淹水处理的gm/gi值为1.14,显著低于60%WHC和100%WHC处理(P < 0.05)(图 4)。
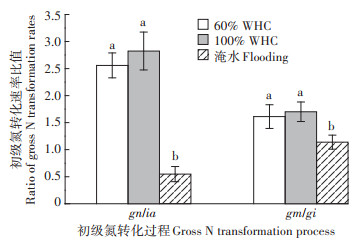
|
图 4 不同水分下土壤初级氮转化速率间的比值 Figure 4 Ratio of gross N transformation rates in soils under different moisture contents |
土壤水分含量会影响土壤氧气含量、微生物数量和活性以及底物的运移,进而影响土壤氮素转化过程[9, 28-29]。有研究指出,土壤含水量低时,孔隙空间的弯曲度增加,土壤颗粒附近水的黏度加大,从而限制了底物向微生物的扩散[30]。BUTCHER等[31]报道,砂壤土水分含量低于田间持水量时,土壤初级氮矿化速率和初级氮固定速率主要受底物运移的影响。本研究结果表明,60%WHC和100%WHC处理间土壤初级氮矿化速率和初级氮固定速率无显著差异,说明土壤水分从60%WHC增加到100%WHC后可能没有显著增加底物向微生物的扩散和移动,具体原因还需进行深入研究。CHENG等[14]研究指出,水分含量从65%WHC增加到100%WHC对林地和草地土壤初级氮矿化速率和初级氮固定速率没有显著影响。GUN-TIÑAS等[32]也报道,水分含量从40%WHC增加到100%WHC对农田和草地土壤初级氮矿化速率没有影响,这与本研究结果一致。但也有研究指出[11, 23, 33],土壤水分含量在40%~100%WHC范围内时,林地和草地土壤初级氮矿化速率和初级氮固定速率随着水分含量的增加而增加。这些研究结果表明,不同土壤的初级氮矿化速率和初级氮固定速率对水分变化的响应程度不同,主要原因可能与土壤养分含量尤其是有效碳含量的差异有关[9]。如果土壤有效碳含量高,为微生物提供的能量和底物多,微生物数量和活性很高,此时碳源不是限制微生物活性的主要因素,水分条件的改善可以进一步提高微生物的数量和活性,进而增加土壤初级氮矿化速率[13]。
与60%WHC处理相比,淹水处理土壤初级氮矿化速率是60%WHC处理的1.31倍(图 3)。ZHANG等[34]研究了60%WHC和饱和水分条件下不同施肥方式土壤的氮保存机制,发现饱和水分条件下土壤初级氮矿化速率是60%WHC条件下的1.5倍之多,本文的结果与之相近。MATHIEU等[17]研究法国东部农业土壤初级氮转化速率时也发现,饱和水分条件下土壤初级氮矿化速率显著高于不饱和水分处理。饱和水分条件下土壤有机质分解产生的还原性物质使得土壤中高价铁、锰被还原,此过程消耗了溶液中的氢离子,导致土壤pH有所升高,由此改善了土壤微生物的生存条件,这可能是土壤初级氮矿化速率增加的一个原因[34-35]。此外,土壤淹水后一些好气性微生物死亡分解产生氨基酸、甘油和含氮化合物,为存活微生物提供了可利用的碳氮底物,促进了微生物的生长和繁殖,也会导致初级氮矿化速率显著增加[17]。淹水处理相对于60%WHC处理对土壤初级氮固定速率的影响与初级氮矿化速率相同,这与其他研究所报道的初级氮固定速率随着水分含量增加而显著增加的结果相一致[13, 34, 36]。但是本研究结果也显示,淹水处理土壤初级氮固定速率是60%WHC处理的1.85倍,增幅大于初级氮矿化速率。可能的原因是参与氮矿化过程的微生物可以利用复杂的有机碳底物,而参与固定过程的微生物主要利用简单易分解的有效碳[37-38],土壤淹水后死亡微生物释放的溶解性碳为氮固定提供了底物,进而促进氮固定过程的进行[11, 28]。
在一定水分含量范围内,硝化速率随水分含量的增加而增加,当土壤水分趋于饱和时,硝化速率显著降低[20]。本研究中60%WHC和100%WHC处理间土壤初级硝化速率没有显著差异,说明在60%WHC和100%WHC条件下水分不是限制砂壤土硝化微生物活性的主要因素。CHENG等[14]研究发现水分含量从65%WHC增加到100%WHC不影响草地土壤初级硝化速率,ZAMAN等[23]也报道苜蓿土壤的初级硝化速率在50%WHC和100%WHC水分条件下没有显著差异,这与本研究结果一致。然而前述研究也发现,水分含量的增加显著提高了林地[14]和黑麦草地[23]土壤的初级硝化速率。适合硝化作用发生的最适水分含量取决于土壤孔隙度、土壤容重和土壤类型[39],因此水分变化对初级硝化速率的影响取决于土壤类型。与60%WHC处理相比,淹水处理显著抑制了硝化作用的进行,这与ZHANG等[34]的研究结论一致。硝化微生物是好气微生物,土壤淹水抑制了氧气向土壤中的扩散和运移,不利于硝化细菌的生长和繁殖。此外,淹水促进了土壤中铵态氮的生物固定,铵态氮固定作用和硝化作用是两个互相竞争底物的过程,铵态氮固定速率的增加势必会减少硝化作用底物的数量,进而导致硝化速率降低。
一般认为,反硝化作用是一个在嫌气条件下进行的微生物学过程,因而受到土壤水分和通气状况的制约[40],土壤水分主要通过控制氧气状况和底物的运移来影响反硝化作用的进行[41]。研究指出,土壤水分对反硝化作用的影响存在一个临界含水量,当土壤含水量大于此临界值时,水分含量的增加可以显著提高反硝化速率;当土壤含水量低于此临界值时,水分含量的变化对反硝化速率没有影响[42]。本研究中土壤水分含量从60%WHC增加到100%WHC时并没有促进反硝化作用的发生,说明100%WHC没有达到砂壤土发生反硝化作用的临界含水量。淹水减少了土壤中的氧气含量,促进了反硝化作用的进行。
在没有作物参与的条件下,土壤中铵态氮的损耗包括硝化和微生物固定两方面。初级硝化速率与初级铵态氮固定速率的比值(gn/ia)可以用来衡量土壤中硝态氮的产生潜势和淋溶风险[43]。如果gn/ia值大于1,说明硝化作用是铵态氮的主要去向,土壤中容易发生硝态氮的淋溶损失;如果gn/ia值小于1,说明铵态氮主要被微生物固定为有机态氮,有利于土壤无机氮的保存和周转[43]。初级氮矿化速率与初级氮固定速率比值(gm/gi)通常用来衡量矿化过程与固定过程的耦合程度,如果gm/gi值接近1,说明有机氮的矿化和无机氮的固定过程紧密偶联,不会为硝化作用的发生提供大量底物[44]。本研究中,60%WHC和100%WHC处理的gn/ia值和gm/gi值都大于1,而淹水处理的gn/ia值小于1,且gm/gi值接近1,说明60%WHC和100%WHC水分条件下砂壤土有机氮矿化产生的铵态氮只有少部分被微生物固定,大量未被固定的铵态氮为硝化过程提供了充足的底物,硝化作用产生的硝态氮容易在短期强降雨或者灌溉时经淋溶或反硝化的途径损失[4]。
本研究结果对于半干旱地区砂壤土施肥和水分管理具有一定指导意义。与淹水条件相比,水分非饱和条件下砂壤土较高的硝化速率和较低的固定速率表明,实际农业生产中氮肥应该少量多次施用,以减少氮素的淋溶损失。而淹水条件下砂壤土的有机氮矿化速率和固定速率都显著提高且密切偶联,铵态氮主要被微生物固定,利于土壤氮的供应、保持和周转;而且淹水抑制了土壤中硝化作用的发生,降低了硝态氮的产生潜势和氮素淋溶损失的风险。因此,在降雨量较少的黑龙江省半干旱地区,实际农业生产中适度增加灌溉不仅可以满足作物对水分的需求,还有利于氮肥在土壤中的保持和周转。值得注意的是,淹水促进了反硝化作用的发生。农田灌溉时要防止漫灌,同时避免短期强降雨造成低洼地区淹涝的发生,今后还应加强N2O排放量的监测以综合评估水分状况变化对砂壤土氮素转化的影响及其环境效应。
4 结论(1)水分含量从60%WHC(田间最大持水量)增加到100%WHC不影响砂壤土初级氮转化速率。
(2)60%WHC和100%WHC水分条件下砂壤土中有机氮矿化速率大于无机氮固定速率,且矿化产生的铵态氮主要被微生物硝化,容易导致硝态氮的积累和淋溶风险的增加。
(3)相比于非饱和水分处理,淹水处理显著促进了土壤中氮素的周转,矿化和固定过程偶联紧密,而且初级硝化速率显著降低,减少了硝态氮的产生和氮淋溶损失,但初级反硝化速率显著增加可能会导致N2O的大量排放。
| [1] |
DI H J, CAMERON K C, MCLAREN R G. Isotopic dilution methods to determine the gross transformation rates of nitrogen, phosphorus, and sulfur in soil: A review of the theory, methodologies, and limitations[J]. Australian Journal of Soil Research, 2000, 38: 213-230. DOI:10.1071/SR99005 |
| [2] |
李平, 郎漫. 开垦年限对黑土氮初级转化速率和净转化速率的影响[J]. 土壤学报, 2020, 57(1): 165-173. LI P, LANG M. Effect of cultivation on gross and net N transformation rates in black soil relative to duration[J]. Acta Pedologica Sinica, 2020, 57(1): 165-173. |
| [3] |
MÜLLER C, RÜTTING T, KATTGE J, et al. Estimation of parameters in complex 15N tracing models by Monte Carlo sampling[J]. Soil Biology and Biochemistry, 2007, 39: 715-726. DOI:10.1016/j.soilbio.2006.09.021 |
| [4] |
郎漫, 李平, 魏玮. 温度对农田黑土氮初级转化速率的影响[J]. 农业环境科学学报, 2021, 40(4): 815-822. LANG M, LI P, WEI W. Effect of temperature on gross N transformation rates in cropland black soil[J]. Journal of Agro-Environment Science, 2021, 40(4): 815-822. |
| [5] |
GÓMEZ-REY M X, COUTO-VÁZQUEZ A, GONZÁLEZ-PRIETO S J. Nitrogen transformation rates and nutrient availability under conventional plough and conservation tillage[J]. Soil & Tillage Research, 2012, 124: 144-152. |
| [6] |
LANG M, LI P, HAN X Z, et al. Gross nitrogen transformations in black soil under different land uses and management systems[J]. Biology and Fertility of Soils, 2016, 52(2): 233-241. DOI:10.1007/s00374-015-1070-8 |
| [7] |
郎漫, 李平, 李淼, 等. 浅层淹水条件下不同施肥处理对黑土温室气体排放的影响[J]. 中国环境科学, 2019, 39(6): 2506-2513. LANG M, LI P, LI M, et al. Effects of different fertilization treatments on greenhouse gas emissions from black soil under shallow flooding condition[J]. China Environmental Science, 2019, 39(6): 2506-2513. DOI:10.3969/j.issn.1000-6923.2019.06.033 |
| [8] |
李平, 郎漫, 李淼, 等. 不同施肥处理对东北黑土温室气体排放的短期影响[J]. 环境科学, 2018, 39(5): 2360-2367. LI P, LANG M, LI M, et al. Short-term effects of different fertilization treatments on greenhouse gas emissions from northeast black soil[J]. Environmental Science, 2018, 39(5): 2360-2367. |
| [9] |
GLEESON D B, MÜLLER C, BANERJEE S, et al. Response of ammonia oxidizing archaea and bacteria to changing water filled pore space[J]. Soil Biology and Biochemistry, 2010, 42: 1888-1891. DOI:10.1016/j.soilbio.2010.06.020 |
| [10] |
LIU R, HAYDEN H L, SUTER H, et al. The effect of temperature and moisture on the source of N2O and contributions from ammonia oxidizers in an agricultural soil[J]. Biology and Fertility of Soils, 2016, 53: 141-152. |
| [11] |
REX D, CLOUGH T J, LANIGAN G J, et al. Gross N transformations vary with soil moisture and time following urea deposition to a pasture soil[J]. Geoderma, 2021, 386: 114904. DOI:10.1016/j.geoderma.2020.114904 |
| [12] |
NISHIO T, KANAMORJ T, FUJIMOTO T. Nitrogen transformations in an aerobic soil as determined by a 15NH4+ dilution technique[J]. Soil Biology and Biochemistry, 1985, 17(2): 149-154. DOI:10.1016/0038-0717(85)90106-3 |
| [13] |
SUN L F, XIA Z W, SANG C P, et al. Soil resource status affects the responses of nitrogen processes to changes in temperature and moisture[J]. Biology and Fertility of Soils, 2019, 55: 629-641. DOI:10.1007/s00374-019-01379-2 |
| [14] |
CHENG Y, CAI Z C, ZHANG J B, et al. Soil moisture effects on gross nitrification differ between adjacent grassland and forested soils in central Alberta, Canada[J]. Plant and Soil, 2012, 352(1/2): 289-301. |
| [15] |
CHENG Y, WANG J, WANG S Q, et al. Effects of soil moisture on gross N transformations and N2O emission in acid subtropical forest soils[J]. Biology and Fertility of Soils, 2014, 50(7): 1099-1108. DOI:10.1007/s00374-014-0930-y |
| [16] |
OLIVIER C D, WILLIAM R H. Decomposition of rice straw and microbial carbon use efficiency under different soil temperatures and moistures[J]. Soil Biology and Biochemistry, 2000, 32(11/12): 1773-1785. |
| [17] |
MATHIEU O, HÉNAULT C, LÉVÊQUE J, et al. Quantifying the contribution of nitrification and denitrification to the nitrous oxide flux using 15N tracers[J]. Environmental Pollution, 2006, 144: 933-940. DOI:10.1016/j.envpol.2006.02.005 |
| [18] |
BURTON J, CHEN C, XU Z, et al. Gross nitrogen transformations in adjacent native and plantation forests of subtropical Australia[J]. Soil Biology and Biochemistry, 2007, 39: 426-433. DOI:10.1016/j.soilbio.2006.08.011 |
| [19] |
GÖDDE M, CONRAD R. Simultaneous measurement of nitric oxide production and consumption in soil using a simple static incubation system, and the effect of soil water content on the contribution of nitrification[J]. Soil Biology and Biochemistry, 1998, 30: 433-442. DOI:10.1016/S0038-0717(97)00197-1 |
| [20] |
KIESE R, HEWETT B, BUTTERBACH-BAHL K. Seasonal dynamic of gross nitrification and N2O emission at two tropical rainforest sites in Queensland, Australia[J]. Plant and Soil, 2008, 309: 105-117. DOI:10.1007/s11104-007-9468-1 |
| [21] |
LIU R, SUTER H, HE J Z, et al. Influence of temperature and moisture on the relative contributions of heterotrophic and autotrophic nitrification to gross nitrification in an acid cropping soil[J]. Journal of Soil and Sediments, 2015, 15: 2304-2309. DOI:10.1007/s11368-015-1170-y |
| [22] |
LAN T, HAN Y, ROELCKE M, et al. Processes leading to N2O and NO emissions from two different Chinese soils under different soil moisture contents[J]. Plant and Soil, 2013, 371: 611-627. DOI:10.1007/s11104-013-1721-1 |
| [23] |
ZAMAN M, CHANG S X. Substrate type, temperature, and moisture content affect gross and net N mineralization and nitrification rates in agroforestry systems[J]. Biology and Fertility of Soils, 2004, 39(4): 269-279. DOI:10.1007/s00374-003-0716-0 |
| [24] |
OSBORNE B B, BARON J S, WALLENSTEIN M D. Moisture and temperature controls on nitrification differ among ammonia oxidizer communities from three alpine soil habitats[J]. Frontiers of Earth Science, 2016, 10(1): 1-12. DOI:10.1007/s11707-015-0556-x |
| [25] |
CEPÁKOVÁ Š, TOŠNER Z, FROUZ J. The effect of tree species on seasonal fluctuations in water-soluble and hot water-extractable organic matter at post-mining sites[J]. Geoderma, 2016, 275: 19-27. DOI:10.1016/j.geoderma.2016.04.006 |
| [26] |
FIERER N, SCHIMEL J P. Effects of drying-rewetting frequency on soil carbon and nitrogen transformations[J]. Soil Biology and Biochemistry, 2002, 34(6): 777-787. DOI:10.1016/S0038-0717(02)00007-X |
| [27] |
MARY B, RECOUS S, ROBIN D. A model for calculating nitrogen fluxes in soil using 15N tracing[J]. Soil Biology and Biochemistry, 1998, 30(14): 1963-1979. DOI:10.1016/S0038-0717(98)00068-6 |
| [28] |
BORKEN W, MATZNER E. Reappraisal of drying and wetting effects on C and N mineralization and fluxes in soils[J]. Global Change Biology, 2009, 15: 808-824. DOI:10.1111/j.1365-2486.2008.01681.x |
| [29] |
于芳芳, 李法云, 贾庆宇. 温度和水分对辽河保护区典型湿地土壤氮矿化的影响[J]. 生态科学, 2019, 38(6): 98-105. YU F F, LI F Y, JIA Q Y. Effects of temperature and moisture on soil nitrogen mineralization of typical wetland in Liaohe reservation zone[J]. Ecological Science, 2019, 38(6): 98-105. |
| [30] |
WEERTS A H, KANDHAI D, BOUTEN W, et al. Tortuosity of an unsaturated sandy soil estimated using gas diffusion and bulk soil electrical conductivity[J]. Soil Science Society of America Journal, 2001, 65: 1577-1584. DOI:10.2136/sssaj2001.1577 |
| [31] |
BUTCHER K R, NASTO M K, NORTON J M, et al. Physical mechanisms for soil moisture effects on microbial carbon-use efficiency in a sandy loam soil in the western United States[J]. Soil Biology and Biochemistry, 2020, 150: 107969. DOI:10.1016/j.soilbio.2020.107969 |
| [32] |
GUNTIAÑAS M E, LEIRÓS M C, TRASAR-CEPEDA C, et al. Effects of moisture and temperature on net soil nitrogen mineralization: A laboratory study[J]. European Journal of Soil Biology, 2012, 48: 73-80. DOI:10.1016/j.ejsobi.2011.07.015 |
| [33] |
STOTTLEMYER R, TOCZYDLOWSKI D. Nitrogen mineralization in a mature boreal forest, Isle Royale, Michigan[J]. Journal of Environmental Quality, 1999, 28: 709-720. |
| [34] |
ZHANG Y S, DING H, ZHENG X Z, et al. Soil N transformation mechanisms can effectively conserve N in soil under saturated conditions compared to unsaturated conditions in subtropical China[J]. Biology and Fertility of Soils, 2018, 65: 495-507. |
| [35] |
郎漫, 李平, 李淼, 等. 浅层淹水条件下不同施肥处理对黑土氮素净转化的影响[J]. 中国土壤与肥料, 2018, 2: 42-48, 126. LANG M, LI P, LI M, et al. Effect of different fertilization treatments on net nitrogen transformation in black soil under shallow flooding condition[J]. Soil and Fertilizer Sciences in China, 2018, 2: 42-48, 126. |
| [36] |
COMPTON J E, BOONE R D. Soil nitrogen transformations and the role of light fraction organic matter in forest soils[J]. Soil Biology and Biochemistry, 2002, 34: 933-943. DOI:10.1016/S0038-0717(02)00025-1 |
| [37] |
GIBBS P, BARRACLOUGH D. Gross mineralization of nitrogen during the decomposition of leaf protein Ⅰ(ribulose 1, 5-diphosphate carboxylase)in the presence or absence of sucrose[J]. Soil Biology and Biochemistry, 1998, 30: 1821-1827. DOI:10.1016/S0038-0717(98)00056-X |
| [38] |
HOYLE F C, MURPHY D V, FILLERY I R P. Temperature and stubble management influence microbial CO2-C evolution and gross N transformation rates[J]. Soil Biology and Biochemistry, 2006, 38: 71-80. DOI:10.1016/j.soilbio.2005.04.020 |
| [39] |
鲍俊丹, 石美, 张妹婷, 等. 中国典型土壤硝化作用与土壤性质的关系[J]. 中国农业科学, 2011, 44(7): 1390-1398. BAO J D, SHI M, ZHANG M T, et al. Nitrification of main soils in China and its relationship with soil properties[J]. Scientia Agricultura Sinica, 2011, 44(7): 1390-1398. DOI:10.3864/j.issn.0578-1752.2011.07.011 |
| [40] |
郑欠, 丁军军, 李玉中, 等. 土壤含水量对硝化和反硝化过程N2O排放及同位素特征值的影响[J]. 中国农业科学, 2017, 50(24): 4747-4758. ZHENG Q, DING J J, LI Y Z, et al. The effects of soil water content on N2O emissions and isotopic signature of nitrification and denitrification[J]. Scientia Agricultura Sinica, 2017, 50(24): 4747-4758. DOI:10.3864/j.issn.0578-1752.2017.24.008 |
| [41] |
THILAKARATHNA S K, HERNANDEZ-RAMIREZ G. Primings of soil organic matter and denitrification mediate the effect of moisture on nitrous oxide production[J]. Soil Biology and Biochemistry, 2021, 155: 108166. DOI:10.1016/j.soilbio.2021.108166 |
| [42] |
HU W F, ZHANG W L, ZHANG L H, et al. Short-term changes in simulated inundation frequency differentially affect inorganic nitrogen, nitrification, and denitrification in estuarine marshes[J]. Ecological Indicators, 2019, 107: 105571. DOI:10.1016/j.ecolind.2019.105571 |
| [43] |
STOCKDALE E A, HATCH D J, MURPHY D V, et al. Verifying the nitrification to immobilization ratio(N/I)as a key determinant of potential nitrate loss in grassland and arable soils[J]. Agronomie, 2002, 22: 831-838. DOI:10.1051/agro:2002060 |
| [44] |
LANG M, LI P, TI C P, et al. Soil gross nitrogen transformations are related to land-uses in two agroforestry systems[J]. Ecological Engineering, 2019, 127: 431-439. DOI:10.1016/j.ecoleng.2018.12.022 |
 2022, Vol. 41
2022, Vol. 41