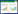文章信息
- 李力, 陆宇超, 刘娅, 孙红文, 梁中耀
- LI Li, LU Yu-chao, LIU Ya, SUN Hong-wen, LIANG Zhong-yao
- 玉米秸秆生物炭对Cd(Ⅱ)的吸附机理研究
- Adsorption Mechanisms of Cadmium(Ⅱ)on Biochars Derived fromCorn Straw
- 农业环境科学学报, 2012, 31(11): 2277-2283
- Journal of Agro-Environment Science, 2012, 31(11): 2277-2283
-
文章历史
- 收稿日期:2012-04-18
生物炭是生物质(如植物秸秆和动物粪便等)在 完全或部分缺氧情况下经热解产生的高度芳构化的 碳质材料[1, 2]。因其富含碳素、孔隙结构发达、比表面积 大和离子交换量高等独特的物理化学性质,生物炭在 固定大气碳素[3],修复受污染土壤[4]、固持营养元素[5, 6] 及提高作物产量[7, 8]等方面的应用日℃得到重视,被认 为是未来的一种新型的环境和农业功能材料。我国的 生物质资源丰富,将作为主要农田生物质废弃物的 秸秆转化成生物炭,可以使农田生物质废弃物资源 化,为创造良好的生态和经济效℃提供广阔思路。近 年来,许多学者报道了生物炭对环境中重金属行为 的影响,其中生物炭对溶液中重金属的吸附去除作 用受到很大关注[9, 10],多集中于对溶液中Pb(Ⅱ)[11, 12, 13]、 Cu(Ⅱ)[13, 14, 15]、Zn(Ⅱ)[15, 16]、Hg(Ⅱ)[17]和Cd(Ⅱ)[16]等的吸 附。但是,由于不同生物炭在物理化学性质上的差异 而具有不同吸附行为,目前生物炭对重金属吸附的 具体机理尚不明确[12]。
本研究以玉米秸秆为原料,分别在350℃和700℃下制备了生物炭,表征了所制备的生物炭的理化性 质,考察了Cd(Ⅱ)在生物炭表面的吸附过程,通过吸 附等温线和解吸曲线的定量分析,吸附前后红外光 谱(FTIR)的定性分析以及pH 对吸附的影响等,提 出了生物炭吸附重金属可能同时存在离子交换和阳 离子-π作用两种模式。
1 材料与方法 1.1 生物炭的制备本文所用生物炭原料为玉米(Zea mays L.)秸秆, 取自天津市津南区农田。生物炭的制备采用缺氧热解 法[18],将秸秆洗净风干粉碎后填满于密闭坩埚中,放 入预热的马弗炉,在350℃和700℃下厌氧加热2 h, 获得不同热解温度下的生物炭样品(分别标记为 BC350和BC700)。待样品冷却后置于研钵中研磨均 匀,过100目筛,储存于干燥器中备用。预实验表明, 生物炭本身不含有可溶出Cd(Ⅱ)
1.2 生物炭的表征在750℃条件下烧蚀4 h,测定两种生物炭的灰 分含量;采用varioMICRO 元素分析仪(Elementar, Germany)测定生物炭元素组成(C、H、N 和S),O 的含 量通过各元素及灰分含量进行质量平衡得到。生物炭 的比表面积(Specific Surface Area,SSA)和孔分布采 用AutoSorb -1 MP & NOVA 2000 分析仪(Quan原 tachrome,USA)测定并通过液氮(77.40 K)BET 吸附等温线计算。生物炭的表面酸碱基团含量采用Boehm 滴定法测定[19],表面基团分布采用Perkin 2 Elmer 1725 X 傅里叶变换红外光谱仪测定。生物炭零电点 (pHPZC)采用文献[20]报道的方法测定。
1.3 吸附/解吸曲线吸附等温线采用批量平衡实验测得:称取0.1000± 0.000 4 g 生物炭,按固液比为1:100(g·ml-1)精确加 入不同浓度的Cd(NO3)2 溶液,溶液中还含有0.01 mol·L-1 CaCl2(背景溶液),以提供必要的离子强度, 溶液的pH=7。加塞摇匀后于(25±1)℃,250 r·min-1条 件下振荡24 h,吸附动力学预实验表明,Cd(Ⅱ)在生 物炭表面的吸附在5 h内达到平衡。4200 r·min-1 离 心30 min 后用0.22 滋m 微孔滤膜过滤,测定上清液 Cd(Ⅱ)浓度(Ce,1)。做不加生物炭的空白实验,此值为 各梯度溶液的初始浓度(C0)。根据Ce,1和C0计算各体 系中溶液平衡时生物炭对Cd(Ⅱ)的吸附量Qe,ads。
解吸曲线通过解吸实验测得:待上述吸附体系得 到的吸附了Cd(Ⅱ)的生物炭自然干燥后,加入背景 溶液,加塞摇匀后,于(25±1)℃,250 r·min-1条件下振 荡24 h,4200 r·min-1 离心30 min 后用0.22 滋m 微孔 滤膜过滤,测定上清液Cd(Ⅱ)浓度(Ce,2)。根据Ce,1和 Ce,2计算各体系中溶液平衡时Cd(Ⅱ)的解吸量Qe,ads。
溶液初始pH 值对Cd(Ⅱ)吸附影响实验:在 (25±1)℃条件下,采用HNO3和NaOH调节生物炭-背 景溶液的pH为2、4、6、8 和10,加入Cd(Ⅱ)储备液, 使其初始浓度C0为1.0 mg·L-1,其余步骤同吸附等温 线实验。分别测定平衡浓度Ce,则生物炭对Cd(Ⅱ)吸 附率可采用下式进行计算:
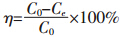
Cd(Ⅱ)浓度采用原子吸收分光光度计(瑞利 WFX-210,中国)测定。数据拟合处理采用Origin 8.5 进行。
2 结果与讨论 2.1 生物炭的性质不同热解温度下制得的两种生物炭的基本理化 性质列于表 1。元素组成分析是判断生物炭结构和性 质最简单和最重要的方法之一。从元素分析结果可以 看出,BC700 与BC350 相比,C 含量较高,H 和O 含 量较低,表征生物炭芳构化程度的H/C 原子比由 0.059 降低至0.024,表征生物炭极性程度的O/C 原子 比由0.31 降低至0.19,说明较高的热解温度能够促进脂肪烃类向芳香烃类缩聚[21]。
由于原料玉米秸秆中存在大量的矿质元素,制得 的生物炭含有较多灰分,其中BC700 比BC350 灰分 含量更高,这与Cao 和Harris的报道是一致的[22]。在 孔隙度方面,BC700 与BC350 相比,SSA 和孔容都增 加了约15倍,这说明生物炭的微孔结构(直径约2 nm) 在更高温度下发育得更完善[23]。从孔容分布图(图 1) 也可以看出,BC700 比BC350 在微孔上具有更多更 集中的孔分布,说明较高热解温度有助于生物炭微孔 的开孔作用。
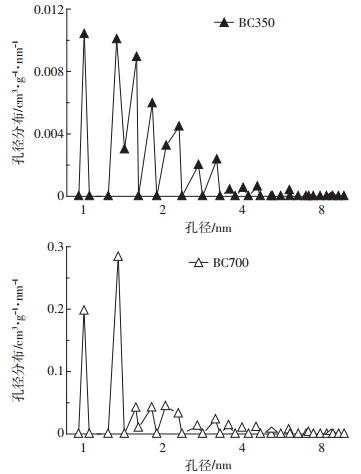
|
| 图 1 生物炭BC350(上)和BC700(下)的孔容分布 Figure 1 Distributions of Pore Volume of BC350(up)and BC700(down) |
生物炭表面富含大量的官能团。一般认为,表面 酸性基团主要来自羧基、酚羟基等酸性含氧官能团, 它们通过解离质子呈现酸性[19]。BC350的表面酸性基 团明显多于BC700(表 1),这与O/C 原子比的结果是 吻合的,说明在低温热解条件下,由于纤维素等前体材料分解不完全而保留了大量含氧官能团,而高温热 解能使大量羧基和酚羟基高度酯化[24],减少可解离质 子的存在。而生物炭表面碱性基团来源比较广泛,多 数研究认为,对于N 含量不高的生物炭(此时-NH2等 含氮碱性官能团的贡献可以忽略),其表面高度共轭 的芳香结构是其呈碱性的主要原因[ 21, 25]。生物炭表面 的γ-吡喃酮等多环或杂环聚集形成连续的石墨结构 层,具有电子云高度密集的π电子结构,它可以作为 Lewis 碱与水分子形成电子供体-受体(Electron Donor-Acceptor,EDA)作用,从而使生物炭表观呈碱 性,该过程的通式可以表示为[ 21, 25, 26, 27]:
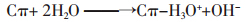
OHBC700 与BC350 相比,π共轭芳香结构更加完 备,表观碱性基团数量更多。
BC350 具有大量酸性基团,在溶液中易于解离出 质子,使得生物炭的零电点pHPZC约7;而相反地,BC700 则通过不断释放OH-离子,使得生物炭的零电点 pHPZC达到10 以上。
2.2 生物炭对Cd(Ⅱ)的吸附及其机理 2.2.1 吸附等温线图 2 给出了生物炭对溶液中Cd(Ⅱ)的等温吸附 情况。采用Langmuir 吸附等温线进行拟合,Langmuir 吸附等温线形式如下:
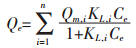
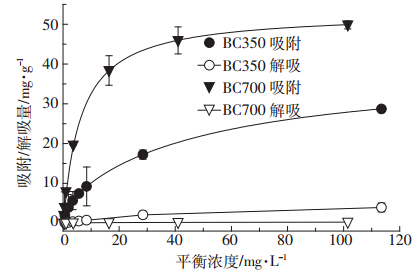
|
| 图 2 Cd(Ⅱ)在两种生物炭表面的吸附等温线和解吸曲线 Figure 2 Adsorption isotherms and desorption curves of Cd(Ⅱ)on two biochars |
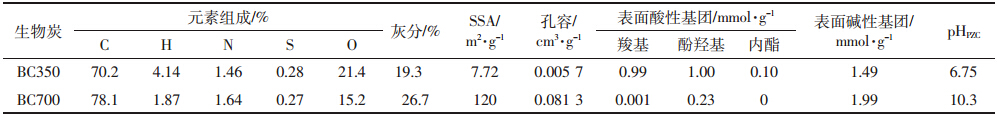
为了区分生物炭可能不同的吸附机理,上式中项 数除取n=1(One-site Langmuir 方程)外,还取n=2 (Two-site Langmuir 方程)进行拟合,表 2 给出了两种 拟合结果的对比。
拟合结果表明,在One-site Langmuir 模型中, BC700 的Cd(Ⅱ)吸附容量(Qm)大于BC350,在Twosite Langmuir 模型中,BC700 的Qm之和大于BC350, 均说明BC700 具有更多的吸附位点,吸附效果更好。Two-site Langmuir 方程拟合程度要优于One-site Langmuir 方程,说明两种不同的吸附机理共同决定了 Cd(Ⅱ)的吸附过程。
2.2.2 吸附机理离子交换和阳离子-π作用是生物炭对Cd(Ⅱ) 吸附的两种最主要的可能机理[28]。
(1)离子交换。离子交换的反应通式可以表达为:
2Surf-OH+Cd2+→(Surf-O)2CdH2+(与表面酸性官能团交换)
2Surf-ONa+Cd2+→(Surf-O)2Cd+2Na+(与表面盐基离子交换,通常是碱金属或碱土金属)
离子交换的本质是生物炭表面带负电荷基团与 溶液中正电荷的Cd(Ⅱ)的静电作用,属于非专性吸 附,吸附能较低。静电作用的强度取决于表面负电基 团产生的可变表面电荷[29],交换能力受pH 的影响较 为显著,具有明显的可逆性。
(2)阳离子-π作用。该作用是近年来受广泛关注 的一种新型的吸附模式[30],通式可以表述为:
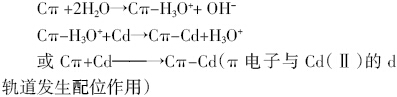
阳离子-π作用的本质比较复杂,其中有一定静 电作用的成分[30]。阳离子-π作用取决于生物炭表面 的芳香程度,仔共轭芳香结构越多,给电子能力越强, 则该种作用越明显。该吸附不受生物炭表面电荷的影 响,受pH影响较小。
在Two-site Langmuir 方程中,各分项KL值大小 代表了该机理的亲和力,Qm的大小代表了该机理的 吸附位点的数量。根据之前研究报道,离子交换比阳 离子-π作用具有更强的吸附亲和力[28],因此表示离 子交换的KL值应当大于阳离子-π作用的KL值。本 研究中,KL,1远大于KL,2的值,可以判定下标为1 的 吸附机理为离子交换,下标为2 的吸附机理为阳离 子-π作用。通过对比生物炭两种机理吸附容量分别 占吸附总容量的比例(Qm,1/Qm,总和Qm,2/Qm,总,图 2),发现BC350 和BC700 离子交换机理吸附容量分别占 13.7%和1.1%,阳离子-π作用吸附容量分别占86.3% 和98.9%,表明阳离子-π作用是生物炭对Cd(Ⅱ)最 主要的吸附过程。
BC350 与BC700 相比,离子交换机理的吸附容 量Qm,1之比为5.37/0.61=8.8,而它们对应的表面酸 性基团数目(表 1)之比为2.0/0.23=8.7,二者很接近, 证实了表面酸性基团对离子交换的决定作用;阳离 子-π作用机理的吸附容量Qm,2之比为33.82/52.30= 0.65,而它们对应的表面碱性基团数目(表 1)之比为 1.49/1.99=0.75,二者比较接近但存在一定差别,表明 阳离子-π作用主要取决于表面碱性基团(主要是π 共轭芳香结构),但也可能受其他一些因素的影响(例 如表面积大小和芳环的共轭程度等)。
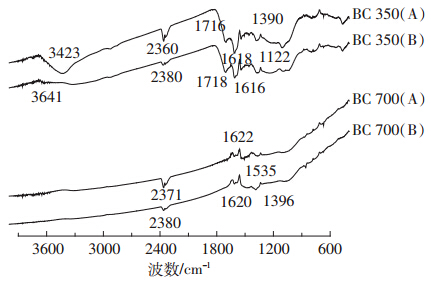
2.2.3 生物炭吸附Cd(Ⅱ)前后的FTIR谱图生物炭吸附Cd(Ⅱ)前后的FTIR 谱图如图 3。对 于BC350,在3700~2900 cm-1范围可见明显宽阔而强 烈的吸收峰,归属为自由或缔合-OH 的伸缩振动,表 明生物炭具有大量的羧基、羟基和羰基等含氧官能 团,这为生物炭表面发生离子交换吸附提供了基础。 1700~1600 cm-1之间羧基、酯基或醛基上C=O 的伸缩 振动和芳环的C=C 伸缩振动峰、1120 cm-1左右醚类 C-O 的伸缩振动峰、以及800~700 cm-1之间的吡啶、呋喃等杂环化合物环的振动峰也十分明显,表明生物 炭具有高度芳香化和杂环化的结构,为生物炭发生阳 离子-π作用吸附提供了基础。对于BC700,3423 cm-1 处-OH 的吸收峰几乎不可见,而1820 cm-1 左右的酯 羰基吸收峰显著加强[24],这表明大量羟基和羧基的高 度内酯化而扭曲,芳香环发育更加完整。
|
| 图 3 两种生物炭对Cd(Ⅱ)吸附前(A)和吸附后(B)红外谱图 Figure 3 FTIR spectrograms of two biochars before(A)and after(B)the absorption of Cd(Ⅱ) |
对比同种生物炭吸附前后FTIR 谱图的变化可 以得出:BC350 含氧官能团峰特征发生明显变化,主 要是波数有所变大,峰强降低,振幅下降,波峰变宽, 其中3423、2360 cm-1 等吸收峰被明显削弱,迁移至 3641cm-1处产生小峰,说明由于吸附后-OH被Cd(Ⅱ) 占据,分子内-OH 中的氢键作用力减小,可见离子交 换模式在BC350 的Cd(Ⅱ)吸附中占有重要地位。 BC700 的1300 cm-1 处峰明显迁移至1396 cm-1,在 1500~1300 cm-1区域原来许多小而密集的峰消失,而 产生连续而强烈的吸收峰,说明原有的仔共轭芳香 结构与Cd(Ⅱ)形成能量较小的稳定结构。可以定性 判定阳离子-π作用存在于BC700吸附过程中。
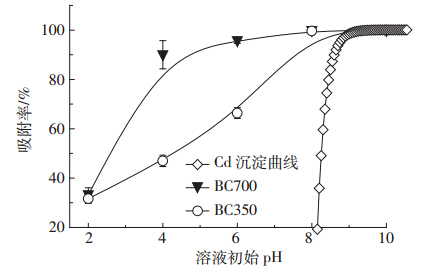
2.3 pH对生物炭吸附Cd(Ⅱ)的影响图 4 列出了生物炭在不同初始pH 条件下的平 衡吸附率。考虑到过高pH会引起Cd(Ⅱ)自身沉淀, 可能干扰判断生物炭对Cd(Ⅱ)的实际吸附率,图中 给出了Cd(Ⅱ)沉淀率随pH 变化的Cd(Ⅱ)的沉淀曲 线。从实验结果可以看出,BC350和BC700对Cd(Ⅱ) 的吸附均不同程度受到溶液pH影响,但BC350 受影 响更大。在低pH条件下(pH=2),两种生物炭对Cd(Ⅱ) 的吸附率仅30%,在pH=4 时BC700 的吸附率达到 90%,而BC350仅47%。此后,BC350 的吸附率随pH 增大迅速增加,而BC700 缓慢上升。
|
| 图 4 pH 对两种生物炭Cd(Ⅱ)吸附量的影响 Figure 4 Effect of pH on Cd(Ⅱ)adsorption onto two biochars |
在低pH条件下,一方面,无论对含氧官能团的点
位还是π共轭点位,溶液中大量存在的H+与Cd(Ⅱ)
均有很强的竞争作用;另一方面,由于pH 溶液
随着pH的升高,溶液中H+含量逐渐减少,H+的 竞争作用逐渐减弱,生物炭对Cd(Ⅱ)的吸附作用增 强,所以BC350 和BC700的吸附率均上升。BC350 与 BC700 相比,具有更大的离子交换位点比例(BC350 的Qm,1 /Qm,总为13.7%,BC700 的Qm,1 /Qm,总为1.1%), 因而受离子交换的影响也较大。由于离子交换作用受 pH 的显著影响,而阳离子-π作用受pH 影响较小, BC350 的吸附率随pH 升高显著变化,而BC700 的吸 附率在达到90%后缓慢上升。可见,pH对阳离子-π 作用的抑制在pH=4 时已经减弱。
2.4 生物炭上吸附态Cd(Ⅱ)的解吸图 2 同时给出了Cd(Ⅱ)的解吸曲线。BC350 和 BC700 的最大解吸率分别为14%和0.5%,解吸量均 较小,说明生物炭对Cd(Ⅱ)的吸附能力很强,能够很 好地阻止Cd(Ⅱ)在水环境中的迁移。另外,在Twosite Langmuir 模型拟合结果中,BC350 和BC700 的离 子交换吸附容量占总吸附容量比(Qm,1 /Qm,总)分别为 13.7%和1.1%,此数值与上述对应生物炭的解吸率十 分接近。这是因为,离子交换机理的本质是静电作用, 容易使吸附的重金属完全解吸且解吸速率较快[32],而 通过阳离子-π作用吸附的重金属则不容易解吸。 BC700的解吸率远小于BC350,说明较高热解温度下 的生物炭具有更深的芳构化程度,阳离子-π作用所 占比重进一步增加,此时生物炭吸附性能更加优良, 具有高度不可逆性。
3 结论(1)热解温度会影响玉米秸秆生物炭的理化性 质。热解温度由350℃升至700℃,表征生物炭芳构 化程度的H/C 原子比由0.059 降低至0.024,表征生 物炭极性程度的O/C 原子比由0.31 降低至0.19,SSA 由7.72 m2·g-1升至120 m2·g-1,孔结构发育更加完全, 生物炭表面官能团的羧基和酚羟基高度酯化和扭曲 化,使表观碱性基团数量多于酸性基团。
(2)制备的两种生物炭BC350和BC700的吸附等 温线很好地符合Langmuir 吸附方程,Two-site Lang原 muir 方程的拟合程度优于One-site Langmuir 方程,R2 达到了0.99以上。离子交换和阳离子-π作用两种不 同的吸附机理共同决定生物炭对Cd(Ⅱ)的吸附过 程,其中阳离子-π作用占主要地位,分别占BC350 和 BC700吸附容量的86.3%和98.9%。生物炭表面的含 氧官能团和仔共轭芳香结构分别为不同的吸附机理 提供位点。
(3)BC700 对Cd(Ⅱ)的吸附容量52.9 mg·g-1,大 于BC350 的39.2 mg·g-1,解吸率仅为0.5%,远小于 BC350的14%,说明其吸附位点多,吸附效果更好。随 着溶液初始pH 升高,生物炭的吸附率均从30%左右 增大至接近100%;BC350 具有更大的离子交换位点 比例,因而受pH影响比BC700 更大。
| [1] | Emma M. Black is the new green[J]. Nature, 2006, 442: 624-626. |
| [2] | Lehmann J, Gaunt J, Rondon M. Bio-char sequestration in terrestrial ecosystems-A review[J]. Mitigation and Adaptation Strategies for Global Change, 2006, 11(2): 395-419. |
| [3] | Laird D A. The charcoal vision: A win-win-win scenario for simultaneously producing bioenergy, permanently sequestering carbon, while improving soil and water quality[J]. Agronomy Journal, 2008, 100(1): 178-181. |
| [4] | Uchimiya M, Lima I M, Klasson K T, et al. Contaminant immobilization and nutrient release by biochar soil amendment: Roles of natural organic matter[J]. Chemosphere, 2010, 80(8): 935-940. |
| [5] | DeLuca T H, MacKenzie M D, Gundale M J. Biochar effects on soil nutrient transformations [M]Lehmann J, Joseph S. Biochar for environmental management: Science and technology. London: Earthscan, 2009: 251-270. |
| [6] | Major J, Steiner C, Downie A, et al. Biochar effects on nutrient leaching[M]Lehmann J, Joseph S. Biochar for environmental management: Science and technology, London: Earthscan, 2009: 271-287. |
| [7] | Tagoe S O, Horiuchi T, Matsui T. Effects of carbonized and dried chicken manures on the growth, yield, and N content of soybean[J]. Plant and Soil, 2008, 306(1): 211-220. |
| [8] | Van Zwieten L, Kimber S, Morris S, et al. Effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility[J]. Plant and Soil, 2010, 327(1): 235-246. |
| [9] | Harvey O R, Herbert B E, Rhue R D, et al. Metal interactions at the biochar-water interface: energetics and structure-sorption relationships elucidated by flow adsorption microcalorimetry[J]. Environmental Science and Technology, 2011, 45(13): 5550-5556. |
| [10] | Beesley L, Moreno-Jimenez E, Gomez-Eyles J L. Effects of biochar and greenwaste compost amendments on mobility, bioavailability and toxicity of inorganic and organic contaminants in a multi-element polluted soil[J]. Environmental Pollution, 2010, 158(6): 2282-2287. |
| [11] | Liu Z, Zhang F S. Removal of lead from water using biochars prepared from hydrothermal liquefaction of biomass[J]. Journal of Hazardous Materials, 2009, 167(1-3): 933-939. |
| [12] | 安增莉, 侯艳伟, 蔡超, 等. 援水稻秸秆生物炭对Pb(Ⅱ)的吸附特性[J]. 援环境化学, 2011, 30(11): 1851-1857. AN Zeng-li, HOU Yan-wei, CAI Chao, et al. Lead(Ⅱ)adsorption characteristics on different biochars derived from rice straw[J]. Environmental Chemistry, 2011, 30(11): 1851-1857. |
| [13] | Uchimiya M, Lima I M, Thomas Klasson K, et al. Immobilization of heavy metal ions(CuⅡ, CdⅡ, NiⅡ, and PbⅡ)by broiler litter-derived biochars in water and soil [J]. Journal of Agricultural and Food Chemistry, 2010, 58(9): 5538-5544. |
| [14] | Uchimiya M, Klasson K T, Wartelle L H, et al. Influence of soil properties on heavy metal sequestration by biochar amendment: 1. Copper sorption isotherms and the release of cations[J]. Chemosphere, 2010, 82 (10): 1431-1437. |
| [15] | Chen X, Chen G, Chen L, et al. Adsorption of copper and zinc by biochars produced from pyrolysis of hardwood and corn straw in aqueous solution[J]. Bioresource Technology, 2011, 102(19): 8877-8884. |
| [16] | Trakal L, Komárek M, SzákováJ, et al. Biochar application to metalcontaminated soil: Evaluating of Cd, Cu, Pb and Zn sorption behavior using single-and multi-element sorption experiment[J]. Plant, Soil and Environment, 2011, 57(8): 372-380. |
| [17] | Kong H L, He J, Gao Y Z, et al. Cosorption of phenanthrene and mercury(Ⅱ)from aqueous solution by soybean stalk-based biochar[J]. Journal of Agricultural and Food Chemistry, 2011, 59(22): 12116-12123. |
| [18] | Chun Y, Sheng G, Chiou C T, et al. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science and Technology, 2004, 38(17): 4649-4655. |
| [19] | Boehm H P, Eley D D. Chemical identification of functional groups[J]. Advances in Catalysis, 1966, 16: 179-274. |
| [20] | Uchimiya M, Wartelle L H, Klasson K T, et al. Influence of pyrolysis temperature on biochar property and function as a heavy metal sorbent in soil[J]. Journal of Agricultural and Food Chemistry, 2011, 59(6): 2501-2510. |
| [21] | Radovic L R, Moreno-Castilla C, Rivera-Utrilla J. Carbon materials as adsorbents in aqueous solutions[M]//Radovic L R. Chemistry and physics of carbon, New York: Marcel Dekker. 2001: 227-405. |
| [22] | Cao X, Harris W. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation[J]. Bioresource Technology, 2010, 101(14): 5222-5228. |
| [23] | Downie A, Crosky A, Munroe P. Physical properties of biochar[M]// Lehmann J, Joseph S. Biochar for environmental management: Science and technology, London: Earthscan, 2009: 13-32. |
| [24] | Antal Jr M J, Gronli M. The art, science, and technology of charcoal production[J]. Industrial and Engineering Chemistry Research, 2003, 42(8): 1619-1640. |
| [25] | Boehm H. Some aspects of the surface chemistry of carbon blacks and other carbons[J]. Carbon, 1994, 32(5): 759-769. |
| [26] | Rivera-Utrilla J, Sanchez-Polo M. Adsorption of Cr(Ⅱ)on ozonised activated carbon: Importance of CⅡ-cation interactions[J]. Water Research, 2003, 37(14): 3335-3340. |
| [27] | Sanchez-Polo M, Rivera-Utrilla J. Adsorbent-adsorbate interactions in the adsorption of Cd(Ⅱ)and Hg(Ⅱ)on ozonized activated carbons[J]. Environmental Science and Technology, 2002, 36(17): 3850-3854. |
| [28] | Cho H H, Wepasnick K, Smith B A, et al. Sorption of aqueous Zn(Ⅱ) andCd(Ⅱ)bymultiwallcarbonnanotubes: Therelativerolesofoxygencontaining functional groups and graphenic carbon[J]. Langmuir, 2009, 26(2): 967-981. |
| [29] | 杨亚提,张一平. 援恒电荷土壤胶体对Cu2+, Pb2+的静电吸附与专性吸附特征[J]. 援土壤学报, 2003, 40(1): 102-109. YANG Ya-ti, ZHANG Yi-ping. The characteristics of Cu2+ and Pb2+ electrostatic and specific adsorptions of constant charge soil colloids[J]. Acta Pedologica Sinica, 2003, 40(1): 102-109. |
| [30] | Ma J C, Dougherty D A. The cation-πinteraction[J]. Chemical Reviews, 1997, 97(5): 1303-1324. |
| [31] | Kadirvelu K, Kavipriya M, Karthika C, et al. Mercury(Ⅱ)adsorption by activated carbon made from sago waste[J]. Carbon, 2004, 42(4): 745-752. |
| [32] | 杨亚提,张一平. 援土壤胶体表面吸附态铜的解吸动力学特征[J]. 援土壤与环境, 2001, 10(3): 181-184. YANG Ya-ti, ZHANG Yi-ping. Kinetics of copper desorption from constant charge soil colloid[J]. Soil and Environmental Sciences, 2001, 10(3): 181-184. |
 2012, Vol. 31
2012, Vol. 31