文章信息
- 张 鹏,武健羽,李 力,刘 娅,孙红文,孙铁珩
- ZHANG Peng,WU Jian-yu,LI Li,LIU Ya,SUN Hong-wen,SUN Tie-heng
- 猪粪制备的生物炭对西维因的吸附与催化水解作用
- Sorption and Catalytic Hydrolysis of Carbaryl on Pig-Manure-Derived Biochars
- 农业环境科学学报, 2012, 31(2): 416-421
- Journal of Agro-Environment Science, 2012, 31(2): 416-421
-
文章历史
- 收稿日期:2011-08-05
2.中科院沈阳应用生态研究所,沈阳 110016
2. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China
生物炭(biochar) 是动植物残体经过缺氧热解制 备的一类含碳物质。具有较高的阳离子交换量、 多 孔、 比表面积大、 表面含有多种官能团等特点 [1] 。对重 金属等无机污染物 [2, 3, 4] 及 PAHs [5] 、 PCBs [6] 、农药等有机 污染物均是一种高效的吸附剂。此外,生物炭施加于 土壤,可以改良土壤,促进作物生长,改变碳循环路 径,增加土壤碳汇,减少温室气体的排放 [7] 。 当前,我国 农田废弃物主要以秸秆及动物粪便为主,年产量巨 大,有效利用率低。 且粪便的长期露天堆积,渗滤液会 随径流污染地下水。 生物炭的制备主要以落叶、 秸秆、 动物粪便等农林废弃物为原材料 [8] ,因此,为农田废弃物的资源化提供了一条有利途径。
我国是传统农业大国,农药的长期使用已造成土 壤严重污染。西维因是一种氨基甲酸酯类杀虫剂,能 够抑制乙酰胆碱酯酶的活性,具有潜在致癌性,水溶 解度约 40 mg · L-1 (30℃) [9] ,对地下水具有潜在危害。 虽然碱性条件下易水解 [10] ,但由于长期积累,土壤中 残留水平高 [11] ,西维因对地下水及农田附近河道仍具 有环境风险,因此对西维因污染土壤的有效修复刻不 容缓。
目前,对生物炭质吸附有机污染物的研究主要集 中在以植物残体为原料制备的低灰分含量生物炭 [12] , 对以动物源为原料制备的高灰分含量的生物炭与有 机物的相互作用研究还很少。 本文以猪粪为原料在不 同温度下制备生物炭,经过除灰处理后,通过批量平 衡实验,研究不同灰分含量生物炭与西维因的相互作 用,旨在了解不同灰分含量的生物炭对西维因吸附与 水解作用机制,为废弃物资源化及土壤修复提供参考 依据。 1 材料与方法 1.1 化学品与溶液
西维因标样(CAS65-25-2) 购于北京百灵威科技 有限公司,纯度 100%。西维因原药由湖南海利化工 股份有限公司提供,纯度 98%。西维因标样及原药均 用甲醇配制成 4g · L-1 储备液,放置于冰箱避光保存。 甲醇购于天津康科德科技有限公司,色谱纯。其他试 剂均为分析纯。
实验用背景溶液含有 5 mmol · L-1 氯化钙和 200 mg · L-1 氯化汞,其 pH 为 6.5。
猪粪购自天津市蓟县马伸桥镇某养猪场,风干并 捡出石块、 树枝等杂物,敲碎备用。 1.2 仪器
Agilent 1200 Series 高 效 液 相 色谱 ; ELementar vario EL 元素分析仪; Quantachrome NOVA 2200e BET 比表面积仪; Perkin Elmer 1725X 型傅里叶变换红外 光谱仪;梅特勒-特立多 AB204-E 天平;飞鸽 Anke TDL-5 离心机; 恒温摇床等。 1.3 生物炭制备
生物炭的制备采用缺氧热解法 [13] 。 风干的大块猪 粪,敲碎后装入瓷坩埚,盖上盖子,置于一定温度(350 益和 700℃) 马弗炉中热解 2h,冷却至室温后取出。 将热解后的生物炭研磨,过筛(60~400 目) ,保存于广 口瓶备用,分别标记为 BC350,BC700。
采用酸洗除灰法 [14] 将部分生物炭除灰,分别取 20 g BC350 和 BC700,先用 200 mL1 mol · L-1 盐酸洗 4 次,每次离心后去除上清液,再用 200 mL 1 mol · L-1 盐 酸:氢氟酸(1:1) 洗 4 次,最后用去离子水洗至近中性, 80℃烘干后置于广口瓶,分别标记为 DA -BC350, DA-BC700。 1.4 生物炭理化性质表征
将生物炭置于马弗炉于 750℃下敞口煅烧 6h, 残余部分为灰分 [15] 。用元素分析仪测定生物炭样品的 C、 H、 N 含量,O 的含量通过总量减去 C、 H、 N 及灰分 的含量获得。 比表面积用 BET-N2 法通过比表面积测 定仪测得。生物炭的 pH 按固水比 2.5:1 与蒸馏水混 合振荡,平衡后测上清液 pH [16] 。 1.5 等温吸附实验
采用批量平衡实验,测定生物炭对西维因的吸 附。分别称取一定量的生物炭于 40 mL 美国 EPA 样 品瓶中,加入 40 mL 背景溶液,预平衡 24h 后,加入 一系列起始浓度不同(1~40 mg · L-1 ) 的西维因溶液,6 个浓度点,每个点做两个平行。并做两个空白,一个空 白只加西维因溶液,一个空白只加生物炭样品。在 (20±2)℃、 150r · min-1 、 避光条件下旋转振荡 24h(预 实验表明 24h 内可达到表观平衡) ,在 4 000r · min-1 下离心 10 min,取上清液,测定西维因浓度。 预实验表 明,瓶壁吸附、 挥发、 生物降解等损失可以忽略不计。 但西维因在弱碱性条件下会水解,BC350 及 BC700 平衡后固相吸附量需通过萃取获得,而西维因在除灰 处理后生物炭-水体系中不发生水解,平衡吸附量由 液相初始浓度和平衡浓度的差值获得。 1.6 西维因水解实验
西维因水解实验在生物炭-水体系中进行。分别 称取 50 mg 未除灰生物炭样品于 40 mL 样品瓶中,加 入 40 mL 背景溶液预平衡 24h 后,加入5 mg · L-1 西 维因溶液,不留顶空,在(20±2)℃、 150r · min-1 、 避光 条件下旋转振荡 7d,在不同时间点取出样品瓶,在 4 000r · min-1 离心 10 min,取上清液,测定西维因浓 度。 另作一组同浓度西维因在 500 mg 未除灰生物炭-水体系中的水解,以考察生物炭添加量对西维因水解 的影响。同时进行仅加西维因的空白,操作方法同上。 分别分析每个样品瓶中液相及固相中西维因的量,通 过质量平衡计算西维因的水解率。 1.7 样品分析
生物炭上西维因的萃取 [17] : 向离心得到的生物炭 残渣加入 10 mL 甲醇,摇匀,超声 10 min,离心,将上清液移入样品瓶,再加入 10 mL 甲醇重复超声萃取 一次,合并两次萃取液,测定西维因的含量。该方法 回收率 80%~85%。
西维因的测定: HPLC-荧光法测定西维因浓度。 使用Agilent Eclipse XDB-C18反相色谱柱 (5 µm, 150Å,4.6×150mm) 。流动相为甲醇:水=7:3,流速 1 mL · min-1 ,荧光检测器的Ex=200 nm,Em=360 nm。 2 结果与分析 2.1 生物炭结构表征
不同温度热解制备的生物炭具有不同的组成结 构,其灰分含量及元素组成、 BET-N2比表面积等列 于表 1。随着温度的升高,生物炭灰分含量增加,pH 升高,碳含量有所降低,H/C 降低,芳香性增加,(O +N)/C 降低,极性降低,比表面积增大。 经过酸洗除灰 处理的生物炭,灰分含量大幅降低,pH 降低,碳含量 比处理前明显增加,BC350由 31.6%增加到66.7%, BC700由25.2%增加到 74.2%,并且比表面积增大。
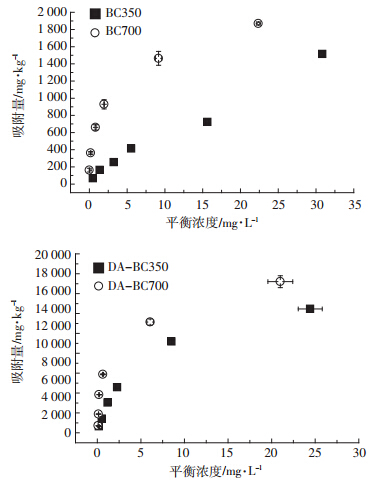
生物炭对西维因的等温吸附曲线如图 1 所示。对 等温吸附数据进行拟合,符合Freundlich方程(表 2) 。 生物炭吸附剂对西维因具有良好的吸附性能,BC350 的 Freundlich 吸附系数 (lgKf) 为 2.06。随着处理温度 的升高,生物炭的吸附能力增强,BC700 的 lgKf 增加到 2.85。 这与相关报道中植物源生物炭对有机物的 吸附性能一致 [18] 。 经过除灰处理后生物炭的吸附能力 显著增强,lgKf 分别增加到 3.35 和 3.70 这是因为除灰后有机碳活性吸附点位暴露出来。 代表等温吸附非 线性程度的n值均约<1,且随生物炭处理温度的升高 显著降低,表明生物炭对西维因的吸附是非线性的, 并且随处理温度的升高非线性程度增加,说明吸附剂 的点位具有较高的不均一性。 吸附是由多种过程控制 的,除了亲脂性分配作用 (吸附等温线表现为线性) , 还有特殊作用力。
|
| 图 1 西维因对生物炭的等温吸附曲线 Figure 1 Carbaryl adsorption isotherms on biochars |
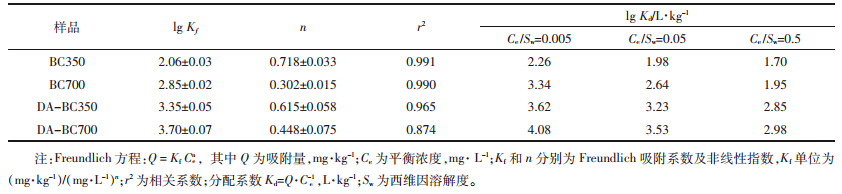 |
通过质量平衡计算得到的西维因在生物炭-水体 系中的水解率随时间的变化如图 2 所示。西维因在 生物炭-水体系中发生了水解反应,且水解分为两个 阶段进行,在 18h 内西维因快速水解,之后进入缓慢 水解阶段进行。 BC700 对西维因的催化水解能力明显 强于BC350,而在生物炭加入量大(500 mg) 的体系 中,西维因的水解能力明显强于生物炭加入量小(50 mg) 的体系。利用拟一级动力学方程拟合,各个体系 的半衰期分别为: BC350(50 mg) 约 24d ; BC700(50 mg) 70h; BC350(500 mg) 130h; BC700(500 mg) 3h。
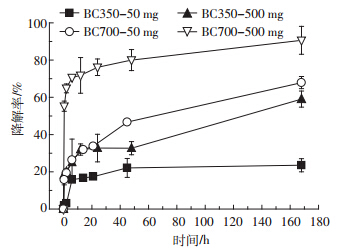
|
| 图 2 西维因在生物炭-水体系中的水解 Figure 2 Hydrolysis of carbaryl in different biochar-water systems |
以动物粪便为原料制备的生物炭中所含的灰分 含量明显高于文献报道植物源制备的生物炭 [19] ,并且 随着制备温度的升高,灰分含量增加(表 1) 。 由于猪 是杂食动物,其排泄物中含有大量无机矿物成分。随 着处理温度的升高,可挥发部分减少,部分不稳定有 机质转化为二氧化碳,造成无机矿物占主要地位。矿 物成分是生物炭具有较高阳离子交换量的主要因素, 并且能够使加入生物炭的溶液具有较高的 pH 值。 此 外,热解后的生物炭高度炭化,与植物源制备的生物 炭中的碳含量随温度的升高而增加不同,猪粪制备的 生物炭中碳的含量从 31.6%降低到 25.2%,而氢和氧的含量分别由 2.36%、 16.9%降低到 1.12%、 4.83%。 研 究表明当热解温度低于 400℃时,热解产物中仍然含 有原料中原有的部分结构,未被完全转化 [20] ,因 此, BC350 中含有部分不定型的有机碳,而 BC700 被完 全炭化,其中不稳定的有机质被热解挥发,不定型碳 向晶体态转化,含碳量有所降低。 H/C、(O+N) /C 原子 比通常作为判断物质芳香性和极性的指标 [21] ,随温度 的升高生物炭的 H/C 降低,芳香性增加;(O+N) /C 降 低,极性降低。 这从另一方面表明,生物炭随温度的增 加,表面极性官能团被氧化,不定型的软质碳向晶体 态的硬碳转化 [22] 。同时,生物炭的比表面积随温度的 升高逐渐增大,由 23.8m2 · g-1 增加到 32.6m2 · g-1 。
除灰处理后,DA-BC700 碳含量比 DA-BC350 略 有升高,可能是由于酸洗后,不仅去除了无机矿物成 分,也去除了表面一部分不定型的有机质组分。通过 观察原子比的变化,同一温度的生物炭,除灰处理后 芳香性增加、 极性降低,表明经过酸洗,表面矿物被剥 离,部分不定型的软碳被去除,芳香性可接触表面增 加。 比表面积经过酸洗后明显增加,特别是 BC700 由 32.6m2 · g-1 突跃到 218m2 · g-1 ,这是由于酸处理剥离 表层矿物后,露出多孔有机碳表面,另外,酸与表层部 分不定型碳发生反应,对生物炭表面具有一定的开孔 作用。可见,不同温度和矿物含量的生物炭具有不同 的结构特征,将对污染物的吸附性能和机理有重要的 影响。
生物炭对西维因的吸附特征与生物炭制备温度 及比表面积有关,说明生物炭比表面积和孔隙度对吸 附具有重要影响,表面吸附起到一定作用,西维因在 生物炭表面可能发生孔填充作用。此外,经过酸处理 后,生物炭表面无机矿物被剥离 [23] ,露出更多的有机 质吸附点位,使西维因分子可接触到原来被无机矿物 覆盖的吸附点位以及经过酸洗开孔作用新增的吸附 点位,因此生物炭的吸附能力被大大增强。
生物炭对西维因的吸附与生物炭的点位可及性 有关。BC350 是无机矿物、 不定型的脂肪碳及玻璃态 的芳香碳共存的结构,部分原生态脂肪碳已经过渡到 芳香碳,表面既具有起分配作用的 “软碳” ,又具有可 发生特殊作用力(表面吸附与孔填充作用) 作用的 “硬 碳” ,因此表现出非线性。BC700 经过高温热解,脂肪 碳全部转化为芳香碳,而且极性降低,提供了更多利 于吸附的刚性平面,主要表现为特殊作用力。表 2 中 经过除灰处理后,BC350 的非线性增加(n 由 0.718 降 低到 0.615) ,而 BC700 的非线性降低(n 由 0.302 升高到 0.448) 。这可能是由于经过酸洗处理,BC350 表 面矿物被去除,提供了更多可及的吸附点位,并且部 分不定型的有机质同时被去除,结晶态有机质部分比 例升高,使吸附非线性增加。BC700 本身是结晶态的 芳香结构,具有很强的非线性,经过酸处理后,表面结 构遭到一定程度的破坏,部分芳香碳受到损失,使非 线性略有减弱。因此,可以认为,西维因在生物炭上的 吸附由多种过程控制,其吸附机制因生物炭结构的变 化而变化。
通过比较表 2 中西维因在生物炭上的分配系数 Kd,发现当西维因浓度低时,生物炭表面吸附点位相 对丰富,随着浓度的升高,表面吸附点位逐渐被西维 因占据 ,Kd值逐渐降低 。 而且低浓度时BC700> BC350; 高浓度时 BC700 与 BC350 较接近。这主要是 因为两种生物炭的结构不一,导致吸附机制随温度变 化不一。 西维因是非离子型农药,其分子具有氨基、 酯 基及苯环结构。 这些结构有利于西维因与高度芳香化 的 BC700 发生电子受体-供体相互作用,促进了表面 吸附作用力 [24] 。因此,BC700 具有特殊作用力的吸附 活性点位有限,在低浓度时具有优势。 而 BC350 尚有 一部分不定型的脂肪碳,能够以分配机制吸附西维因 分子,因此在高浓度时表现出优势。经过除灰处理后 Kd增大,这是由于除灰处理后,生物炭比表面积增 大,矿物表层脱落,有机质吸附点位露出,西维因分子 可及的有效吸附位增加 [25] 。
西维因是氨基甲酸酯类杀虫剂,在中性及弱酸性 环境中较稳定,在碱性环境中易被催化水解。添加生 物 炭 后,溶液 pH 升高 ,BC700(pH7.6) > BC350 (pH7.1) ,且随着添加量增加到 500 mg,pH 进一步升 高,BC700 体系升高到 9.1,BC350 体系升高到 7.9。表 明西维因的水解是由于溶液中 pH 偏碱性造成的碱 催化水解。生物炭是无机矿物、 不定型有机质及结晶 态有机质共存的复合结构,表面被无机矿物包裹,类 似于黏土矿物,具有很高的阳离子交换量 [26] 。生物炭 加入水溶液后,表面阳离子和水分子的 H+ 进行离子 交换,使水溶液中具有大量游离的 OH-,升高了体系 的 pH。此外,添加生物炭的体系与相同 pH 条件下的 纯水体系(预实验水中半衰期: pH=6.8 时约26d,pH= 8.9 时约 4h) 相比,对西维因的水解起到更大的促进 作用。表明除碱催化机制外,还有其他因素影响西维 因水解。Wei 等 [27] 研究黏土矿物对氨基甲酸酯农药的 水解反应影响,发现黏土表面矿物对氨基甲酸酯也有 催化作用,可能是通过表面螯合作用或表面酸性机制产生催化效应。高灰分生物炭结构与黏土矿物类似, 黏土矿物具有的催化机制,可能是生物炭对西维因催 化水解的另一种机制。 4 结论
高灰分生物炭具有无机矿物、 不定型有机质及结 晶态芳香碳有机质相互结合的结构,作为吸附剂能够 有效地吸附西维因。 生物炭对西维因的吸附表现出非 线性,且随处理温度的升高,非线性增强。 高温热解得 到的生物炭的吸附性能强于低温热解的生物炭,低温 热解的生物炭既有分配作用又有特殊作用力,而高温 热解的生物炭以特殊作用力为主。 生物炭经过除灰处 理,剥离了表面覆盖的无机矿物,增强了其对西维因 的吸附能力。
高灰分生物炭使溶液 pH 升高,对西维因具有碱 催化水解作用,且随处理温度的升高,生物炭灰分增 加,对西维因碱催化水解能力增强。
综上所述,以农业业废弃物猪粪为原料制备的生物 炭能够有效地吸附农药,并且对农药有碱催化水解作 用,将生物炭施加于土壤,不仅能够固定土壤中过量 施加的农药,阻止其随径流迁移,而且能够碱催化水 解土壤中长期积累的农药,有效地修复农药污染土 壤,降低环境风险。
| [1] | Johannes Lehmann, Stephen Joseph. Biochar for environmental management science and technology[M]. London, UK: Earthscan, 2009. |
| [2] | Hsu Nai-hua, Wang Li-shan, Lin Yu-chi, et al. Reduction of Cr(Ⅵ) by crop-residue-derived black carbon[J]. Environmental Science & Te chnology, 2009, 43: 8801-8806. |
| [3] | Liu Zhen -gang, Zhang Fu -shen. Removal of lead from water using biochars prepared from hydrothermal liquefaction of biomass[J]. J ournal of Hazardous Materials , 2009, 167: 933-939. |
| [4] | Cao xin -de, Harris Willie. Properties of dairy -manure derived biochar pertinent to its potential use in remediation[J]. Biore s ource Technology, 2010, 101: 5222-5228. |
| [5] | 吴 成, 张晓丽, 李关宾. 黑碳制备的不同热解温度对其吸附菲的影 响[J]. 中国环境科学, 2007, 27(1): 125-128. WU Cheng, ZHANG Xiao-li, LI Guan-bin. Effects of pyrolytic temperature of phenanthrene on its adsorption to black carbon[J]. China Envi ronme ntal Science , 2007, 27(1): 125-128. |
| [6] | Cho Yeo-myoung, Ghosh Upal, Kennedy Alan J, et al. Field application of activated carbon amendment for in-situ stabilization of polychlorinated biphenyls in marine sediment[J]. Environme ntal Science & Technology, 2009, 43: 3815-3823. |
| [7] | 张阿凤, 潘根兴, 李恋卿. 生物黑炭及其增汇减排与改良土壤意义[J]. 农业环境科学学报. 2009, 28(12): 2459-2463. ZHANG A-feng, PAN Gen -xing, LI Lian -qing. Biochar and the effect on C stock enhancement, emission reduction of green house gases and soil reclaimation[J]. J ournal of Agro -Environme nt Science , 2009 , 28(12): 2459-2463. |
| [8] | Laird David A, Brown Robert C, Amonette James E. Review of the pyrolysis platform for coproducing bio-oil and biochar[J]. Biofuels Bio products & Biorefining, 2009,3: 547-562. |
| [9] | Kidd H, James DR(Eds.). The agrochemicals handbook[M]. Second Edition. Cambridge, UK: Royal Society of Chemisty Information Services, 1991. |
| [10] | Beyers Daniel W, Carlson Clarence A, Keefe Thomas J. Toxicity of carbaryl and malathion to two federally endangered fishes, as estimated by regression[J]. Environmental Toxicology and Chemis try , 1994 , 13 : 101-107. |
| [11] | Murthy N B. Effect of carbaryl and 1 -naphthol on seedling growth of barley, and on growth and nodulation of groundnut in two soils[J]. Proc eedings of the Indian A cademy of Sciences(Plant Scie nces) , 1990, 100(1): 11-16. |
| [12] | Qiu Yu -ping, Cheng Hai -yan, Xu Chao. Surface characteristics of crop-residue-derived black carbon and lead(Ⅱ)adsorption[J]. W ater Res earch, 2008, 42: 567-574. |
| [13] | Chun Yuan, Sheng Guang-yao, Chou T, et al. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science & Technology, 2004, 38(17): 4649-4655. |
| [14] | Yang Ya-ning, Sheng Guang-yao. Enhanced pesticide sorption by soils containing particulate matter from crop residue burns[J]. Environmental Science & Te chnology, 2003, 37(16): 3635-3639. |
| [15] | ASTM, D1762-84 Standard test method for chemical analysis of wood charcoal[S]. Conshohocken, PA, 2007. |
| [16] | 鲁如坤. 土壤农化分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Soil agricultural chemical analysis method[M]. Beijing: China Agricultural Scientech Press, 2000. |
| [17] | Qin Su-jie, Gan Jian-ying, Liu Wei -ping, et al. Degradation and ad sorption of foshiazate in soil[ J]. J ournal of A gricultural and Food Chemis try, 2004, 52: 6239-6242. |
| [18] | Zhang Hong-hua, Lin Kun -de, Wang Hai -long, et al. Effect of Pinus radiata derived biochars on soil sorption and desorption of phenanthrene[J]. Environmental Pollution, 2010, 158: 2821-2825. |
| [19] | Marco keiluweit, Peters Nico, Mark G Johnson, et al. Dynamic molecular structure of plant biomass-derived black carbon(biochar)[J]. Environmental Science & Technology, 2010, 44: 1247-1253. |
| [20] | Baldock J A, Smernik R J. Chemical composition and bioavailability of thermally altered pinus resinosa(red pine)wood[J]. Organic Geo chemis try, 2002, 33: 1093-1109. |
| [21] | Chen B L, Johnson E J, Chefetz B, et al. Sorption of polar and nonpolar aromatic organic contaminants by plant cuticular materials: The role of polarity and accessibility[J]. Environmental Science & Technology, 2005, 39: 6138-6146. |
| [22] | Gunasekara A S, Simpson M J, XingB S. Identification and characterization of sorption domains in soil organic matter using structurally modified humic acids[J]. Environmental Scienc e & Technology, 2003, 37: 852-858. |
| [23] | Yang Yu, Shu Liang, Wang Xi -long, et al. Impact of de-ashing humic acid and humin on organic matter structural properties and sortion mechanisms of phenanthrene[J]. Environmental Science & Technology, 2011, 45(9): 3996-4002. |
| [24] | Nguyen Thanh H, Cho Hyun-hee, Poster Dianne L, et al. Evidence for a pore-filling mechanism in the adsorption of aromatic hydrocarbons to a natural wood char[J]. Environmental Science & Technology, 2007, 41: 1212-1217. |
| [25] | Ji liang-liang, Wan Yu-qiu, Zheng Shou-rong, et al. Adsorption of tetracycline and sulfamethoxazole on crop residue -derived ashes: implication for the relative importance of black carbon to soil sorption[J]. Env ironmental Science & Technology, 2011, 45(13): 5580-5586. |
| [26] | Bruno O Dias, Carlos A Silva,Fábio S Higashikawa, et al. Use of biochar as bulking agent for the composting of poultry manure: Effect on organic matter degradation and humification[J]. Biores ource Tech nology, 2010, 101: 1239-1246. |
| [27] | Wei J, Furrer G, Kaufmann S, et al. Influence of clay minerals on the hydrolysis of carbamate pesticides[J]. Environmental Science & Tech nology, 2001, 35(11): 2226-2232. |
 2012, Vol. 31
2012, Vol. 31