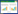文章信息
- 钟来元, 沐杨昌, 杨杰文
- ZHONG Lai-yuan, MU Yang-chang, YANG Jie-wen
- 不同尺寸纳米针铁矿表面性质及其对Cr(Ⅵ)吸附量的比较
- Surface Properties and Cr(Ⅵ) Adsorption of Nano-goethite of Different Sizes
- 农业环境科学学报, 2015, 34(11): 2120-2125
- Journal of Agro-Environment Science, 2015, 34(11): 2120-2125
- http://dx.doi.org/10.11654/jaes.2015.11.012
-
文章历史
- 收稿日期: 2015-05-24
纳米材料是指长、宽、高中至少有一维的尺寸在1~100 nm范围内的物质。当固体颗粒大小减小到纳米尺度时,表面原子数量所占比例急剧升高,由于具有较少的最相邻原子或配位数,表面原子具有很高的自由能和活性[1]。因此,与大尺寸(> 100 nm)颗粒相比,纳米颗粒在表面结构与性质、化学吸附反应等方面有特殊表现。近年来,纳米颗粒固-液界面过程已成为地球化学、环境化学等领域研究热点[2]。
大量研究已证实,颗粒尺寸大小对金属氧化物吸附重金属离子有重要影响。7 nm赤铁矿对Cu2+的吸附量比25 nm或88 nm尺寸的大,而后两者的吸附量基本相同[3]。这可能是由于7 nm样品表面弛豫或重构作用,导致其配位环境更匹配Cu2+与表面氧原子络合过程中的Jahn-Teller效应。10.5 nm和550 nm赤铁矿对Zn2+的吸附机理也存在明显区别,前者可形成四或六配位锌表面络合物,而后者仅存在六配位锌表面络合物[4]。总之,尺寸效应广泛存在于金属氧化物对重金属离子的吸附过程中[5, 6, 7, 8],但相关机理还有待进一步探明。
针铁矿是土壤中常见金属氧化物,化学性质十分活跃,也可以纳米形态存在于自然界[9]。过去数十年,针铁矿吸附重金属反应已有大量文献报道[10]。但目前尚不清楚不同纳米尺寸针铁矿的表面性质及其对污染吸附能力的差异。因此,本文拟用XRD、HRTEM、ζ-电位和ATR-FTIR等技术对3种不同纳米尺寸针铁矿表面性质进行表征,并比较它们对土壤典型重金属污染物Cr(Ⅵ)的吸附量,以期促进人们对纳米材料在控制污染物环境行为方面的认识。
1 材料与方法 1.1 不同尺寸纳米针铁矿的制备与表征所用试剂均从Fisher Scientific公司购得;实验用水为18.2 MΩ·cm超纯水(Merck Millipore公司Milli-Q®水纯化系统制备)。所有玻璃器皿均用10%稀硝酸浸泡过夜,依次用自来水、超纯水洗净后备用。
参照文献方法[11],制备尺寸大小为10、20、30 nm左右针铁矿,所得悬液样品在6000~8000 D渗透膜内进行纯化,直至渗析液电导率小于1.0 μS·cm-1。将纯化好的样品保存在棕色玻璃瓶备用。针铁矿颗粒物浓度(M/V)用烘干法测定:称取一定体积悬液至烧杯,100 ℃烘干至恒重,用差减法计算针铁矿浓度。
晶型分析:将一定体积纳米针铁矿悬液均匀分散在洁净载玻片上,室温下风干后,对样品进行X射线衍射分析(X′Pert X-Ray Diffractometer,飞利浦,荷兰)。样品晶型用Jade 6.0软件分析,衍射谱图用Origin Pro 8.0 绘制。
HRTEM表征:将一定体积5 mg·L-1纳米针铁矿悬液滴至镀碳铜筛,室温下风干后,对样品进行HRTEM分析(JEM-2000FX,日本电子公司)。图像导入Image J软件,随机量取50个颗粒的长、宽尺寸,计算平均值得到颗粒大小尺寸。经分析,本实验所得纳米针铁矿实际平均尺寸分别为10.1、24.5、36.4 nm,故以下将样品称为Goe-10、Goe-24和Goe-36。
ATR-FTIR表征:所用仪器为PerkinElmer公司Spectrum one傅立叶变换红外光谱(LiTaO3检测器,ATR配件为单反射水平金刚石/ZnSe晶体)。将约0.5 mL 的5 g·L-1纳米针铁矿悬液直接滴到ATR配件晶面,风干后,收集样品红外数据(扫描次数150次,波长范围600~4000 cm-1,波长分辨率4 cm-1,扫描速度0.5 cm·s-1)。寻峰和差谱用Omnic 8.0软件完成。
ζ-电位测定:配置一系列以0.01 mol·L-1 NaCl为支持电解质的50 mg·L-1纳米针铁矿悬液,用0.1 mol·L-1 HCl 或NaOH将其pH值调节在3.0~11.0范围内,振荡72 h后测定悬液pH值,并取数毫升悬液测定其ζ-电位(ZetaPals,Brookhaven仪器公司,美国)
1.2 针铁矿对Cr(Ⅵ)吸附实验按针铁矿浓度5.0 g·L-1、Cr(Ⅵ)浓度0.5 mmol·L-1、NaNO3浓度0.01 mol·L-1的初始反应条件,依次向50 mL塑料离心管加入一定体积纳米针铁矿悬液、以NaNO3为支持电解质的K2CrO4溶液,随后加超纯水至悬液体积为25 mL。用0.1 mol·L-1 HCl 或NaOH将悬液pH值控制在3.0~11.0范围内,振荡72 h使反应达到平衡后[12]测定悬液pH值。取一部分样品于10 000 r·min-1离心15 min,上清液过0.25 μm滤膜,用二苯碳酰二肼法测定滤液Cr(Ⅵ)浓度[13]。剩余样品用于测定悬液ζ-电位。
针铁矿吸附Cr(Ⅵ)ATR-FTIR表征:
(1)溶液Cr(Ⅵ)红外光谱。配置以0.01 mol·L-1 NaCl为支持电解质的100 mmol·L-1 K2CrO4溶液,将pH值调节在3.0~11.0范围内,随后收集其红外光谱。
(2)表面吸附态Cr(Ⅵ)光谱。由于高pH条件下,Cr(Ⅵ)吸附量很低,仅对pH 3.5条件进行研究。吸取该条件下含有吸附态Cr(Ⅵ)的纳米针铁矿悬液于ATR晶面,风干后收集红外数据。由于悬液中Cr(Ⅵ)离子浓度极低,所得红外数据被认为仅包含纳米针铁矿和吸附态Cr(Ⅵ)信息,将针铁矿贡献扣除后,即可得到吸附态Cr(Ⅵ)红外光谱。
2 结果与讨论 2.1 不同尺寸纳米针铁矿表征将XRD数据输入Jade 6.0软件,经过背景扣除、曲线平滑处理和拟合等步骤后,检索PDF卡,可知本文所合成样品均为针铁矿(图 1)。样品Goe-10、Goe-24和Goe-36均在2θ角约为21°处出现最大衍射峰,晶面间距d值分别为0.417 72、0.417 82、0.417 87 nm,与报道值0.418 3 nm基本一致[10]。该衍射峰对应的晶面为(101)面。同时,最大衍射峰所对应半峰宽值(°)依次为0.758、0.689和0.647。图 1还表明:Goe-10的(002)晶面、Goe-22和Goe-36的(301)晶面分别产生各自样品的第二大衍射峰。研究发现,d值和半峰宽大小受结晶度、内应力、结晶缺陷等因素影响。晶粒尺寸越小,则d值越大,峰越宽[14]。由此可见,本文所研究的3个样品中,Goe-10结晶度最低,Goe-36最高,Goe-24介于两者之间。
|
| 图 1 不同尺寸纳米针铁矿X 射线衍射谱 Figure 1 XRD patterns of nano-goethite of different sizes |
TEM图像表明,上述3个针铁矿样品均呈细长针状外观,晶体主要沿c轴生长。但如图 2左侧高倍图像中直线所示,Goe-24样品晶粒端面呈较规则几何形状,而Goe-10端面形状不规则,说明相关晶面生长不充分。此外,从图 2右侧低倍图像中圆圈区域可以看出,针铁矿纳米颗粒之间某些沿同一方向生长的晶面可相互粘连,形成晶畴和表面台阶位。

|
| 图 2 不同尺寸纳米针铁矿TEM 图像 Figure 2 TEMimages of nano-goethite of different sizes |
总之,根据XRD和TEM结果可知,受生长过程中pH和温度等因素的影响,针铁矿颗粒最终可生成不同纳米尺寸晶体,各类型晶面的发育程度不同,导致结晶程度和表面相貌也不同。
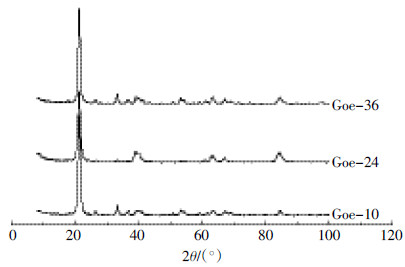
利用ATR-IR可以获取针铁矿表面以及内部结构的信息。根据前人研究[10],3140 cm-1被指认为体相羟基(υOH)伸缩振动频率;892 cm-1是位于(001)晶面上羟基(δOH)面内弯曲振动频率,795 cm-1是该晶面上羟基(γOH)面外弯曲振动频率,这两者是针铁矿红外诊断频率;630 cm-1是Fe-O对称伸缩振动频率。如图 3所示,本文所研究3个针铁矿样品表面相关官能团均在上述波数附近表现出红外活性,但具体数值略有差异。研究发现结晶度降低将使羟基的弯曲振动频率降低,而伸缩振动频率升高[15]。但从图 3并未得出类似结论,其中原因还有待研究。
|
| 图 3 不同尺寸纳米针铁矿ATR-IR 表征 Figure 3 Characterization of nano-goethite of different sizes by ATR-IR |
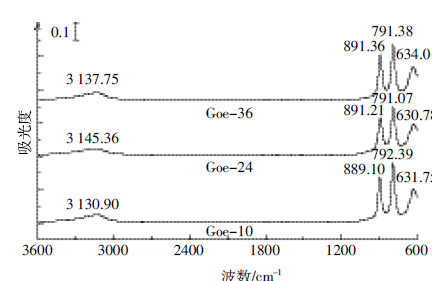
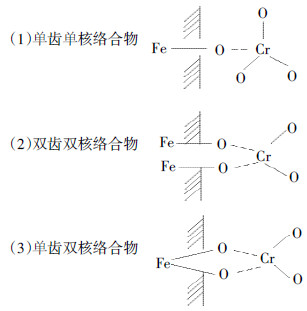
由图 4可知,尺寸大小对针铁矿表面ζ-电位有一定影响。就所研究3种针铁矿样品而言,其ζ-电位有如下大小顺序:Goe-10 > Goe-24 ≈ Goe-36,表明Goe-10表面所带正电荷数量最多。目前认为,针铁矿表面末端O与Fe有三种配位方式[10]:
|
| 图 4 不同pH条件下纳米针铁矿表面ζ-电位 Figure 4 ζ-potential of nano-goethite of different size as a function of pH |
表面末端氧原子对溶液H+的亲和力因其配位方式不同而不同,以单配位方式最强,后两者相对较弱[16]。同时,晶面类型不同,其表面氧原子配位方式也不同,如上述3种配位方式均可出现在(101)晶面,而(210)晶面仅存在单配位和双配位2种方式。因此,在相同pH条件下,不同晶面所带电荷的数量和性质将有明显区别。正如分子模拟结果表明[17]:(110)晶面之间夹角越小,越有利于H+的累积,所带正电荷数量越多。因此,在2~10 nm尺寸范围内,具有较高(110)/(021)晶面面积比的针铁矿颗粒表面所带电荷数量较多。
更进一步的是,Goe-10与 Goe-24、Goe-36的等电点(PZC)也不相同,前者为8.77,后两者为8.22,这同样是由它们晶面类型及其组成方式的差异所致。在针铁矿3个重要组成晶面中,(001)晶面的PZC为8.9,(101)晶面为9.2[18]。总之,以上结果再次说明Goe-10与 Goe-24、Goe-36在晶体结构和表面性质方面存在较大差异。
2.2 不同尺寸纳米针铁矿对Cr(Ⅵ)的吸附如图 5所示,针铁矿对Cr(Ⅵ)的吸附量与其尺寸大小和pH条件有关。3种样品对Cr(Ⅵ)的吸附量均随pH升高而降低。这是因为pH越低,表面所带正电荷数量越多,对阴离子的静电引力作用越强,有利于阴离子与表面的相互作用;相反,随着pH升高,表面所带负电荷数量增加,对阴离子的静电斥力作用增强,不利于阴离子向表面靠近。但就尺寸效应而言,Cr(Ⅵ)吸附量大小顺序为Goe-10 > Goe-24 ≈ Goe-36。正如图 4所示,在相同pH条件下,Goe-10所带正电荷数量最多,其对Cr(Ⅵ)离子的吸附量也相应最大。由此可见,只有当针铁矿尺寸 < 10 nm时,表面暴露出的吸附位点才显著增加,才能观察到明显的纳米效应。
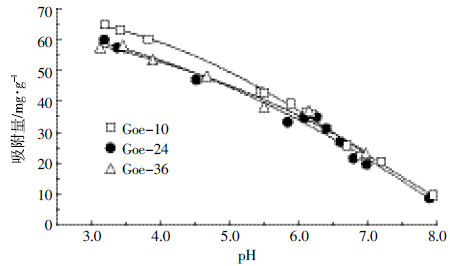
|
| 图 5 不同pH条件下纳米针铁矿对Cr(Ⅵ)的吸附 Figure 5 Adsorption of Cr(Ⅵ) by nano-goethite of different sizes as a function of pH |
吸附作用导致表面ζ-电位变化通常被认为是专性吸附的重要证据[19]。如图 6所示,纳米针铁矿对Cr(Ⅵ)的吸附方式也为专性吸附。这是因为吸附Cr(Ⅵ)后,纳米针铁矿(Goe-10)表面ζ-电位值降低,尤其是在低pH条件下,变化更加明显。该结论与前人报道的针铁矿对Cr(Ⅵ)吸附方式一致[20]。表面吸附态Cr(Ⅵ)空间结构可表示为:
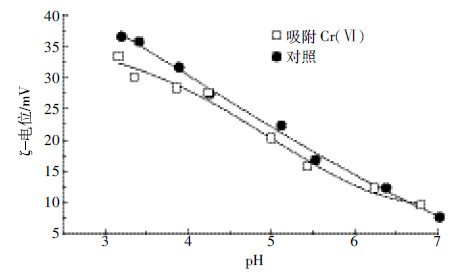
|
| 图 6 吸附Cr(Ⅵ)对纳米针铁矿(Goe-10)表面ζ-电位的影响 Figure 6 Effect of Cr(Ⅵ) adsorption on ζ-potential of nano-goethite as a function of pH |
此外,ATR-FTIR对针铁矿对Cr(Ⅵ)吸附反应的表征结果也能证实上述结论。溶液中Cr(Ⅵ)离子有3种形态(CrO2-4、HCrO-4和Cr2O2-7),它们相互间可建立以下化学平衡[21]:
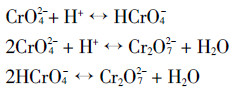
该化学平衡的移动主要受pH和离子浓度等因素控制。同时,Cr(Ⅵ)离子的形态不同,其红外特征也不同。如图 7所示,在pH 3.0~10.0范围内,100 mmol·L-1 Cr(Ⅵ)离子可在949、897、881、877、775 cm-1等波数处表现出红外活性。参考前人研究结果[21]可知,HCrO-4红外振动频率为949、897 cm-1;Cr2O2-7红外振动频率为949、881、773 cm-1;CrO2-4红外振动频率为880 cm-1。由于Cr2O2-7仅在Cr(Ⅵ)初始浓度很高的条件下存在,在本文实验条件下,可仅考虑HCrO-4与针铁矿表面的相互作用。
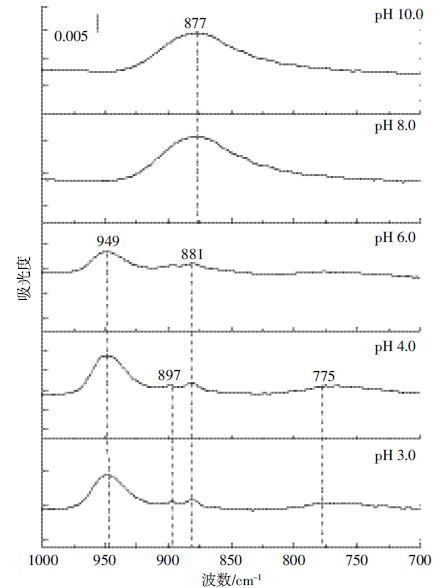
|
| 图 7 不同pH条件下Cr(Ⅵ)离子(100 mmol·L-1)红外光谱特征 Figure 7 IR spectrum of 100 mmol·L-1 Cr(Ⅵ) under different pH |
经扣除背景,图 8显示出针铁矿表面吸附态Cr(Ⅵ)的红外光谱特征。Goe-10表面吸附态Cr(Ⅵ)分别在944.95、889.02、790.67、730.89 cm-1等波数处表现出红外活性,且振动频率与溶液离子态的区别十分明显。这显然是针铁矿对HCrO-4的专性吸附作用所致。
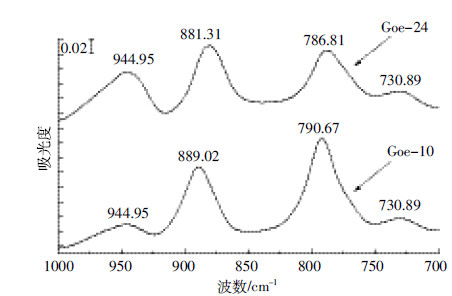
|
| 图 8 纳米针铁矿对Cr(Ⅵ)吸附的ATR-FTIR表征 Figure 8 Characterization of Cr(Ⅵ) adsorption on nano-goethite of different sizes by ATR-FTIR |
通过控制Fe(Ⅲ)/OH-摩尔浓度比、老化温度等反应条件,可得到10.1、24.5、36.4 nm针铁矿样品。当颗粒尺寸减小到10 nm,针铁矿结晶度降低,某些晶面发育不完整。3种尺寸针铁矿样品均出现相互平行晶面某种程度粘连的晶筹现象。利用ATR-FTIR技术,得到了体相羟基(υOH)伸缩振动、(001)晶面上羟基(δOH)面内和面外弯曲振动以及Fe-O对称伸缩振动频率。针铁矿表面所带正电荷数量多少顺序为Goe-10>Goe-24≈Goe-36,表明颗粒尺寸越小,其表面正电荷数量越多,因而对Cr(Ⅵ)的吸附量越大。纳米针铁矿对Cr(Ⅵ)的吸附方式为专性吸附。
| [1] | Fernández-García M, Martínez-Arias A, Hanson J C, et al. Nanostructured oxides in chemistry:Characterization and properties[J]. Chemical Reviews, 2004, 104(9):4063-4104. |
| [2] | Auffan M, Rose J, Bottero J Y. Towards a definition of inorganic nanoparticles from an environmental, health and safety perspective[J]. Nature Nanotechnology, 2009, 4(10):634-641. |
| [3] | Madden A S, Hochella Jr M F, Luxton T P. Insights for size-dependent reactivity of hematite nanomineral surfaces through Cu2+ sorption[J]. Geochimica et Cosmochimica Acta, 2005, 70(16):4095-4104. |
| [4] | Ha J Y, Trainor T P, Farges F, et al. Interaction of aqueous Zn(Ⅱ) with hematite nanoparticles and microparticles:Part 1. EXAFS study of Zn(Ⅱ) adsorption and precipitation[J]. Langmuir, 2009, 25(10):5574-5585. |
| [5] | Yean S, Cong L, Yavuz C T, et al. Effect of magnetite particle size on adsorption and desorption of arsenite and arsenate[J]. Journal of Materials Research, 20(12):3255-3264. |
| [6] | Auffan M L, Rose J, Proux O, et al. Enhanced adsorption of arsenic onto maghemites nanoparticles:As(Ⅲ) as a probe of the surface structure and heterogeneity[J]. Langmuir, 2008, 24(7):3215-3222. |
| [7] | Zeng H, Singh A, Basak S, et al. Nanoscale size effects on uranium(Ⅵ)adsorption to hematite[J]. Environmental Science and Technology, 2009, 43(5):1373-1378. |
| [8] | Zhang H Z, Chen B, Banfield J F. The size dependence of the surface free energy of titania nanocrystals[J]. Physical Chemistry Chemical Physics, 2009, 11(14):2553-2558. |
| [9] | Qafoku N P. Terrestrial nanoparticles and their controls on soil-/Geo-processes and reactions[J]. Advances in Agronomy, 2010, 107:33-91. |
| [10] | Cornell R M, Schwertmann U. The iron oxides:Structure, properties, reactions, occurrences, and uses[M]. 2ed. Weinheim:Wiley-VCH Verlag, 2003:253-296. |
| [11] | Zhang H Z, Bayne M, Fernando S, et al. Size-dependent bandgap of nanogoethite[J]. Journal of Physical Chemistry C, 2011, 115(36):17704-17710. |
| [12] | 杨杰文, 陈爱珠, 钟来元. 砖红壤对Cr(Ⅵ)吸附-解吸反应动力学研究[J]. 环境化学, 2010, 29(2):200-204.YANG Jie-wen, CHEN Ai-zhu, ZHONG Lai-yuan. Kinetics of chromium(Ⅵ) adsorption and desorption onto latosol[J]. Environmental Chemistry, 2010, 29(2):200-204. |
| [13] | Bartlett R, James B. Behavior of chromium in soils:Ⅲ. Oxidation[J]. Journal of Environmental Quality, 1979, 8(1):31-35. |
| [14] | Echigo T, Hatta T, Nemoto S, et al. X ray photoelectron spectroscopic study on the goethites with variations in crystallinity and morphology:Their effects on surface hydroxyl concentration[J]. Physics and Chemistry of Minerals, 2012, 39(9):769-778. |
| [15] | Rochester C H, Topham S A. Infrared study of surface hydroxyl groups on goethite[J]. J Chem Soc Faraday Trans, 1979, 75:591-602. |
| [16] | Boily J F, Felmy A R. On the protonation of oxo-and hydroxo-groups of the goethite(α-FeOOH) surface:A FTIR spectroscopic investigation of surface O-H stretching vibrations[J]. Geochimica et Cosmochimica Acta, 2008, 72(14):3338-3357. |
| [17] | Rustad J, Felmy A. The influence of edge sites on the development of surface charge on goethite nanoparticles:A molecular dynamics investigation[J]. Geochimica et Cosmochimica Acta, 2005, 69(6):1405-1411. |
| [18] | Gaboriaud F, Ehrhardt J J. Effects of different crystal faces on the surface charge of colloidal goethite(α-FeOOH) particles:An experimental and modeling study[J]. Geochimica et Cosmochimica Acta, 2003, 67(5):967-983. |
| [19] | Sposito G. The chemistry of soils[M]. New York:Oxford University Press, 1989:127-169. |
| [20] | Fendorf S, Eick M J, Grossl P, et al. Arsenate and chromate retention mechanisms on goethite:1. Surface structure[J]. Environmental Science and Technology, 1997, 31(2):315-320. |
| [21] | Hoffmann M M, Darab J G, Fulton J L. An infrared and X ray absorption study of the equilibria and structures of chromate, bichromate, and dichromate in ambient aqueous solutions[J]. Journal of Physical Chemistry A, 2001, 105(10):1772-1782. |
 2015, Vol. 34
2015, Vol. 34