文章信息
- 邓鑫, 周祥, 刘志红, 李晓军, 台培东
- DENG Xin, ZHOU Xiang, LIU Zhi-hong, LI Xiao-jun, TAI Pei-dong
- Cd2+对伸展摇蚊及黄色羽摇蚊幼虫的毒性效应研究
- Toxic Effects of Cadmium on Larvae of Chironomus riparius and Chironomus flaviplumus
- 农业环境科学学报, 2015, 34(9): 1640-1645
- Journal of Agro-Environment Science, 2015, 34(9): 1640-1645
- http://dx.doi.org/10.11654/jaes.2015.09.002
-
文章历史
- 收稿日期: 2015-03-24
2. 中国科学院沈阳应用生态研究所, 沈阳 110016;
3. 迪肯大学瓦南布尔校区环境与生命学院, 综合生态中心, 维多利亚 3280
2. Shenyang Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China;
3. Center for Integrated Ecology, School of Life and Environmental, Deakin University, Warrnambool Campus, Victoria 3280, Australia
镉(Cd)是生物的非必需元素,但作为自然界中主要的重金属污染物,近年来随着污水灌溉、农药杀虫剂使用、工业尤其是矿业点源排放等活动的日趋加剧,水体镉污染问题也持续加重,给水生态安全,尤其是水生生物带来了严重的危害[1]。镉进入水体后易累积在沉积物中,沉积物中的镉含量能达到水相中镉含量的上百倍[2]。由于镉难降解的特性,其进入水体沉积物后可通过生物积累效应进入食物链,危及水体生物甚至整个水生态系统的健康[3]。
摇蚊幼虫是底栖动物的代表性生物之一,在水体中分布广泛,约占底栖生物量的70%~80%[4],对水质变化敏感,是水体质量的重要指示生物,不同地域及水质的优势摇蚊种类不同。摇蚊幼虫是美国国家环境保护局(USEPA)和经济合作与发展组织(OECD)推荐的生物毒性测试物种[5],被大量用作检测沉积物及化学品毒性的生物物种,通过摇蚊幼虫的急慢性毒性研究对评估污染物对整体水生生物以及水体健康的影响有极大帮助。国内目前关于摇蚊研究主要集中在系统学、经济学方面,如将摇蚊作为指示生物监测水质[6, 7]、供水系统中摇蚊防治[8],但在毒理学方面的研究还开展较少[9, 10]。
本文选取伸展摇蚊(Chironomus riparius)和黄色羽摇蚊(Chironomus flaviplumus)为研究对象,两者均隶属于昆虫纲,双翅目,长角亚目,摇蚊科(Diptera:Chironomidae),是国际上推崇的受试物种,也是我国水体中常见的摇蚊种类,通过对其进行96 h急性毒性实验及20 d慢性毒性实验,以受试生物的死亡率、体长、口器畸形、羽化时间等为评价终点,对水体及沉积物中镉对摇蚊幼虫可能产生的影响进行全面分析,为我国水生态系统健康评价体系提供更理想的方法和指标。
1 材料与方法 1.1 实验材料培养液配制:摇蚊幼虫培养液的配制参照《沉积物-水系统中摇蚊毒性试验加标于沉积物法》(GB/T 27859-2011)[11]中介质M7制备方法。各组分最终浓度如下:CaCl2·2H2O 293.8 mg·L-1、MgSO4·7H2O 123.3 mg·L-1、KCl 5.8 mg·L-1、NaHCO3 64.8 mg·L-1、NaSiO3·9H2O 10.0 mg·L-1、NaNO3 0.274 mg·L-1、KH2PO4 0.143 mg·L-1、K2HPO4 0.184 mg·L-1。其pH 7.0~7.3、电导率185~190 μS·cm-1、溶解氧88~94 mg·L-1。
受试生物:6月采自野外的伸展摇蚊幼虫及黄色羽摇蚊在室内成功培养后用于实验,摇蚊羽化后移入培养箱产卵,培养条件为光暗周期16 h/8 h,温度(20±0.2)℃。将产于同一日的摇蚊卵取出放入培养液中孵化。慢性毒性实验选用1龄摇蚊幼虫(摇蚊卵孵化后3 d,体长约为0.2 cm),急性毒性实验选用3龄摇蚊幼虫(摇蚊卵孵化后8 d,体长约为3 cm)。将摇蚊食物(德彩鱼饲料)磨碎用培养液稀释成溶液,以每只摇蚊0.25~0.40 mg·d-1计,每2 d对摇蚊做一次食物补充。
试剂:CdCl2·2.5H2O,购自天津试剂厂,分析纯(纯度为99%)。
沉积物介质:使用抓斗式采泥器,采集辽河流域蒲河断面处上层松软的清洁沉积物,风干后用60目筛网去除大的枝叶及沉积物中的生物[12]。过筛后的沉积物保存在4℃冰箱中,备用。
1.2 实验方法 1.2.1 急性毒理实验方法选取同一天孵化的三龄摇蚊幼虫进行急性毒理实验。镉实测浓度分别为5.00、10.09、20.00、40.13、80.22 mg·L-1,96 h急性毒性实验设置3个平行样本。实验开始时记录烧杯重量及水位,补充实验用水保持固定水位,实验温度控制在(20±0.2)℃。每隔24 h观察各实验组摇蚊幼虫存活情况,使用玻璃棒轻触摇蚊幼虫3次后摇蚊幼虫不做"8"字运动则认定该摇蚊死亡。取出死亡虫体用于切片制作,于显微镜下观测其体长及口器畸形状况。
1.2.2 慢性毒性实验方法将可溶性CdCl2·2.5H2O设定为2.5、5.0、10.0、20.0、40.0、80.0、160.0、320.0 mg·kg-1,实测浓度分别为2.6、5.2、10.7、21.1、41.9、81.7、164.3、326.5 mg·kg-1。在500 mL烧杯中加入140 g (含水率69%)沉积物样品和190 mL培养液,沉积物上覆水体积比约为1:2,沉积物深约3 cm,每种浓度处理共3个重复。每个烧杯中加15头一龄伸展摇蚊及黄色羽摇蚊幼虫,置于光照培养箱中[(16 h光照/8 h黑暗),(20±0.2)℃]培养,24 h持续曝气。实验过程中,换水频率为一周3次,保证温度、pH值、上覆水硬度等参数与驯养期间一致。
1.2.3 镉测定方法沉积物样品经冷冻干燥后研磨,精确称取1 g研磨后的样品置于消解罐内,用少量蒸馏水润湿,加入7 mL纯硝酸和3 mL纯氢氟酸,轻微振荡后,放置0.5 h (预消解)后加盖密封,于微波消解炉内消解2 h[13]。消解完毕把样品倒入坩埚中,置于电热板上加热沸腾赶酸。至液体将尽,将坩埚从电热板上取下,加入2 mL HNO3溶解固体,移入100 mL比色管中,纯水定容,采用火焰原子吸收分光光度法分析镉含量。所有试验设置3个平行,实验结果取平均值。
1.2.4 玻片标本制作显微镜切片的制作遵循Seather的有关流程[14]。将死亡后的摇蚊幼虫制成切片,为防止解剖镊对口器部分破坏,制作切片时使用解剖镊将摇蚊头部作为整体解剖,将解剖后的头部移至滴有加拿大树胶的载玻片上,以盖玻片封片后,于玻片左侧标注摇蚊幼虫的采集数据,完成切片制作。使用显微镜对切片进行镜检和显微拍照。实验结束时仍存活的摇蚊幼虫置20%的乙醇中保存,待虫体死亡后,也制作成切片并在显微镜下检测口器畸形情况。
1.3 数据处理观察记录摇蚊幼虫存活数,利用Probit 法(SPSS for Win 10.0)计算半数死亡时的Cd2+浓度(96 h、20 d LC50)、相关系数及95%的置信区间,并推导相应毒力回归方程。 羽化时间计算方法参照GB/T 27859—2011[11]:
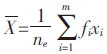
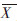 为摇蚊羽化时间;i为观察间隔数;m为观察间隔最大值;fi为观察间隔i中羽化的摇蚊数量;ne为实验最后阶段所羽化的摇蚊总数(ne=∑fi);xi为观察间隔i中所羽化的摇蚊发育速率。
为摇蚊羽化时间;i为观察间隔数;m为观察间隔最大值;fi为观察间隔i中羽化的摇蚊数量;ne为实验最后阶段所羽化的摇蚊总数(ne=∑fi);xi为观察间隔i中所羽化的摇蚊发育速率。
所得数据经Excel和SPSS 14.0统计分析软件处理后,采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)进行摇蚊幼虫各观测指标间的差异分析(显著性水平为0.05),使用Pearson相关系数评价不同因子间的相关关系。
2 实验结果 2.1 Cd2+对摇蚊幼虫的急性毒性试验 2.1.1 Cd2+对摇蚊幼虫的致死性比较随着镉处理浓度的增加,摇蚊幼虫行动逐渐变慢,生长率减缓,对照组中有部分摇蚊进入了四龄期,但实验组并未出现发育到四龄的幼虫。同时,随着暴露时间的延长,摇蚊体色越来越淡,死亡时颜色接近乳白色。
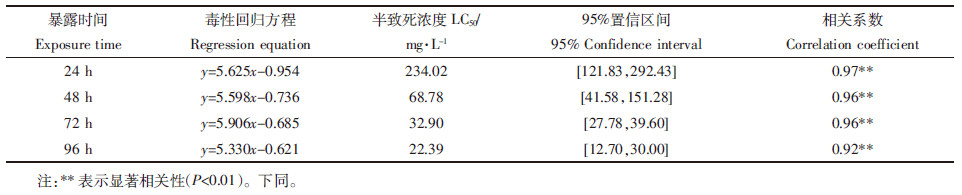
急性毒性试验的毒理回归方程、半致死浓度和相关系数统计结果如表 1、表 2所示。Cd2+对三龄伸展摇蚊及黄色羽摇蚊幼虫96 h LC50值分别为22.39 mg·L-1及33.41 mg·L-1。在4个不同的暴露时间点上,Cd2+对三龄黄色羽摇蚊幼虫的半致死毒性分别是三龄伸展摇蚊幼虫的1.15、1.26、1.60、1.49倍。随着暴露时间的延长,LC50值逐渐减小。
 |
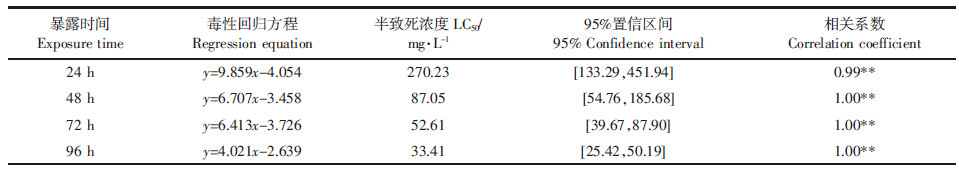 |
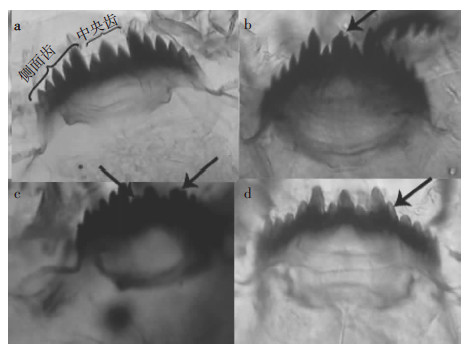
正常情况下伸展摇蚊幼虫下唇板如图 1a所示,呈规则的弧线,其上包含3个中央齿和12个侧面齿。如果出现口器畸形,畸形类别有中央齿裂开(图 1b)、侧面齿缺失和中央齿缺失(图 1c)、下唇板齿式颜色变淡(图 1d)等多种。
|
| 图 1 伸展摇蚊幼虫口器及畸形示意图 Figure 1 Mentum and mentum deformity of C. riparius |
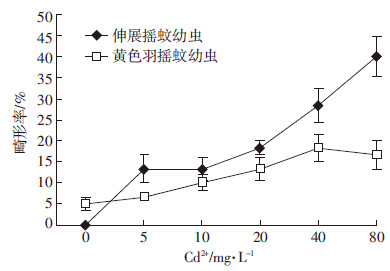
不同浓度的Cd2+对三龄伸展摇蚊幼虫及黄色羽摇蚊幼虫口器畸形的影响如图 2所示。当Cd2+浓度为0、5.00、10.00、20.00、40.00、80.00 mg·L-1时,三龄伸展摇蚊幼虫的畸形率分别达到0.00%、13.33%、13.33%、18.33%、28.33%、40.00%,而同龄黄色羽摇蚊幼虫的畸形率则分别为5.00%、6.67%、10.00%、13.33%、20.00%、18.33%。相关性检验发现,摇蚊幼虫形率与Cd2+浓度之间存在显著正相关(P < 0.01),与伸展摇蚊幼虫的相关系数为0.98,而与黄色羽摇蚊幼虫的相关系数为0.89。在同浓度Cd2+处理下,三龄伸展摇蚊幼虫的畸形率通常要高于三龄黄色羽摇蚊幼虫。另通过对畸形类别统计表明,Cd2+对于摇蚊幼虫的口器畸形主要表现为侧面齿缺失和中央齿缺失。
|
| 图 2 三龄伸展摇蚊及黄色羽摇蚊幼虫在不同Cd2+浓度下口器畸形率 Figure 2 Mentum deformity rates of three instar C. riparius and C. flaviplumus |
20 d慢性暴露后,沉积物中不同Cd2+浓度对应的两种摇蚊幼虫的存活率和羽化用时见表 3。不同Cd2+浓度下摇蚊存活率之间存在显著差异,两种摇蚊幼虫的存活率均与Cd2+浓度显著负相关(P < 0.01)。通过SPSS14.0对相关数据进行统计分析后得出,沉积物中Cd2+对伸展摇蚊20 d半致死浓度LC50值为226.26 mg·kg-1(95%置信区间为[156.62,371.55]),对黄色羽摇蚊20 d半致死浓度LC50值为351.84 mg·kg-1(95%置信区间为[225.621,664.862])。由于最高测试浓度下黄色羽摇蚊幼虫死亡率低于50%外推结果,因此可能存在一定误差。总之,黄色羽摇蚊比伸展摇蚊对沉积物中Cd2+有更高的耐受性。
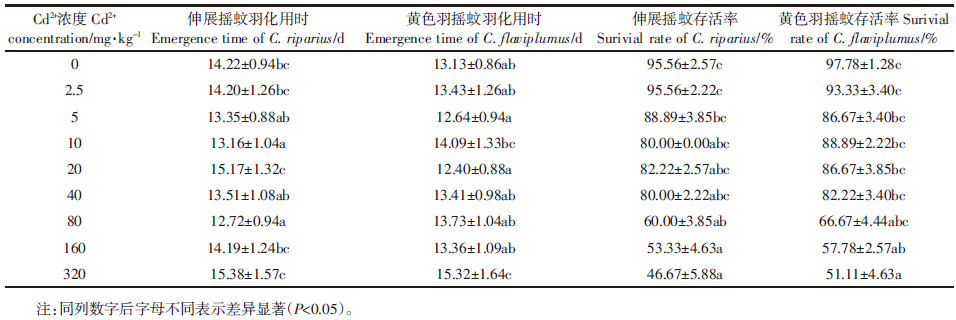 |
不同Cd2+浓度下摇蚊羽化用时存在显著差异,伸展摇蚊羽化用时与沉积物中Cd2+浓度正相关但不显著,Cd2+浓度与黄色羽摇蚊羽化用时则显著正相关(P < 0.05)。当Cd2+为2.5 mg·kg-1时,摇蚊羽化用时及存活率与对照组相比均无差异;当Cd2+浓度为320 mg·kg-1时,摇蚊幼虫羽化用时最长。实验过程中观察到,摇蚊幼虫最容易死亡的时期为一龄期、二龄期及蛹期。与对照组相比,Cd2+浓度大于80 mg·kg-1时,处理组羽化出的摇蚊飞行无力,且羽化后存活时间低于对照组。
3 分析与讨论 3.1 Cd2+对摇蚊幼虫的急性毒效摇蚊存活率是摇蚊毒性实验中常见的监测指标。本试验中Cd2+对三龄伸展摇蚊及黄色羽摇蚊幼虫的96 h LC50分别为22.39 mg·L-1及33.41 mg·L-1。大量研究证明高龄摇蚊幼虫对污染的耐受能力更强[15, 16],耐受能力的增加和镉摄入量的累积共同导致LC50值随着暴露时间的增加逐渐减少。
有研究表明摇蚊幼虫对不同污染物的耐受性也有所不同,如摇蚊属(Chironomus)耐有机污染能力强;而前突摇蚊属(Procladius)耐重金属污染能力更强[17]。本研究中Cd2+对三龄黄色羽摇蚊幼虫96 h LC50是三龄伸展摇蚊幼虫的1.49倍。有学者认为不同摇蚊幼虫对同种重金属耐受性间的差异,是由不同物种摇蚊幼虫对重金属的排泄作用及重金属结合蛋白量的不同而导致的[18, 19]。
外源毒物对摇蚊幼虫的致畸作用主要发生在口器颏部,口器的畸形会影响摄食,从而对摇蚊幼虫的生长发育造成影响。大量文献已将口器畸形率及畸形方式作为检验重金属污染程度的指标,并已发现摇蚊幼虫口器畸形率与污染物浓度显著正相关[20, 21]。E.A.M等依照摇蚊慢性毒性实验导则[5]《沉积物-水系统加标于沉积物法OECD 219》将一龄羽摇蚊(Chironomus tentans)幼虫暴露于沉积物Cd2+胁迫下,发现随着Cd2+浓度的升高,伸展摇蚊中间齿裂开及缺失的概率显著上升[22]。本研究中随着Cd2+浓度的升高,伸展摇蚊幼虫口器畸形率高于黄色羽摇蚊幼虫,表明黄色羽摇蚊对Cd2+胁迫耐受性高于伸展摇蚊幼虫。对摇蚊口器畸形类型统计表明,Cd2+对摇蚊幼虫的口器畸形影响主要表现为侧面齿缺失和中间齿缺失。
3.2 Cd2+对摇蚊幼虫的慢性毒效已有研究表明,进行急性毒性实验时水体中Cd2+在伸展摇蚊体内的富集为20~30 μmol Cd·g-1[23],进行慢性毒性实验时沉积物中Cd2+在摇蚊体内的富集为0.5~2.6 μmol Cd·g-1[24, 25]。本研究中,沉积物中Cd2+对三龄伸展摇蚊及黄色羽摇蚊幼虫的20 d LC50分别为226.6 mg·kg-1及351.84 mg·kg-1。对沉积物中Cd2+的低富集能力是导致摇蚊幼虫20 d LC50值与96 h LC50值差异的主要原因。
摇蚊羽化时间是摇蚊慢性毒性实验常用的指示终点,部分有机化合物如三氯苯酚、六氯苯等都会在摇蚊幼虫生长阶段通过促进其前胸蜕皮素的分泌或抑制其保幼激素的分泌来促进摇蚊幼虫的羽化[9, 26]。但多数污染物如大部分重金属(Pb、Cu、Cd)、农药(林丹、毒死蜱等)等对摇蚊幼虫羽化起抑制作用[27, 28]。本研究中镉污染对沉积物中黄色羽摇蚊的羽化过程有显著抑制作用,对伸展摇蚊的羽化抑制但不显著。有研究表明过量食物促进了摇蚊羽化[29],镉对伸展摇蚊的致死率大于黄色羽摇蚊,摇蚊死亡时多处于一龄阶段,而每日添加食物量并未减少,因此存活摇蚊获得过量食物促进了羽化。
4 结论水中Cd2+对三龄伸展摇蚊及黄色羽摇蚊幼虫的96 h LC50分别为22.39 mg·L-1及33.41 mg·L-1,沉积物中Cd2+对三龄伸展摇蚊及黄色羽摇蚊幼虫的20 d LC50分别为226.6 mg·kg-1及351.84 mg·kg-1。摇蚊幼虫口器畸形率与Cd2+浓度显著正相关,且伸展摇蚊幼虫受镉胁迫影响大于黄色羽摇蚊幼虫,Cd2+对摇蚊幼虫的口器畸形影响主要表现为侧面齿缺失和中间齿缺失。镉污染对摇蚊羽化起抑制作用。黄色羽摇蚊对镉污染的耐受性要高于伸展摇蚊。
| [1] | Gao B, Zhou H, Liang X, et al. Cd isotopes as a potential source tracer of metal pollution in river sediments[J]. Environmental Pollution, 2013, 181:340-343. |
| [2] | Yi Y J, Wang Z Y, Zhang K, et al. Sediment pollution and its effect on fish through food chain in the Yangtze River[J]. International Journal of Sediment Research, 2008, 23(4):338-347. |
| [3] | 金泰廙, 孔庆瑚, 叶葶葶, 等. 镉致人体健康损害的环境流行病学[J]. 浙江省医学科学院学报, 2001, 1:89- 97. JIN Tai-yi, KONG Qing-hu, YE Ting-ting, et al. Environmental epidemiology:Human health impacts caused by cadmium[J]. Acta Academiae Medicinae Zhejiang, 2001, 1:89-97. |
| [4] | 齐 鑫, 马勇军, 潘志祥. 水环境中的摇蚊幼虫研究进展[J]. 台州学院学报, 2008, 30(6):38-42. QI Xin, MA Yong-jun, PAN Zhi-xiang. Progress about chironomid larvae in water environment[J]. Journal of Taizhou University, 2008, 30(6):38-42. |
| [5] | Organisation for Economic Co-operation and Development( OECD). OECD 218. OECD guidelines for the testing of chemicals:Sediment-water chironomid toxicity test using spiked sediment[S]. French:OECD, 2004. |
| [6] | Guo X W. Studies on Chironomid communities of Nanhu Lake(South Lake), Wuhan, China[J]. Journal of Huazhong Agricultural University, 1995, 14(6):578-585. |
| [7] | 史玉强. 辽宁大伙房水库底栖动物演替与水质生物学评价[J]. 大连水产学院学报, 1998, 13(1):47-53. SHI Yu-qiang. The benthic succession and biological assessment of Dahuofang Reservoir, Liaoning[J]. Journal of Dalian Fisheries University, 1998, 13(1):47-53. |
| [8] | 张瑞雷, 王新华, 周 令, 等. 城市供水系统摇蚊污染发生与防治研究[J]. 昆虫知识, 2004, 41(3):223-226. ZHANG Rui-lei, WANG Xin-hua, ZHOU ling, et al. Advances in the studies on infesting and controlling chironomids in municipal water system[J]. Entomological Knowledge, 2004, 41(3):223-226. |
| [9] | 刘 丽, 钟文钰, 祝凌燕. 沉积物中六氯苯对摇蚊幼虫慢性毒性效应研究[J]. 生态毒理学报, 2014, 9(2):261-267. LIU Li, ZHONG Wen-jue, ZHU Ling-yan. Chronic effects of hexachl-orobenzen(HCB) in sediments to Chironomus kiiensis Larvae[J]. Asian Journal of Ecotoxicology, 2014, 9(2):261-267. |
| [10] | 李 浩, 王 琴, 邓金钗, 等. Cu2+对羽摇蚊幼虫(Chironomus plumosus)口器致畸作用和抗氧化酶活性的影响[J]. 生态与农村环境学报, 2012, 28(2):203-208. LI Hao, WANG Qin, DENG Jin-chai, et al. Effect of copper on antioxidant enzymes activity and mouthpart deformity of Chironomus plumosus[J]. Journal of Ecology and Rural Environoment, 2012, 28(2):203-208. |
| [11] | 中国检验检疫科学研究院. GB/T 27859—2011化学品 沉积物-水系统中摇蚊毒性试验加标于沉积物法[S]. 北京:中国标准出版社, 2012. Chinese Academy of Inspection and Quarantine. GB/T 27859—2011 Chemicals sediment-water chironomid toxicity test-Spiked sediment method[S]. Beijing:China Standards Press, 2012. |
| [12] | David J S, Ary A H, Vincent P. Effect of sediment quality on macroinvertebrates in Sunraysia region of the Murray-Darling Rivers, Australia[J]. Environmental Pollution, 2008, 156:689-698. |
| [13] | 国家技术监督局. GB/T 17141—1997土壤质量铅、镉的测定石墨炉原子吸收分光光度法[S]. 北京:中国标准出版社, 1998. State Bureau of Quality and Technical Supervision. GB/T 17141—1997 Soil quality-Determination of lead, cadmium-Graphite furnace atomic absorption spectrophotometry[S]. Beijing, China Standards Press, 1998. |
| [14] | Seather O A. Some Nearctic podonominae, diamesinae and orthocladinae(Diptera:Chironomidae)[J]. Bulletin of the Fisheries Research Board of Canada, 1969, 170:1-154. |
| [15] | Jorgelina R M, Karsten L. Accumulation and chronic toxicity of uranium over different life stages of the aquatic invertebrate Chironomus tentans[J]. Arch Environ Contam Toxicol, 2009 57(3):531-539. |
| [16] | 谢建春. 水体污染与水生动物[J]. 生物学通报, 2001, 36(6):10-11. XIE Jian-chun. Water pollution and aquatic animals[J]. Bulletin of Biology, 2001, 36(6):10-11. |
| [17] | Shuhaimi-Othman M, Yakub N, Umirah N S, et al. Toxicity of eight metals to Malaysian freshwater midge larvae Chironomus javanus(Diptera, Chironomidae)[J]. Toxicology and Industrial Health, 2011, 27(10):879-886. |
| [18] | Yamamura M, Suzuki K T, Hatakeyama S, et al. Tolerance to cadmiumand cadmium-binding proteins induced in the midge larva, Chirono mus yoshimatsui(Diptera, Chironomidae)[J]. Comparative Biochemistry and Physiology C:Toxicology & Pharmacology, 1983, 75(1):21-24. |
| [19] | Postma J F, van Nugteren P, Buckert- de Jong M B. Increased cadmium excretion in metal - adapted populations of the midge Chironomus riparius(Diptera, Chironomidae)[J]. Environmental Toxicology and Chemistry, 1996, 15(3):332- 339. |
| [20] | Janssens L B, Postma J, Vermeulen A, et al. Morphological deformities in Chironomus riparius meigen larvae after exposure to cadmium over several generations[J]. Water Air and Soil Pollution, 2001, 129(1-4):167-179. |
| [21] | Almut G, Luc J B. Behavioural, developmental and morphological responses of Chironomus gr. thummi Larvae(Diptera, Nematicera) to aquatic pollution[J]. Journal of Aquatic Ecosystem Health, 1995, 4(3):205-214. |
| [22] | Martinez E A, Moore B C, Schaumloffe L J, et al. Morphological abnormalities in Chironomus tentans exposed to cadmium-and copper-spiked sediments[J]. Ecotoxicology and Environmental Safety, 2003, 55(2):204-212. |
| [23] | Gillis P L, Diener L C, Reynoldson T B, et al. Cadmium induced production of a metallothionein-like protein in Tubifex tubifex(Oligo-chaeta) and Chironomus riparius(Diptera):Correlation with whole body(reproduction andgrowth) endpoints of toxicity[J]. Environ Toxicol Chem, 2002, 21(9):1836-1844. |
| [24] | Bervoets L, Solis D, Romero A M, et al. Trace metallevels in chironomid larvae and sediments from a Bolivian River:Impact of mining activities[J]. Ecotoxicology and Environmental Safety, 1998, 41(3):275-283. |
| [25] | Gillis P L, Reynoldson T B, Dixon D G. Metallothionein-like protein and tissue metal concentrations in invertebrates(Oligochaetes and Chironomids) collected from reference and metal contaminated field sediments[J]. Great Lakes Res, 2006, 32(3):565-577. |
| [26] | Ristola T, Kukkonen J V, Pellinen J. Body residues and responses of the midge Chironomus riparius to sediment associated 2, 4, 5-trichlorophenol in subchronic and chronic exposures[J]. Archives Environmental Contamination Toxicology, 1999, 37(1):42-49. |
| [27] | Agra A, Soares A M. Effects of two insecticides on survival, growth and emergence of Chironomus riparius meigen[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(4):501-504. |
| [28] | Ebau W, Rawi C S, Din Z, et al. Toxicity of cadmium and lead on tropical midge larvae, Chironomus kiiensis Tokunaga and Chironomus javanus Kieffer(Diptera:Chironomidae)[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(8):631-634. |
| [29] | Kallie R T, Vincent J P, Ary A H. Food limitation in Chironomus tepperi Effect on survival, sex ratios and development across two generations[J]. Ecotoxicology and Environmental Safety, 2012, 10(84):1-8. |
 2015, Vol. 34
2015, Vol. 34