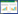文章信息
- 林晓燕, 牟仁祥, 曹赵云, 朱智伟, 陈铭学
- LIN Xiao-yan, MOU Ren-xiang, CAO Zhao-yun, ZHU Zhi-wei, CHEN Ming-xue
- 耐镉细菌菌株的分离及其吸附镉机理研究
- Isolation and Cadmium Adsorption Mechanisms of Cadmium-Resistant Bacteria Strains
- 农业环境科学学报, 2015, 34(9): 1700-1706
- Journal of Agro-Environment Science, 2015, 34(9): 1700-1706
- http://dx.doi.org/10.11654/jaes.2015.09.011
-
文章历史
- 收稿日期: 2015-04-02
近年来,随着工农业生产的快速发展,环境中重金属污染日趋严重。在所有重金属污染中镉的污染最为突出。镉是一种常见的重金属污染物,可造成细胞氧化损伤,引起DNA断裂,破坏细胞内含物,降低酶的活性[1, 2]。与其他重金属元素相比,具有更高的生物有效性,镉离子进入植物根部对人类健康产生了潜在的危害[3],镉污染治理问题已引起广泛关注。与以往重金属污染治理的化学修复和植物修复方法相比,微生物修复具有费用低且能够处理低浓度污染或大面积污染等方面的独特优势,具有良好的生态效益和应用前景。镉污染的微生物修复已成为当今环境科学的热点研究领域,也是最具有挑战性的研究方向之一[4]。微生物修复镉污染的首要任务就是获得新的具有较高耐性和较强吸附能力的微生物菌株,并通过研究明确其抗性和吸附机理[5, 6, 7],为后期镉污染微生物修复技术的建立和实际应用提供理论依据和参考价值。但是,由于不同微生物和重金属相互作用的复杂性及其细胞本身结构的差异性,很多关于微生物吸附重金属机理方面的问题还不清楚,国内外也未形成统一的抗性理论及标准[6, 8, 9, 10]。因此,需要对此方面开展更加深入细致的研究。
本研究拟从镉污染土壤中分离鉴定出对镉具有高耐性的细菌菌株,通过利用扫描电镜观察镉在菌体表面的沉积作用,利用红外光谱,通过官能团吸收峰值的位移和变化,分析镉及多种金属离子存在时细胞壁表面化学基团的变化情况,对菌株耐受镉和吸附镉的内在机理进行阐述,为后期通过控制参与吸附重金属的细菌细胞壁表面基团,提高这些基团去除重金属污染的能力,从而建立重金属污染微生物修复技术提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 土样来源供试土壤样品采自浙江省杭州市富阳某水稻田,土壤pH为6.27,全镉含量0.57 mg·kg-1,约为《土壤环境质量标准》(GB 15618—1995)[11]中二级标准限量值的2倍。
1.1.2 培养基配方LB液体培养基:牛肉膏3.0 g,蛋白胨10.0 g,琼脂20.0 g,NaCl 5.0 g,加双蒸水至1 L,pH调至7.0~7.2;121℃高压灭菌20 min。LB固体培养基需另加1.5%的琼脂后灭菌。
麦康凯琼脂培养基:氯化钠5 g,琼脂17 g,乳糖10 g,0.01%结晶紫水溶液10 mL,0.5%中性红水溶液5 mL,蒸馏水1000 mL。
1.2 耐镉菌株的富集、筛选及抗镉能力 1.2.1 耐镉菌株的富集和筛选取5 g土样加入到45 mL无菌水中,振荡2 h后静置10 min,取上清制得土壤悬液。取适量土壤悬液,采用稀释涂布法均匀涂布在含Cd2+浓度为50 mg·L-1的LB固体培养基平板上,置于37℃恒温培养箱中倒置培养2 d,挑选菌落形态不同的单菌落,分别转移接种于Cd2+浓度更高的固体培养基中,挑取能够在高浓度Cd2+平板上生长的菌落进行划线纯化,纯化后菌株保存在甘油管中置于-70℃冰箱备用。
1.2.2 耐性菌株的抗镉能力将分离到的纯菌株接种到LB液体培养基进行活化,37℃、150 r·min-1振荡培养1 d后,接种到Cd2+浓度分别为100、200、300、400、500、1000 mg·L-1的固体培养基平板上和Cd2+浓度分别为20、40、60、80、100 mg·L-1的液体培养基中,观察其生长情况。每个浓度设置3个平行。
1.3 耐镉菌株的鉴定 1.3.1 菌落形态及生理生化鉴定将活化后的菌株划线接种到LB固体培养基上,37℃恒温培养箱中倒置培养1 d后,观察菌落的表面形状、颜色和边缘特征等,并挑选单菌落,进行革兰氏染色。生理生化的鉴定参照标准方法进行[12, 13]。
1.3.2 16S rDNA 序列分析采用柱式细菌基因组DNA抽提试剂盒(上海生工)提取菌株的基因组DNA,并以基因组DNA为模板,采用细菌通用引物27 f:(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492 r (5′-TACGGTTACCTTGTTACGACTT-3′)进行16S rDNA的PCR扩增。50 μL PCR反应体系如下:10×PCR缓冲液5 μL (含MgCl2),dNTP 1 μL,引物各2 μL,模板DNA 2 μL,Taq酶(10 000 U·mL-1)0.5 μL,ddH2O 37.5 μL。
PCR程序为:①94℃ 5 min;②94℃ 1 min,54℃ 1 min,72℃ 1 min;③第②步循环30次;④72℃ 10 min;⑤4℃ 10 min。阴性对照(水取代模板)检测整个加样和PCR过程有无污染,阳性对照采用本实验室保存的枯草芽孢杆菌菌株B19 DNA取代待测菌株DNA作用模板用来检测PCR扩增的特异性。PCR产物的纯化和测序由上海生工生物工程股份有限公司完成。测序结果提交GenBank,并通过BLAST程序与NCBI数据库(http://www.ncbi.nlm.nih.gov/blast)中的已有菌株序列进行同源性比对,然后通过软件MEGA4.0采用邻接法(Neighbor-joining method )构建系统发育树[14]。
1.4 耐镉菌株对镉的吸附机理研究 1.4.1 耐镉菌株吸附重金属试验将经过活化的菌株以2%的接种量分别接种到终浓度为10 mg·L-1的Cd2+和其他金属离子(Cr2+、Cu2+、Mn2+、Ni2+、Pb2+、Zn2+)的LB液体培养基中,30℃ 和150 r·min-1下振荡培养24 h后离心。利用原子吸收光谱仪分别测定上清液中重金属的初始浓度和吸附后的浓度[15],离心后的菌体在70℃下烘至恒重后称量,每个样品重复测定3次取平均值。按下式计算重金属的吸附率(A):
A=(C1-C2)/C1×100%
式中:C1、C2 分别为上清液中重金属的起始浓度和吸附后的浓度,mg·L-1。
1.4.2 吸附机理研究对于扫描电镜分析试验,分别设置不添加Cd2+(对照)和加70 mg·L-1 Cd2+(菌株LCd2为40 mg·L-1的Cd2+)的两个处理,并按上述处理配制相应的LB液体培养基。将活化好的菌株以2%接种量分别接种到上述培养基中,30℃、150 r·min-1下振荡培养24 h后,将两株菌的菌液分别用蒸馏水洗3次,菌株细胞经过戊二醛固定、乙醇梯度脱水、干燥以及喷金等操作后,用扫描电镜(SEM)观察菌体表面特征并拍照。
对Cd2+吸附能力较强的菌株LCd1进行了透射电镜观察。分别设置不添加Cd2+(对照)和加70 mg·L-1 Cd2+的两个处理,并按上述处理配制相应的LB液体培养基。将经过活化的菌株以2%接种量分别接种到上述培养基中,30℃、150 r·min-1下振荡培养24 h,将两株菌的菌液分别用蒸馏水洗3次,菌株细胞经固定、脱水、包埋、切片、染色等步骤,制备超薄菌株切片,置于透射电镜下观察和拍照。
红外光谱分析试验共设置4个处理:①不添加重金属离子,作对照;②只加10 mg·L-1Cd2+;③只加80 mg·L-1(菌株LCd1) Cd2+和50 mg·L-1(菌株LCd2)Cd2+;④加10 mg·L-1Cd2+和10 mg·L-1其他金属离子(Cr2+、Zn2+、Pb2+、Cu2+、Ni2+、Mn2+)。活化后的菌株以2%接种量分别接种到上述培养基中,30℃、150 r·min-1下振荡培养24 h后离心去上清,细胞沉淀按文献[16, 17]方法进行干燥、磨粉、压片和红外光谱分析。
2 结果与讨论 2.1 耐镉细菌的分离鉴定结果 2.1.1 耐镉细菌的筛选和形态、生理生化鉴定结果经过富集培养、分离纯化,筛选到2株对Cd2+具有较高耐性的细菌菌株,分别编号为LCd1和LCd2。菌株LCd1在LB固体培养基上能耐受Cd2+浓度为400 mg·L-1,在LB液体培养基中能够耐受Cd2+浓度为80 mg·L-1;菌株LCd2在LB固体培养基上能耐受Cd2+浓度为300 mg·L-1,在LB液体培养基中能够耐受Cd2+浓度为50 mg·L-1。试验证明,连续驯化能增加两株菌对Cd2+的耐受浓度。
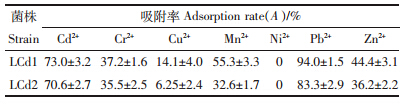
菌株LCd1在LB固体培养基上的菌落为纺锤状,不透明,边缘锯齿状,菌落表面隆起,颜色较深,为浅棕色(图 1);革兰氏染色阴性;菌体细长且长短不一,成对或短链状排列。菌株LCd2在LB固体培养基上的菌落为不规则纺锤状,粘稠,不透明,边缘平滑,颜色为乳白色(图 1);在麦康凯琼脂上为粉红色或红色,呈黏稠状;革兰氏染色阴性;菌体粗短杆状。菌株LCd1的生理生化鉴定结果为:氧化酶阳性,能利用枸橼酸盐,精氨酸双水解酶阳性,能氧化分解葡萄糖和木糖,不能分解蔗糖和乳糖,产酸不产气,能够液化明胶、分解尿素,可将硝酸盐还原为亚硝酸盐并产气,吲哚试验阴性,在4℃不生长而在42℃可以生长,菌株产碱,生长过程中培养基pH 可升至8.74。菌株LCd2的生理生化鉴定结果为:过氧化物酶阳性,能够液化明胶;能够利用蔗糖、乳糖、鼠李糖、山梨醇、蜜二糖、棉子糖发酵,不产生黄色色素;鸟氨酸脱羧酶、精氨酸双水解酶阳性,赖氨酸脱羧酶、吲哚试验阴性。
|
| 图 1 菌株LCd1和菌株LCd2在LB平板上的形态(37℃,培养1 d) Figure 1 Morphology of strain LCd1 and LCd2 on LB plate(37℃,incubated for 1 d) |
菌株LCd1和LCd2经16S rDNA测序后所得片段长度分别为1391 bp和1396 bp,GeneBank登录号为KF411752和KF411753。通过NCBI数据库中的BLAST软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)将测序所得的序列与GeneBank中已发表的16S rDNA序列进行同源性比对,结果显示:菌株LCd1和LCd2序列分别与铜绿假单胞菌(Pseudomonas aeruginosa)和阴沟肠杆菌(Enterobacter cloacae)的同源性达到100%和99%。系统发育树如图 2所示。菌株 LCd1和LCd2 分别与 Pseudomonas aeruginosa和 Enterobacter菌属的几株细菌具有较近的同源性。结合两株菌株的形态学、生理生化特征以及16S rDNA 序列分析结果,可初步确定所分离的两株高镉耐性菌株为铜绿假单胞菌和阴沟肠杆菌。

|
| 图 2 基于16S rDNA序列构建的菌株LCd1和LCd2的系统发育树 Figure 2 Phylogenetic tree of strains LCd1 and LCd2 based on 16S rDNA sequences |
从表 1可以看出,7种供试重金属离子除Ni2+外,菌株LCd1和LCd2对其都有一定的吸附能力,且以对Pb2+和 Cd2+的吸附能力最强,菌株LCd1对两种重金属离子的吸附能力强于菌株LCd2。菌株LCd1对7种重金属离子的吸附率依次为Pb2+>Cd2+>Mn2+> Zn2+>Cr2+>Cu2+>Ni2+;菌株LCd2对7种重金属离子的吸附率依次为Pb2+>Cd2+>Zn2+>Cr2+>Mn2+>Cu2+>Ni2+。可见,菌株LCd1和LCd2对不同重金属吸附能力不同,可能是由于两株菌株表面的活性基团(吸附位点)选择性不同所致。然而,两株菌株又有一定的共性,在高效吸附Cd2+的同时,都对Pb2+具有更高的吸附率,这种同时高效吸附多种重金属离子菌株的获得为铅镉复合污染提供了珍贵的生物修复材料。
图 3为菌株LCd1和菌株LCd2处理前后的扫描电镜照片。Cd2+处理过和未处理菌体(对照)在扫描电镜下观察有明显不同。就菌株LCd1而言,Cd2+未处理过的菌体表面光滑,呈单个离散排列或聚集成团排列(图 3A);Cd2+处理过的菌体由于吸附了大量的镉,菌体表面粗糙,出现不规则的凸起,与未吸附镉的菌株相比,菌体变大并聚集在一起,周围有明显沉淀,说明胞外沉淀很可能是该菌吸附镉的一个重要机理(图 3B)。与菌株LCd1相比,菌株LCd2处理前后这种差别更明显:未处理的菌体短小,表面光滑,排列疏松(图 3C);Cd2+处理过的菌株,菌体膨大,大量的镉以胞外聚集物的形式存在,与菌体间杂质一起形成较大的颗粒附着在菌体上并聚集在一起(图 3D),胞外大量的颗粒状聚集物也说明胞外沉淀可能是镉积累的一个重要因素。究其原因,很可能是菌体在面对重金属毒害时所采取的一种通过聚集形成沉淀来减轻重金属毒性的生存方式。

|
| 图 3 菌株LCd1和菌株LCd2的扫描电镜图 Figure 3 Scanning electron microscopy(SEM) images of strains LCd1 and LCd2 |
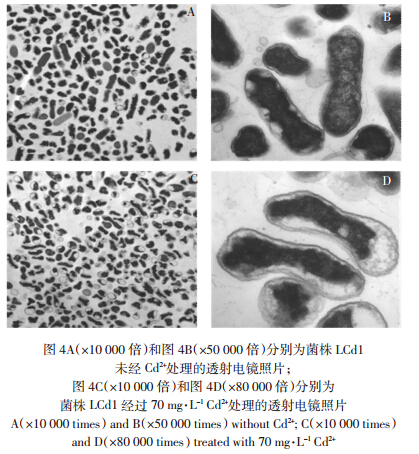
透射电镜观察菌株LCd1不同处理后的富集吸附,结果见图 4。在无Cd2+条件下,细胞表面光滑,胞内充实;Cd2+处理过的菌体细胞呈不规则的凸起或弯曲状,同时胞浆向中间聚拢,有的细胞中出现大小不等的空泡,细胞内可能发生变性反应。这说明一定浓度的Cd2+处理会给细菌的细胞带来损伤,使菌体出现凋亡特征。同时,结合图 3的扫描电镜照片观察结果推测,铜绿假单胞菌LCd1吸附镉的机理主要是胞外Cd2+沉淀反应。
|
| 图 4 镉处理前后的透射电镜图 Figure 4 Transmission electron microscopy(TEM)images of strain LCd1 |
图 5是利用红外光谱仪检测两株菌吸附重金属前后细胞壁上一些化学基团变化情况。由图 5可以看出,IR谱图出现明显差异,与未吸附重金属的图谱(1-1和2-1)相比,吸附后的图谱上部分基团波数有所变化,峰位发生偏移,波峰增多或变宽。菌体吸附重金属离子前后IR图谱之间的差异集中表现在微生物分析灵敏区500~1800 cm-1和2800~3500 cm-1。

|
| 图 5 菌株LCd1和LCd2吸附重金属前后的红外光谱图 Figure 5 IR spectrograms of strains LCd1 and LCd2 before and after adsorption of heavy metals |
图 5中阴影部分为一个较宽的吸收峰,对应-OH和-NH的振动,说明菌体中存在大量的吸附水,并且随Cd2+浓度的增加(1-3和2-3)和重金属种类的增加(1-4和2-4),该峰变得更宽,说明缔合-OH和-NH的特征吸收峰在高浓度Cd2+或其他重金属离子的共同作用下参与了Cd2+的吸收和积累。这与刘爱民等[17]、刘红娟等[10]的报道一致。图 5A的1-2中波数由对照中的1539 cm-1变成1549 cm-1,主要是由于N-H键的弯曲振动产生的,表明在Cd2+存在下,菌株LCd1细胞壁上的蛋白质酰胺Ⅱ 带(N-H 的弯曲振动与C-N 伸展振动的叠加)表现活跃,参与Cd2+的吸附。蛋白质酰胺Ⅰ带中的N-H伸缩振动在1400 cm-1左右处产生吸收峰。菌株LCd1在高浓度Cd2+存在下在1406 cm-1处的波数移动到1397 cm-1(1-3),菌株LCd2在高浓度Cd2+存在下(2-3)以及多种重金属离子同时存在下(2-4),蛋白质酰胺Ⅰ带中的N-H键通过伸缩振动参与了Cd2+及多种重金属离子的吸收与富集。
1000~1100 cm-1附近的吸收峰由磷酸基团P=O、P-OH、PO43-以及胺基中的-C-N-等引起,图 5A中Cd2+存在的情况下,在1074 cm-1的峰位移到1084 cm-1,表明无论是在低Cd2+(1-2)还是高Cd2+(1-3)浓度下,菌株LCd1细胞壁上的磷酸基团P=O、P-OH、PO43-以及胺基中的-C-N-均参与了Cd2+的吸附。图 5B的2-4处理中,在多种重金属离子的共同作用下,1065 cm-1处的峰位前移到1079 cm-1,同样说明了菌株LCd2细胞壁上的磷酸基团(P=O、P-OH、PO43-)以及胺基中的-C-N-参与了重金属的吸附,并出现了一个新的波数峰1049 cm-1,说明该基团在结合Cd2+的过程中发挥了重要作用。536 cm-1处的谱峰是M-O和O-M-O(M-金属离子)振动吸收峰[15],图 5A中10 mg·L-1的Cd2+浓度下,536 cm-1处的峰向高波数移动到555 cm-1处,并在467 cm-1处出现一新的波数峰,说明这些基团在结合Cd2+的过程中发挥了重要作用,活跃参与重金属离子的络合作用。
总的来说,两株菌株吸附重金属的主要场所在细胞壁上,细胞壁上各种基团的活性直接影响重金属的吸附,同种重金属不同浓度下或多种重金属共同存在下细胞壁上参与镉及其他重金属积累的基团不尽相同。这可能与两株菌自身的性质有关,主要表现在:对于菌株LCd1,低浓度Cd2+存在下,参与镉吸附的基团有蛋白酰胺Ⅱ带、磷酸基团(P=O、P-OH、PO43-)、胺基中的-C-N-、-OH、-NH以及与金属离子相结合的M-O和O-M-O;高浓度Cd2+存在下,参与的基团有蛋白酰胺Ⅰ 带、磷酸基团(P=O、P-OH、PO43-)、胺基中的-C-N-、-OH和-NH;多种重金属离子同时存在时,发生变化的主要是-OH和-NH。菌株LCd2对低浓度Cd2+似乎不太敏感,没有基团发生明显的变化;高浓度Cd2+或多种重金属离子同时存在下,蛋白酰胺Ⅰ带均发生明显变化,-OH和-NH也发生一定程度的变化;多种离子同时存在时,磷酸基团(P=O、P-OH、PO43-)和胺基中的-C-N-也发生不同程度的变化。
3 结论通过富集培养、分离纯化筛选到两株对镉具有较高耐性和较强吸附能力的优势细菌菌株LCd1和LCd2,分别鉴定为铜绿假单胞菌(Pseudomonas aeruginosa)和阴沟肠杆菌(Enterobacter cloacae)。
两株菌株对多种重金属具有吸附能力且表现出很强的对Pb2+和 Cd2+的吸附能力,菌株LCd1的吸附能力强于菌株LCd2;两株优势菌株的获得可为铅镉复合污染的生物修复提供良好的菌株材料。
初步探明了两株菌耐受镉和吸附镉的机理:胞外沉淀很可能是两株菌株吸附重金属镉的一个重要途径;两株菌株细胞壁上参与重金属积累的化学基团有所差别,推测可能与两株菌株自身某些性质有关。后期可通过控制参与重金属吸附的细菌细胞壁表面基团,提高其吸附重金属及去除重金属污染的能力,为环境中镉等重金属的修复提供行之有效的新方法和新思路。
| [1] | 刘爱民, 黄为一. 抗Cd细菌J5的筛选和抗Cd2+特性[J]. 农业环境科学学报, 2005, 24(增刊):223-227. LIU Ai-min, HUANG Wei-yi. Screening of cadmium resistant bacterium J5 and its resistance to Cd2+ [J]. Journal of Agro-Environment Science, 2005, 24(Suppl):223-227. |
| [2] | Nies D H. Microbial heavy-metal resistance[J]. Applied Microbiology and Biotechnology, 1999, 51(6):730-750. |
| [3] | 窦敏娜, 呼 庆, 齐鸿雁, 等. 重金属抗性菌HQ-1生物吸附镉与银的比较研究[J]. 微生物学通报, 2007, 34(6):1097-1103. DOU Min-na, HU Qing, QI Hong-yan, et al. Comparative studies on metal biosorption of cadmium and silver by a heavy metals hyperresistant bacillus cereus[J]. Microbiology, 2007, 34(6):1097-1103. |
| [4] | 徐磊辉, 黄巧云, 陈雯莉.环境重金属污染的细菌修复与检测[J]. 应用与环境生物学报, 2004, 10(2):256-262. XU Lei-hui, HUANG Qiao-yun, CHEN Wen-li. Bacterial bioremediation and bio-detection of heavy metal-contaminated environments[J]. Chinese Journal of Applied & Environmental Biology, 2004, 10(2):256-262. |
| [5] | 应娇妍, 袁红莉, 李宝珍. 一株茎点霉菌的抗镉机制[J]. 中国环境科学, 2003, 23(6):575-578. YING Jiao-yan, YUAN Hong-li, LI Bao-zhen. The cadmium resistance mechanisms of Phoma strain[J]. China Environmental Science, 2003, 23(6):575-578. |
| [6] | 潘建华, 刘瑞霞. 蜡状芽孢杆菌Bacillus cereus吸附铅的研究[J]. 环境科学, 2004, 25(2):166-169. PAN Jian-hua, LIU Rui-xia. Biosorption of Pb2+ by Bacillus cereus biomass[J]. Chinese Journal of Environmental Science, 2004, 25(2):166-169. |
| [7] | 呼 庆, 齐鸿雁, 窦敏娜, 等. 强抗镉蜡状芽孢杆菌的分离鉴定及其抗性机理[J]. 环境科学, 2007, 28(2):427-430. HU Qing, QI Hong-yan, DOU Min-na, et al. Isolation, molecular characterization and resistance mechanism study on a cadmium hyperresistant Bacillus cereus[J]. Chinese Journal of Environmental Science, 2007, 28(2):427-430. |
| [8] | Volesky B, Holan Z R. Biosorption of heavy metals[J]. Biotechnology Progress, 1995, 11(3):235-250. |
| [9] | 陈素华, 孙铁珩, 周启星, 等. 微生物与重金属间的相互作用及其应用研究[J]. 应用生态学报, 2002, 13(2):239-242. CHEN Su-hua, SUN Tie-heng, ZHOU Qi-xing, et al. Interaction between microorganisms and heavy metals and its application[J]. Chinese Journal of Applied Ecology, 2002, 13(2):239-242. |
| [10] | 刘红娟, 张 慧, 党 志, 等. 一株耐镉细菌的分离及其富集Cd的机理[J]. 环境工程学报, 2009, 3(2):367-371. LIU Hong-juan, ZHANG Hui, DANG Zhi, et al. Isolation and bio-accumulation mechanisms of a Cd-resisting bacterium[J]. Chinese Journal of Environmental Engineering, 2009, 3(2):367-371. |
| [11] | 国家环境保护局. GB 15618—1995 土壤环境质量标准[S]. 北京:中国标准出版社, 1995. National Environmental Protection Agency. GB 15618—1995 Environmental quality standard for soils[S]. Beijing:China Standards Press, 1995. |
| [12] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:162-167. DONG Xiu-zhu, CAI Miao-ying. Manual of systematic determinative general bacteriology[M]. Beijing:Science Press, 2001:162-167. |
| [13] | Garrity G M, Bell J A, Lilburn T G. Taxonomic outline of the prokaryotes bergey's manual of systematic bacteriology[M]. Second Edition. New York:Berlin Heidelberg, 2004. |
| [14] | Saitou N, Nei M. The neighbor-joining method:A new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987, 4(4):406-425. |
| [15] | Llanos J, Capasso C, Parisi E, et al. Susceptibility to heavy metals and cadmium accumulation in aerobic and anaerobic thermophilic microorganisms isolated from deep-sea hydrothermal vents[J]. Current Microbiology, 2000, 41(3):201-205. |
| [16] | Kamnev A A, Antonyuk L P, Matora L Y, et al. Spectroscopic characterization of cell membranes and their constituents of the plant associated soil bacterium Azospirillum brasilense[J]. Journal of Molecular Structure, 1999, 480-481:387-393. |
| [17] | 刘爱民, 黄为一. 应用红外方法探讨耐镉菌株高积累Cd2+的机理[J]. 环境科学学报, 2005, 25(11):1502-1506. LIU Ai-min, HUANG Wei-yi. Research on high accumulating Cd2+ mechanism of a toletant-Cd2+ strain by Infrared spectroscopy analysis[J]. Acta Scientiae Circumstantiae, 2005, 25(11):1502-1506. |
 2015, Vol. 34
2015, Vol. 34