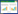文章信息
- 王国兴, 董桂军, 艾士奇, 熊志强, 晏磊, 高亚梅, 王彦杰, 王伟东
- WANG Guo-xing, DONG Gui-jun, AI Shi-qi, XIONG Zhi-qiang, YAN Lei, GAO Ya-mei, WANG Yan-jie, WANG Wei-dong
- 通风量对堆肥化过程中氮素转化及nirK基因多样性和数量的影响
- Effects of ventilation on nitrogen transformation and nirK gene diversity and abundance during composting process
- 农业环境科学学报, 2016, 35(3): 565-572
- Journal of Agro-Environment Science, 2016, 35(3): 565-572
- http://dx.doi.org/10.11654/jaes.2016.03.021
-
文章历史
- 收稿日期: 2015-10-18
2. 黑龙江省农垦总局植保植检站, 黑龙江 哈尔滨 150000
2. Plant Protection and Inspection Station, Heilongjiang Land Reclamation Bureau, Harbin 150000, China
根据环境保护部和国土资源部2014年公布的《全国土壤污染状况调查公报》,农业已超过工业成为中国最大面源污染产业。2010年我国畜禽粪便年排放量约19亿t,其中总污染量达到2.27亿t,预计2020 年全国畜禽粪便总污染量将达2.98亿t[1]。随着养殖业的快速发展,畜禽粪便排放量不断增加,对环境的压力越来越大。堆肥化作为处理农业废物的有效途径之一,已经得到了广泛的应用,但由于堆肥化过程中氮素损失和排放温室气体,导致堆肥产品质量下降,污染空气。因此研究堆肥化过程中氮素的转化规律具有实际意义。
反硝化作用是堆肥过程中参与氮素循环的一个重要过程。反硝化细菌在厌氧条件下,通过酶催化还原反应将氮氧化合物NO3-、NO2-转化成气态氮(NO、N2O、N2)[2]。N2O 作为一种典型的温室气体,是人类排放的首要消耗臭氧层的物质[13],而堆肥过程产生的N2O是其重要来源之一[3]。亚硝酸还原酶(Nir)是反硝化细菌驱动反硝化作用的关键酶[4]。许多研究将nirK和nirS基因作为环境样品中反硝化细菌群落的分子标记物,并且发现nirK基因对环境因子的响应更敏感[5]。近期,研究人员发现nirK型的反硝化细菌存在于农田、草地、森林、水体以及沉积物等环境中[6, 7, 8, 9, 10]。同时还发现,环境性质的改变可以影响反硝化细菌的群落结构和种群丰度,如全氮含量、NO3-含量、含水量、pH 等[11],而反硝化细菌的群落结构和种群丰度又能反映这些调控因子的综合作用。
在强制通风堆肥过程中N2O 排放量与通气量有关。当通气量较低时,堆体内存在较多缺氧和厌氧的环境,导致反硝化作用进而产生大量 N2O;当通气量较高时,氮素在堆肥初期以NH3挥发的形式大量损失,降低后期甚至整个堆肥过程中N2O排放量[12, 13]。Osada等[14]研究了通风率(19.2~96.1 L·m-3·min-1)对猪粪堆肥过程中N2O 排放的影响,结果表明当堆体通风率大于40 L·m-3·min-1时,可基本控制堆肥过程N2O 排放。因此,研究反硝化细菌群落及其对环境的响应,对降低堆肥过程中反硝化作用有重要的意义。
本研究模拟好氧堆肥过程,以草坪草与牛粪为原料,对堆肥过程中理化指标、反硝化功能基因nirK基因多样性和数量随着堆肥时间的变化情况进行了研究,以期为优化堆肥工艺及减少氮素的损失提供理论指导。
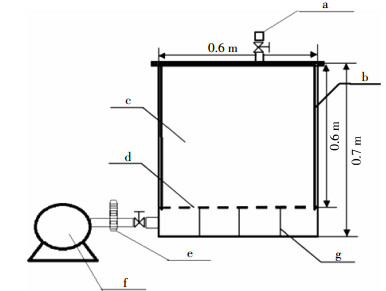
1 材料与方法 1.1 堆肥试验材料与处理试验材料为牛粪和草坪草,牛粪取自大庆市周边农村,草坪草取自黑龙江八一农垦大学校内草坪。将牛粪与草坪草按1:1(体积比)均匀混合,调节含水率至65%~70%,C/N至24~30,置入3个尺寸为0.6 m×0.6 m×0.6 m的发酵箱中,堆体原料的起始重量和体积分别为70 kg和0.18 m3,混合后含水率和C/N分别为67.10%和26.83。堆肥试验装置是由发酵箱和控制系统组成,发酵箱由钢铁材料制成,底部加有通风筛,内壁加有保温层(图 1)。装置放置于自建铁皮板房中用于试验。
|
| (葬) 空气检测器与阀门;(遭) 保温板;(糟) 发酵室; (d) 空气孔筛;(e) 流量计;(f) 空气压缩机;(g) 隔栏 图 1 堆肥装置 Figure 1 Construction for manure composting |
设置3种处理条件的堆肥发酵系统:处理CK,0 L·min-1·kg-1 TS(总固体含量),静态堆肥;处理TF1,0.05 L·min-1·kg-1 TS,微好氧堆肥;处理TF4,0.2 L·min-1·kg-1 TS,好氧堆肥。均为3次重复。在堆肥第9 d翻堆1次,进一步混合物料。
将堆肥开始时设置为第0 d,堆肥至63 d结束,在第0、3、5、7、14、21、28、35、42、63 d取样。采用多点混合法取样(上中下3层,每层前、后、左、右、中五点取样),样品充分混合后带回实验室,一部分直接测定理化参数,另一部分用缓冲液-20 ℃保存,用于分子生物学分析。所有测量重复3次。
1.2 堆肥理化参数的测定堆体温度测定:在试验进行期间,于每天14:00定时测定各处理堆体中间位置的温度(优利德UT325数字测温仪),同时测定环境温度。
O2含量测定:每天14:00,采用氧气含量测定仪(GT 901,China)现场插入各处理堆体的上、中、下、左、右五个位点,测量O2含量,取其平均值作为堆体中O2的实时含量。
含水率测定:样品在105 ℃烘16 h,利用衡重法测定含水率。
pH 测定:取2.0 g 鲜样按 1:10加入去离子水,200 r·min-1振荡30 min,真空过滤,采用小型pH检测器B-212(HORIBA,Japan)测定滤液 pH。
氨气释放速率测定:用箱体设置的密封盖密封箱体,顶部留有出气孔。每天14:00,释放的气体利用0.05%硼酸吸收液吸收1 h后,加入2~3滴甲基红-亚甲基蓝混合指示剂,采用0.025 mol·L-1 H2SO4标准溶液滴定。由于实验通气量大、缺少有效的收集装置,选择其中一个时间段,计量氨气释放速率。
总有机碳和总氮测定:采用总有机碳/总氮分析仪(multi N/C®2100,德国耶拿)分析样品总有机碳和总氮。
水溶性NO3--N和水溶性NH4+-N测定:分别采用酚二磺酸比色法和纳氏试剂比色法测定[15, 16]。
以上所有参数测定均重复3次,取其平均值,最大实验误差限<5%。
1.3 克隆文库构建 1.3.1 总 DNA 的提取使用PowerSoil DNA Isolation Kit提取样品DNA(Mobio,USA),-20 ℃保存,具体步骤参考厂商说明书。
1.3.2 细菌nirK基因扩增样品中nirK基因扩增引物为F1aCu(5′-ATCATGGTSCTGCCGCG-3′)/R3Cu(5′-GCCTCGATCAGRTTG TGGTT-3′)[17],PCR 试剂购于博凌科为PCR mix(含染料)。PCR 反应体系为 50 μL体系:2×buffer 25 μL,F1aCu(50 μmol·L-1)0.5 μL,R3Cu(50 μmol·L-1)0.5 μL,模板 DNA 1 μL,加 ddH2O 补至50 μL。反应条件:95 ℃变性 3 min,95 ℃ 20 s,57 ℃ 30 s,72 ℃ 40 s(30个循环),72 ℃延伸10 min。扩增5管重复,将扩增产物均匀混合以消除单次扩增的偏向性。PCR 扩增产物用AXYGEN DNA凝胶回收试剂盒纯化,具体步骤参考厂商说明书。
1.3.3 nirK基因克隆文库的构建使用全式金pEASY-T1 Cloning Kit构建克隆文库,具体步骤参考厂商说明书。随机挑取80~100个克隆子送至华大基因测序,测序获得的nirK基因序列利用 NCBI Blast 数据库进行同源性分析和相关信息检索,并将获得的nirK基因序列提交到GenBank数据库。
1.3.4核苷酸序列接受号本研究获得的nirK基因核苷酸序列在NCBI数据库中的序列接受号为KR857239-KR857247。
1.4 定量 PCR扩增nirK基因引物为F1aCu:R3Cu,所用仪器为ABI 7500荧光定量PCR仪(ABI,USA)。反应体系为20 μL:2×SYBR Green 荧光定量PCR Mix(博凌科为,北京)10 μL,上下游引物各 0.5 μL,DNA 模板1 μL,用Mili-Q无菌水补足20 μL。nirK扩增条件:95 ℃预变性 3 min,95 ℃变性 30 s,57 ℃退火 1 min,72 ℃延伸 1 min,40个循环。定量扩增得到的数据均在 72 ℃进行采集,所有的样品重复3次。每次反应结束后会得到一条溶解曲线,用以判断扩增子的特异性。nirK基因标准曲线是将每种目标基因分别连接到质粒中,然后提取质粒 DNA并测定其浓度,计算出拷贝数,再进行10倍系列梯度稀释,作为标准品。目标基因标准曲线的稀释范围均为1.0×103~1.0×108。
1.5 数据处理采用 SPSS 19.0软件对堆体不同位置的功能基因数目进行显著性差异分析(One-way ANOVA,Student-Newman-Keuls检验)。采用Canoco 4.5 软件对生物信息矩阵进行基于线性模型的冗余分析(RDA)方法[18]分析每种环境因子与nirK基因的关系,将生成的数据文件用Canodraw4.5作图。
2 结果与分析 2.1 堆肥过程中主要参数的变化 2.1.1 堆体温度与环境温度温度是判断堆肥产品能否达到无害化条件的重要指标之一[19]。处理TF1和TF4的堆体温度分别在第4 d和第5 d迅速升高到50 ℃以上,并且超过50 ℃的高温期分别达到9 d和5 d(图 2);而处理CK始终没有达到50 ℃。处理TF4由于带走了大量的热量[20, 21],高温期持续时间较短,但基本可以达到堆肥的卫生学指标(GB 7959—1987)[22]。在降温期各处理的温度差异不显著。由以上结果可以看出,高温期持续的时间,处理TF1要优于其他两个处理。

|
| 图 2 堆肥过程中堆体温度和环境温度的变化 Figure 2 Changes of pile temperature and environmental temperature during composting |
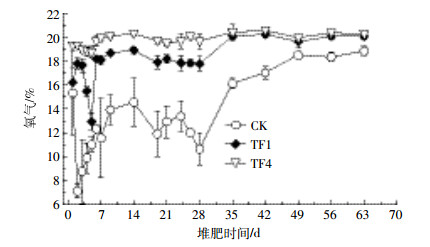
各处理的堆体O2含量随时间的变化趋势基本一致,堆肥开始时O2含量先降低,随着堆肥的进行,各处理O2含量逐渐升高,并维持稳定(图 3)。处理TF1和TF4的最低O2含量出现在第5 d,分别为12.94%和18.72%,随后上升,至稳定时为20%左右。而对照CK最低O2含量出现在第2 d,为7.1%,随后上升,腐熟期稳定在18%左右。方差分析显示,通风处理较不通风处理变化显著(P<0.05)。由结果可以看出,处理TF1和TF4均能满足堆肥过程中微生物对氧的需求。
|
| 图 3 肥过程中堆体O2含量的变化 Figure 3 Changes of O2 content in compost pile during composting |
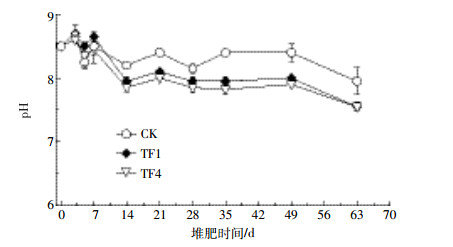
在升温的过程中木质纤维素等有机物,会产生大量水溶性氨促使堆体升温期各处理的pH上升,随后下降(图 4)。翻堆处理后,各处理的pH均上升;随着堆肥高温期的持续进行,各处理的pH升至8.4以上;随后各处理的pH均下降,并且通风量越大,pH下降越快。到堆肥结束后,TF1和TF4处理的pH维持在7.5左右。统计分析结果表明,通风处理(TF1和TF4)的好氧堆肥样品pH与静止堆肥(CK)之间的差异显著(P<0.05)。
|
| 图 4 堆肥化过程pH的变化 Figure 4 Changes of pH in compost pile during composting |
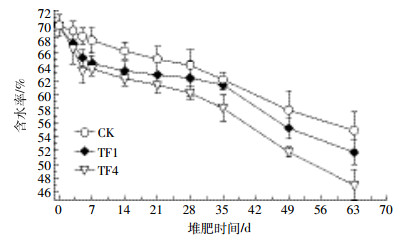
在整个堆肥过程中各处理的含水率均呈下降趋势。堆肥初期各处理堆体的含水率为69.86%,处理TF1和TF4的含水率下降较快,堆肥结束后含水率分别下降至51.75%和47.08%,而CK的含水率下降至54.88%(图 5),整个堆肥过程中各处理的含水率分别下降了14.98%、18.11%和22.78%。统计分析结果表明,堆肥结束时,通风处理对堆体含水率的影响差异显著(P<0.05),通风量的大小与堆体中的含水率呈负相关。
|
| 图 5 堆肥过程中含水率的变化 Figure 5 Changes of water content in compost pile during composting |
堆肥水溶性NH4+-N和NO3--N含量与堆肥条件及各种微生物活性的相关关系,是堆肥腐熟度评价的重要指标。随着堆体温度的升高,氨化作用增强,大量有机氮被微生物快速转化为NH4+-N并积累,处理TF1在第5 d可达到最大值80.12 mg·kg-1,处理TF4和CK在第7 d分别达到最大值39.02 mg·kg-1和38.12 mg·kg-1(图 6)。在堆肥降温期和腐熟期,由于挥发损失与微生物的固化作用,NH4+-N含量逐渐降低,到63 d堆肥结束后各处理的NH4+-N含量下降到3~4 mg·kg-1。根据Bernal等[23]研究的结果,3种处理在堆肥结束后NH4+-N含量均低于40 mg·kg-1,达到肥料的腐熟指标。堆肥结束时各处理堆体的NH4+-N含量差异并不显著(P>0.05)。

|
| 图 6 堆肥过程中铵态氮(NH4+-N)的变化 Figure 6 Changes of NH4+-N content in compost pile during composting |
|
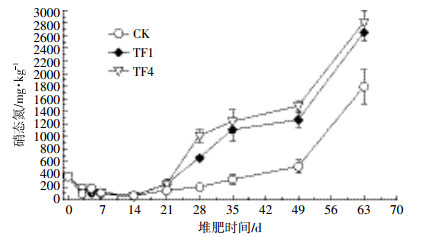
| 图 7 堆肥过程中硝态氮 (NO3--N) 的变化 Figure 7 Changes of NO3--N content in compost pile during composting |
堆肥开始时NO3--N含量为369.45 mg·kg-1,在升温期和高温期,NO3--N含量处于较低水平,在第14 d,各处理堆体的NO3--N含量降至最低,各处理(CK、TF1、TF4)分别为62.81、54.54、61.41 mg·kg-1。在堆肥后期,各处理堆体的NO3--N含量逐渐上升,到堆肥结束后,各处理(CK、TF1、TF4)的NO3--N含量分别达到1 793.26、2 649.63、2 811.50 mg·kg-1。处理TF1和处理TF4由于氧气的供应较稳定,更有利于NO3--N的生成。统计分析结果表明,堆肥结束后通风处理的NO3--N含量与CK差异显著(P<0.05),通风可以有效增加NO3--N含量,但是两通风处理间差异不显著。
2.2.2 通风处理对堆体NH3释放速率的影响堆肥过程中NH3的释放速率随时间的变化如图 8。处理TF4和处理TF1的NH3释放速率变化趋势一致,NH3释放速率均在高温期达到最大值,分别为3.825、1.02 g·h-1。随着堆肥进行,NH3释放速率下降,翻堆后NH3的释放速率有短暂的升高,随后又降低,在堆肥后期,NH3释放速率接近于零。处理CK在整个堆肥过程中的NH3释放速率低,高温期NH3释放速率最高为0.48 g·h-1。

|
| 图 8 堆肥过程中NH3释放速率的变化 Figure 8 Changes of NH3 volatilization rates in compost pile during composting |
Frederick等[24]研究了不同O2补充速率(0、0.1、1、10 mL·min-1)对堆肥的影响,发现随着O2供量的增加,NH3的释放速率增加,与本试验研究的结果一致。pH 对堆肥过程中NH4+-N的挥发具有较大影响[25]。有研究认为,高的pH值和堆肥温度会造成NH3的逸出[26],本研究中处理CK的pH高于处理TF4和处理TF1,但其NH3的释放速率最低。本研究中通风量对NH3挥发的影响较大,较高的通风量导致NH3的释放速率增大。
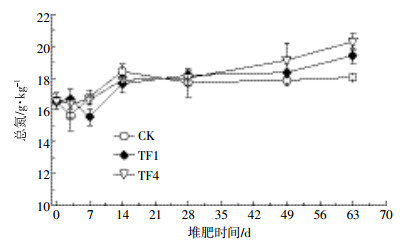
2.2.3 总氮含量总氮含量是衡量堆肥产品肥效的重要指标,合理控制堆肥过程中的通风量,对于减小氮素的损失具有重要作用。由图 9可知,除了处理CK的堆体总氮含量变化趋势为先降低后升高,再次降低的趋势以外,处理TF1和TF4的堆体总氮含量变化趋势均为先降低后升高。堆肥过程中,由于微生物矿化有机物及CO2的损失,造成干物质含量降低速率高于总氮的损失速率,总氮含量在堆肥结束后有所增加[27]。到高温期,处理TF4的总氮含量下降幅度最小,由16.55 g·kg-1下降至16.43 g·kg-1,而处理TF1与处理CK均由16.55 g·kg-1下降至15.5 g·kg-1左右。随后处理TF1和TF4总氮含量一直上升,到63 d堆肥结束后其总氮含量分别为19.40、20.29 g·kg-1,而CK的总氮含量在第14 d达到最高值18.41 g·kg-1,随后下降,堆肥结束时处理CK的总氮含量为18.04 g·kg-1。由此可以看出,通风处理虽然增加了前期氨气的挥发,但是通风处理的TN均较CK的高,这可能是由于处理CK局部厌氧而导致的反硝化作用所造成的。运用方差分析发现,在堆肥腐熟期,通风处理对TN的影响显著,呈正相关(P<0.05)。
|
| 图 9 堆肥过程中总氮(TN)的变化 Figure 9 Changes of TN content in compost pile during composting |
3种堆肥处理的氮素损失情况如表 1。处理TF4的总氮损失最大为501.14 g,氮损失率也最大为43.23%;处理CK氮损失量与氮损失率最小,分别为317.80 g和27.41%;处理TF1较小的通风量使NH3挥发导致的氮损失较小,总氮损失小于处理TF4。由此可见,总氮损失与通风量大小相关,通风量越大越容易导致氮素损失。统计结果表明,不同通风量对牛粪堆肥过程中总氮的损失有显著的影响(P<0.05)。
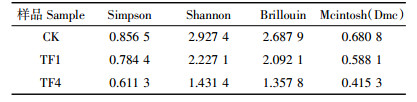
堆肥结束时,CK、TF1和TF4中nirK基因多样性结果见表 2。通过NCBI Blast比对共发现9种OTU,CK、TF1和TF4分别为9、5、3个OTU,样品CK的Simpson、Shannon、Brillouin和Mcintosh(Dmc)指数分别为0.856 5、2.927 4、2.687 9、0.680 8,均为所有处理中最大值(表 3),而样品TF4的多样性指数均最低。该结果说明CK处理堆肥63 d样品中的nirK基因多样性最高,nirK基因的多样性随着通风量的增大而减小。由此可知,通风处理可以减少堆肥过程中的反硝化细菌nirK基因的多样性。
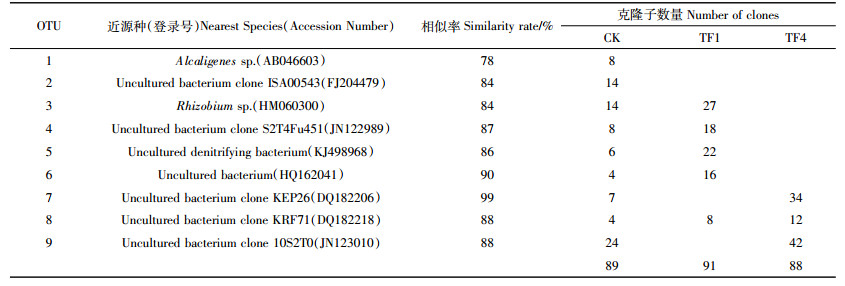 |
 |
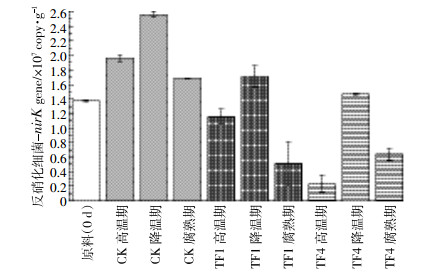
利用荧光定量PCR对各个时期的堆肥样品进行nirK基因的定量分析,结果见图 10。在堆肥的降温期,所有处理均达到了最高nirK基因拷贝数,分别为CK 2.56×107 copy·g-1、TF1 1.71×107 copy·g-1和TF4 1.47×107 copy·g-1。nirK基因最小拷贝数出现在TF4高温期的样品中,为2.32 ×106 copy·g-1。在高温期、降温期和腐熟期,通风处理的样品中nirK基因显著低于不通风处理的样品,并且在高温期和降温期,堆肥样品中nirK基因的数量随着通风量的增大而减小。
|
| 图 10 堆肥过程中反硝化细菌nirK基因数量的变化图 Figure 10 Changes of nirK gene number of denitrifying bacteria during composting |
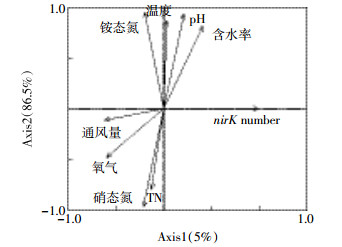
冗余分析(Redundancy analysis,RDA)是研究特定因素对生物群落所造成影响的生态学分析工具,其二维排序图表征不同因子对生物群落分布的影响。RDA 二维排序图中,带箭头的矢量线表示环境因子,线段的长短表示种群与该环境因子相关系数的大小,箭头连线与排序轴的夹角表示该因子与排序轴相关性的大小,夹角越小,相关性越大。由堆肥过程中反硝化细菌nirK基因的数量与环境因子关系的 RDA 二维排序图(图 11)可知,通风量是影响nirK基因数量的最显著因素,其次是氧气。尽管通风处理中堆肥氧气浓度高,特别是在TF4处理中氧气浓度始终在20%左右,但是在整个堆肥过程中却始终存在nirK基因,说明高浓度氧气并不能完全抑制反硝化细菌的生长,而仅能抑制其活动,减少nirK基因拷贝,降低反硝化作用造成的氮素损失。
|
| 图 11 反硝化细菌nirK基因数量与环境因子关系的 RDA 二维排序图 Figure 11 Two-dimensional ordination diagram of RDA of nirK gene number and environmental factors |
硝化作用是硝化细菌在有氧条件下,将铵态氮转化为硝态氮的过程。相反,反硝化作用是反硝化细菌在厌氧条件下,通过酶催化还原反应将氮氧化合物NO3-、NO2-转化成气态氮(NO、N2O、N2)[2]。从实验结果可知,在堆肥过程的降温期和腐熟期,不同处理的铵态氮和氨气释放速率变化不显著(图 6和图 8),硝态氮和总氮含量随着通风量的增加而增高(图 7和图 9)。在堆肥过程的高温期,铵态氮和氨气释放速率变化剧烈,可能是由于通风量增加,改变堆体内供氧环境所致,引起了堆体微生物活性的变化,并且随着温度升高,微生物剧烈活动而快速消耗有机质产生氨气,通过气体的流动被带走。硝态氮随通风量的增加而增加的结果,说明通风处理抑制了由NO3-向气态氮(NO、N2O、N2)转化的途径。通过荧光定量分析和克隆文库分析(图 10和表 2)发现,nirK基因数量和多样性随着通风量的增加而减少。冗余分析结果同样得出,通风量显著影响nirK基因数量,其次是氧气。通风量的增加,改变了堆体内的供氧环境,并通过气体的流动带走更多的水分和挥发性物质,改变了硝态氮和总氮含量。这表明,理化环境的变化引起了堆体微生物活性的变化,影响了反硝化微生物的活性,抑制了反硝化作用,减小反硝化作用所造成的氮素损失。
4 结论(1)在整个堆肥化过程中,通风处理对pH、含水率、氧气和氮素损失的影响显著。堆肥结束时NH4+-N的含量随通风量变化差异不显著,但总氨气释放速率、NO3--N的含量和总氮含量随着通风量的增大而增加,并且影响显著。
(2)通风处理可以显著降低样品中nirK基因多样性和数量,减少反硝化作用造成氮素的损失,并且增加总氮和硝态氮含量。
(3)通过合理的通风处理降低反硝化作用,可以为优化堆肥工艺及减少氮素的损失提供理论指导。
| [1] | 仇焕广,廖绍攀,井月,等.我国禽畜粪便污染的区域差异与发展趋势分析[J].环境科学, 2013, 34(7):2766-2774. QIU Huan-guang, LIAO Shao-pan, JING Yue, et al. Regional differences and development tendency of livestock manure pollution in China[J]. Environmental Science, 2013, 34(7):2766-2774. |
| [2] | Maeda K, Hanajima D, Toyoda S, et al. Microbiology of nitrogen cycle in animal manure compost[J]. Microbial Biotechnology, 2011, 4(6):700-709. |
| [3] | Maeda K, Morioka R, Hanajima D, et al. The impact of using mature compost on nitrous oxide emission and the denitrifier community in the cattle manure composting process[J]. Microbial Ecology, 2010, 59(1):25-36. |
| [4] | Rosch C, Mergel A, Bothe H. Biodiversity of denitrifying and dinitrogen-fixing bacteria in an acid forest soil[J]. Applied and Environmental Microbiology, 2002, 68(8):3818-3829. |
| [5] | Smith J M, Ogram A. Genetic and functional variation in denitrifer populations along a short-term restoration chronosequence[J]. Applied and Environmental Microbiology, 2008, 74(18):5615-5620. |
| [6] | Wertz S, Goyer C, Zebarth B J, et al. Effects of temperatures near the freezing point on N2O emissions, denitrification and on the abundance and structure of nitrifying and denitrifying soil communities[J]. FEMS Microbiology and Ecology, 2013, 83(1):242-254. |
| [7] | Hartmann A A, Barnard R L, Marhan S, et al. Effects of drought and N-fertilization on N cycling in two grassland soils[J]. Oecologia, 2013, 171(3):705-717. |
| [8] | Jung J, Yeom J, Han J, et al. Seasonal changes in nitrogen-cycle gene abundances and in bacterial communities in acidic forest soils[J]. Journal of Microbiology, 2012, 50(3):365-373. |
| [9] | Steven A W, Paul N N, John D A, et al. Bacterial community structure and denitrifier(nir-gene) abundance in soil water and groundwater beneath agricultural land[J]. Soil Research, 2011, 49(1):65-76. |
| [10] | Huang S, Chen C, Wu Q, et al. Distribution of typical denitrifying functional genes and diversity of the nirS-encoding bacterial community related to environmental characteristics of river sediments[J]. Biogeosciences Discussions, 2011, 8(3):5251-5280. |
| [11] | Robertson G P, Paul E A, Harwood R R. Greenhouse gases in intensive agriculture:Contributions of individual gases to the radiative forcing of the atmosphere[J]. Science, 2000, 289(5486):1922-1925. |
| [12] | 吴伟祥,李丽劼,吕豪豪,等.畜禽粪便好氧堆肥过程氧化亚氮排放机制[J].应用生态学报, 2012, 23(6):1704-1712. WU Wei-xiang, LI Li-jie, LÜ Hao-hao, et al. Mechanisms of nitrous oxide emission during livestock manure aerobic composting[J]. Chinese Journal of Applied Ecology, 2012, 23(6):1704-1712. |
| [13] | Sommer S G, MØller H B. Emission of greenhouse gases during composting of deep litter from pig production effect of straw content[J]. Journal of Agricultural Science, 2000, 134(3):327-335. |
| [14] | Osada T, Kuroda K, Yonaga M. Determination of nitrous oxide, methane, and ammonia emissions from a swine waste composting process[J]. Journal of Material Cycles and Waste Management, 2000, 2(1):51-56. |
| [15] | 虞泳,曾光明,陈耀宁,等.农业废物好氧堆肥中氨氧化细菌的群落结构[J].环境科学, 2011, 32(10):3067-3072. YU Yong, ZENG Guang-ming, CHEN Yao-ning, et al. Succession of ammonia-oxidizing bacteria community structure during agricultural waste composting[J]. Environmental Science, 2011, 32(10):3067-3072. |
| [16] | 杨恋,杨朝晖,曾光明,等.好氧堆肥高温期的嗜热真菌和嗜热放线菌群落结构[J].环境科学学报, 2008, 28(12):2514-2521. YANG Lian, YANG Zhao-hui, ZENG Guang-ming, et al. Succession of the rmophilic fungi and actinomycetes communities during the thermophilic period of aerobic composting[J]. Acta Scientiae Circumstantiae, 2008, 28(12):2514-2521. |
| [17] | Hallin S, Lindgren P E. PCR detection of genes encoding nitrile reductase in denitrifying bacteria[J]. Applied and Environmental Microbiology, 1999, 65(4):1652-1657. |
| [18] | Wei D, Yang Q, Zhang J Z, et al. Bacterial community structure and diversity in a black soil as affected by long-term fertilization[J]. Pedosphere, 2008, 18(5):582-592. |
| [19] | Atlas R M, Bartha R. Microbial ecology:Fundamentals and applications[M]. Massachusetts:Addison Wesley Publishing Reading, 1981. |
| [20] | 魏源送,李承强,樊耀波,等.不同通风方式对污泥堆肥的影响[J].环境科学, 2001, 22(3):54-59. WEI Yuan-song, LI Cheng-qiang, FAN Yao-bo, et al. Effect on sewage sludge composting with different aeration modes[J]. Environmental Science, 2001, 22(3):54-59. |
| [21] | 徐红,樊耀波,贾智萍,等.时间温度联合控制的强制通风污泥堆肥技术[J].环境科学,2000,21(6):51-55. Xu H, Fan Y B, Jia Z P, et al. Forced aeration composting of sewage sludge controlled by time and temperature controller[J]. Environmental Science, 2000, 21(6):51-55. |
| [22] | Yu H, Zeng G, Huang H, et al. Microbial community succession and lignocellulose degradation during agricultural waste composting[J]. Biodegradation, 2007, 18(6):793-802. |
| [23] | Bernal M P, Paredes C, Sánchez-Monedero M A, et al. Maturity and stability parameters of composts prepared with a wide range of organic wastes[J]. Bioresource Technology, 1998, 63(1):91-99. |
| [24] | Frederick C, Michel Jr, C A Reddy. Effect of oxygenation level on yard trimmings composting rate, odor production and compost quality in bench-scale reactors[J]. Compost Science and Utilization, 1998, 6(4):6-14. |
| [25] | 刘宁,赵义武,史春梅.覆盖、翻堆对堆肥过程中N2O、NH3排放规律的研究[J].环境卫生工程, 2013, 21(1):53-57. LIU Ning, ZHAO Yi-wu, SHI Chun-mei. Effects of covering and turning on emission regularity of N2O and NH3 during composting process[J]. Environmental Sanitation Engineering, 2013, 21(1):53-57. |
| [26] | 杨延梅,刘鸿亮,杨志峰,等.控制堆肥过程中氮素损失的途径和方法综述[J].北京师范大学学报(自然科学版), 2004, 41(2):213-216. YANG Yan-mei, LIU Hong-liang, YANG Zhi-feng, et al. Methods and techniques in the control of nitrogen loss during the composting:A review[J]. Journal of Beijing Nomal Univesity(Natural Science), 2004, 41(2):213-216. |
| [27] | Fang M, Wong J W C, Ma K K, et al. Co-composting of sewage sludge and coal fly ash:Nutrient transformations[J]. Bioresource Technology, 1999, 67(1):19-24. |
 2016, Vol. 35
2016, Vol. 35