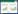文章信息
- 许彩云, 靳红梅, 常志州, 杜静, 黄红英, 艾玉春, 周立祥
- XU Cai-yun, JIN Hong-mei, CHANG Zhi-zhou, DU Jing, HUANG Hong-ying, AI Yu-chun, ZHOU Li-xiang
- 麦秸生物炭添加对猪粪中温厌氧发酵产气特性的影响
- Effect of biochar pyrolyzed from wheat straws at different temperatures on biogas production characteristics of pig manure during mesophilic digestion
- 农业环境科学学报, 2016, 35(6): 1167-1172
- Journal of Agro-Environment Science, 2016, 35(6): 1167-1172
- http://dx.doi.org/10.11654/jaes.2016.06.020
文章历史
- 收稿日期: 2015-12-24
2. 农业部农村可再生能源开发利用华东科学观测实验站, 南京 210014 ;
3. 南京农业大学资源与环境科学学院, 南京 210095
2. East China Scientific Observing and Experimental Station of Development and Utilization of Rural Renewable Energy, Ministry of Agriculture, Nanjing 210014, China ;
3. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China
我国是生猪养殖大国,截至2013年生猪年饲养总量(出栏+存栏)已超过11亿头[1]。随着养殖规模不断扩大,产生的粪尿及污水也相对集中,给猪场周边环境造成了巨大的压力。大中型沼气工程是处理规模猪场粪污的有效途径,特别是在处理低浓度的尿液和污水方面,具有缓解环境污染问题和能源问题的双重效益[2]。
猪粪厌氧消化过程中,微生物产生的中间代谢物对厌氧消化产能有严重的抑制作用,如氨抑制和酸抑制等问题[3-5]。目前对厌氧消化中间产物抑制的控制主要通过基质调配或过程调控等手段实现,如通过进行多物料混合厌氧消化、调节碳氮比[6]、添加调节因子或微量营养盐[7]、接种特定功能微生物驯化污泥等[8-9]。与欧洲等国家的大型沼气工程不同,我国畜禽养殖场沼气工程发酵原料单一且有机负荷低。多原料混合厌氧消化操作和过程控制较为复杂,对于厌氧消化原料较为单一的养猪场较难应用。活性炭可用于猪粪厌氧发酵,具有减少厌氧消化启动阶段有机负荷冲击、加速产甲烷菌群累积,以及提高猪粪厌氧消化产甲烷率的作用[10]。但是活性炭价格昂贵,需从厌氧消化剩余物中回收再利用才能减少运行成本[11],操作不便。因此,研究低成本、简便、高效且环保的猪粪厌氧消化产气率促进方法,对规模猪场沼气工程的实际运行具有迫切的应用价值。
生物炭是由生物质在部分或完全缺氧的条件下经热解炭化产生的一类高度芳香化、较稳定且难溶性物质[12]。生物炭与活性炭理化性质相近,但价格低廉,近年来作为活性炭的替代品在土壤质量改善、环境污染阻控和污染修复等方面有广泛的应用[13]。目前,国内外只有少量报道针对生物炭添加对畜禽粪便厌氧发酵产气影响的研究,且结果并不一致[14-16]。例如,Mumme等[14]研究发现,添加生物炭可以提高鸡粪、牛粪和藻类及其混合物的产气潜力和甲烷含量;而Inthapanya等[17]研究却发现,添加生物炭在提升牛粪厌氧消化产气潜力的同时,降低了气体中的甲烷含量,且过量的生物炭对提升牛粪厌氧消化产气潜力没有作用。除了生物炭添加量外,其自身的特性也对厌氧消化产气和产甲烷潜力有显著的影响[14, 16],如pH、比表面积和孔径大小、表面功能基团等,会调控厌氧发酵体系物质传递与转化、微生物代谢与协同作用等过程。
制备温度是影响生物炭特性最重要的因素,添加不同制备温度的生物炭可能对畜禽粪便厌氧产气和产甲烷特性有一定的影响。麦秸是一类来源广且优质的生物炭制备原料,但目前,对麦秸生物炭添加后猪粪中温厌氧发酵产气特性的研究未见报道。为此,本文在(37±1)℃条件下,采用序批式厌氧消化工艺进行低浓度猪粪厌氧发酵试验,探讨不同制备温度的麦秸生物炭添加对猪粪产气特性的影响,为低浓度猪场粪污厌氧消化高产工艺理论研究和生产应用提供技术支撑。
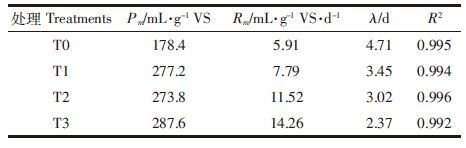
1 材料与方法 1.1 试验材料生物炭由麦秸经400、500、600 ℃烧制而成,制作方法同Jin等[18],分别用BC400、BC500和BC600表示,其理化性质详见表 1。猪粪一次性取自宜兴市坤兴养猪场,0~4 ℃冷藏备用,其总固体(TS)含量为25%,挥发性固体(VS)含量为81%,总有机碳(TOC)、总氮(TN)和总磷(TP)含量分别为36.86%、2.07%和1.97%,C/N为17.77。接种污泥取自宜兴市坤兴养猪场沼气池污泥,中温(35~40 ℃)驯化至产甲烷量达50%后使用,其TS为4.88%,VS为67.21%。
|
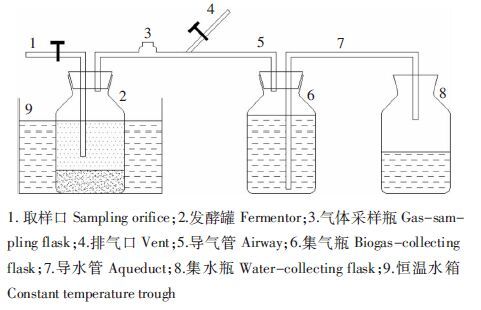
厌氧消化试验在自制的玻璃反应器内进行,反应器容积1.0 L,有效容积0.9 L,在顶部设有出气孔口和气体取样口,示意图见图 1。整个试验期间将发酵罐放置在恒温水浴锅内,以保证发酵罐内温度恒定在(37±1)℃。
|
| 图 1 厌氧发酵装置图 Figure 1 Anaerobic fermentation devices |
试验采用批次发酵,在上述反应器中接种驯化污泥20%(V/V),加入猪粪115 g(合干物质28.8 g),水600 mL混合,调节各处理的TS负荷均为4.2%。在上述反应体系中,分别添加BC400、BC500和BC600各3.0 g,使其占系统干物质重的8.0%,同时设置未加生物炭的处理作为对照,分别对应的处理编号为T1、T2、T3和T0。混合均匀后,通入氮气2 min以驱赶发酵罐内的空气,密封后进行厌氧发酵。每日定时检测产气量和甲烷等气体含量,直至产气结束。每个处理两个平行,取平均值进行分析。
1.3 测定方法日产气量采用排水法测定;甲烷含量采用GC9890A/T气相色谱仪分析(TCD检测器);TS和VS用加热干燥法及马弗炉灼烧法测定。
1.4 数据分析厌氧发酵系统产气过程的动力学模拟采用修正的Gompertz模型,其公式如下:
式中:P(t)为t时间内的累积产气量,mL·g-1 VS;Pm为最大累积产气量,mL·g-1 VS;Rm为最大产气速率,mL·g-1 VS·d-1;λ为延滞期,d;e为常数,2.718 28。
各指标在不同处理间的差异采用单因素方差分析(ANOVA),统计分析软件为SPSS 13.0,数据拟合采用Origin 9.0。
2 结果与讨论 2.1 产气特性各处理产气速率和累积产气率随时间变化如图 2所示。由图 2a可以看出:厌氧发酵起始阶段,对照处理的日产气率逐渐增加,第5 d和第9 d出现小幅降低,至第12 d逐渐达到最大值8.25 mL·g-1 VS;之后产气率下降后再次出现稳步上升,至第26 d达到第二个产气高峰7.99 mL·g-1 VS,随后逐渐降低并维持在较低水平,第38 d后日产气率小于总产气率的1%[19]。添加生物炭后,猪粪日产气率大幅提高。T1~T3处理均在第8 d达到最大值,分别为13.97、22.17 mL·g-1 VS和26.85 mL·g-1 VS。第二个高峰期出现在第21~22 d,分别为9.97、9.71 mL·g-1 VS和10.57 mL·g-1 VS,随后日产气率逐渐降低并维持在较低水平。但添加BC400的处理(T1)在发酵后期依然保持较高的日产气率,直至第45 d后才低于总产气率的1%[19]。

|
| 图 2 各处理中温厌氧发酵中日产气量(a)及累积产气量(b) Figure 2 Daily productivity and cumulative production of biogas in different treatments during anaerobic digestion |
添加不同热解温度生物炭各处理的累积产气量如图 2b所示。可以看出:累积产气量的总体变化趋势为前期快速增长,之后增加速率变小,并逐渐趋于平稳,这与大部分猪粪厌氧发酵研究结果相似;添加生物炭后,系统的累积产气量显著(P<0.05)高于T0处理,至试验结束时,T1~T3处理的累积产气量达260.7~288.7 mL·g-1 VS,较T0处理增幅约为77.1%~96.1%(表 2)。

|
消化时间T90(即反应过程的累积产气量达到总累积产气量的90%所需要的时间),是表征消化性能和消化效率的重要指标。对照处理中,T90为35 d;添加生物炭后,T90分别为40、30 d和26 d。可见,添加BC500和BC600的处理系统中消化效率明显提高。这可能是由于添加这两种生物炭后系统的缓冲能力和微生物的活动得到增强[21-22],底物被消耗速率增加。
2.2 产甲烷特性各处理在厌氧发酵过程中的甲烷含量和产甲烷速率如图 3所示。可以看出,添加生物炭后猪粪厌氧发酵产甲烷含量明显高于对照处理(图 3a),T1~T3处理的平均甲烷含量分别为63.4%、65.0%和66.4%,显著(P<0.05)高于对照处理(52.7%),但T1~T3之间差异不显著(表 2)。这主要是由于生物炭可以缓解粪便厌氧发酵过程中中间产物的抑制,减少厌氧消化启动阶段有机负荷冲击,加速产甲烷菌群累积的作用[14-17]。同时,生物炭作为介导物,可能直接参与厌氧反应体系中微生物种间的直接电子转移,极大地促进了甲烷产生效率[23-24]。此外,生物炭中裸露的羰基也可能与二氧化碳结合,降低了二氧化碳含量,提高了甲烷含量[25]。
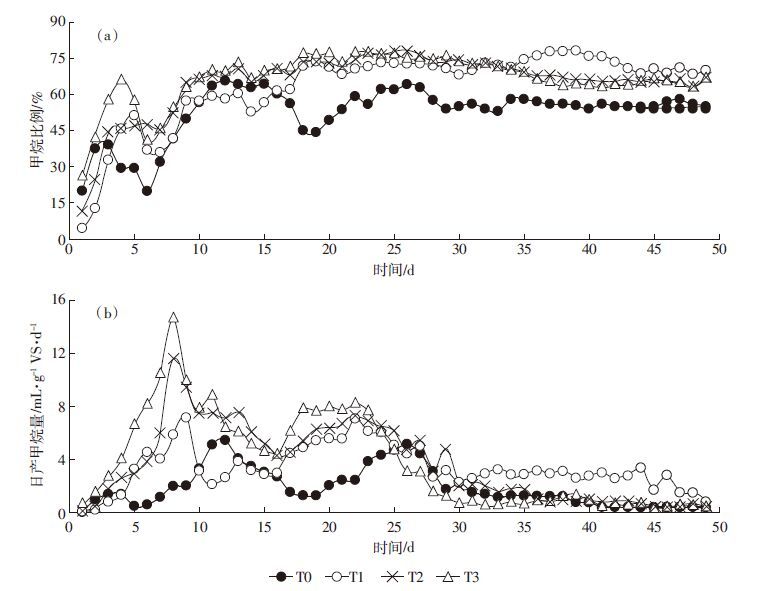
|
| 图 3 各处理中温厌氧发酵中甲烷比例(a)及日产甲烷量(b) Figure 3 Methane percentages(a) and daily methane production(b) in different treatments during anaerobic digestion |
整个厌氧发酵过程中,产甲烷速率的变化趋势相似,即前期迅速升高,随后逐渐降低,最终达到稳定。T0、T1、T2和T3处理甲烷产生率分别在第12、9、8 d和8 d时达到最大值,分别为5.42、7.13、11.60 mL·g-1 VS和14.60 mL·g-1 VS。整个厌氧发酵过程中,添加生物炭处理的甲烷产量显著(P<0.05)高于对照处理,增幅为78.1%~101.8%(表 2)。此变化趋势与厌氧发酵过程中产气速率的变化密切相关。值得注意的是,T1处理发酵30 d后,产甲烷率反而出现小幅增加,并维持在2.25~3.34 mL·g-1 VS之间。这可能是由于添加BC400后,促进了厌氧发酵系统中微生物的互营作用,进而导致电子传递增强[21];但其与BC500和BC600对厌氧反应体系的影响差异尚需进一步探究。
2.3 动力学分析厌氧发酵产气过程被认为是微生物生长的函数[26],因此,采用修正的Gompertz方程对累积产气进行拟合。从拟合结果(表 3)可以看出,各处理厌氧消化产气特性与模型拟合度均较高(R2>0.99),同时拟合值Pm与实测值(即VS产气量)相差不大,反映出体系中底物较为一致,且添加生物炭后对体系的稳定性有促进作用。延滞期是反映厌氧消化性能的一个重要指标[27],添加生物炭后厌氧发酵的延滞期缩短,说明其有利于反应体系中厌氧微生物的增殖和活化,进而提高对底物的转化效率,这与T90变化相一致。
2.4 不同热解温度的麦秸生物炭对产气特性的影响添加BC600的处理其总产气量和甲烷产量均最高,其次为BC500,而BC400最低(表 2)。这与麦秸生物炭自身的特性密切相关。对同一物料而言,制备温度是影响产物特性最主要的驱动因子。随着热解温度的增加,生成的生物炭中挥发性C含量逐渐降低,而pH、EC、固定C、灰分含量,以及比表面积和孔隙度均逐渐增加(表 1),这与前期研究结果相似[18]。其中,SBET和Vtotal的增加对厌氧消化系统有直接的促进影响。一方面,可以为厌氧微生物提供更大的接触面积,对微生物的生长和累积提供了更有利的场所[21-22];另一方面,微环境的形成增加微生物种间的直接电子转移,促进菌群间的互营[23-24],进而极大地促进了甲烷产生效率。此外,较高温度获得的麦秸生物炭表面可能带有更多裸露的羰基,其可与二氧化碳结合,降低了二氧化碳含量,提高了甲烷含量[25]。因此,添加BC600的处理总产气量和甲烷产量均最高,同时大大缩短了发酵延滞期。
虽然不同热解温度的麦秸生物炭对总产气量和产甲烷量的影响效果不显著,但产气特性存在明显的差异。特别是第10~40 d期间,各处理间差异较为明显(图 2和图 3)。添加BC400的处理,其产气特性明显有别于另外两种生物炭添加处理:系统前期累积产气量较少,但第26 d后有持续增加的趋势(图 2b);同时,发酵30 d后,产甲烷率也出现小幅增加,并维持在2.25~3.34 mL·g-1 VS之间(图 3b)。这说明,与其他两种生物炭相比,BC400对猪粪厌氧消化存在一定的延滞期(表 3)。造成这一差异的主要原因是BC400较低的SBET和Vtotal无法短时间内促进厌氧微生物的增殖和活化,因此对底物的转化效率较其他生物炭处理略低。对于不同麦秸生物炭表面功能基团对厌氧消化产气特性的影响尚需进一步探究。
(1) 添加麦秸热解生物炭后猪粪中温厌氧消化的产气量和产甲烷量分别为260.7~288.7 mL·g-1 VS和163.7~185.5 mL·g-1 VS,较纯猪粪处理提高了77.1%~96.1%和78.1%~101.8%(P<0.05);同时可明显提高猪粪厌氧发酵系统的消化效率(T90),缩短厌氧发酵的延滞期。
(2) 不同麦秸生物炭对猪粪厌氧发酵的促进作用表现为BC600>BC500>BC400,且产气特性明显不同,热解温度造成的生物炭自身性质的差异是导致这一现象最主要的原因。
| [1] | . 2014年中国统计年鉴. 中华人民共和国国家统计局[M]. 北京: 中国统计出版社, 2014 . China Statistical Yearbook. Compiled by national bureau of statistics of China[M]. Beijing: China Statistics Press, 2014 . |
| [2] | Lu J, Zhu L, Hu G, et al. Integrating animal manure-based bioenergy production with invasive species control:A case study at Tongren Pig Farm in China[J]. Biomass and Bioenergy, 2010, 34 (6) :821–827 . |
| [3] | Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process:A review[J]. Bioresource Technology, 2008, 99 (10) :4044–4064 . |
| [4] | Rajagopal R, Massé D, Singh G. A critical review on inhibition of anaerobic digestion process by excess ammonia[J]. Bioresource Technology, 2013, 143 :632–641 . |
| [5] | Yenigün O, Demirel B. Ammonia inhibition in anaerobic digestion:A review[J]. Process Biochemistry, 2013, 48 (5/6) :901–911 . |
| [6] | Wang X J, Yang G H, Feng Y Z, et al. Optimizing feeding composition and carbon-nitrogen ratios for improved methane yield during anaerobic co-digestion of dairy, chicken manure and wheat straw[J]. Bioresource Technology, 2012, 120 :78–83 . |
| [7] | Banks C J, Zhang Y, Jiang Y, et al. Trace element requirements for stable food waste digestion at elevated ammonia concentrations[J]. Bioresource Technology, 2012, 104 :127–135 . |
| [8] | Hatamoto M, Imachi H, Ohashi A, et al. Identification and cultivation of anaerobic, syntrophic long-chain fatty acid-degrading microbes from mesophilic and thermophilic methanogenic sludges[J]. Applied and Environmental Microbiology, 2007, 73 (4) :1332–1340 . |
| [9] | Shin S G, Han G, Lim J, et al. A comprehensive microbial insight into two-stage anaerobic digestion of food waste-recycling wastewater[J]. Water Research, 2010, 44 (17) :4838–4849 . |
| [10] | Morita M, Malvankar N S, Franks A E, et al. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates[J]. mBio, 2015, 2 (4) :e00159–11 . |
| [11] | Aktaş Ö, Çeçen F. Bioregeneration of activated carbon:A review[J]. International Biodeterioration & Biodegradation, 2007, 59 (4) :257–272 . |
| [12] | Monlau F, Sambusiti C, Antoniou N, et al. Pyrochars from bioenergy residue as novel bio-adsorbents for lignocellulosic hydrolysate detoxification[J]. Bioresource Technology, 2015, 187 :379–386 . |
| [13] | Paz-Ferreiro J, Lu H, Fu S, et al. Use of phytoremediation and biochar to remediate heavy metal polluted soils:A review[J]. Solid Earth, 2013, 5 (2) :2155–2179 . |
| [14] | Mumme J, Srocke F, Heeg K, et al. Use of biochars in anaerobic digestion[J]. Bioresource Technology, 2014, 164 :189–197 . |
| [15] | Luo C, Lü F, Shao L, et al. Application of eco-compatible biochar in anaerobic digestion to relieve acid stress and promote the selective colonization of functional microbes[J]. Water Research, 2015, 68 :710–718 . |
| [16] | 潘君廷, 邱凌, HassaneinA A M, 等. 生物炭添加对鸡粪厌氧消化产气特性的影响[J]. 农业机械学报, 2014, 45 (12) : 229–233 . PAN Jun-ting, QIU Ling, Hassanein A A M, et al. Orthogonal experiment on biogas production characteristics of chicken manure with biochar[J]. Transactions of the Chinese Society for Agricultural Machinery, 2014, 45 (12) :229–233 . |
| [17] | Inthapanya S, Preston T, Leng R. Biochar increases biogas production in a batch digester charged with cattle manure[J]. Livestock Research for Rural Development, 2012, 24 (12) :212 . |
| [18] | Jin H, Arazo R O, Gao J, et al. Leaching of heavy metals from fast pyrolysis residues produced from different particle sizes of sewage sludge[J]. Journal of Analytical and Applied Pyrolysis, 2014, 109 :168–175 . |
| [19] | VDI 4630. Fermentation of organic materials-Characterisation of the substrate, sampling, collection of material data, fermentation tests[S]. Germany, 2006. |
| [20] | Meng Y, Shen F, Yuan H, et al. Start-up and operation strategies on the liquefied food waste anaerobic digestion and a full-scale case application[J]. Bioprocess and Biosystems Engineering, 2014, 37 (11) :2333–2341 . |
| [21] | Sieber J R, McInerney M J, Gunsalus R P. Genomic insights into syntrophy:The paradigm for anaerobic metabolic cooperation[J]. Annual Review of Microbiology, 2012, 66 (1) :429–452 . |
| [22] | Shen L, Zhao Q, Wu X, et al. Interspecies electron transfer in syntrophic methanogenic consortia:From cultures to bioreactors[J]. Renewable and Sustainable Energy Reviews, 2016, 54 :1358–1367 . |
| [23] | Rotaru A, Shrestha P M, Liu F H, et al. A new model for electron flow during anaerobic digestion:Direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane[J]. Energy & Environmental Science, 2014, 7 (1) :408–415 . |
| [24] | Chen S, Rotaru A-E, Shrestha P M, et al. Promoting interspecies electron transfer with biochar[J]. Scientific Reports, 2014, 4 :5019 . |
| [25] | Mao J D, Johnson R L, Lehmann J, et al. Abundant and stable char residues in soils:Implications for soil fertility and carbon sequestration[J]. Environment Science & Technology, 2012, 46 (17) :9571–9576 . |
| [26] | Gujer W, Zehnder A. Conversion processes in anaerobic digestion[J]. Water Science & Technology, 1983, 15 (8/9) :127–167 . |
| [27] | 周孟津, 张榕林, 蔺金印. 沼气实用技术[M].2版. 北京: 化学工业出版社, 2009 ZHOU Meng-jin, ZHANG Rong-lin, LIN Jin-yin. Biogas practical technology[M].Second edition. Beijing: Chemical Industry Press, 2009 . |
 2016, Vol. 35
2016, Vol. 35