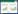文章信息
- 赖长鸿, 颜增光, 廖博文, 李松蔚, 贺鸿志, 黎华寿, 陈桂葵
- LAI Chang-hong, YAN Zeng-guang, LIAO Bo-wen, LI Song-wei, HE Hong-zhi, LI Hua-shou, CHEN Gui-kui
- 皇竹草生物炭的结构特征及其对Cr(Ⅵ)的吸附性能
- Structural feature and chromium(Ⅵ) adsorption of biochar derived from Pennisetum hydridum
- 农业环境科学学报, 2016, 35(6): 1188-1193
- Journal of Agro-Environment Science, 2016, 35(6): 1188-1193
- http://dx.doi.org/10.11654/jaes.2016.06.023
文章历史
- 收稿日期: 2015-11-26
2. 中国环境科学研究院 环境基准与风险评估国家重点实验室, 北京 100012 ;
3. 广东省现代生态农业与循环农业工程技术研究中心, 广州 510642
2. State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China ;
3. Guangdong Engineering Research Center for Modern Eco-agriculture and Circular Agriculture, Guangzhou 510642, China
铬广泛应用于电镀、皮革等工业领域,已被纳入美国EPA公认的129种重点污染物之一[1-2]。水体中的铬主要是以Cr(Ⅲ)和Cr(Ⅵ)两种稳定的价态存在,两者在毒性、移动性和生物有效性上存在明显差异:Cr(Ⅲ)难溶解且不易迁移,在自然界普遍存在;而Cr(Ⅵ)以CrO42-和Cr2O72-形式存在,有毒且可溶,易迁移且毒性为Cr(Ⅲ)的100倍[3]。接触Cr(Ⅵ)的化合物容易对人体造成毒性危害,如皮炎、过敏、甚至可引发癌症[4-6]。
目前水体铬污染治理的方法很多,如:氧化聚沉、静电沉淀、铝盐凝聚、反渗透、离子交换树脂、吸附和凝聚过微孔膜等[7],但是这些方法操作复杂、成本较高且难以推广应用。吸附法由于成本低、操作简单、原位修复且去除效果较好,被认为是一种有效实用的铬去除方法。选择廉价且具高效吸附效能的材料是此方法应用于实践的关键所在。
由于生物炭具有多孔性,较大的比表面积,较强的表面吸附能力,高度的化学惰性,其表面高度芳香化结构和部分羟基、酚羟基、羰基等官能团,对有机和无机污染物具有高度的亲和力,已被作为良好的吸附材料而成为国内外环境研究领域关注的新热点[8-9]。生物炭是指生物残渣在低氧条件下燃烧,生成多孔结构、低密度的具碳丰富的材料[10]。生物炭表面特殊的微孔结构和表面化学特性使其对重金属也具有一定的吸附能力,并可影响重金属在环境中的分布、迁移以及生物有效性[11-12]。但是由于制备生物炭的原料不同,导致了各类生物炭的吸附效果差异显著。
皇竹草(Pennisetum hydridum)对生存环境要求低,根系发达、生长快、产量高,在贫瘠退化的沙滩地、沙地和水土流失较为严重的陡坡地均能适应生长[13]。近年来,皇竹草逐渐被应用于生态环境治理、水土保持、植被修复,还被应用于饲料、造纸、饮料食品和新能源领域,可见其生物炭的开发无疑将开拓又一新的利用前景。鉴于目前国内外有关皇竹草基生物炭的研究报道较少,本研究将分析不同热解温度下制备的皇竹草生物炭的表面结构特征及其对铬的吸附效能,探讨该类型的生物炭吸附铬的可能机理,以期为皇竹草的利用和水体铬污染的治理提供科学依据。
1 材料与方法 1.1 生物炭的制备皇竹草于2014年10月采自广东省广州市华南农业大学生态系农场(23.21°N,113.42°E),测得其茎秆金属元素含量见表 1。将皇竹草的茎秆部分在烘干箱内于80 ℃烘干,再放入马弗炉(型号FR-1236,北京永光明医疗仪器厂)并通入氮气10 min驱赶氧气,然后分别于300、500、700 ℃ 缺氧条件下制备生物炭,炭化时间2 h。
取过100目筛的皇竹草生物炭样品100 mg置于50 mL塑料离心管中,然后添加40 mL的Cr(Ⅵ)溶液(其初始pH 5.5,背景电解质NaNO3的浓度为0.01 mol·L-1)。采用重铬酸钾配置Cr(Ⅵ)溶液(下同),初始浓度分别设为 2.0、5.0、10.0、20.0、50.0、80.0 mg·L-1,恒温(25 ℃)振荡 24 h(200 r·min-1)后,采用0.45 μm微孔滤膜过滤生物炭。本实验设3个平行处理,并重复两次。
Cr的吸附量通过以下公式[14]计算:
式中:Qt为时间t时生物炭对Cr(Ⅵ)的吸附量,mg·g-1;C0为溶液中Cr(Ⅵ)的初始浓度,mg·L-1;Ct为时间 t时溶液中Cr(Ⅵ)的浓度,mg·L-1;m为对应取样管中生物炭的质量,g。
采用 Freundlich 模型(2)和Langmuir 模型(3)拟合,其公式[14]分别为:
式中:Qe表示平衡时的吸附量,mg·g-1;Qm表示最大吸附量,mg·g-1;Ce表示平衡时的溶液浓度,mg·L-1;Kf是吸附容量,mg·g-1;n是 Langmuir 常数,表示吸附强度;b是 Freundlich 常数,表示吸附强度大小。
1.2.2 生物炭对Cr(Ⅵ)的动力学吸附实验取过100目筛的皇竹草生物炭样品100 mg置于50 mL 离心管中,加入40 mL初始pH 5.5、背景电解质NaNO3的浓度为0.01 mol·L-1,Cr(Ⅵ)浓度为 20 mg·L-1的溶液,恒温(25 ℃,200 r·min-1)振荡,分别于0.1、0.3、0.7、1、2、8、16、30、48 h 取样,过孔径为 0.45 μm 的醋酸纤维滤膜,滤液立即加硝酸(GR)调至 pH<2。用原子吸收光谱仪-火焰法测定Cr浓度。
1.3 生物炭特征分析实验方法 1.3.1 生物炭的产率取皇竹草茎秆于烘干箱80 ℃烘干。烘干后的皇竹草茎秆质量记为m1,将其装入质量为m2的不锈钢饭盒中;马弗炉通入氮气使其处于无氧条件,然后将饭盒放入,分别设置三种不同制备温度(300、500、700 ℃)进行炭化2 h,至冷却,取出并测得m3,按下式计算产率p:
称取过100目筛的生物炭约0.5 mg(精确至0.01 mg),平铺于瓷坩埚底部,敞口置于马弗炉内,800 ℃下灰化4 h,冷却至室温后取出,称量。按下式计算灰分含量:
式中:A为样品中灰分,%;G为灼烧前生物炭含量,g;G1为空镍坩埚质量,g;G2为灰分与镍坩埚质量,g。
1.3.3 生物炭的SEM分析将少量的过100目筛的生物炭样品镀金并粘在样品台上,然后使用扫描电镜(荷兰FEI公司)观察样品形状和表面特征(电压为20 kV)。
1.3.4 生物炭的pH称取生物炭1.0 g于15 mL离心管中,加入到10 mL浓度为0.01 mol·L-1的氯化钙溶液中,振荡2 min,静置30 min,然后用雷磁酸度计(上海精科有限公司)测量pH值。
1.3.5重金属含量的测定Zn、Cu、Pb、Ni、Cd和Cr等重金属的总含量采用原子吸收光谱仪(德国耶拿公司)测定,Cr(Ⅵ)含量采用二苯碳酰二肼法(岛津-紫外分光光度计,上海善可精密仪器有限公司)测定。
1.3.6 数据处理和统计分析实验数据用平均数±标准误(Mean±SE)来表示,采用Microsoft Excel和SPSS 17.0进行计算和统计分析,并用Duncan检验法进行显著性差异分析(P<0.05)。
2 结果与分析 2.1 不同热解温度制备的生物炭的主要理化特性由表 2可知,随着热解温度的升高,皇竹草生物炭的产率显著降低,而pH和灰分则逐渐增加。热解温度为700 ℃时的皇竹草生物炭使Cr(Ⅵ)溶液的pH为8.72,呈碱性;产率为15.12%(仅为300 ℃的31.96%);灰分为30.86%,比300、500 ℃制备的生物炭灰分分别增加了32.05%、21.59%。随着热解温度增加,生物炭的产率明显下降,其可能原因为:炭化温度越高,越有利于皇竹草生物质转化为合成气或生物炭油,相应地转化为生物炭的量就越少。
|
由图 1的生物炭形态结构扫描(SEM)照片可见,在不同热解温度下制备的皇竹草生物炭的结构相似,均具有多孔和管状结构。热解温度为700 ℃ 与300 ℃时制备的生物炭相比,其管状结构的孔壁变薄,孔壁的表面变得不光滑,并有附着物,切面有突起结构,部分出现了微孔中孔,这可能将有利于其吸附重金属等污染物质。

|
|
图 1
不同热解温度下制备的皇竹草基生物炭的形态结构扫描照片
Figure 1
SEM images of biochars derived from Pennisetum hydridum under different pyrolytic temperature
|
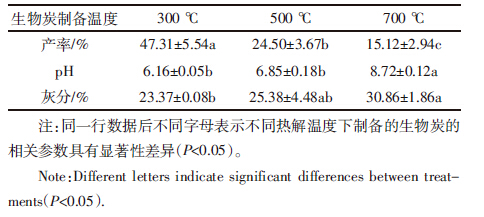
分别采用Langmuir模型和Freundlich模型拟合三种温度下制备的生物炭对Cr(Ⅵ)的等温吸附,相关参数见表 3。Langmuir吸附方程假定固体表面由大量的吸附活性中心组成,其吸附只在活性中心点发生,当表面吸附活性中心被占满,则说明吸附量达到饱和值,吸附物在吸附剂表面呈单分子层分布[15]。本实验中制备温度为500、700 ℃时的生物炭的最大吸附量(Qm)分别可达17.45、17.15 mg·g-1,明显高于300 ℃制备的生物炭(Qm=6.04 mg·g-1)。以Freundlich模型拟合结果来看,500、700 ℃制备的生物炭的Freundlich 常数n和吸附容量Kf均比300 ℃所制备的生物炭的大。这两种模型的拟合结果均说明500、700 ℃制备的生物炭对铬的吸附强度和吸附容量大于300 ℃所制备的生物炭。
|
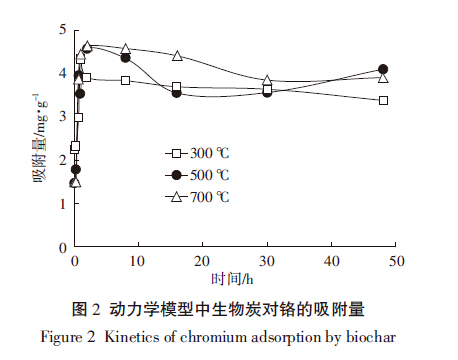
由图 2可见,三种不同温度制备的生物炭在1 h之内对Cr(Ⅵ)的吸附作用随着时间延长而快速增加,当吸附进行至1 h时基本达到饱和状态,随后无明显变化,但是不同温度条件下制备的生物炭达到饱和状态时的吸附量不同。在到达饱和状态之前,Cr(Ⅵ)下降最快的是加入了700 ℃制备的生物炭的溶液,说明该温度条件下所制备的生物炭的吸附效率最高。在前30 h,700 ℃制备的皇竹草生物炭对铬的吸附效果最好;在前10 h,500 ℃和700 ℃下制备的生物炭对铬的吸附量明显大于300 ℃下制备的,如当吸附时间为2 h时,三种温度下制备的生物炭吸附量分别为3.92、4.57、4.64 mg·g-1。
|
|
图 2
动力学模型中生物炭对铬的吸附量
Figure 2
Kinetics of chromium adsorption biochar
|
热解温度是影响生物炭炭化的一大主要因素。Li 等[16]的试验发现低温慢速炭化能够生产较多的咖啡渣生物炭,本实验中当热解温度为300 ℃时,皇竹草生物炭的产率为47.31%,为700 ℃时生物炭产率的312.90%,与其结果一致,说明了低温炭化可影响生物炭的产量,温度越低,其产率越高。相较于稻秆基,产炭量高可能是由于皇竹草本身含有较高的纤维素和木质素:在炭化过程中,且在缺氧条件下,随热解温度的升高,皇竹草有机组分逐步裂解,特别是温度达到240~350 ℃时纤维素发生分解,达到280~500 ℃时木质素的组分发生变化,材料中的氧元素被消耗,碳氮比升高,炭化程度也随之提高[17-19]。
Chen等[17]的研究表明,随着热解温度的变化,生物炭的表面结构也发生明显变化。随着裂解温度的升高,有机物质会逐渐被消耗,生物炭表面孔隙结构变得越来越明显,并产生孔径更小的孔结构[18-19]。本试验运用SEM 清晰地观察到了不同热解温度下所制备出的皇竹草生物炭的表面结构,其具有多孔和管状结构特征,皇竹草生物炭中的大孔一般为植物韧皮部组织热解后残留的细胞结构。
3.2 皇竹草生物炭对Cr(Ⅵ)的吸附作用本研究中皇竹草生物炭对Cr(Ⅵ)的吸附容量可达4.64 mg·g-1(pH 5.5),高于红脂乳香树(Pistacia terebinthus L.)油质种子对 Cr(Ⅵ)的吸附容量3.53 mg·g-1[20],但低于芦竹(Arundo donax L.)碎屑的吸附容量8.45 mg·g-1 [21]。已有研究表明,生物炭对重金属吸附作用的大小与生物炭的化学组成、表面结构及官能团等密切相关[5, 14]。在制备生物炭的炭化过程中,O/C会发生改变,K、Na等化学组分也会发生改变。如Azouaou 等[14]研究发现咖啡渣生物炭的主要成分为氧和碳,分别占58.59%和33.75%,另含少量的K、Na、Si等元素。咖啡渣生物炭对溶液中Pb2+的吸附与蛋白质含量呈正相关,咖啡渣中的蛋白质含量越高,则对Pb2+的吸附作用越强[22]。生物炭的炭化程度越高,则微孔数量和芳香碳含量增多,这分别有利于填充作用和π-π电子受体-供体作用的发生。张桂香等[23]的研究也证实了这一点,他们的实验发现碳质吸附剂对甲磺隆吸附作用的强度与H/C、O/C均呈负相关。此外,吸附剂表面的疏水性越强越有利于甲磺隆的吸附[23]。生物炭被添加进入溶液后,会影响溶液中金属离子的形态及其吸附剂表面官能团的电离状态[24],而且,酸性Cr(Ⅵ)溶液中主要以Cr2O72-等阴离子存在,添加生物炭后溶液由橙红色逐渐变为无色,溶液中发生氧化还原反应;生物炭吸附过程中溶液的电荷特性也会发生明显变化,其电荷特性取决于最初制备成生物炭的原料。赵凌宇等[25]研究了木屑和稻秆基生物质炭对 Hg的吸附作用,认为其吸附机制包括离子交换作用、还原作用和生物质炭羟基与羧基与汞的络合作用等,以Freundlich模型拟合发现主要是以单层吸附为主,吸附量可达34.965 mg·g-1。由此可见,生物炭对污染物吸附作用的强弱是由生物炭本身的特性所决定的。本试验中,热解温度为500 ℃和700 ℃时制备的生物炭对铬的吸附作用明显高于300 ℃时所制备的生物炭,其原因可能在于:热解温度越高,生物炭的炭化程度就越高,微孔数量和芳香碳含量也相应增多,因此对铬的吸附效果就越强。本试验中SEM的结果也证明了这一点。
4 结论热解温度可明显改变皇竹草生物炭的理化性质,随热解温度的升高,产率减少,而灰分、pH则增加;不同热解温度会导致皇竹草生物炭表面结构发生变化,进而直接影响皇竹草生物炭对铬的吸附效果;本试验中的三种生物炭均可在吸附进行1 h时达到对铬吸附的饱和状态,热解温度为500 ℃和700 ℃时制备的生物炭对铬的吸附作用明显高于300 ℃时所制备的生物炭。
| [1] | Broadway A, Cave M R, Wragg J, et al. Determination of the bioaccessibility of chromium in glasgow soil and the implications for human health risk assessment[J]. Science of the Total Environment, 2010, 409 (2) :267–277 . |
| [2] | Namasivayam C, Sureshkumar M V. Modelling thiocyanate adsorption onto surfactant-modified coir pith, an agricultural solid waste[J]. Process Safety and Environmental Protection, 2007, 85 (6) :521–525 . |
| [3] | 伍清新, 刘杰, 游少鸿, 等. 李氏禾湿地系统净化Cr(Ⅵ)污染水体的机理研究[J]. 环境科学学报, 2014, 34 (9) : 2306–2312 . WU Qing-xin, LIU Jie, YOU Shao-hong, et al. Purification of Cr(Ⅵ)-polluted water by constructed wetland planted with Leersia hexandra Swartz[J]. Acta Scientiae Circumstantiae, 2014, 34 (9) :2306–2312 . |
| [4] | Legrand L, Ei Figuigui A, Mereier F, et al. Reduction of aqueous chromate by Fe(Ⅱ)/Fe(Ⅲ) carbonate green rust:Kinetic and mechanistic studies[J]. Environmental Science and Technology, 2004, 38 (17) :4587–4595 . |
| [5] | Belay A A. Impacts of chromium from tannery effluent and evaluation of alternative treatment options[J]. Journal of Environmental Protection, 2010, 1 (1) :53–58 . |
| [6] | Gibb H J, Lees P S J, Pinsky P F, et al. Lung cancer among workers in chromium chemical production[J]. American Journal of Industrial Medi-cine, 2000, 38 (2) :115–126 . |
| [7] | Garg U K, Kaur M P, Garg V K, et al. Removal of hexavalent chromium from aqueous solution by agricultural waste biomass[J]. Journal of Hazardous Materials, 2007, 140 (1/2) :60–68 . |
| [8] | Cui L Q, Li L Q, Zhang A F, et al. Biochar amendment greatly reduces rice Cd uptake in a contaminated paddy soil:A two-year fleld experiment[J]. Bio-Resources, 2011, 6 (3) :2605–2618 . |
| [9] | Hossain M K, Strezov V, Chan K Y, et al. Chemosphere, 2010, 78(9):1167-1171[J]. Chemosphere, 2010, 78 (9) :1167–1171 . |
| [10] | Beesley L, Moreno-Jiménez E, Gomez-Eyles J L, et al. A review of bio-chars' potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution, 2011, 159 (12) :3269–3282 . |
| [11] | Srinivasan P, Sarmah A K, Smernik R, et al. A feasibility study of agricultural and sewage biomass as biochar, bioenergy and biocomposite feedstock:Production, characterization and potential applications[J]. Science of the Total Environment, 2015, 512-513C :495–505 . |
| [12] | Spokas K A, Novak J M, Masiello C A, et al. Physical disintegration of biochar:An overlooked process[J]. Environmental Science and Technology Letters, 2014, 1 (8) :326–332 . |
| [13] | 马崇坚, 刘发光. 皇竹草在生态环境治理中的应用研究进展[J]. 中国水土保持, 2012, 358 (1) : 41–44 . MA Chong-jian, LIU Fa-guang. Research of Pennisetum hydridum in the application of ecological environment[J]. Journal of Hazardous Materials, 2012, 358 (1) :41–44 . |
| [14] | Azouaou N, Sadaoui Z, Djaafri A, et al. Adsorption of cadmium from aqueous solution onto untreated coffee grounds:Equilibrium, kinetics and thermodynamics[J]. Journal of Hazardous Materials, 2010, 184 (1-3) :126–131 . |
| [15] | 张希衡. [J]. 水污染控制工程, 2003 : 199–209 . ZHANG Xi-heng. Water pollution control engineering[J]. Beijing:Metallurgical Industry Press. 2003:199-209., 2003 :199–209 . |
| [16] | Li X F, Strezov V, Kan T, et al. Energy recovery potential analysis of spent coffee grounds pyrolysis products[J]. Journal of Analytical and Applied Pyrolysis, 2014, 110 :79–87 . |
| [17] | Chen T, Zhang Y X, Wang H T, et al. Influence of pyrolysis temperature on characteristics and heavy metal adsorptive performance of biochar derived from municipal sewage sludge[J]. Bio-resource Technology, 2014, 164 (4) :47–54 . |
| [18] | Lehmann J, Joseph S. Biochar for environmental management:Science and technology[M]. London: 2009 : 1 -81. |
| [19] | 朱庆祥. 生物炭对Pb、Cd污染土壤的修复试验研究[D]. 重庆:重庆大学, 2011:18-52. ZHU Qing-xiang. Experimental study on lead and cadmium contaminated soil remediation with biochar[D]. Chongqing:Chongqing University, 2011:18-52. |
| [20] | Deveci H, Kar Y. Adsorption of hexavalent chromium from aqueous solutions by biochars obtained during biomass pyrolysis[J]. Journal of Industrial and Engineering, 2013, 19 (2) :190–196 . |
| [21] | Sun Y, Yue Q, Mao Y, et al. Enhanced adsorption of chromium onto activated carbon by microwave-assisted H3PO4 mixed with Fe/Al/Mn activation[J]. Journal of Hazardous Materials, 2014, 265 (2) :191–200 . |
| [22] | Tokimoto T, Kawasaki N, Nakamura T, et al. Removal of lead ions in drinking water by coffee grounds as vegetable biomass[J]. Journal of Colloid and Interface Science, 2005, 281 (1) :56–61 . |
| [23] | 张桂香, 何秋生, 闫雨龙, 等. 沉积物、生物炭和活性炭吸附甲磺隆的特征及机理[J]. 农业环境科学学报, 2014, 33 (12) : 2374–2380 . ZHANG Gui-xiang, HE Qiu-sheng, YAN Yu-long, et al. Characteristics and mechanisms for metsulfuron-methyl sorption by sediments, biochars and activated carbon[J]. Journal of Agro-Environment Science, 2014, 33 (12) :2374–2380 . |
| [24] | Sari A, Tuzen M. Removal of mercury from aqueous solution using moss(Drepanocladus revolvens) biomass:Equilibrium, thermodynamic and kinetic studies[J]. Journal of Hazardous Materials, 2009, 171 (1-3) :500–507 . |
| [25] | 赵凌宇, 王延华, 杨浩, 等. 木屑和稻秆基生物质炭对汞的吸附特性比较[J]. 农业环境科学学报, 2015, 34 (3) : 556–562 . ZHAO Ling-yu, WANG Yan-hua, YANG Hao, et al. Adsorption of Hg(Ⅱ) by biochars produced from sawdust and rice straw[J]. Journal of Agro-Environment Science, 2015, 34 (3) :556–562 . |
 2016, Vol. 35
2016, Vol. 35