2. 湖北省农田监测工程技术中心, 三峡大学, 湖北 宜昌 443002;
3. 三峡库区生态环境教育部工程研究中心, 三峡大学, 湖北 宜昌 443002
2. Hubei Engineering Technology Research Center for Farmland Environment Monitoring, China Three Gorges University, Yichang 443002, China;
3. Engineering Research Center of Eco-environment in Three Gorges Reservoir Region, Ministry of Education, China Three Gorges University, Yichang 443002, China
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类常见的有机污染物,它们广泛存在于空气、水、土壤和沉积物中,而且在环境中长时间停留[1],具有致癌性、致畸性和诱变性的特点。多环芳烃容易在土壤、沉积物和污水污泥中积累[2],一旦进入环境中,将会威胁到植物、动物及人类的健康[3]。
萘(Naphthalene,Nap)是多环芳烃中分子量最低的一种持久性有毒有机污染物,由两个苯环组成,被美国环境保护署列入16种优先控制污染物清单[4]。在未被污染的土壤中测得萘的含量较低,仅有1~20 μg·kg-1,但部分受到污染的地点附近含量最高可达到6410 mg·kg-1 [4],对环境和生物造成严重危害。萘容易被植物根部吸收,对植物的发芽和生长有着抑制作用[5]。因此,修复土壤中萘污染日益成为环境保护的热点问题之一。
为了治理多环芳烃污染物,物理修复、化学修复、自然衰减、生物修复等方法相继被提出,并取得了一定成效[6]。在这些方法中,植物修复的优点在于环境友好、经济可行、能量消耗少,具有推广应用的基础[7]。利用植物修复大面积污染场地的实例显示,该方法不仅成本低廉,同时也可以改善污染地周围土壤环境[8-9]。目前,植物修复土壤污染的方式一般有以下几种:植物单作或套作、植物-微生物联合修复、添加土壤改良剂强化植物修复等[10-11]。其中植物单作或套作修复无法应用于较高浓度的污染土壤,因为多环芳烃能在植物根部形成膜而阻止养分、水分的吸收,使植物生长受到严重抑制[12];而植物-微生物联合修复的缺点在于微生物有时无法适应自然条件下的PAHs污染土壤,含水量、温度、pH值等难以人为控制的因素可能导致微生物无法正常生长、繁殖[13]。这些研究中植物无法适应重度污染的场地,修复效果也有限,因此,为拓宽植物修复的应用范围,通过添加增强植物对重度多环芳烃污染的耐受能力成为植物修复的一个研究方向。
硒是一种类金属元素,被世界卫生组织和国际营养组织确定为人类和动物必需的微量营养元素。硒虽不是植物的必需元素,但由于其具有抗氧化性,对植物的生长有着积极作用,尤其是在应激环境下。研究表明,适量的硒能通过增强植物体内抗氧化系统的活力,调节植物体内活性氧(Reactive oxygen species,ROS)的累积,从而提高植物在重金属、干旱、高温等胁迫下的适应能力和耐受性[14-16]。尽管许多研究报道了硒对增加产量、促进植物生长的积极作用,但是关于硒对多环芳烃胁迫下植物响应机制和降解效果的影响报道不多。
车前草,又名车轮菜,二年生或多年生草本植物,在我国分布范围广。由于其生长迅速,适应能力强,有潜力用于污染土壤的植物修复[17]。本文以车前草为试验对象,通过向低硒土壤中添加外源硒,提高土壤含硒量,研究外源硒添加后车前草对萘污染土壤的响应机制和修复效果的影响,探究多环芳烃胁迫下植物的耐受性机制,为多环芳烃污染地区的生物治理提供一定科学依据。
1 材料与方法 1.1 材料车前草采集于三峡大学植物园内,选择同一批种子萌发的车前草,采长势相近的健康植株用于试验。供试土壤取自于三峡大学植物园,自然风干后过筛,去除碎石杂质。测得土壤理化性质为:pH为7.38(土水比1:5),TP为445.1 mg·kg-1,TN为316 mg·kg-1,有机质为2.79 g·kg-1,Se为0.02 mg·kg-1,多环芳烃未被检测出(检出限为5 μg·kg-1)。亚硒酸钠和萘购买于美国Sigma公司,纯度 > 98%,多环芳烃标液、二氯甲烷(色谱纯)、正己烷(色谱纯)、乙腈(色谱纯)、层析硅胶(100~200目)、无水硫酸钠、丙酮、磷酸氢二钾和磷酸二氢钾购置于Aladdin试剂公司。
1.2 试验设计将萘溶于丙酮溶液,添加到风干的土壤中。先取部分土壤配制成高浓度母土,置于通风橱中12 h,待丙酮充分挥发,再将母土与试验用土搅拌均匀,萘的浓度设置参考了Smith等[18]和李玉龙等[19]的研究,配制萘浓度为0、50、200、800 mg·kg-14个梯度的试验用土。选取规格为底径23 cm,高15 cm的PVC不透水实验用盆,每盆装入3 kg土壤。
研究表明,硒从有益作用到有害作用的浓度范围很窄,适量浓度下硒对植物的生长发育、光合和呼吸作用、提高抗逆能力等方面有着促进作用,浓度超过一定范围时反而有毒害作用[20-21]。硒的浓度设置参考了Wang等[22]的研究,向土壤中添加外源硒,使缺硒土壤(低于0.1 mg·kg-1)的含硒量达到适量水平(0.2~0.4 mg·kg-1)。亚硒酸钠配制成水溶液添加到土壤中,每个浓度梯度设置无硒组和加硒组,无硒组中不添加外源硒,加硒组中硒的加入量为0.2 mg·kg-1。每个处理重复3次。
选择长势一致且健康的车前草幼苗栽入盆中,每盆3株,每种处理设置无植物对照组,萘和硒的添加浓度与植物组相同,移至植物园内培养60 d,植物园内高温为15~25 ℃,低温为6~10 ℃,空气相对湿度在60%左右,期间每隔2 d随机移动花盆位置,定期浇水,保持土壤水分含量维持在60%田间持水量。
1.3 试验方法 1.3.1 植物质量和长度测定栽种60 d后测量植物质量和长度,将车前草整株从土中取出,小心抖落根系上附着的土壤,然后依次用蒸馏水和去离子水充分清洗植物表面,洗去土壤残留,擦拭干净,分成地上部分与根部两个部分,分别测量地上部分及根部的长度和质量。
1.3.2 根系形态测量根系测量采用MICROTEK MRS—9600TFU2L扫描仪(上海中晶科技有限公司),使用LA-S植物根系分析系统(万深科技有限公司)分析根表面积、根体积、根尖数和平均直径。
1.3.3 生理指标测定取0.5 g新鲜植物组织在手动匀浆器中磨碎,其中加入2 mL预冷的磷酸盐缓冲溶液,然后匀浆在4 ℃ 3500 r·min-1条件下离心10 min,取上清液用于过氧化氢酶(Catalase,CAT)、还原型谷胱甘肽(Glutathione,GSH)和丙二醛(Malondialdehyde,MDA)含量的测定。分别使用CAT、GSH、MDA和总蛋白试剂盒测得,试剂盒购买于南京建成生物工程研究所。
CAT活性测定采用可见光法,以每毫克蛋白每秒分解的H2O2数量表示一个单位的过氧化氢酶活性,单位为(FW)mg-1 protein。GSH的测定利用二硫代二硝基苯甲酸与巯基化合物反应产生黄色化合物,测定420 nm下的吸光度,单位为(FW)mg · g-1protein。MDA含量采用硫代巴比妥酸(TBA)法测定,含量用(FW)nmol·mg-1 protein表示。
1.3.4 土壤中萘的提取与测定取5 g土样于离心管中,加二氯甲烷超声萃取(功率为40 kHz),4000 r·min-1离心10 min,取上清液。上述步骤重复3次。上清液溶剂置换为正己烷,浓缩至1 mL,过硅胶层析柱分离净化,浓缩液用1:1的二氯甲烷和正己烷洗脱,用旋转蒸发仪将溶剂置换为乙腈,过0.22 μm滤膜后采用Waters e2696高效液相色谱仪(HPLC)进行测定,具体方法参照文献[23]。进样量为20 μL,流速为1.5 mL·min-1,柱温为30 ℃。参照《土壤和沉积物多环芳烃的测定高效液相色谱法》(HJ 784—2016),测得标准替代物回收率为81.9%~105.3%。萘在土壤中的去除率=(试验初始土壤萘含量-试验完成时土壤萘含量)/试验初始土壤萘含量× 100%
1.4 数据分析Microsoft Excel 2013用于数据前期整理,Graphed Prism 7用于图表制作,SPSS 19软件用于统计学分析,采用单因素方差分析显著性差异(P < 0.05),所有数据均为3次重复的平均值。
2 结果与分析 2.1 硒对不同浓度萘胁迫下植物生长状况的影响通过测定植物的质量和长度,研究萘和硒的添加对车前草生长的影响。如图 1所示,在无污染土壤中,车前草长势最好,加硒组与无硒组之间的质量、长度差异不明显(P > 0.05)。随着土壤中萘浓度的增加,植物地上部分和根部的生长受到抑制,当萘浓度达到800 mg·kg-1时,抑制作用最明显。地上部分的质量与长度趋势相近,与无污染条件相比,车前草质量和长度受抑制程度随着萘浓度的增大而变强,在800 mg· kg-1组中质量降幅达57.2%,长度抑制了65.4%。根部质量在50 mg·kg-1组中下降趋势不明显,为3.6%,在200 mg·kg-1与800 mg·kg-1组中分别降低16.0%和54.4%。根部长度在50 mg·kg-1与200 mg·kg-1组中降幅较为轻微,最大降幅出现在800 mg·kg-1组中,达到69.5%。硒的加入改善了萘对植物的胁迫,除对照组(0 mg·kg-1)外,加硒组地上部分质量与无硒组相比均有显著增长(P < 0.05),分别达17.5%、21.0%和54.7%,硒对根部质量的影响在800 mg·kg-1组有显著效果(P < 0.05)。根部长度显著增长出现在50、200 mg·kg-1与800 mg·kg-1组中(P < 0.05),硒的添加使得地上部分长度分别增长了32.9%、40.5%,根部长度增长了15.5%和38.3%。
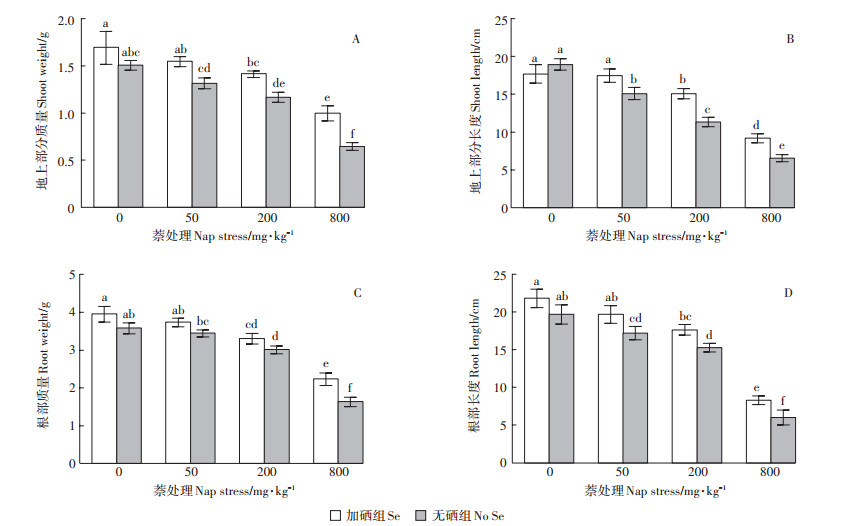
|
平均值±标准误差,n=3,不同小写字母表示不同处理组间存在显著性差异(P < 0.05)。下同 Each value is the mean ± SD of three replicates. Columns indexed by different letters indicate significant difference(P < 0.05). The same below 图 1 硒对萘胁迫下车前草地上部分和根部质量及长度的影响 Figure 1 Effects of Se on fresh weight and length of Plantago asiatica L. shoots and roots exposed to naphthalene |
萘胁迫下车前草的根系形态变化见图 2,与植株质量、长度变化趋势相似,根系形态各指标随萘浓度的增加均显示出下降的趋势。与0 mg·kg-1相比,50 mg·kg-1萘胁迫对根表面积的抑制作用不明显,仅有2.6%,200 mg·kg-1和800 mg·kg-1胁迫下根表面积减少了24.4%和45.5%。如图 2A所示,加硒处理使得所有萘浓度组中根表面积较无硒组显著增大(P < 0.05),200 mg·kg-1处理时增幅最大,达40.9%。从图 2B可看出,根体积在萘胁迫下加硒组和无硒组均呈下降趋势,与根表面积变化相似,加硒组根体积均比同浓度处理下无硒组中有了显著增大(P < 0.05),在800 mg· kg-1组中增幅最大,达63.9%。0 mg·kg-1组中加硒对根尖数和平均直径的影响不明显,在50、200 mg·kg-1和800 mg·kg-1组中呈显著性差异(P < 0.05),硒的加入使根尖数分别增多了27.2%、36.4%、59.0%,平均直径增大了24.9%、25.8%和30.8%。
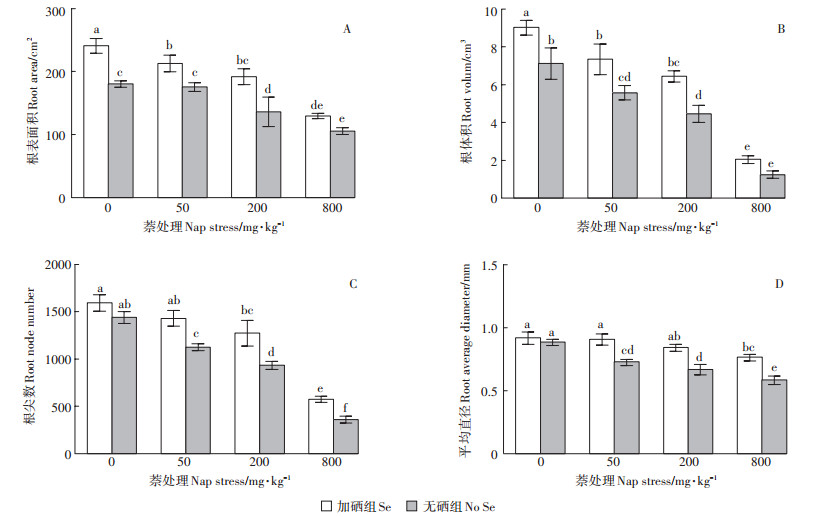
|
图 2 硒对萘胁迫下车前草的根表面积、根体积、根尖数、平均直径的影响 Figure 2 Effect of Se on root area, root volume, root node number and root mean diameter of Plantago asiatica L. grown in naphthalene contaminated soil |
MDA的含量可反映植物细胞质膜脂的过氧化水平。如图 3所示,随着萘浓度的升高,加硒组与无硒组中植物体内MDA含量均呈上升趋势,在800 mg·kg-1浓度达到最大,与无胁迫处理相比分别增大了47.9%和41.1%。硒的添加使得各浓度萘胁迫下车前草根系MDA含量较无硒组均显著降低(P < 0.05),减少了植物根部受到的损伤,在50 mg·kg-1和200 mg·kg-1时降幅较大,分别为15.8%和15.0%,此后降幅变缓。
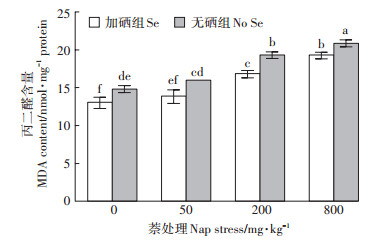
|
图 3 硒对萘胁迫下车前草根部丙二醛含量的影响 Figure 3 Effect of Se on malondialdehyde content in Plantago asiatica L. root exposed to different concentrations of naphthalene |
CAT是植物体内重要的抗氧化酶,可分解植物受胁迫时产生的过多自由基。由图 4可知,当萘的添加浓度上升时,车前草中CAT活性也在不断增强。当萘的添加量为50 mg·kg-1和200 mg·kg-1时,CAT活性提高趋势较缓,较0 mg·kg-1组提高了6.9%和10.0%,在800 mg·kg-1时提高幅度达到最大,为31.0%。与无硒组对比,在0 mg·kg-1和50 mg·kg-1组中硒的添加使CAT活性增加幅度不明显,在200 mg·kg-1和800 mg· kg-1浓度时则增幅达到显著差异水平(P < 0.05)。
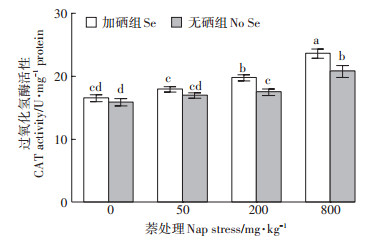
|
图 4 硒对萘胁迫下车前草根部过氧化氢酶活性的影响 Figure 4 Effect of Se on catalase activity in Plantago asiatica L. root exposed to different concentrations of naphthalene |
GSH是植物体内的抗氧化物质,含有活性巯基,对清除由活性氧产生的H2O2有着重要作用。由图 5可知,车前草根系GSH含量与CAT活性变化趋势相似,在萘胁迫下车前草根系GSH含量随着萘浓度增大而升高。50 mg·kg-1处理时GSH含量较0 mg·kg-1组增加幅度不明显,为12.5%,在200 mg·kg-1和800 mg·kg-1时增加29.2%和48.1%。0 mg·kg-1和50 mg· kg-1处理时,加硒组与无硒组相比GSH含量增加未达到显著差异(P > 0.05),此后增幅变大,在200 mg·kg-1处理时为24.2%,800 mg·kg-1组中达到33.4%,差异性均达到显著水平(P < 0.05)。
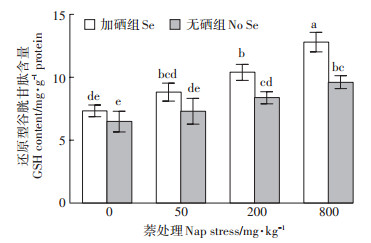
|
图 5 硒对萘胁迫下车前草根系谷胱甘肽含量的影响 Figure 5 Effect of Se on glutathione content in Plantago asiatica L. root exposed to different concentrations of naphthalene |
种植60 d后,土壤中残留萘的含量见图 6。由图可知,未种植组与种植组中的土壤萘含量与试验初始时相比均有所减少,但种植组中萘的残留量较无植物对照组中明显降低,种植车前草后,萘的去除率在53.6%~98.6%。其中50 mg·kg-1处理下萘的降解效果最好,加硒组和无硒组中降解率均超过98%。总的来说,土壤中萘的去除率在低含量时较高,随着萘质量分数的增大,加硒组和无硒组的去除率均呈下降趋势。此外,加硒后车前草对污染土壤中萘的去除效果优于无硒组,在50、200 mg·kg-1和800 mg·kg-1处理组中分别提高了0.5%、11.6%和6%。
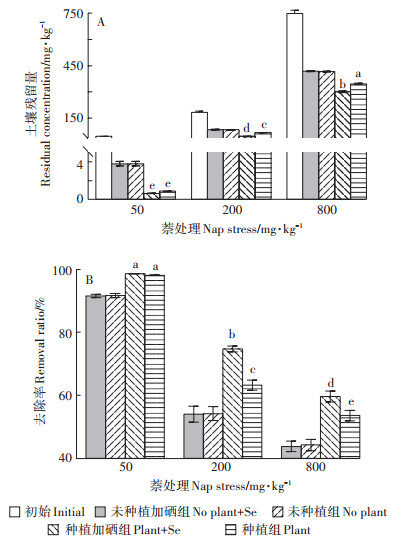
|
图 6 硒对不同浓度处理组萘残留量和去除率的影响 Figure 6 Effect of Se on the residual naphthalene in soil and removal ratio of Plantago asiatica L. at different concentrations of naphthalene |
植物的生物学性状能指示其生长环境。本研究发现植物的生物量和长度受到萘含量的抑制,且抑制程度随萘含量的升高而增大,这与宋宜枝等[24]关于苍耳的研究结果一致。硒不是植物生长所必需的元素,但作为对植物生长有益的元素,已有研究证明适量浓度硒的添加对植物生长具有刺激作用[25]。试验结果显示,向土壤中加入适量的硒在不同程度上增加了车前草地上部分和根部的质量和长度,外源硒的添加能够减轻萘对车前草生长的毒害作用。
根系作为提供水分和养分的重要器官,是最早感知逆环境胁迫的部位,根系形态的改变是植物维持养分吸收的重要应激反应,与植物生长密切相关[26]。因此,根系形态直观地反映了植物对逆环境的适应能力[27]。本试验中根表面积、体积、根尖数和平均直径随着萘添加浓度的升高依次降低,通过向土壤中添加亚硒酸盐,车前草各项根系形态学指标在50、200、800 mg·kg-1时均显著增加(P < 0.05)。可见萘抑制了车前草根系的生长发育,但外源硒的添加能够在一定程度上缓解萘的毒害效应,改善根系对养分和水分的吸收利用,对植株生长发育起到积极作用,使植物更好地适应环境。
MDA是植物膜脂过氧化物,常作为细胞膜受损害程度的衡量指标[28]。在本研究中,车前草受到萘胁迫后,其细胞膜透性增加,MDA含量随着萘浓度的增加而上升,硒的加入显著减少了植物体内MDA含量(P < 0.05),表明硒能缓解萘胁迫下植株体内MDA的累积,具有减轻氧化应激和保护脂质膜的作用[29]。当植物受到外界环境胁迫时会产生活性氧成分,导致细胞膜结构及功能的变化,对植株造成不利影响。为保护自身免受环境伤害,植物以ROS为信号刺激产生大量抗氧化物质。植物抵抗ROS的系统分为两类:一类是小分子物质,如还原型谷胱甘肽、胡萝卜素、抗坏血酸等;另一类是抗氧化酶,如过氧化氢酶、过氧化物酶、超氧化物歧化酶等[30]。土壤萘污染对车前草产生胁迫时会引起活性氧的大量积累,对植物细胞造成氧化损伤。为减轻或消除细胞损伤,植物体内的酶保护系统和非酶抗氧化剂启动保护机制,表现为车前草根系的GSH含量和CAT活性呈增加趋势。在外源硒的作用下,相同浓度萘胁迫下(200 mg·kg-1和800 mg· kg-1)加硒组中抗氧化物质含量和抗氧化酶活性较无硒组显著增大(P < 0.05),表明硒的加入有效提高了车前草根系内源保护系统的抵抗能力,这一趋势与张彩虹等[31]研究结果一致。Tedeschini等[32]研究也表明,硒对抗氧化能力具有积极作用,能提高活性氧的清除。
萘的残留量均随初始添加含量增大而呈上升趋势。由于挥发、淋溶、光解的作用,无植物组中萘的含量有所下降[33],外源硒的添加对无植物土壤中萘的残留量影响不显著。最大降解率出现在50 mg·kg-1组中,可能因为萘是多环芳烃中苯环最少、最易挥发和光解的一种,且该浓度下萘对车前草的胁迫作用较其他浓度组小,利于植物修复。硒的加入提高了植物对土壤多环芳烃污染的去除率,在200、800 mg·kg-1组中去除率分别上升了11.6%和6.0%。已有研究表明,植物根系越发达,为植物生长提供的营养和水分就越充足,为生命过程提供的能量就越多,越能够合成抗氧化酶及抗氧化分子,修复活性氧损伤[34]。根系不仅对植物生长起到至关重要的作用,其分泌物和脱落物能够影响微生物的数量结构和土壤酶活性,从而影响烃类物质的降解[35]。植物可以通过释放单糖、氨基酸和黄酮类化合物等根系分泌物来加速生物修复[36],但渗出液受环境因素的影响较大,且明显受氧化应激的抑制[37]。硒通过减轻根部受到的逆境抑制、增强根的耐受性、促进根系分泌物的释放来提高植物对污染物的去除[38]。本研究中,同一污染水平下,加硒处理中土壤萘残留浓度均低于无硒组,硒的添加明显促进了植物对土壤中萘的修复,这可能是由于硒增强了植物的内源保护机制,根系生长发育得到保护,根表面积显著增大(P < 0.05),污染物与根的接触面积得以增大,一方面增加植物对污染物的吸收,另一方面促进了根系分泌物的释放,提高根际土壤中微生物和酶的活性,从而强化了有机污染物的降解[39]。
4 结论(1)萘对车前草地上部分和根部质量、长度以及根系形态的胁迫随萘在土壤中的含量增大而增加,硒的加入一定程度上缓解了萘对植物各项生物学性状的抑制作用。
(2)各浓度萘处理下,加硒组和无硒组中植物细胞膜均受到脂质过氧化损伤,加硒组中车前草体内抗氧化酶(CAT)活性和抗氧化物质(GSH)含量高于无硒组,硒的作用在于增强植物的内源保护能力,减轻逆环境下活性氧对植物细胞的伤害。
(3)在不同萘污染浓度下添加硒均使土壤中萘的降解率显著提升,最高可达11.6%。硒通过提高植物的抗逆性来增强植物对土壤中多环芳烃的修复能力。
| [1] |
Behera B K, Das A, Sarkar D J, et al. Polycyclic aromatic hydrocarbons (PAHs) in inland aquatic ecosystems:Perils and remedies through biosensors and bioremediation[J]. Environmental Pollution, 2018, 241: 212-233. DOI:10.1016/j.envpol.2018.05.016 |
| [2] |
García-Sánchez M, Košnář Z, Mercl F, et al. A comparative study to evaluate natural attenuation, mycoaugmentation, phytoremediation, and microbial-assisted phytoremediation strategies for the bioremediation of an aged PAH-polluted soil[J]. Ecotoxicology & Environmental Safety, 2018, 147: 165. |
| [3] |
Tejeda-Agredano M C, Gallego S, Vila J, et al. Influence of the sunflower rhizosphere on the biodegradation of PAHs in soil[J]. Soil Biology & Biochemistry, 2013, 57(3): 830-840. |
| [4] |
Preuss R, Angerer J, Drexler H. Naphthalene:An environmental and occupational toxicant[J]. International Archives of Occupational and Environmental Health, 2003, 76(8): 556-576. DOI:10.1007/s00420-003-0458-1 |
| [5] |
陆志强, 陈昌徐, 马丽, 等. 镉和萘单一及复合胁迫对红树植物白骨壤幼苗生理影响的差异分析[J]. 植物资源与环境学报, 2015, 24(3): 60-67. LU Zhi-qiang, CHEN Chang-xu, MA Li, et al. Difference analysis on effects of single and combination stresses of Cd and Nap on physiology of mangrove Avicennia marina seedlings[J]. Journal of Plant Resources and Environment, 2015, 24(3): 60-67. DOI:10.3969/j.issn.1674-7895.2015.03.08 |
| [6] |
Gan S, Lau E V, Ng H K. Remediation of soils contaminated with polycyclic aromatic hydrocarbons(PAHs)[J]. Journal of Hazardous Materials, 2009, 172(2): 532-549. |
| [7] |
Kang J W. Removing environmental organic pollutants with bioremediation and phytoremediation[J]. Biotechnology Letters, 2014, 36(6): 1129-1139. DOI:10.1007/s10529-014-1466-9 |
| [8] |
Cunningham S D, Berti W R, Huang J W. Phytoremediation of contaminated soils[J]. Trends in Biotechnology, 1995, 13(9): 393-397. DOI:10.1016/S0167-7799(00)88987-8 |
| [9] |
王亚男, 程立娟, 周启星. 植物修复石油烃污染土壤的机制[J]. 生态学杂志, 2016, 35(4): 1080-1088. WANG Ya-nan, CHENG Li-juan, ZHOU Qi-xing. Phytoremediation mechanisms of petroleum-contaminated soils[J]. Chinese Journal of Ecology, 2016, 35(4): 1080-1088. |
| [10] |
王娇娇, 呼世斌, 魏丽琼, 等. 甜菜与牧草间作对多环芳烃污染土壤的修复作用[J]. 农业环境科学学报, 2016, 35(6): 1090-1096. WANG Jiao-jiao, HU Shi-bin, WEI Li-qiong, et al. Phytoremediation of polycyclic aromatic hydrocarbons(PAHs)-contaminated soil by intercropped beet-grasses[J]. Journal of Agro-Environment Science, 2016, 35(6): 1090-1096. |
| [11] |
刘鑫, 黄兴如, 张晓霞, 等. 高浓度多环芳烃污染土壤的微生物-植物联合修复技术研究[J]. 南京农业大学学报, 2017, 40(4): 632-640. LIU Xin, HUANG Xing-ru, ZHANG Xiao-xia, et al. Experimental study on plant-microbial remediation of high concentration PAHs-contaminated soil[J]. Journal of Nanjing Agricultral University, 2017, 40(4): 632-640. |
| [12] |
Pezeshki S R, Hester M W, Lin Q, et al. The effects of oil spill and clean-up on dominant US Gulf coast marsh macrophytes:A review[J]. Environmental Pollution, 2000, 108(2): 129-139. DOI:10.1016/S0269-7491(99)00244-4 |
| [13] |
李贺. 土壤中高分子量多环芳烃污染微生物修复的问题及对策[J]. 基因组学与应用生物学, 2013, 32(3): 384-392. LI He. Puzzle and countermeasure of microbial remediation to highmolecular weight PAHs contaminated soil[J]. Genomics and Applied Biology, 2013, 32(3): 384-392. |
| [14] |
Saidi I, Chtourou Y, Djebali W. Selenium alleviates cadmium toxicity by preventing oxidative stress in sunflower(Helianthus annuus) seedlings[J]. Journal of Plant Physiology, 2014, 171(5): 85-91. DOI:10.1016/j.jplph.2013.09.024 |
| [15] |
Nawaz F, Ashraf M Y, Ahmad R, et al. Supplemental selenium improves wheat grain yield and quality through alterations in biochemical processes under normal and water deficit conditions[J]. Food Chemistry, 2015, 175(175): 350-357. |
| [16] |
Djanaguiraman M, Prasad P V V, Seppanen M. Selenium protects sorghum leaves from oxidative damage under high temperature stress by enhancing antioxidant defense system[J]. Plant Physiology & Biochemistry, 2010, 48(12): 999-1007. |
| [17] |
刘丽杰, 王玥, 金忠民, 等. 车前草对重金属Cd2+的积累及生理响应[J]. 黑龙江畜牧兽医(上半月), 2016(8): 15-19. LIU Li-jie, WANG Yue, JIN Zhong-min, et al. Accumulation of heavy metal cadmium(Ⅱ) ions by herba plantaginis and its physiological responses[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(8): 15-19. |
| [18] |
Smith M J, Flowers T H, Duncan H J, et al. Study of PAH dissipation and phytoremediation in soils:Comparing freshly spiked with weathered soil from a former coking works[J]. Journal of Hazardous Materials, 2011, 192(3): 1219-1225. DOI:10.1016/j.jhazmat.2011.06.033 |
| [19] |
李玉龙, 刘永军. 萘、菲、芘在土壤中的降解及其对植物生长的影响[J]. 西北农林科技大学学报(自然科学版), 2016, 44(3): 96-102. LI Yu-long, LIU Yong-jun. Degradation of naphthalene, phenanthrene, and pyrene in soil and their effects on plant growth[J]. Journal of Northwest A & F University(Nat Sci Ed), 2016, 44(3): 96-102. |
| [20] |
Hartikainen H. Selenium as an anti-oxidant and pro-oxidant in ryegrass[J]. Plant and Soil, 2000, 225(1/2): 193-200. DOI:10.1023/A:1026512921026 |
| [21] |
Malik J A, Goel S, Kaur N, et al. Selenium antagonises the toxic effects of arsenic on mungbean(Phaseolus aureus Roxb.) plants by restricting its uptake and enhancing the antioxidative and detoxification mechanisms[J]. Environmental & Experimental Botany, 2012, 77(2): 242-248. |
| [22] |
Wang Z, Gao Y. Biogeochemical cycling of selenium in Chinese environments[J]. Applied Geochemistry, 2001, 16(11): 1345-1351. |
| [23] |
高彦征, 朱利中, 凌婉婷, 等. 土壤和植物样品的多环芳烃分析方法研究[J]. 农业环境科学学报, 2005, 24(5): 1003-1006. GAO Yan-zheng, ZHU Li-zhong, LING Wan-ting, et al. Analysis method for Polycyclic Aromatic Hydrocarbons(PAHs) in plant and soil samples[J]. Journal of Agro-Environment Science, 2005, 24(5): 1003-1006. DOI:10.3321/j.issn:1672-2043.2005.05.035 |
| [24] |
宋宜枝, 刘慧刚, 席颖, 等. 外源硒对菲胁迫下苍耳光合荧光特性的影响[J]. 武汉大学学报(理学版), 2018, 64(4): 363-370. SONG Yi-zhi, LIU Hui-gang, XI Ying, et al. Effect of exogenous selenium on photosynthetic fluorescence characteristics of Xanthium sibiricum patrin ex widder under phenanthrene stress[J]. Journal of Wuhan University (Natural Science Edition), 2018, 64(4): 363-370. |
| [25] |
Pilon-Smits E A, Quinn C F, Tapken W, et al. Physiological functions of beneficial elements[J]. Current Opinion in Plant Biology, 2009, 12(3): 267-274. DOI:10.1016/j.pbi.2009.04.009 |
| [26] |
Lynch J P. Roots of the second green revolution[J]. Australian Journal of Botany, 2007, 55(5): 493-512. DOI:10.1071/BT06118 |
| [27] |
李希铭, 宋桂龙. 镉胁迫对紫花苜蓿镉吸收特征及根系形态影响[J]. 草业学报, 2016, 25(2): 178-186. LI Xi-ming, SONG Gui-long. Cadmium uptake and root morphological changes in Medicago sativa under cadmium stress[J]. Acta Prataculturae Sinica, 2016, 25(2): 178-186. |
| [28] |
Guajardo E, Correa J A, Contreras-Porcia L. Role of abscisic acid (ABA) in activating antioxidant tolerance responses to desiccation stress in intertidal seaweed species[J]. Planta, 2016, 243(3): 767-781. DOI:10.1007/s00425-015-2438-6 |
| [29] |
Ding Y Z, Feng R W, Wang R G, et al. A dual effect of Se on Cd toxicity:Evidence from plant growth, root morphology and responses of the antioxidative systems of paddy rice[J]. Plant and Soil, 2014, 375(1/2): 289-301. |
| [30] |
高菲, 戴志华, 韩丹, 等. 硒影响植物抗氧化系统的作用与机制[J]. 生物技术进展, 2017, 7(5): 467-472. GAO Fei, DAI Zhi-hua, HAN Dan, et al. Effects and mechanisms of selenium on antioxidant system in plants[J]. Current Biotechnology, 2017, 7(5): 467-472. |
| [31] |
张彩虹, 于秀针, 姜鲁艳, 等. 硒对低温胁迫下番茄幼苗叶片抗氧化系统的影响[J]. 新疆农业科学, 2014, 51(6): 1083-1089. ZHANG Cai-hong, YU Xiu-zhen, JIANG Lu-yan, et al. The effects of Se on the antioxidant system of tomato seedling leaves under low temperature stress[J]. Xinjiang Agricultural Sciences, 2014, 51(6): 1083-1089. |
| [32] |
Tedeschini E, Proietti P, Timorato V, et al. Selenium as stressor and antioxidant affects pollen performance in Olea europaea[J]. Flora, 2015, 215: 16-22. DOI:10.1016/j.flora.2015.05.009 |
| [33] |
Peng S, Zhou Q, Zhang C, et al. Phytoremediation of petroleum contaminated soils by Mirabilis jalapa L. in a greenhouse plot experiment[J]. Journal of Hazardous Materials, 2009, 168(2): 1490-1496. |
| [34] |
Xue T, Hartikainen H, Piironen V. Antioxidative and growth-promoting effect of selenium on senescing lettuce[J]. Plant & Soil, 2001, 237(1): 55-61. |
| [35] |
廖丹, 黄华斌, 庄峙厦, 等. 多环芳烃(PAHs)污染对滨海湿地入侵植物互花米草的影响[J]. 应用与环境生物学报, 2018, 24(4): 894-900. LIAO Dan, HUANG Hua-bin, ZHUANG Zhi-xia, et al. Effects of polycyclic aromatic hydrocarbons(PAHs) contamination on invasive plant Spartina alterniflora in coastal wetlands[J]. Chin J Appl Environ Biol, 2018, 24(4): 894-900. |
| [36] |
Macek T, Macková M, Káš J. Exploitation of plants for the removal of organics in environmental remediation[J]. Biotechnology Advances, 2000, 18(1): 23-34. DOI:10.1016/S0734-9750(99)00034-8 |
| [37] |
Naveed M, Brown L K, Raffan A C, et al. Plant exudates may stabilize or weaken soil depending on species, origin and time[J]. European Journal of Soil Science, 2017, 68(6): 806-816. DOI:10.1111/ejss.12487 |
| [38] |
Chen T F, Zheng W J, Wong Y S, et al. Selenium-induced changes in activities of antioxidant enzymes and content of photosynthetic pigments in Spirulina platensis[J]. Journal of Integrative Plant Biology, 2008, 50(1): 40-48. DOI:10.1111/j.1744-7909.2007.00600.x |
| [39] |
王效国, 呼世斌, 程治文, 等. 大豆、龙葵单作和间作对芘污染土壤的修复[J]. 环境工程学报, 2015, 9(12): 6128-6134. WANG Xiao-guo, HU Shi-bin, CHENG Zhi-wen, et al. Phytoremediation of pyrene contaminated soil by monoculture and intercropping of Glycine max and Solanum nigrum[J]. Chinese Journal of Environmental Engineering, 2015, 9(12): 6128-6134. DOI:10.12030/j.cjee.20151277 |
 2019, Vol. 38
2019, Vol. 38


