2. 华南农业大学农业农村部华南热带农业环境重点实验室, 广州 510642;
3. 广州草木蕃环境科技有限公司, 广州 510640
2. Key Laboratory of Agro-Environment in the Tropics, Ministry of Agriculture and Rural Affairs, South China Agricultural University, Guangzhou 510642, China;
3. Guangzhou Ecological Research Co., Ltd, Guangzhou 510640, China
镉(Cadmium,Cd)是生物非必需元素,其毒害效应已受到人们的广泛关注[1-2]。Cd进入土壤环境中容易被植物吸收,可通过食物链进入人体,不仅造成贫血、高血压、骨痛病等疾病,而且还具有潜在的致癌作用,严重威胁食品安全、人体健康及农业的可持续发展[3-4],是被公认的对人类最具威胁的主要有毒金属之一。由于Cd的移动性强、毒性高、污染面积大而被称为“五毒之首” [5]。长期以来,植物对重金属污染的抗性(耐性)问题一直是污染生态学等研究领域的热点问题。
水稻(Oryza sativa L.)是我国,尤其是南方地区主要的粮食作物,且品种繁多[6]。据研究,水稻品种不同对Cd的吸收积累存在很大差异[7]。Cd胁迫诱导植株体内产生活性氧(Reactive oxygen species,ROS),使细胞受到伤害,导致代谢紊乱,因此破坏植物正常的生理生化功能。为了抵御Cd的毒害作用,植物进化了一系列抗性机制,如抗氧化酶和抗氧化剂清除活性氧的毒害;抗坏血酸-谷胱甘肽循环(AsA-GSH)系统维持细胞氧化还原平衡:液泡的区室化和外排机制;植物体内螯合物与Cd结合解除Cd的毒害[8-10]。
非蛋白巯基(Non-protein thiols,NPT)化合物主要包括还原型谷胱甘肽(Reduced glutathione,GSH)、植物螯合肽(Phytochelatins,PCs)和半胱氨酸(Cysteine,Cys)等,是植物体内的一类多肽。植物体内的GSH、PCs、Cys以及金属硫蛋白(Metallothionein,MTs)等巯基物质可与细胞内游离的Cd离子配位结合转化成络合态存在于细胞质或运输到液泡中[11],从而减轻细胞质受到的Cd毒害。PCs在对Cd的解毒、防御Cd引起的氧化胁迫和代谢方面具有重要作用。早在1990年Verkleij等[12]的报道中就表明,根系所吸收的Cd至少有60%是以PC-Cd复合物形式存在[12]。在水稻(Oryza sativa)、谷子(Setaria italica L.)、拟南芥(Arabidopsis thaliana)、小麦(Triticum aestivum)、蓖麻(Ricinus communis)、大豆(Glycine max)等植物中证实了巯基物质在Cd的螯合、固定等方面起着重要作用[13-18]。PCs是在植物螯合肽合成酶的作用下以GSH为底物合成的多肽。GSH是低分子量的抗氧化剂,对植物新陈代谢的维持起到很重要的作用[19]。GSH具有清除自由基、抵抗过氧化损伤、保护酶和结构蛋白及膜系统的功能[11]。此外,与GSH代谢密切相关的解毒酶——谷胱甘肽硫转移酶(Glutathione S-transferase,GST)在Cd解毒过程中也发挥了重要作用[20]。GSH在GST的作用下可与细胞内的Cd离子络合形成复合物,将有毒物质转移到液泡内[21-22],以达到缓解Cd毒害的作用。范业赓等[23]发现,甘蔗叶片在Cd胁迫下GSH和NPT含量有上升的趋势,产生的GSH和NPT可以有效地清除活性氧及自由基,阻止膜脂过氧化。高可辉[24]的研究表明,水稻幼苗体内的GSH含量随处理时间的延长而逐渐增加,同样说明GSH对水稻解除Cd的毒害发挥重要作用。然而,水稻品种不同在Cd胁迫下的解毒过程不同,巯基物质含量对水稻Cd污染较敏感[25]。Cd胁迫对Cd高低积累型水稻非蛋白巯基含量的影响机制研究不足,不利于指导解决水稻种植过程中遭受Cd胁迫的问题。
本实验基于前期研究筛选出的高低Cd积累型水稻品种[26],通过营养液沙培的方式,研究高低Cd积累型水稻品种Cd含量与非蛋白巯基化合物之间的关系,以及在Cd胁迫下NPT(包括GSH和PCs)和GST活性的动态变化规律,为揭示不同积累型水稻Cd解毒的生理机制提供理论依据,也可为耐Cd胁迫且低Cd积累的水稻品种的选用和选育提供有效的生物学途径。
1 材料与方法 1.1 实验设计本实验选取的材料为前期实验筛选出的Cd高积累型水稻品种欣荣优2045和低积累型水稻品种优I2009[26]。采用营养液沙培方法,探讨Cd胁迫下不同耐性水稻中NPT、GSH、PC、GST、过氧化氢(H2O2)和硫代巴比妥酸反应产物(TBARS)的动态变化。培养基质为经干热灭菌的河沙(150 ℃灭菌2 h,灭菌后50 ℃烘干备用)。将灭菌后的河沙装入双层嵌套使用的塑料杯(透明塑料杯的体积为700 mL,规格为9 cm×6.5 cm×10.5 cm),其中里面的塑料杯底部穿孔以方便更换营养液,外层塑料杯四周和底部用黑色遮光袋包住,以免光照对根系生长造成影响。
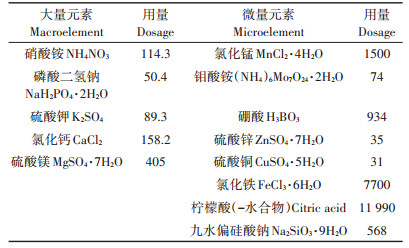
挑选饱满的水稻种子用10%的H2O2消毒10 min,用无菌水清洗干净,以除去H2O2,再用蒸馏水浸泡48 h,期间每日换水4次。待种子露白后在温度为25 ℃,相对湿度为75%的人工气候箱暗箱中催芽24 h,挑选发芽一致的水稻种子均匀播种于装好河沙的塑料杯中(1 kg·杯-1)。营养液参照国际水稻研究所(IRRI)推荐的水稻常规营养液配方配制(表 1)。将水稻放置于人工气候箱中进行培养,条件为:光照时间为14 h·d-1,光照强度为3000 lx,昼/夜温度为28 ℃/ 25 ℃,昼/夜相对湿度为80%/75%。每2 d更换一次营养液。待幼苗长至四叶一心时,进行CdCl2处理。根据文献研究设定Cd2+处理浓度为50 μmol·L-1。样品分别在处理前(0,对照)和第1、3、5、7 d收获。每个处理重复3次,每杯种植水稻2株。
|
|
表 1 水稻常规营养液配方 (mg·L-1) Table 1 Conventional nutrient solution formula for rice (mg·L-1) |
水培实验结束后,小心采集水稻幼苗样品,用自来水洗净根系河沙及地上部杂物后用去离子水彻底清洗,然后将幼苗从基部剪开,分为根部和地上部。样品一部分用于Cd含量的测定,另一部分存于-80 ℃超低温冰箱冷藏供各项生理生化指标测定。
1.2.2 植物样品中Cd含量的测定称取0.1 g鲜样,用硝酸和高氯酸的混酸(4:1)消解后,用石墨炉原子吸收(ZEEnit700P,德国耶拿)测定样品中Cd含量。
1.2.3 GSH和GST活性的测定GSH和GST活性采用南京建成试剂盒推荐方法测定。蛋白含量测定用考马斯亮蓝染色法[27],以结晶牛血清蛋白(BSA)为标准蛋白。组织中GST活性(U· mg-1 prot):规定每毫克组织蛋白在37 ℃反应1 min,扣除非酶促反应,使反应体系中GSH浓度降低1 μmol·L-1为一个酶活力单位。
1.2.4 NPT和PCs含量的测定称取1.00 g水稻鲜样,加4 mL 5%磺基水杨酸(SSA)冰浴研磨,12 000 g离心15 min(4 ℃),上清液定容至10 mL。分袋保存。
NPT物质含量测定采用Rama Devi等[28]的方法:反应体系为1 mL上清液与1.85 mL 0.2 mol · L-1的Tris-HCl(pH 8.2)和0.15 mL 10 mol·L-1的5,5-双二硫(2-硝基苯甲酸)(DTNB),反应20 min后用多功能酶标仪于412 nm处测定吸光值,以不加DTNB为空白。以GSH为-SH标样,做标准曲线。
PCs含量用差减法计算[29],即:PCs=NPT-GSH
1.2.5 H2O2和TBARS含量的测定称取1.00 g鲜样,加4.8 mL 5%三氯乙酸(TCA)冰浴研磨,12 000 g离心15 min(4 ℃),上清液定容至10 mL。分装保存。
H2O2的测定参照Jana等[30]的方法:取1 mL上清液,加0.3 mL 0.1%(m/V)硫酸钛[溶于20%(V/V)硫酸],410 nm下读数(25 ℃)。
TBARS含量参照Heath等[31]的测定方法:取2 mL上清液,加2 mL 0.5%(m/V)TCA于试管,摇匀后保鲜膜封口,95 ℃水浴30 min,冰浴终止。由532 nm和600 nm下吸收度的差值计算TBARS含量。
1.2.6 数据分析实验数据以平均数±标准误(Mean±Stand error)表示,采用Microsoft Excel 2010和SPSS 17.0进行数据计算和统计分析,并用Duncan′ s检验法进行显著性分析。
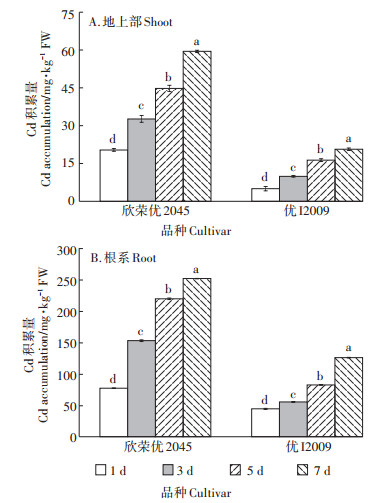
2 结果与分析 2.1 Cd胁迫下高低积累型水稻品种间Cd吸收积累量的差异随Cd胁迫时间的延长,两品种水稻对Cd的吸收积累均呈显著上升趋势(图 1)。在处理的第7 d时,欣荣优2045和优I2009地上部对Cd的吸收量均达到最大值,分别为59.80 mg·kg-1 FW和20.74 mg·kg-1 FW,与第1 d相比,增加了1.92倍和3.10倍;欣荣优2045和优I2009的根系对Cd的吸收量也在第7 d时达到最大值,分别为252.84 mg·kg-1 FW和126.54 mg· kg-1 FW,与第1 d相比,增加了2.26倍和1.84倍。而且各个处理时间段,无论是地上部还是根系,欣荣优2045对Cd的吸收积累均显著高于优I2009。
|
不同小写字母表示同一品种不同处理时间之间差异显著(P < 0.05)。下同 The different lowercase letters indicate significant differences among treatment time for the same cultivar(P < 0.05). The same below 图 1 水稻幼苗积累Cd的动态变化 Figure 1 Dynamic changes of Cd accumulation in rice seedling |
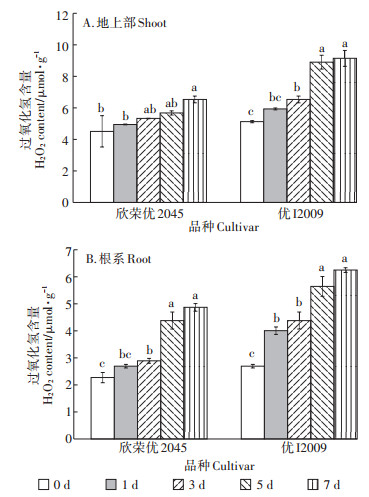
如图 2所示,两品种水稻的H2O2含量随处理时间的延长呈逐渐上升趋势,第7 d时,欣荣优2045和优I2009地上部的H2O2含量达最高值,分别为6.57 μmol·g-1和9.19 μmol·g-1,相较于对照,分别上升了45%和78%;欣荣优2045和优I2009根系H2O2的含量在第7 d时也均达到最高值,分别为4.89 μmol·g-1和6.28 μmol·g-1,相较于对照,分别上升了1.14倍和1.32倍。综上所述,优I2009体内H2O2含量上升的幅度大于欣荣优2045,说明随处理时间的延长,优I2009受Cd的毒害作用更大。
|
图 2 Cd胁迫对H2O2含量的影响 Figure 2 Effect of cadmium stress on H2O2 content |
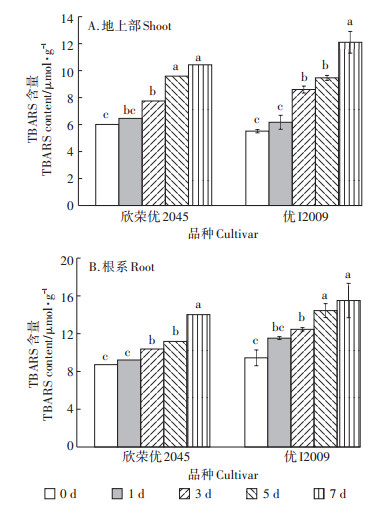
随时间延长,两品种水稻地上部和根系的TBARS含量的变化趋势与H2O2相似(图 3)。欣荣优2045地上部的TBARS含量在第1、3、5、7 d比对照分别增加了7%、29%、59%和74%,优I2009地上部的TBARS含量分别上升了12%、56%、72%和120%;欣荣优2045根系TBARS的含量在第1、3、5、7 d比对照分别上升了6%、19%、28%和61%,优I2009根系的TBARS含量分别上升了22%、32%、53%和64%。综上所述,优I2009体内TBARS含量上升的幅度大于欣荣优2045,同样说明优I2009水稻品种对Cd的耐受性相较于欣荣优2045更弱。
|
图 3 Cd胁迫对TBARS含量的影响 Figure 3 Effect of cadmium stress on TBARS content |
如图 4所示,随Cd处理时间的延长,两品种水稻地上部和根系NPT的含量呈先升后降的趋势。NPT含量在第5 d时达到最大值,与其对照相比,欣荣优2045和优I2009地上部的NPT含量分别增加了107%和48%,根系含量增加了1.38倍和5.13倍。在第7 d时,两品种水稻的NPT含量均显著下降。在各个Cd处理时间段,欣荣优2045的NPT含量(尤其是根系)均高于优I2009。
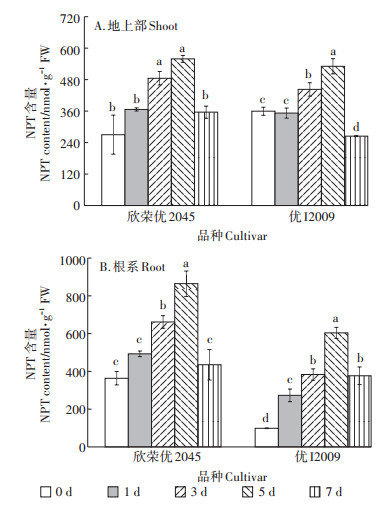
|
图 4 Cd胁迫对NPT含量的影响 Figure 4 Effect of cadmium stress on NPT content |
随Cd胁迫时间的延长,欣荣优2045和优I2009体内GSH含量的变化趋势差异很大(图 5)。欣荣优2045体内的GSH含量呈逐渐上升趋势,第7 d时达到最大值,地上部和根系分别为178.43 nmol · g-1和161.97 nmol·g-1,相较于对照分别增加了2.09倍和1.06倍;而优I2009体内的GSH含量则呈先升后降的变化趋势,第3 d时达到最大值,地上部和根系分别为118.35 nmol·g-1和149.23 nmol·g-1,相较于对照增加了86%和2.33倍,第7 d时,地上部和根系含量分别降为79.97 nmol·g-1和64.48 nmol·g-1,相较于第3 d分别下降了32%和57%。
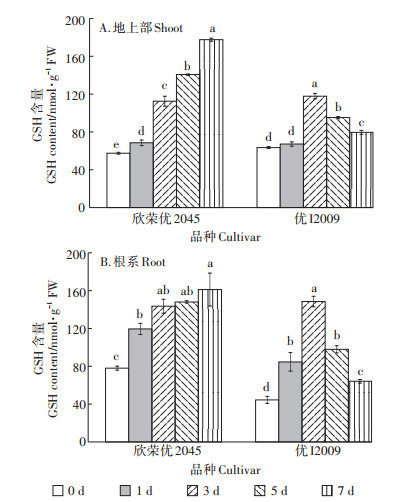
|
图 5 Cd胁迫对GSH含量的影响 Figure 5 Effect of cadmium stress on GSH content |
两种水稻地上部和根系PCs含量的变化与NPT含量的变化趋势一致(图 6)。欣荣优2045和优I2009地上部的NPT含量在第5 d时达到最大值,分别为420.35 nmol·g-1和437.76 nmol·g-1,与其对照相比增加了97%和47%;而欣荣优2045和优I2009根系的PC含量分别为720.05 nmol·g-1和508.38 nmol·g-1,与其对照相比增加了1.51倍和8.37倍。在第7 d时,两个水稻品种的PCs含量均显著下降。
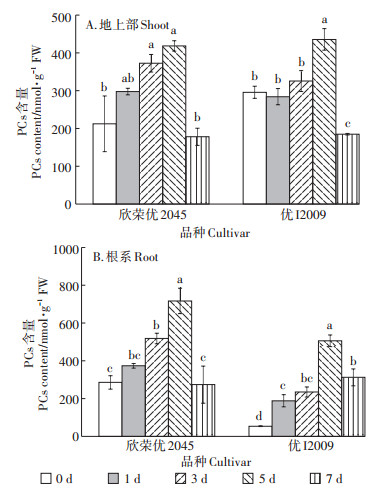
|
图 6 Cd胁迫对PCs含量的影响 Figure 6 Effect of cadmium stress on PCs content |
随Cd胁迫时间的延长,两品种水稻地上部GST活性都呈先升后降的趋势(图 7),第3 d时活性均达到最高,为145.90 U·mg-1(欣荣优2045)和146.67 U· mg-1(优I2009),比对照上升了70%(欣荣优2045)和129%(优I2009),第3 d后GST活性显著下降,到第7 d时,下降了31%(欣荣优2045)和51%(优I2009)。
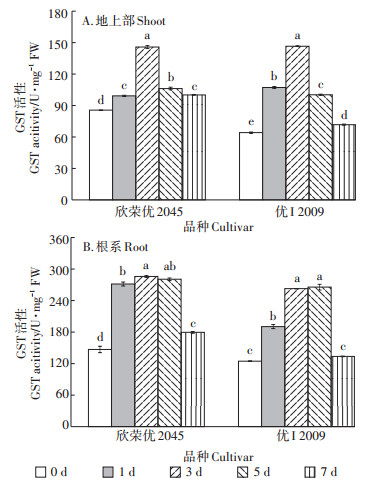
|
图 7 Cd胁迫对GST含量的影响 Figure 7 Effect of cadmium stress on GST content |
两品种水稻根系GST活性亦呈先升后降的趋势,其中GST活性最大的是第3 d和第5 d,欣荣优2045的GST活性分别为287.33 U·mg-1和282.20 U·mg-1,比对照增加了95%和91%;优I2009的GST活性分别为264.01 U·mg-1和266.94 U·mg-1,比对照增加了1.11倍和1.13倍。到第7 d时,两品种水稻的GST活性均显著下降,相较于第5 d,欣荣优2045和优I2009分别下降了36%和50%。
3 讨论同一条件下,不同品种水稻间和不同器官间Cd的吸收和积累存在差异。这种差异主要是由水稻内外部形态结构的差异、不同品种对Cd的生理生化反应机制以及水稻植株对Cd吸收转运机制的不同所致[32]。本研究中,随Cd胁迫时间的延长,两品种水稻对Cd的吸收积累量为欣荣优2045 > 优I 2009,且根部 > 地上部,这与我们前期的研究一致[26]。
在Cd胁迫下,植物体内产生的大量ROS导致植物体内代谢紊乱。植物细胞产生的H2O2是ROS的主要产物,其含量可反映机体内脂质过氧化程度和细胞损伤程度,而TBARS是植株体内脂类过氧化物的最终产物,其含量水平通常可用来反映植株遭受氧化胁迫的水平。随Cd胁迫时间的延长,两品种水稻的H2O2和TBARS含量逐渐上升,而Cd低积累品种优I2009体内的H2O2和TBARS含量上升的幅度大于欣荣优2045(图 2和图 3),说明优I2009受Cd的毒害作用比欣荣优2045更大。
为抵御Cd胁迫,植物体内产生的非蛋白巯基物质(GSH、PCs、Cys等)络合Cd是重要的解毒机制之一[11]。巯基物质与Cd形成的络合物减少了细胞质中自由Cd离子的浓度,或将其运输到液泡中区隔,形成区室化作用[21-22, 33]。GSH是植物体内重要的抗氧化剂和信号物质[11],是在生物体胞内代谢过程和遭受氧化胁迫时产生的H2O2的最有效清除剂之一[34]。本研究中,随Cd胁迫时间的延长,欣荣优2045的GSH含量逐渐上升,与H2O2活性呈正相关,而优I2009表现出先升后降的趋势,说明欣荣优2045在清除活性氧的功能方面表现出更强的解毒能力,而优I2009在Cd胁迫前期表现出对Cd胁迫的应激反应,但在Cd胁迫后期可能是因为过多ROS的生成超出了其清除范围,因此GSH含量逐渐下降。两品种水稻随Cd胁迫时间的延长,NPT和PCs含量呈先上升后下降的趋势,说明Cd胁迫后水稻幼苗可通过诱导前期(1~5 d)NPT和PCs的合成来减轻Cd对水稻幼苗的毒害作用,这属于水稻幼苗应对Cd胁迫的自救机制。并且欣荣优2045的NPT含量高于优I2009,说明Cd高积累型品种合成更多的NPT与Cd络合,解毒能力更强[25]。Cd胁迫后期,NPT和PCs的含量下降,可能的原因是随Cd胁迫时间的延长,Cd引起的过氧化损伤不断加剧,打破了植物体内ROS产生和清除的动态平衡,使其诱导NPT和PCs合成的能力下降,说明两种水稻NPT和PC的合成能力存在一个Cd胁迫时间的阈值。
GST是生物体内重要的解毒酶,与GSH代谢密切相关,可保护细胞免受Cd的毒害[20]。GST还具有过氧化物酶的功能,能平衡H2O2的产生和清除[35]。本研究中,两品种水稻随Cd胁迫时间的延长,GST活性呈先上升后下降的趋势,因为在Cd胁迫下,H2O2等活性氧不断生成,而在植物防御机制中起着重要作用的GST活性也随之升高,以减轻Cd的毒害作用,但随Cd胁迫时间的延长,GST活性下降,表明水稻抗氧化系统对Cd的耐受性有一定的时间限值,超过这一时间限值时,未被清除的活性氧会对细胞产生不可逆的损伤,GST的解毒作用被抑制,致使其酶活性下降。通过比较两品种水稻的GST活性(图 7)发现,同一时间段欣荣优2045高于优I2009,说明不同Cd积累型水稻的GST活性对Cd胁迫的应答机制存在一定的基因型差异,这可能与两品种GST同功酶的组成、表达和功能不同有关[20, 36-37]。
4 结论随Cd胁迫时间的延长,两品种水稻的H2O2和TBARS含量逐渐增加,同时也不同程度地刺激了两品种水稻NPT(包括GSH和PCs)的合成和GST的生成,且Cd低积累型品种优I2009遭受的氧化胁迫水平和膜脂过氧化程度大于Cd高积累型品种欣荣优2045。但是,当Cd胁迫超过一定的时间限值时,两品种水稻所合成的NPT和生成的GST活性均被抑制。此外,Cd高积累型水稻品种欣荣优2045可以通过合成更多的NPT与Cd络合来清除活性氧,相较于Cd低积累型水稻品种,优I2009表现出更强的解毒能力。
| [1] |
Kim R Y, Yoon J K, Kim T S, et al. Bioavailability of heavy metals in soils:Definitions and practical implementation:A critical review[J]. Environmental Geochemistry and Health, 2015, 37(6): 1041-1061. DOI:10.1007/s10653-015-9695-y |
| [2] |
Sebastian A, Prasad M N V. Cadmium minimization in rice:A review[J]. Agronomy for Sustainable Development, 2014, 34(1): 155-173. |
| [3] |
Sato A, Takeda H, Oyanagi W, et al. Reduction of cadmium uptake in spinach(Spinacia oleracea L.) by soil amendment with animal waste compost[J]. Journal of Hazardous Materials, 2010, 181(1/2/3): 298-304. |
| [4] |
Zhao F, Ma Y, Zhu Y, et al. Soil contamination in China:Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. |
| [5] |
李兆辉, 王光明, 徐云明, 等. 镉、汞、铅污染及其微生物修复研究进展[J]. 中国畜牧兽医, 2010, 37(9): 39-43. LI Zhao-hui, WANG Guang-ming, XU Yun-ming, et al. Progress on pollutions of cadmium, mercury, lead and microbial remediation[J]. Chinese Animal Husbandry and Veterinary Medicine, 2010, 37(9): 39-43. |
| [6] |
Chen G, Li X, He H, et al. Varietal differences in the growth of rice seedlings exposed to perchlorate and their antioxidative defense mechanisms[J]. Environmental Toxicology and Chemistry, 2015, 34(8): 1926-1933. DOI:10.1002/etc.3028 |
| [7] |
Guo J, Tan X, Fu H, et al. Selection for Cd pollution-safe cultivars of chinese kale(Brassica alboglabra L. H. Bailey) and biochemical mechanisms of the cultivar-dependent cd accumulation involving in Cd subcellular distribution[J]. Journal of Agricultural and Food Chemistry, 2018, 66(8): 1923-1934. DOI:10.1021/acs.jafc.7b05123 |
| [8] |
Lin Y F, Aarts M G. The molecular mechanism of zinc and cadmium stress response in plants[J]. Cellular and Molecular Life Sciences, 2012, 69(19): 3187-3206. DOI:10.1007/s00018-012-1089-z |
| [9] |
Seth C S, Remans T, Keunen E, et al. Phytoextraction of toxic metals:A central role for glutathione[J]. Plant, Cell & Environment, 2012, 35(2): 334-346. |
| [10] |
Sharma S S, Dietz K, Mimura T. Vacuolar compartmentalization as indispensable component of heavy metal detoxification in plants[J]. Plant, Cell & Environment, 2016, 39(5): 1112-1126. |
| [11] |
Jozefczak M, Remans T, Vangronsveld J, et al. Glutathione is a key player in metal-induced oxidative stress defenses[J]. International Journal of Molecular Sciences, 2012, 13(3): 3145-3175. DOI:10.3390/ijms13033145 |
| [12] |
Verkleij J, Schat H. Mechanisms of metal tolerance in higher plants [M]//Heavy metal tolerance in plants: Evolutionary aspects, Boca Raton, Florida: CRC Press, 1990: 179-193.
|
| [13] |
王朋, 邓小娟, 黄益安, 等. 镉胁迫下不同大豆品种各器官中镉和非蛋白巯基物质的动态变化[J]. 华南农业大学学报, 2016, 37(2): 42-50. WANG Peng, DENG Xiao-juan, HUANG Yi-an, et al. Dynamic changes of cadmium and non-protein thiol in different organs of different soybean genotypes under cadmium stress[J]. Journal of South China Agricultural University, 2016, 37(2): 42-50. |
| [14] |
Dos Reis R A, Keunen E, Mourato M P, et al. Accession-specific life strategies affect responses in leaves of Arabidopsis thaliana plants exposed to excess Cu and Cd[J]. Journal of Plant Physiology, 2018, 223: 37-46. DOI:10.1016/j.jplph.2018.01.008 |
| [15] |
王亚丽, 仪慧兰, 韩彦莎. SO2对谷子幼苗根系镉胁迫的缓解作用[J]. 农业环境科学学报, 2017, 36(3): 443-448. WANG Ya-li, YI Hui-lan, HAN Yan-sha. Sulfur dioxide alleviates cadmium toxicity in the roots of foxtail millet seedlings[J]. Journal of Agro-Environment Science, 2017, 36(3): 443-448. |
| [16] |
Qin S, Liu H, Nie Z, et al. AsA-GSH cycle and antioxidant enzymes play important roles in Cd tolerance of wheat[J]. Bulletin of Environmental Contamination and Toxicology, 2018, 101(5): 684-690. DOI:10.1007/s00128-018-2471-9 |
| [17] |
Ye W, Guo G, Wu F, et al. Absorption, translocation, and detoxification of Cd in two different castor bean(Ricinus communis L.) cultivars[J]. Environmental Science and Pollution Research, 2018, 25(29): 28899-28906. DOI:10.1007/s11356-018-2915-0 |
| [18] |
Li Q, Guo J, Zhang X, et al. Changes of non-protein thiols in root and organic acids in xylem sap involved in cadmium translocation of cadmium-safe rice line(Oryza Sative L.)[J]. Plant and Soil, 2019, 439(1/2): 475-486. |
| [19] |
Chaparzadeh N, D'Amico M L, Khavari-Nejad R A, et al. Antioxidative responses of calendula officinalis under salinity conditions[J]. Plant Physiology and Biochemistry, 2004, 42(9): 695-701. DOI:10.1016/j.plaphy.2004.07.001 |
| [20] |
Zhang C H, Ge Y. Response of glutathione and glutathione S-transferase in rice seedlings exposed to cadmium stress[J]. Rice Science, 2008, 15(1): 73-76. DOI:10.1016/S1672-6308(08)60023-2 |
| [21] |
Foyer C H, Theodoulou F L, Delrot S. The functions of inter-and intracellular glutathione transport systems in plants[J]. Trends in Plant Science, 2001, 6(10): 486-492. DOI:10.1016/S1360-1385(01)02086-6 |
| [22] |
Marrs K A. The functions and regulation of glutathione S-transferases in plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 1996, 47: 127-158. DOI:10.1146/annurev.arplant.47.1.127 |
| [23] |
范业赓, 廖洁, 王天顺, 等. 镉胁迫对甘蔗抗氧化酶系统及非蛋白巯基物质的影响[J]. 湖南农业科学, 2019(4): 23-27. FAN Ye-geng, LIAO Jie, WANG Tian-shun, et al. Effects ofcadmium stress on antioxidant enzyme system and non-protein thiols substances insugarcane[J]. Hunan Agricultural Sciences, 2019(4): 23-27. |
| [24] |
高可辉.镉胁迫及缺硫对水稻非蛋白巯基物质含量和谷胱甘肽硫转移酶活性的影响[D].南京: 南京农业大学, 2011. GAO Ke-hui. Effects of cadmium stress and sulfur deficiency on nonprotein sulfhydryl content and glutathione S-transferase activity in rice[D]. Nanjing: Nanjing Agricultural University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012270436.htm |
| [25] |
李江遐, 张军, 马友华, 等. 不同水稻品种对镉的吸收转运及其非蛋白巯基含量的变化[J]. 生态环境学报, 2017, 26(12): 2140-2145. LI Jiang-xia, ZHANG Jun, MA You-hua, et al. Uptake and translocation of cadmium and content of non-protein thiols in different rice cultivars[J]. Ecology and Environmental Sciences, 2017, 26(12): 2140-2145. |
| [26] |
Li D, Wang L, Wang Y, et al. Soil properties and cultivars determine heavy metal accumulation in rice grain and cultivars respond differently to Cd stress[J]. Environmental Science and Pollution Research, 2019, 26(14): 14638-14648. DOI:10.1007/s11356-019-04727-9 |
| [27] |
陈建勋, 王晓峰. 植物生理学实验指导[M]. 第二版. 广州: 华南理工大学出版社, 2006: 24-25. CHEN Jian-xun, WANG Xiao-feng. Experimental guidance of plant physiology[M]. 2nd Edition. Guangzhou: South China University of Technology Press, 2006: 24-25. |
| [28] |
Rama Devi S, Prasad M N V. Copper toxicity in Ceratophyllum demersum L.(Coontail), a free floating macrophyte:Response of antioxidant enzymes and antioxidants[J]. Plant Science, 1998, 138(2): 157-165. DOI:10.1016/S0168-9452(98)00161-7 |
| [29] |
Bhargava P, Srivastava A K, Urmil S, et al. Phytochelatin plays a role in UV-B tolerance in N2-fixing cyanobacterium Anabaena doliolum[J]. Journal of Plant Physiology, 2005, 162(11): 1220-1225. DOI:10.1016/j.jplph.2004.12.006 |
| [30] |
Jana S, Choudhuri M A. Glycolate metabolism of three submersed aquatic angiosperms during ageing[J]. Aquatic Botany, 1982, 12: 345-354. DOI:10.1016/0304-3770(82)90026-2 |
| [31] |
Heath R L, Packer L. Photoperoxidation in isolated chloroplast I. Kinetics and stoichiometry of fatty acid peroxidation[J]. Archives of Biochemistry and Biophysics, 1968, 125(1): 189-198. DOI:10.1016/0003-9861(68)90654-1 |
| [32] |
贺慧, 陈灿, 郑华斌, 等. 不同基因型水稻镉吸收差异及镉对水稻的影响研究进展[J]. 作物研究, 2014, 28(2): 211-215. HE Hui, CHEN Can, ZHENG Hua-bin, et al. Research progress of cadmium absorption of different genotypes of rice and the effect of cadmium on rice[J]. Crop Research, 2014, 28(2): 211-215. DOI:10.3969/j.issn.1001-5280.2014.02.25 |
| [33] |
Li T, Di Z, Islam E, et al. Rhizosphere characteristics of zinc hyperaccumulator Sedum alfredii involved in zinc accumulation[J]. Journal of Hazardous Materials, 2011, 185(2/3): 818-823. |
| [34] |
Jozefczak M, Keunen E, Schat H, et al. Differential response of Arabidopsis leaves and roots to cadmium:Glutathione-related chelating capacity vs antioxidant capacity[J]. Plant Physiology and Biochemistry, 2014, 83: 1-9. DOI:10.1016/j.plaphy.2014.07.001 |
| [35] |
杜琳, 张荃. 植物谷胱甘肽与抗氧化胁迫[J]. 山东科学, 2008, 21(2): 27-32. DU Lin, ZHANG Quan. Plant glutathione and antioxidant stress[J]. Shandong Science, 2008, 21(2): 27-32. |
| [36] |
Deng F, Hatzios K K. Characterization and safener induction of multiple glutathione S-transferases in three genetic lines of rice[J]. Pesticide Biochemistry and Physiology, 2002, 72(1): 24-39. |
| [37] |
Dixit V, Pandey V, Shyam R. Differential antioxidative responses to cadmium in roots and leaves of pea(Pisum sativum L. cv. Azad)[J]. Journal of Experimental Botany, 2001, 52(358): 1101-1109. DOI:10.1093/jexbot/52.358.1101 |
 2019, Vol. 38
2019, Vol. 38