氮肥一般是作物生长的限制性因素,在盐渍化土壤中合理施用氮肥可有效降低盐分对作物生长的危害。硝化作用是土壤氮循环的重要环节,在氮素形态转化和氮循环过程中起着至关重要的作用,直接影响环境质量和氮肥的利用效率[1]。氨氧化作用和亚硝酸氧化作用是硝化作用的两个关键步骤,其中氨氧化作用是硝化作用的限速步骤,主要是在氨氧化古菌(AOA)和氨氧化细菌(AOB)的参与下完成[2]。随着分子生物学的不断发展,人们对于AOA和AOB的研究不断深入。越来越多的学者关注不同环境条件对AOA、AOB丰度[3]和群落结构组成的影响[4],以及AOA和AOB对硝化作用的相对贡献等[5]。
氨氧化微生物的生长受土壤环境的影响。其中土壤盐分是影响氨氧化微生物生长和群落结构的重要因素。有研究发现AOB和AOA的丰度与盐度呈负相关[6],盐分会抑制AOB的生长,对AOA丰度影响不显著[7]。但是也有研究发现高盐分可以促进AOA和AOB的生长[8]。Caffrey等[9]研究也表明河口沉积物中AOA丰度随着盐分的增加而增加,但盐分对AOB没有影响。Mosier等[10]研究发现AOB丰度随着土壤盐度的增加而增加,在低盐度条件下AOA amoA的基因丰度高于AOB基因。此外,有研究发现在盐碱地中AOB amoA基因丰度比AOA amoA基因丰度高两个数量级[11]。以上研究结果表明盐分对氨氧化微生物丰度的影响目前尚无定论。此外,盐分在影响AOA和AOB丰度的同时也影响其群落结构的改变。前人研究表明,在不同盐分环境中AOA的群落结构会发生改变,AOB的群落结构多样性和盐分梯度无相关关系[12],而湿地土壤中盐分可显著改变AOA和AOB的群落结构[13]。有研究表明AOB的多样性会随着盐分的增加而提高[14],但是Dang等[15]研究发现盐分会降低AOB的多样性。盐分是一个日益受到关注的环境因素,然而盐分对土壤氨氧化微生物丰度和群落结构影响的认识仍然存在争议。
新疆地处我国的西北部,属于干旱地区,淡水资源短缺问题尤为严重。但是该地区咸水资源比较丰富,在淡水资源短缺不断加剧的背景下,合理利用咸水资源进行灌溉已经成为农业生产中缓解淡水资源不足的较为经济、有效的手段。咸水灌溉一方面提供了作物生长所需要的水分,缓解旱情;另一方面也将盐分带入土壤,改变土壤的理化性质,进而影响土壤养分转化和微生物生长。AOA和AOB共同参与土壤硝化作用,然而,关于长期咸水灌溉对AOB和AOA群落结构的影响及其对土壤硝化作用的贡献所知甚少。因此,了解土壤氨氧化微生物群落结构多样性对咸水灌溉引起的土壤盐分变化的响应具有重要意义。本研究在已连续开展10年咸水滴灌试验的基础上,通过荧光定量PCR方法测定AOA和AOB的丰度,采用高通量测序分析AOA和AOB群落结构多样性。我们假设经过长期咸水滴灌会改变AOA和AOB的群落结构,降低AOA和AOB丰度并抑制硝化作用。因此,本研究的目的是比较不同灌溉水盐度对氨氧化微生物丰度和群落结构的影响,评价AOA和AOB对于硝化作用的贡献,并探讨分析土壤理化性质与氨氧化微生物丰度和群落结构间的关系。
1 材料和方法 1.1 试验区概况试验区位于石河子大学农学院试验站(44°18′ N,86°02′E)内,平均海拔450.8 m。试验区属于典型温带干旱大陆性气候,多年平均气温为6.5~7.2 ℃,无霜期为168~171 d,年日照时数为2721~2818 h,年蒸发量1660 mm,年平均降水量为210 mm。试验区土壤类型为石灰性冲积土。0~30 cm土层基础理化性质(2009年试验开始前)如下:电导率(EC)为0.13 dS·m-1,pH值7.9,速效磷25.9 mg·kg-1,速效钾253 mg·kg-1,全氮1.1 g·kg-1,有机质16.8 g·kg-1。供试作物为棉花(Gossypium hirsutum L. cv Xinluzao No. 52),通常在4月中旬种植,9月中旬收获。
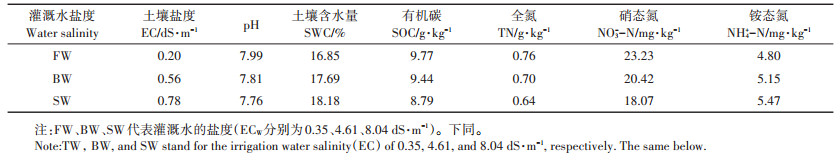
1.2 试验设计试验区在2009—2017年已经连续开展9年的不同盐度灌溉水滴灌田间试验。依据灌溉水盐度设置了3个处理,每个处理3次重复,共9个小区,每个试验小区面积25 m2,采用完全随机区组设计。3个处理的灌溉水盐度分别为0.35、4.61、8.04 dS·m-1(分别用FW、BW和SW表示),试验中FW取自当地深层地下水,BW和SW处理灌溉水盐分是通过在淡水中加入等量的NaCl和CaCl2(质量比1:1)配制而成。氮肥(尿素N≥46.4%)施用量为N360 kg·hm-2,此氮肥用量为当地棉花大田生产推荐用量。2018年试验开始前3种灌溉水盐度处理土壤基本理化性见表 1。
|
|
表 1 2018年试验开始前3种灌溉水盐度处理土壤理化性质 Table 1 Physicochemical properties of the soils under three water salinity treatments prior to the beginning of the experiment in 2018 |
棉花种植采用覆膜栽培,一膜两管4行,行距配置为(30+60+30)cm,播种密度22.2万株·hm-2。2018年棉花于4月20日播种,为保证出苗,播种后滴淡水45 mm。棉花生长期间灌水9次,6月中旬开始至8月下旬结束,灌溉周期为7~10 d,每次灌水45~60 mm,总灌溉量450 mm,磷肥(重过磷酸钙,P2O5≥44.0%)施用量为P2O5 105 kg·hm-2,钾肥(硫酸钾,K2O≥51.0%)施用量K2O 60 kg·hm-2,全部作基肥在播种前一次性施入。试验中氮肥全部作追肥,2018年氮肥分别在6月27日(第二水)、7月4日(第三水)、7月12日(第四水)、7月19日(第五水)和7月25日(第六水)通过滴灌系统分五次随水施用。其他栽培管理措施参照当地大田生产。
1.3 土壤样品采集与测定2018年(试验第10年)在棉花蕾铃期,最后一次施肥结束后第3 d(7月28日)用直径2.5 cm土钻在每个小区的棉花行内,按S型线路随机采集3个耕层土壤样品,采集深度为0~20 cm。每个小区3个重复,土样混合均匀并去除其中的杂物、细根。将一部分土样过2 mm筛后分成两部分,一部分用于测定土壤理化性质和土壤潜在硝化势,一部分用于氨氧化微生物丰度和多样性的检测。用于提取DNA的土壤样品保存于-80 ℃条件下。
1.3.1 土壤理化性质和潜在硝化势测定土壤含水量采用烘干法测定;土壤盐度和pH值采用MP521 Lab pH/ Conductivity Meter型电导率仪测定,测定盐度水土比为5:1[16],测定pH值水土比为2.5:1[17];土壤NO3--N和NH4+-N使用2 mol·L-1 KCl浸提后使用流动分析仪测定(Smart Chem140,Analytik Jena AG)[18];土壤有机碳(SOC)使用K2Cr2O7-H2SO4外加热法测定[16];土壤全氮(TN)使用半微量凯氏定氮法测定[16]。
土壤潜在硝化势测定采用Kurola等[19]测定方法,准确称取5 g新鲜土壤样品于50 mL离心管中振荡培养24 h后,使用2 mol·L-1 KCl浸提并通过比色法测定土壤浸提液中NO2--N的浓度,潜在硝化势(PNR)以μg(NO2--N)·g-1·h-1(干土)表征。
土壤潜在硝化势计算公式如下:
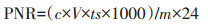
|
(1) |
式中:c为从标曲上查得的显色液NO2--N浓度,mg·mL-1;V为显色液的体积,mL;ts为分取倍数,m为烘干样品质量;24为24 h。
1.3.2 DNA提取称取新鲜土壤样品0.3 g,使用Power SoilTM DNA Isolation Kit(Mo Blo Laboratories,Inc,USA)试剂盒,按照操作说明书提取DNA样品,并将提取的土壤总DNA在-80 ℃下保存。
1.3.3 qPCR测定使用实时荧光定量PCR仪检测目标基因丰度,qPCR的反应体系为20 μL,其中包括10 μL 2 × SYBR®Green qPCR Master Mix(Applied Biosystems,Foster City,CA,USA),前后引物各1 μL,2 μL DNA模板(约2 ng·μL-1)和6 μL ddH2O。AOA amoA基因扩增引物是Arch-amoAF(5′ - STAATGGTCTGGCTTAGACG - 3′)和Arch - amoAR(5′ - GCGGCCATCCATC TGTATGT-3′)[20]。AOB amoA基因扩增引物是amoA-1F(5-GGGG TTTCTACTGGTGGT)和amoA-2R(5′ - CCCCTCKGSAAAGCCTTCTTC - 3′)[21]。PCR反应体系如下:95 ℃ 5 min,接着40个循环,95 ℃ 10 s,55 ℃ 20 s,72 ℃ 30 s。
1.3.4 高通量测序采用高通量测序技术测定AOA和AOB群落结构组成。PCR扩增引物与qPCR相同。PCR扩增体系为25 μL,其中包括2 μL DNA模板,前后引物各1 μL,5 μL 5×PCR buffer,2 μL(2.5 mmol·L-1)dNTP,5 μL 5× Q5High GC Enhancer buffer,0.25 μL(0.02U·µL-1)Q5 High - Fidelity DNA polymerase(NEB)和8.75 μL ddH2O。反应体系如下:98 ℃ 5 min,接着35个循环,98 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,最后72 ℃ 5 min。PCR产物使用Agencourt AMPure Beads(Beckman Coulter,Indianapolis,IN)纯化,并用PicoGreen dsDNA Assay kits(Invitrogen,Carlsbad,CA,USA)质量化,各样品等量混合后,在上海派森诺生物科技股份有限公司(上海,中国)使用Illumina MiSeq平台进行高通量测序,每个处理重复3次。
1.4 数据分析使用SPSS软件(Version SPSS 21.0)进行数据方差分析和相关性分析,显著水平为0.05;各处理间差异比较采用LSD法(P < 0.05);高通量测序结果使用UCHIME软件(Version 4.2),鉴定并去除嵌合体序列,得到最终有效数据。使用QIIME软件(Version 1.8.0)对序列在97%的相似度水平下进行聚类并获得OTUs数,基于OTUs数得到不同分类水平上的物种丰度,再利用R语言(Version 3.2.0)绘制成样品各分类学水平下的群落结构图。使用Mothur(Version 1.30.1)软件分析样品α多样性指数(ACE,Chao1,辛普森指数,香农指数),分析时将样品所含序列数进行标准化并在97%相似度水平下,对各样品α多样性指数值统计。基于Galaxy平台进行LEfSe分析[Line discriminant analysis(LDA)Effect Size],LDA值> 4。RDA分析(Redundancy analysis)使用R语言Vegan包进行分析和作图。
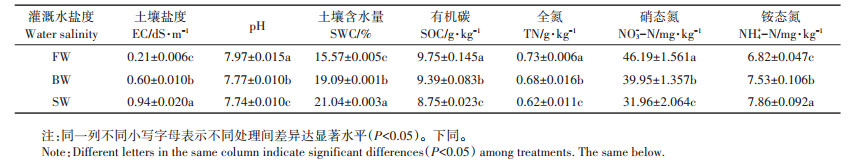
2 结果分析 2.1 咸水滴灌对土壤理化性质的影响灌溉水盐度显著影响土壤理化性质(表 2)。与FW处理相比,BW和SW处理土壤盐分、含水量和NH4+-N含量显著增加,而pH值、SOC、TN、NO3--N含量显著降低(P < 0.05,下同)。BW和SW处理NO3--N含量较FW处理降低13.5%和30.8%。相反,BW和SW处理NH4+-N含量较FW处理增加10.4%和15.2%。
|
|
表 2 不同灌溉水盐度处理土壤理化性质 Table 2 Soil physicochemical properties as affected by different irrigation water salinity treatments |
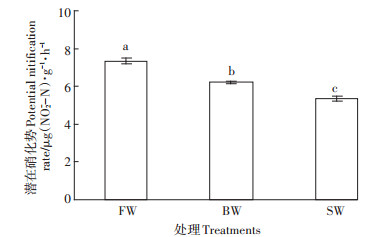
BW和SW处理显著降低土壤潜在硝化势(PNR)见图 1,FW处理PNR分别较BW和SW处理高18.1%和37.3%。
|
图 1 不同灌溉水盐度处理土壤潜在硝化势 Figure 1 Soil potential nitrification rate as affected by different irrigation water salinity treatments |
BW和SW处理显著降低土壤AOA和AOB丰度(表 3)。不同处理土壤AOA amoA基因丰度在2.18× 106~3.57×106 copies·g-1(干土),AOB amoA基因丰度在1.94×105~3.15×105 copies·g-1(干土)。与FW处理相比,BW和SW处理AOA和AOB丰度分别较FW处理降低28.4%、39.0%和23.3%、38.4%。BW处理AOA/AOB显著低于FW和SW处理,而SW和FW处理之间无显著差异。
|
|
表 3 不同灌溉水盐度处理AOA和AOB丰度 Table 3 Abundance of AOA and AOB as affected by different irrigation water salinity treatments |
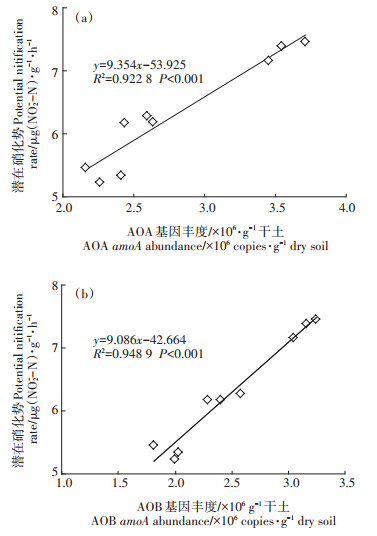
AOA和AOB对PNR的相对贡献如图 2所示。AOA丰度与PNR呈极显著正相关关系(R2=0.922 8,P < 0.001)。相似地,AOB丰度也与PNR呈极显著正相关关系(R2=0.948 9,P < 0.001)。说明PNR的变化与AOA和AOB丰度存在高度的相关性。
|
图 2 AOA(a)和AOB(a)丰度与土壤潜在硝化势的相关性 Figure 2 Correlations between AOA(a)and AOB (b)abundance and potential nitrification rate of soil |
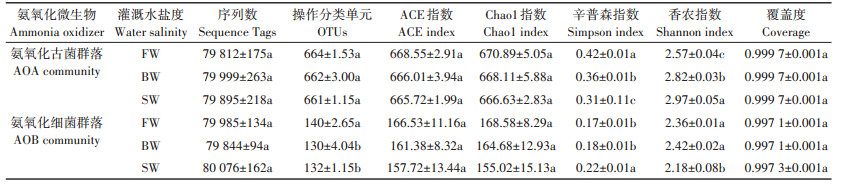
各处理AOA和AOB的amoA基因的测序数在79 812~80 076(表 4),覆盖度在0.997 1~0.999 7。在97%的相似度水平下,AOA和AOB序列分别可划分为661~664和130~140 OTUs。BW和SW处理显著降低AOB群落OTUs,但对AOA无影响。ACE和Chao1指数通常用来衡量群落中含OTU数目的指数,ACE和Chao1指数越大,表明群落的丰富度越高。辛普森和香农指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响,一般香农指数值越大,辛普森指数值越小,说明样品的物种多样性越高。灌溉水盐度对丰富度指数(ACE和Chao1)无显著影响。与FW处理相比,BW和SW处理显著增加AOA香农指数,且辛普森指数显著降低。SW处理显著降低AOB香农指数,且显著增加辛普森指数。BW处理对AOB多样性指数无显著影响。
|
|
表 4 不同灌溉水盐度处理AOA和AOB α多样性 Table 4 α diversity properties of AOA and AOB as affected by different irrigation water salinity treatments |
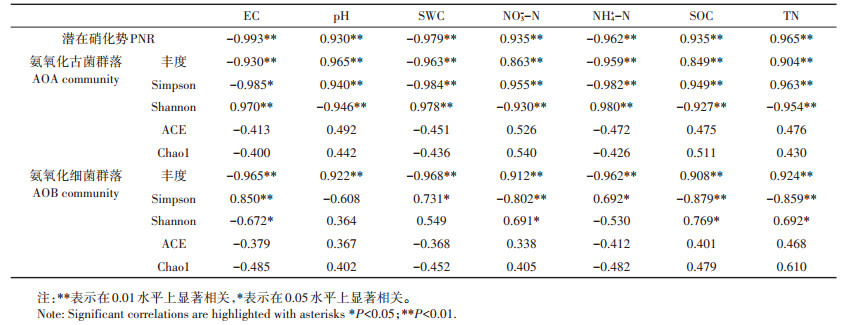
土壤理化性质与AOA、AOB的丰度,多样性指数,土壤潜在硝化势之间相关关系见表 5。土壤潜在硝化势,AOA、AOB丰度,AOA群落辛普森指数与pH、NO3--N、SOC、TN呈显著正相关,但是和EC、SWC、NH4+-N呈显著负相关。AOA的香农指数与EC、SWC、NH4+-N呈显著正相关,而与pH、NO3--N、SOC、TN呈显著负相关。AOB的辛普森指数与EC、SWC、NH4+-N呈显著正相关,而与NO3--N、SOC、TN呈显著负相关。AOB的香农指数与NO3--N、SOC、TN呈显著正相关,而仅与EC呈显著负相关。
|
|
表 5 土壤理化性质与潜在硝化势,AOA、AOB丰度,多样性指数间相关性分析 Table 5 Correlations among soil physicochemical properties, potential nitrification rates, AOA and AOB abundance and diversity under different water salinity treatments |
高通量测序结果显示,纲水平上,AOA群落由Candidatus Nitrosocaldus、Candidatus Nitrososphaera、Betaproteobacteria、Marine archaeal group 1、Unknown组成(图 3a)。除Unknown,Candidatus Nitrosocaldus(0.6%~1%)相对丰度较高。Candidatus Nitrosocaldus属于自养和需氧氨氧化古菌,常出现在中性或微碱性陆地地热环境中。不同灌溉水盐度对AOA群落影响不一致,例如,Betaproteobacteria和Marine archaeal group 1对灌溉水盐度较为敏感,BW和SW处理中Betaproteobacteria相对丰度显著低于FW处理,而Marine archaeal group 1显著高于FW处理;SW处理Candidatus Nitrosocaldus显著高于FW和BW处理。

|
(a)AOA纲水平群落结构组成,(b)AOB属水平群落结构 (a)Distribution of AOA community class group, (b)Distribution of AOB community genus group 图 3 不同灌溉水盐度处理氨氧化微生物群落结构 Figure 3 Community structure of AOA and AOB as affected by different irrigation water salinity treatments |
AOB属水平上群落主要由Nitrosospira、Nitrosomonas、Nitrosovibrio和Unknown组成(图 3b),Nitrosospira(52.9%~59.4%)相对丰度较高。Nitrosospira属于氨氧化细菌中的一类,参与氨氧化过程对亚硝酸盐的亲和力较高,可高效利用底物。Nitrosomonas随着灌溉水盐度的增加相对丰度显著降低,SW处理中没有检测到Nitrosomonas的存在。BW处理中Nitrosospira相对丰度显著低于FW和SW处理。
2.7 AOA和AOB群落LEf Se分析使用LEfSe(LDA > 4.0,P < 0.05)进行不同处理间群落比较分析,得到不同灌溉水盐度条件下氨氧化微生物群落显著差异种群(图 4)。AOA仅有1个差异物种(图 4a),出现在SW处理,说明AOA种群相对稳定,高盐度灌溉水刺激Candidatus Nitrosocaldus生长,AOB共有5个显著差异物种(图 4b),5个差异种群均来自BW处理,说明中等盐度灌溉水可刺激Bacteria,Proteobacteria、Nitrosomonadaceae、Betaproteobacteria、Nitrosomonadales的生长。

|
图 4 不同灌溉水盐度处理AOA(a)和AOB(b)群落LEfSe分析 Figure 4 LEfSe analysis of AOA(a)and AOB (b)communities under different irrigation water salinity treatments |
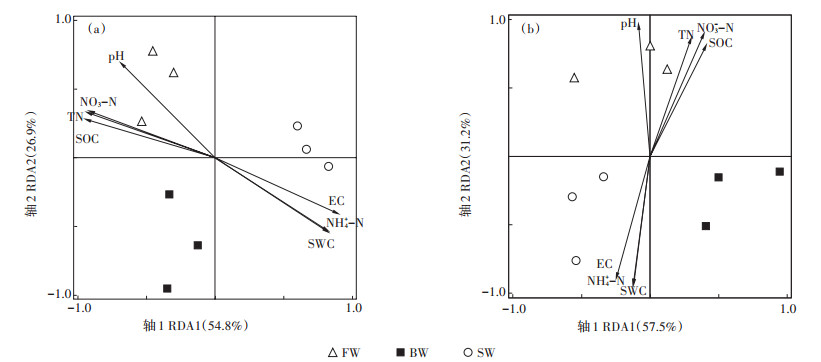
利用RDA分析AOA和AOB群落结构与土壤理化性质的关系,AOA群落结构与土壤理化性质间的关系见图 5a,轴1的解释度为54.8%,轴2的解释度为26.9%。AOA群落结构与NO3--N(解释度59.1%,P= 0.002)、pH值(解释度23.2%,P=0.032)、土壤盐分(解释度10.4%,P=0.042)存在显著相关关系。对于AOB,轴1解释度为57.5%,轴2解释度为31.2%(图 5b)。AOB群落结构仅与NO3--N(解释度33.3%,P= 0.04)、pH值(解释度47.7%,P=0.012)呈显著相关关系,与其他土壤理化性质无显著相关关系。
|
图 5 AOA(a)和AOB(b)群落结构与土壤理化性质间RDA分析 Figure 5 Redundancy analysis (RDA) of correlations between soil physicochemical properties and the community structure of AOA (a)and AOB (b) |
淡水资源短缺是限制农业可持续发展的重要因素,合理利用咸水灌溉已成为缓解干旱区淡水资源不足的重要手段。然而,长期咸水灌溉会导致盐分在土壤中的积累,影响土壤理化性质和养分的循环转化,特别是氮素转化的关键过程[22]。本研究结果表明微咸水、咸水灌溉使土壤盐分、含水量、NH4+-N含量显著增加,而pH值、有机质、NO3--N含量显著降低。土壤含水量增加是因为盐水灌溉土壤蒸散率降低[23]。pH值降低可能是因为土壤中氯离子的积累,导致土壤pH值下降[24]。有机质的降低是因为盐渍土壤中植物生物量减少导致有机物输入量下降[25]。另外,微咸水、咸水处理,土壤NH4+-N含量增加,而NO3--N含量呈现相反的趋势,可能是土壤盐度的增加抑制了土壤的硝化作用[26]。
3.2 咸水滴灌对土壤潜在硝化势和AOA、AOB丰度的影响土壤潜在硝化势可直接反映土壤硝化活性。本研究结果表明长期微咸水和咸水灌溉显著抑制土壤潜在硝化势。这与He等[27]研究相似,其研究结果显示土壤潜在硝化势随土壤盐度的增加而显著降低。然而,也有研究表明适度盐分可提高土壤潜在硝化速率,而高盐度抑制土壤潜在硝化速率[28],这可能是因为一些参与硝化作用的微生物具有一定的耐盐性,在一定盐度范围内可促进硝化作用微生物的生长,提高硝化速率[29]。
AOA和AOB是参与硝化作用的关键微生物,盐分是影响其生长的重要因素[30],本研究发现随着灌溉水盐度的增加,AOA和AOB丰度均显著降低。Jin等[31]研究也发现,较高的盐分会抑制AOB生长。然而也有研究发现盐分对AOA丰度无显著影响[32],或者中等盐度可以刺激AOA生长[33]。前人研究表明新疆碱性土壤中AOB丰度高于AOA,是主导微生物类型[34]。但本研究表明AOA丰度高于AOB,可能是微咸水和咸水灌溉后土壤盐分成为影响AOA、AOB生长和活性的主导因素。Bernhard等[35]也得到相似的研究结果。但也有研究发现河口区AOB丰度高于AOA[36],甚至盐分越高AOB丰度高于AOA的幅度越大[37]。这些矛盾的结果可能是AOA和AOB属于两类微生物群体,不同环境条件下,AOA和AOB对于盐分的响应是不同的。另外自然环境复杂多变,可能是多种因素综合作用下共同影响AOA和AOB活性[38]。
相关性分析表明,AOA和AOB丰度均与PNR、NO3--N浓度存在极显著正相关关系,说明AOA和AOB共同参与灌耕灰漠土中的硝化作用。本研究中微咸水灌溉条件下AOA/AOB显著低于淡水灌溉,而咸水灌溉条件下AOA/AOB显著高于微咸水灌溉。说明不同AOA和AOB的生长对于盐分的响应是不同的。我们推测AOB可能是微咸水灌溉条件下硝化作用的主导微生物种群,而AOA可能是咸水灌溉条件下主导微生物种群。
3.3 咸水滴灌对土壤AOA和AOB群落组成及多样性的影响咸水、微咸水灌溉改变了AOA和AOB的群落结构。本研究表明AOA群落多样性高于AOB,在含有盐分的河口区和海岸区环境中也出现相似的结果[27, 39]。不同灌溉水盐度对AOA和AOB群落多样性的影响是不一致的。对于AOA来说,随着灌溉水盐度的增加,群落辛普森指数显著降低,而香农指数显著增加。而对于AOB来说,咸水灌溉显著增加AOB群落辛普森指数,而降低香农指数。说明,在该环境条件下AOA群落结构对于盐分的变化更为敏感。Gao等[40]研究也表明盐分越高AOA多样性越高,而AOB群落多样性在中等盐度时最高,在高盐度时最低。也有研究发现在红树林沉积物中盐分与AOB群落香农指数呈正相关关系,与辛普森指数呈负相关关系,而AOA群落多样性对盐分变化不敏感[41]。说明不同土壤环境下盐分对AOA和AOB的群落结构影响存在差异。
虽然灌溉水盐度对AOA群落OTUs无显著影响,但是AOA群落对于不同灌溉水盐度的响应是不同的。通常AOA的耐受性较强,对环境的改变不敏感[42]。本研究结果表明在纲水平上,除Unknown外,Candidatus Nitrosocaldus是主要微生物种群,咸水灌溉显著增加Candidatus Nitrosocaldus相对丰度,说明其对盐分具有较强的耐受性。另外也有可能是Candidatus Nitrosocaldus一些物种可将尿素直接作为生长的能量来源[43],因此获得能量来源的途径较多,利于其完成整个硝化作用。本研究中随着灌溉水盐度的增加Marine archaeal group 1相对丰度显著增加,说明盐分激发了AOA耐盐种群的生长。原因可能是Marine archaeal group 1主要在海洋环境中出现,对于盐分具有较好的适应性[44]。在AOB属水平上,Nitrosospira是优势微生物种群,且咸水灌溉Nitrosospira相对丰度高于微咸水灌溉。另外,Nitrosomonas相对丰度随着灌溉水盐度的增加而显著降低,SW处理中没有检测到Nitrosomonas的存在。这与前人研究一致,即Nitrosospira在高盐环境富集,而Nitrosomonas在低盐或者中盐环境中富集[45]。
LEf Se分析结果表明AOA群落结构较为稳定,只有咸水灌溉时刺激了Candidatus Nitrosocaldus生长。而AOB群落对于盐分的响应较为敏感,微咸水灌溉出现5个显著高于其他处理的差异物种,这再一次印证了我们推测的微咸水灌溉条件下AOB较为活跃,是参与硝化作用的主导微生物种群,而咸水灌溉条件下AOA可能是主导微生物种群。
3.4 土壤性质对AOA和AOB群落结构的影响咸水灌溉抑制氨氧化微生物的生长,改变其群落结构,然而土壤的环境条件复杂,AOA和AOB对潜在硝化作用的贡献高度依赖于土壤初始环境[46],经过10年咸水灌溉,土壤理化性质发生显著改变,环境因素的改变也影响着氨氧化微生物群落的变化。RDA结果表明,除盐分以外,NO3--N解释AOA群落结构总变异量的59.1%(P=0.002),解释AOB群落总变异的33.3%(P=0.04),说明咸水、微咸水灌溉条件下,NO3--N是影响AOA和AOB群落结构的主要因素之一。但是也有研究表明,土壤NO3--N仅与AOB群落变化存在显著相关关系[47]。这可能是由于土壤养分条件不同,长期咸水灌溉土壤氮素水平显著低于淡水灌溉,AOA一般在较苛刻的环境(低氮、强酸性和高温)中生长更为活跃,表达功能活性更强[48]。此外,土壤pH是影响AOA和AOB群落变化的主要因素,pH对AOB群落(解释度47.7%,P=0.012)的影响要大于AOA(解释度23.2%,P=0.032)。这可能是因为AOA细胞具渗透膜,可维持细胞内pH接近中性[49],而本研究中pH变化范围较小,AOB群落对于pH变化响应比AOA更敏感。然而,有学者研究表明一般碱性土壤中硝化作用主导微生物类型是AOB,而与AOA关系不大[50]。不一致的结果说明盐分是影响农田土壤氨氧化微生物生态位变化的主导因素。然而本试验还不能具体分析出AOA和AOB分别对硝化作用的贡献率,这仍然需要后续进行深入研究。
4 结论长期微咸水、咸水灌溉显著增加土壤盐分、含水量、NH4+-N含量,降低pH值、NO3--N含量、有机碳和全氮含量。咸水、微咸水灌溉显著降低土壤PNR和AOA、AOB的amoA基因拷贝数。微咸水、咸水灌溉改变了AOA和AOB的群落结构组成,AOA群落的纲水平上,以Candidatus Nitrosocaldus、Candidatus Nitrososphaera、Betaproteobacteria和Marine archaeal group 1为主导,且咸水灌溉显著增加Candidatus Nitrosocaldus的相对丰度。在AOB群落的属水平上,以Nitrosospira、Nitrosomonas和Nitrosovibrio为主导。盐分是影响硝化作用、氨氧化微生物生长及群落结构改变的主导因素。除盐分外,土壤pH、NO3--N含量也是影响AOA和AOB群落结构改变的主要环境因素。AOA和AOB丰度与土壤PNR、NO3--N均呈显著正相关关系,共同参与硝化过程,但二者对于盐分的响应不同,淡水和微咸水灌溉条件下AOB可能是主导微生物种群,而咸水灌溉条件下AOA是主导微生物种群。
| [1] |
王敬, 程谊, 蔡祖聪, 等. 长期施肥对农田土壤氮素关键转化过程的影响[J]. 土壤学报, 2016, 53(2): 292-304. WANG Jing, CHENG Yi, CAI Zu-cong, et al. Effects of long-term fertilization on key processes of soil nitrogen cycling in agricultural soil: A review[J]. Acta Pedologica Sinica, 2016, 53(2): 292-304. |
| [2] |
谢月, 梁红, 宋立全, 等. 东北沼泽湿地土壤中氨氧化微生物活性和丰度研究[J]. 农业环境科学学报, 2018, 37(3): 546-551. XIE Yue, LIANG Hong, SONG Li-quan, et al. Activity and abundance of ammonia-oxidizing bacteria and ammonia - oxidizing archaea of marsh wetland soil in Northeast of China[J]. Journal of Agro-Environment Science, 2018, 37(3): 546-551. |
| [3] |
Szukics U, Grigulis K, Legay N, et al. Management versus site effects on the abundance of nitrifiers and denitrifiers in European mountain grasslands[J]. Science of the Total Environment, 2019, 648: 745-753. DOI:10.1016/j.scitotenv.2018.08.039 |
| [4] |
孙雪微, 许修宏, 孟庆欣, 等. 牛粪堆肥中氨氧化细菌群落结构及其与环境因子相关性研究[J]. 农业环境科学学报, 2017, 36(1): 189-197. SUN Xue-wei, XU Xiu-hong, MENG Qing-xin, et al. Research of ammonia oxidizing bacterial community structure and its correlation with environmental factors in cow manure composting[J]. Journal of AgroEnvironment Science, 2017, 36(1): 189-197. |
| [5] |
Ouyang Y, Norton J M, Stark J M. Ammonium availability and temperature control contributions of ammonia oxidizing bacteria and archaea to nitrification in an agricultural soil[J]. Soil Biology and Biochemistry, 2017, 113: 161-172. DOI:10.1016/j.soilbio.2017.06.010 |
| [6] |
Li X R, Xiao Y P, Ren W W, et al. Abundance and composition of ammonia-oxidizing bacteria and archaea in different types of soil in the Yangtze River estuary[J]. Journal of Zhejiang University Science B, 2012, 13(10): 769-782. DOI:10.1631/jzus.B1200013 |
| [7] |
Cui Y W, Zhang H Y, Ding J R, et al. The effects of salinity on nitrification using halophilic nitrifiers in a Sequencing Batch Reactor treating hypersaline wastewater[J]. Scientific Reports, 2016, 6: 24825. DOI:10.1038/srep24825 |
| [8] |
Wang Y F, Gu J D. Effects of allylthiourea, salinity, and pH on ammonia/ammonium-oxidizing prokaryotes in mangrove sediment incubated in laboratory microcosms[J]. Applied Microbiology and Biotechnology, 2014, 98(7): 3257-3274. DOI:10.1007/s00253-013-5399-3 |
| [9] |
Caffrey J M, Bano N, Kalanetra K, et al. Ammonia oxidation and ammonia-oxidizing bacteria and archaea from estuaries with differing histories of hypoxia[J]. The ISME Journal, 2007, 1(7): 660. DOI:10.1038/ismej.2007.79 |
| [10] |
Mosier A C, Francis C A. Relative abundance and diversity of ammonia-oxidizing archaea and bacteria in the San Francisco Bay estuary[J]. Environmental Microbiology, 2008, 10(11): 3002-3016. DOI:10.1111/j.1462-2920.2008.01764.x |
| [11] |
Keshri J, Mishra A, Jha B. Microbial population index and community structure in saline–alkaline soil using gene targeted metagenomics[J]. Microbiological Research, 2013, 168: 165-173. DOI:10.1016/j.micres.2012.09.005 |
| [12] |
Beman J M, Francis C A. Diversity of ammonia-oxidizing archaea and bacteria in the sediments of a hypernutrified subtropical estuary: Bahia del Tobari, Mexico[J]. Applied Environmental Microbiolgy, 2006, 72(12): 7767-7777. DOI:10.1128/AEM.00946-06 |
| [13] |
He Y, Hu W, Ma D, et al. Abundance and diversity of ammonia-oxidizing archaea and bacteria in the rhizosphere soil of three plants in the Ebinur Lake wetland[J]. Canadian Journal of Microbiology, 2017, 63(7): 573-582. DOI:10.1139/cjm-2016-0492 |
| [14] |
Cao H, Hong Y, Li M, et al. Community shift of ammonia-oxidizing bacteria along an anthropogenic pollution gradient from the Pearl River Delta to the south China Sea[J]. Applied Microbiology and Biotechnology, 2012, 94(1): 247-259. |
| [15] |
Dang H, Li J, Chen R, et al. Diversity, abundance, and spatial distribution of sediment ammonia-oxidizing Betaproteobacteria in response to environmental gradients and coastal eutrophication in Jiaozhou Bay, China[J]. Applied Microbiology and Biotechnology, 2010, 76(14): 4691-4702. |
| [16] |
鲍士旦.土壤农化分析[M].三版.北京: 中国农业出版社, 2011: 23-24, 31-33, 46-48. BAO Shi - dan. Soil agrochemical analysis[M]. 3th Edition. Beijing: China Agriculture Press, 2011: 23-24, 31-33, 46-48. |
| [17] |
王慎强, 余位培. 影响碱化土壤pH测定的主要因素[J]. 土壤通报, 1994, 25(6): 252-255. WANG Shen-qiang, YU Wei-pei. The main factors affecting pH determination of alkalized soil[J]. Chinese Journal of Soil Science, 1994, 25(6): 252-255. DOI:10.3321/j.issn:0564-3945.1994.06.010 |
| [18] |
朱靖蓉, 王成, 肖英, 等. 振荡浸提时间对不同保存方式土壤NO3--N和NH4+-N含量测定值的影响[J]. 新疆农业科学, 2014, 51(4): 761-767. ZHU Jing-rong, WANG Cheng, XIAO Ying, et al. Effect of oscillations and extraction time on measurement of content of NO3--N and NH4+-N in soil held by different saving methods[J]. Xinjiang Agricultural Sciences, 2014, 51(4): 761-767. |
| [19] |
Kurola J, Salkinoja-Salonen M, Aarnio T, et al. Activity, diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil[J]. FEMS Microbiology Letters, 2005, 250(1): 33-38. DOI:10.1016/j.femsle.2005.06.057 |
| [20] |
Hu H W, Zhang L M, Dai Y, et al. pH-dependent distribution of soil ammonia oxidizers across a large geographical scale as revealed by high-throughput pyrosequencing[J]. Journal of Soils and Sediments, 2013, 13(8): 1439-1449. DOI:10.1007/s11368-013-0726-y |
| [21] |
Ebie Y, Noda N, Miura H, et al. Comparative analysis of genetic diversity and expression of amoA in wastewater treatment processes[J]. Applied Microbiology and Biotechnology, 2004, 64(5): 740-744. DOI:10.1007/s00253-004-1558-x |
| [22] |
Ma T, Zeng W, Li Q, et al. Effects of water, salt and nitrogen stress on sunflower (Helianthus annuus L.) at different growth stages[J]. Journal of Soil Science and Plant Nutrition, 2016, 16(4): 1024-1037. |
| [23] |
Malash N M, Flowers T J, Rsgsb R. Effect of irrigation methods, management and salinity of irrigation water on tomato yield, soil moisture and salinity distribution[J]. Irrigation Science, 2008, 26(4): 313-323. DOI:10.1007/s00271-007-0095-7 |
| [24] |
范庆锋, 张玉龙, 陈重, 等. 保护地土壤盐分积累及其离子组成对土壤pH值的影响[J]. 干旱地区农业研究, 2009, 27(1): 16-20. FAN Qing-feng, ZHANG Yu-long, CHEN Chong, et al. Effects of soil salinity accumulating and ion constitution on pH in the soil of protected field[J]. Agricultural Research in the Arid Areas, 2009, 27(1): 16-20. |
| [25] |
Rietz D N, Haynes R J. Effects of irrigation-induced salinity and sodicity on soil microbial activity[J]. Soil Biology and Biochemistry, 2003, 35(6): 845-854. DOI:10.1016/S0038-0717(03)00125-1 |
| [26] |
Bernhard A E, Bollmann A. Estuarine nitrifiers: New players, patterns and processes[J]. Estuarine, Coastal and Shelf Science, 2010, 88(1): 1-11. DOI:10.1016/j.ecss.2010.01.023 |
| [27] |
He H, Zhen Y, Mi T, et al. Ammonia-oxidizing Archaea and Bacteria differentially contribute to ammonia oxidation in sediments from adjacent waters of Rushan Bay, China[J]. Frontiers in Microbiology, 2018, 9: 116. DOI:10.3389/fmicb.2018.00116 |
| [28] |
Bernhard A E, Tucker J, Giblin A E, et al. Functionally distinct communities of ammonia-oxidizing bacteria along an estuarine salinity gradient[J]. Environmental Microbiology, 2007, 9(6): 1439-1447. DOI:10.1111/j.1462-2920.2007.01260.x |
| [29] |
Duan M, House J, Liu Y, et al. Contrasting responses of gross and net nitrogen transformations to salinity in a reclaimed boreal forest soil[J]. Biology and Fertility of Soils, 2018, 54(3): 385-395. DOI:10.1007/s00374-018-1268-7 |
| [30] |
Min W, Guo H J, Zhang W, et al. Irrigation water salinity and N fertilization: Effects on ammonia oxidizer abundance, enzyme activity and cotton growth in a drip irrigated cotton field[J]. Journal of Integrative Agriculture, 2016, 15(5): 1121-1131. DOI:10.1016/S2095-3119(15)61158-3 |
| [31] |
Jin T, Zhang T, Ye L, et al. Diversity and quantity of ammonia-oxidizing Archaea and Bacteria in sediment of the Pearl River Estuary[J]. China Applied Microbiology and Biotechnology, 2011, 90(3): 1137-1145. DOI:10.1007/s00253-011-3107-8 |
| [32] |
Wang H, Gilbert J A, Zhu Y, et al. Salinity is a key factor driving the nitrogen cycling in the mangrove sediment[J]. Science of the Total Environment, 2018, 63: 1342-1349. |
| [33] |
Zhang Y, Chen L, Dai T, et al. The influence of salinity on the abundance, transcriptional activity, and diversity of AOA and AOB in an estuarine sediment: A microcosm study[J]. Applied Microbiology and Biotechnology, 2015, 99(22): 9825-9833. DOI:10.1007/s00253-015-6804-x |
| [34] |
李晨华, 贾仲君, 唐立松, 等. 不同施肥模式对绿洲农田土壤微生物群落丰度与酶活性的影响[J]. 土壤学报, 2012, 49(3): 567-574. LI Chen-hua, JIA Zhong-jun, TANG Li-song, et al. Effect of model of fertilization on microbial abundance and enzyme activity in oasis farmland soil[J]. Acta Pedologica Sinica, 2012, 49(3): 567-574. |
| [35] |
Bernhard A E, Landry Z C, Blevins A, et al. Abundance of ammoniaoxidizing archaea and bacteria along an estuarine salinity gradient in relation to potential nitrification rates[J]. Applied Environmental Microbiology, 2010, 76(4): 1285-1289. DOI:10.1128/AEM.02018-09 |
| [36] |
Magalhães C M, Machado A, Bordalo A A. Temporal variability in the abundance of ammonia-oxidizing bacteria vs archaea in sandy sediments of the Douro River estuary[J]. Portugal Aquatic Microbial Ecology, 2009, 56(1): 13-23. |
| [37] |
Wankel S D, Mosier A C, Hansel C M, et al. Spatial variability in nitrification rates and ammonia-oxidizing microbial communities in the agriculturally impacted Elkhorn Slough estuary[J]. California Applied Environmental Microbiology, 2011, 77(1): 269-280. DOI:10.1128/AEM.01318-10 |
| [38] |
Santos J P, Mendes D, Monteiro M, et al. Salinity impact on ammonia oxidizers activity and amoA expression in estuarine sediments[J]. Estuarine, Coastal and Shelf Science, 2018, 211: 177-187. DOI:10.1016/j.ecss.2017.09.001 |
| [39] |
Cao H, Li M, Hong Y, et al. Diversity and abundance of Ammonia-oxidizing Archaea and Bacteria in polluted mangrove sediment[J]. Systematic and Applied Microbiology, 2011, 34(7): 513-523. DOI:10.1016/j.syapm.2010.11.023 |
| [40] |
Gao J, Hou L, Zheng Y, et al. Shifts in the community dynamics and activity of ammonia-oxidizing prokaryotes along the Yangtze estuarine salinity gradient[J]. Journal of Geophysical Research: Biogeosciences, 2018, 123(11): 3458-3469. DOI:10.1029/2017JG004182 |
| [41] |
Li M, Cao H, Hong Y, et al. Spatial distribution and abundances of Ammonia-oxidizing Archaea (AOA) and Ammonia-oxidizing Bacteria (AOB) in mangrove sediments[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 1243-1254. DOI:10.1007/s00253-010-2929-0 |
| [42] |
Könneke M, Bernhard A E, José R, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature, 2005, 437(7058): 543. DOI:10.1038/nature03911 |
| [43] |
Qin W, Jewell T N, Russell V V, et al. Candidatus nitrosocaldales[J]. Bergey's Manual of Systematics of Archaea and Bacteria, 2015, 1-2. |
| [44] |
Karner M B, DeLong E F, Karl D M. Archaeal dominance in the mesopelagic zone of the Pacific Ocean[J]. Nature, 2001, 409(6819): 507. DOI:10.1038/35054051 |
| [45] |
Sahan E, Muyzer G. Diversity and spatio-temporal distribution of Ammonia-oxidizing Archaea and Bacteria in sediments of the Westerschelde estuary[J]. FEMS Microbiology Ecology, 2008, 64(2): 175-186. |
| [46] |
Tao R, Wakelin SA, Liang Y, et al. Response of Ammonia-oxidizing Archaea and Bacteria in calcareous soil to mineral and organic fertilizer application and their relative contribution to nitrification[J]. Soil Biology and Biochemistry, 2017, 114: 20-30. DOI:10.1016/j.soilbio.2017.06.027 |
| [47] |
Tago K, Okubo T, Shimomura Y, et al. Environmental factors shaping the community structure of Ammonia-oxidizing Bacteria and Archaea in sugarcane field soil[J]. Microbes and Environments, 2014, ME14137. |
| [48] |
宋亚珩, 王媛媛, 李占明, 等. 淹水水稻土中氨氧化古菌丰度和群落结构演替特征[J]. 农业环境科学学报, 2014, 33(5): 999-1006. SONG Ya-heng, WANG Yuan-yuan, LI Zhan-ming, et al. Succession of abundance and community structure of Ammonia - oxidizing Archaea in paddy soil during flooding[J]. Journal of Agro -Environment Science, 2014, 33(5): 999-1006. |
| [49] |
Valentine D L. Opinion: Adaptations to energy stress dictate the ecology and evolution of the archaea[J]. Nature Reviews Microbiology, 2007, 5(4): 316. DOI:10.1038/nrmicro1619 |
| [50] |
Shen J P, Zhang L M, Zhu Y G, et al. Abundance and composition of Ammonia-oxidizing Bacteria and Ammonia-oxidizing Archaea communities of an alkaline sandy loam[J]. Environmental Microbiology, 2008, 10(6): 1601-1611. DOI:10.1111/j.1462-2920.2008.01578.x |
 2019, Vol. 38
2019, Vol. 38