2. 上海污染控制与生态安全研究院, 上海 200092;
3. 中国水产科学研究院东海水产研究所, 上海 200090;
4. 嘉兴市环境科学研究所有限公司, 浙江 嘉兴 314100
2. Shanghai Institute of Pollution Control and Ecological Security, Shanghai 200092, China;
3. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;
4. Jiaxing Environmental Science Research Institute Limited Company, Jiaxing 314100, China
四环素类抗生素(Tetracycline antibiotics,TCs)由于其抗菌谱广、价格低廉以及具有显著的治疗价值已经被广泛使用于水产养殖、畜禽业和医药卫生等行业[1]。四环素类抗生素的频繁使用造成了其在环境中呈现出一种“假持久性”的现象,所带来的一系列环境污染和生态安全问题已引起广泛关注[1-3]。然而,它们的化学结构并不稳定,尤其是四环素(Tetracycline,TC)、金霉素(Chlortetracycline,CTC)、土霉素(Oxytetracycline,OTC)等天然四环素,在水体中极易发生异构化,生成差向四环素类异构体[4-7]。因此,重视四环素类母体污染物的同时,其异构化产物造成的环境污染和生态安全问题也迫切需要关注。
据研究报道,金霉素异构化产物4-差向金霉素(4-epi-chlortetracycline,ECTC)在国内外的地表水中均有检出[8-10]。基于药物化学理论,在弱酸性条件(pH=2~6)下,四环素类抗生素分子中的不对称碳原子C-4可逆地发生异构化,形成差向四环素;在弱碱性(pH=8)条件下,四环素的C环打开,转化为内酯化异构体(异四环素);在酸性较强(pH<2)的条件下,四环素C6位上的叔羟基易脱落而形成脱水四环素[11-12]。同时,也有报道指出差向异构体的半衰期相对较长,细胞毒性相比母体药物明显增加[13]。然而,自然水体比药物化学的研究环境复杂得多,四环素类抗生素及其异构体对水体环境条件十分敏感,且不同种类四环素的降解性质差异较大,但目前此方面的研究鲜有报道。
藻类作为水生生态系统的初级生产者,在水生生态系统中发挥着重要作用。另外,藻类较其他水生生物敏感,被经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)推荐为模式生物。藻细胞会不断蓄积抗生素,抗生素产生的毒性效应将随着食物链的递增而影响较高营养级别的生物,甚至对人类健康造成威胁[14]。徐冬梅等[15]研究报道了土霉素、金霉素及强力霉素对蛋白核小球藻和斜生栅藻的细胞膜通透性及生长抑制作用差异,姜思等[16]报道了四环素等4种常用抗生素对莱茵衣藻的生长及光化学活性的抑制作用,以上研究均表明四环素类抗生素对藻类具有一定的毒性。然而,这些研究均着眼于药物母体对藻类的毒性影响,对其代谢及降解产物的毒性效应研究报道甚少。因此,探索四环素类抗生素降解产物的毒性效应,有望更加全面地认识抗生素在水体中降解所带来的环境风险。
因此,本研究选取具有代表性的斜生栅藻(Scenedesmus obliquus)为受试生物,选用四环素类抗生素中稳定性较弱的金霉素为目标化合物,探索金霉素异构体降解产物对斜生栅藻的毒性效应并对其毒性机制进行探讨,为全面认识四环素类抗生素因降解和转化产生的潜在的环境风险提供依据。
1 材料与方法 1.1 仪器与试剂仪器:UVPC-2401紫外-可见分光光度计(日本岛津公司)、GXZ型智能恒温人工培养箱(宁波江南仪器厂)、JY92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、LDZM-40KCS立式压力蒸汽灭菌锅(上海申安医疗器械厂)、Waters高效液相色谱-质谱仪(美国Waters)、Heraeus MultifugeX1冷冻离心机[赛默飞世尔科技(中国)有限公司]。
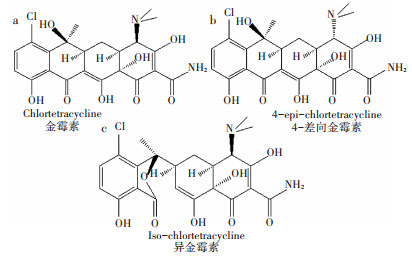
供试斜生栅藻(Scenedesmus obliquus,FACHB- 416)藻种购自中国科学院武汉水生生物研究所,抗生素及其异构体标准品均购自百灵威科技有限公司,纯度均>90%,质谱级甲酸和乙腈购自上海安谱科学仪器有限公司,活性氧自由基(ROS)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)试剂盒购自南京建成生物工程有限公司,其余化学试剂均为分析纯购自国药集团化学试剂有限公司。金霉素(Chlortetracycline,CTC),4 -差向金霉素(4-epi-chlortetracycline,ECTC),异金霉素(Iso-chlortetracycline,ICTC)结构式如图 1所示。
|
图 1 三种金霉素异构体的基本结构 Figure 1 Chemical structure of three chlortetracycline isomers |
按照OECD推荐方法,斜生栅藻藻种在无菌条件下于BG11培养基中培养。培养条件为温度25 ℃,光照周期设置为12 h光照及12 h黑暗,光照强度为3000~4000 lx,放置于智能恒温光照培养箱中静置培养至对数生长期,并继续扩大培养,预培养3代,镜检细胞正常后培养至对数生长期进行毒性试验。
1.3 藻类毒性试验按照OECD推荐方法,将培养至对数生长期的斜生栅藻分别接种到50 mL含有CTC、ECTC和ICTC药物的培养液中进行无菌培养,药物的浓度分别设置为1×10-5、1×10-6、5×10-7 mol·L-1,同时选用不添加药物的培养液进行无菌培养作为对照组(CK)。试验藻细胞初始密度约为8.0×105 cells·mL-1,各个浓度设置3个平行。将藻细胞于含有不同浓度的抗生素中静置培养72 h,每隔24 h用无菌注射器取出1 mL测定吸光度(培养液pH相同,放入恒温光照培养箱中进行培养)。本实验建立了斜生栅藻藻密度与吸光度之间的线性关系,且相关指数R2>0.999,利用紫外-可见分光光度计于680 nm处测定光密度来表征斜生栅藻藻细胞的密度,并根据以下公式计算藻细胞生长抑制率:
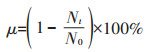
|
式中:μ为斜生栅藻生长抑制率;Nt和N0分别为t(24、48、72 h)时刻和t0(初始接种)时的藻细胞个数。
1.4 高效液相色谱-串联质谱(HPLC-MS)解析藻液中CTC及异构体降解产物藻细胞培养期间,每隔12 h使用无菌注射器在无菌条件下取1 mL藻液,并使用0.22 μm纤维素滤膜过滤,取滤出清液进行CTC及异构体降解产物浓度的检测。CTC及异构体降解产物浓度使用高效液相色谱-质谱仪(配电喷雾离子源,ESI)测定。检测条件如下:色谱柱为Waters Atlantis C18(2.1 mm×150 mm);柱温为30 ℃;流动相为1%甲酸/乙腈(80/20);进样量和流速分别为10 μL和0.2 mL·min-1,毛细管电压20 V;荷质比m/z为479。
1.5 藻细胞亚细胞形态的测定取暴露72 h后的藻液10 mL,4 ℃ 10 000 r·min-1离心10 min,去上清液,参考邹宁等[17]的方法对样品进行前处理,采用LEICA EM UC7型超薄切片机切片,经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5~10 min后,在Hitachi H-7650型透射电镜中观察。
1.6 粗酶液提取将暴露72 h后的藻液无菌条件下转移至已灭菌的50 mL离心管中,放置超声波细胞破碎机下破碎8 min,工作10 s,间隔10 s,功率为200 W。细胞破碎结束后4 ℃ 10 000 r·min-1离心10 min,上清液即为粗酶液。
1.7 活性氧自由基(ROS)、细胞通透性、叶绿素及抗氧化系统测定斜生栅藻细胞通透性的测定参考Ouyang等[18]的方法,采用荧光指示物乙二酸荧光素(FDA)对藻细胞进行标记,通过荧光酶标仪测定荧光强度间接反应细胞膜的通透性,叶绿素a采用反复冻融法[19]测定,可溶性蛋白质采用考马斯亮蓝染色法[20]进行测定,本研究中ROS、SOD、CAT的测定均严格按照南京建成生物工程有限公司试剂盒说明书进行操作。
1.8 数据分析所有数据均采用mean ± SD的形式表示,利用GraphPad prism 7和SPSS进行数据分析及单因素方差分析(ANOVA)中的LSD检验进行统计分析(不同小写字母表示经LSD法检验后差异显著P<0.05)。
2 结果与讨论 2.1 CTC对斜生栅藻的生长抑制及异构体降解产物分析图 2为3种浓度CTC胁迫下斜生栅藻的生长抑制情况。结果表明,CTC在所测浓度范围内对斜生栅藻具有明显的生长抑制作用,且随着浓度升高,对斜生栅藻生长的抑制率增大。在72 h暴露过程中,CTC于48 h时对斜生栅藻的生长抑制率最大,1×10-5、1× 10-6、5×10-7 mol·L-1的暴露浓度下抑制率分别达到22.79%、17.78%、15.08%。已有研究提出,四环素类抗生素可通过主动转运进入细胞并与细胞核糖体上30S亚基不可逆结合,阻止氨酰基转移与DNA结合而抑制细胞蛋白质的合成,从而抑制藻细胞生长[21-22]。然而,本研究还发现CTC在水相环境中很不稳定,易转变成其他降解产物。因此,我们认为四环素类抗生素对藻类的抑制机制除母体药物的作用之外,其降解产物或是降解产物与母体药物的混合物对藻细胞所产生的不利影响也不可忽视[23]。

|
图 2 CTC胁迫下斜生栅藻的生长抑制情况 Figure 2 The growth inhibition rate of Scenedesmus obliquus under CTC stress |
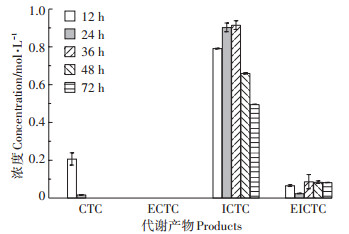
据已有报道,CTC对水体条件十分敏感,易产生ECTC、ICTC、脱水金霉素等一系列降解及代谢产物[24]。Halling-Sorensen等[25]和Soeborg等[26]研究认为,pH、水体温度及光照强度对四环素类抗生素的水解影响显著,差向四环素类和异四环素类是主要的降解产物,水解产物中ICTC的半衰期最长。同时,Solliec等[27]指出CTC在加标的地表水溶液中孵育一个月后,已经基本被转化成ICTC及4-差向异金霉素(4-epiiso-chlortetracycline,4-EICTC)。基于此,为深入考察不同种类降解产物的毒性贡献,本研究使用HPLCMS对金霉素在斜生栅藻存在下的异构体降解产物进行了测定。如图 3所示,CTC在藻液中并不稳定,24 h已经基本转化为异构体产物,且随着胁迫时间的延长,CTC逐渐向ICTC转化,并伴随着少量4-EICTC的产生,ICTC的浓度在36 h达到最大,随后,藻液中的异构体抗生素浓度降低,这可能是由于藻细胞会优先积累抗生素,之后再通过吸附[28]、吸收[29]、降解或代谢[30]等一系列响应,将抗生素转化成其他降解产物进行释放。由图 3可以得出,在斜生栅藻存在下的CTC转化产物主要以ICTC为主。
|
图 3 斜生栅藻藻液中CTC的异构化产物分布 Figure 3 The distribution of isomerized products of CTC in algae suspension |
图 4为斜生栅藻暴露于CTC异构体降解产物ECTC与ICTC下,72 h内的生长抑制情况。在所测浓度范围ECTC、ICTC的胁迫下,斜生栅藻均表现出明显的生长抑制。在ECTC胁迫下,斜生栅藻在48 h时生长抑制情况最为严重,1×10-5、1×10-6、5×10-7 mol·L-1的ECTC对斜生栅藻抑制率分别为18.77%、14.86%、13.01%。而在ICTC胁迫下,斜生栅藻生长抑制率在72 h内随药物浓度的降低而升高。结合图 2分析,母体药物CTC与异构体降解产物ECTC、ICTC结构相似,但它们对于斜生栅藻的生长抑制却表现出了明显不同的规律,取代基空间构象的不同可能是造成毒性差异的主要原因[31]。此外,由图 5可知,CTC母体药物暴露较其异构体降解产物具有更高的毒性,暴露浓度为1×10-5 mol·L-1的CTC与其余各处理组相比,其对斜生栅藻的生长抑制呈现出显著差异(P<0.05),而作为主要降解产物之一的ICTC的毒性效力最低。但是,结合图 3中CTC异构体降解产物的分布结果可见,在暴露24 h时,CTC在藻液中的存在以ICTC形式为主。因此,推测CTC母体药物所产生的较高的毒性可能是由于3种异构体降解产物的联合作用。

|
图 4 ECTC、ICTC胁迫下斜生栅藻的生长抑制情况 Figure 4 The growth inhibition rate of Scenedesmus obliquus under ECTC and ICTC stress |

|
图 5 10-5 mol·L-1CTC在不同时间与其余各组的显著性差异分析 Figure 5 Analysis of significant difference between 10-5 mol·L-1 CTC with other groups at different time |
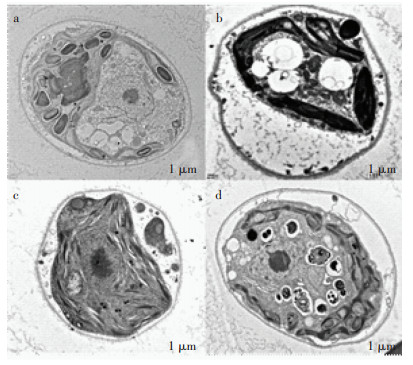
图 6为1×10-5 mol·L-1 3种药物处理下斜生栅藻的亚细胞形态。由图可知,对照组的细胞呈现椭圆形,有较规则的细胞壁,具有完整的细胞结构,叶绿体几乎充满了整个细胞,而在CTC、ECTC、ICTC胁迫下,藻细胞有不同程度的损伤,叶绿体萎缩,发生了明显的质壁分离,叶绿体的萎缩会影响藻细胞的光合作用,影响藻类正常的生长代谢[32]。其中,CTC处理下细胞受损最为严重,与其表现出的生长抑制情况一致。研究表明,在藻细胞受到外界胁迫时,其细胞形态会发生变化,使得细胞变性,破裂,发生质壁分离,对叶绿体具有较大的毒害作用,影响藻类的光合作用[32-33]。
|
(a. CK; b. 1×10-5 mol·L-1 CTC; c. 1×10-5 mol·L-1 ECTC; d. 1×10-5 mol·L-1 ICTC) 图 6 CTC及其异构体降解产物72 h胁迫下藻细胞的亚细胞形态 Figure 6 Subcellular morphology of algal cells after 72 h stress in CTC and its isomer degradation products |
细胞膜是保护细胞的第一道屏障,可以选择性控制物质进出细胞,通透性是它们主动或被动地将物质输入和输出细胞的能力的指标,细胞膜通透性的改变会使得有毒物质更容易进入藻细胞,在藻细胞中不断地进行积累,导致藻细胞的代谢过程紊乱,从而对藻细胞产生毒性[34]。已有研究表明,低浓度的四环素类抗生素可以影响淡水绿藻的细胞膜通透性[15],因此,本研究也进一步对CTC及其异构体降解产物胁迫下的斜生栅藻细胞通透性进行了考察。图 7为CTC及其异构体降解产物72 h胁迫对斜生栅藻细胞膜通透性的影响,与对照组相比,CTC及其异构体降解产物均使斜生栅藻细胞膜通透性显著增大,CTC母体药物及其异构体降解产物均对斜生栅藻细胞膜造成一定程度的损伤,也是影响藻类正常生长的重要因素之一。

|
图 7 CTC及其异构体降解产物72 h胁迫下对斜生栅藻细胞通透性的影响 Figure 7 The effects of CTC and its isomer degradation products on cellular permeability of Scenedesmus obliquus in 72 h |
据已有研究报道,微藻在外源污染物的胁迫下会应激产生大量ROS,ROS的过量产生随之会导致细胞产生氧化应激,损害微藻的细胞膜和蛋白质,从而抑制正常生理生化功能[35]。基于此,本研究对CTC母体药物及其异构体降解产物胁迫下的斜生栅藻进行了ROS分析。结果如图 8所示,10-5 mol·L-1 CTC、ECTC、ICTC处理组的藻细胞在72 h时的ROS相比于对照组分别增加了2.19、2.01、1.49倍,且所有处理组均较对照组产生显著差异。细胞内ROS的不断产生和积累会破坏ROS积累与清除之间的平衡,从而激发抗氧化系统的活性。因此,基于ROS的分析结果,本研究进一步选取了SOD和CAT两类生物体内主要的抗氧化酶进行分析。图 9呈现了藻细胞内CAT和SOD的活性变化趋势,证实了藻细胞内氧化应激的变化。在CTC母体药物的胁迫下,藻细胞内的SOD和CAT的活性均显著升高,与ROS的变化趋势呈正相关。这可能是由于CTC胁迫下ROS含量显著升高,藻细胞产生了脂质过氧化,促使SOD和CAT的活性显著增加,清除了藻细胞内多余的活性氧[36];而在ECTC及ICTC胁迫下,藻细胞内的SOD与CAT的活性变化与对照组相比差异性明显减弱,表明了CTC母体药物对藻细胞内ROS及抗氧系统的影响最为明显。

|
图 8 CTC及其异构体降解产物72 h胁迫下对斜生栅藻ROS的影响 Figure 8 The effects of CTC and its isomer degradation products on ROS of Scenedesmus obliquus in 72 h |

|
图 9 CTC及其异构体降解产物72 h胁迫下对斜生栅藻CAT和SOD酶活性的影响 Figure 9 The effects of CTC and its isomer degradation products on CAT and SOD of Scenedesmus obliquus in 72 h |
叶绿素a是光合作用的重要参数,其浓度的变化可以直接影响藻类生物量的变化,间接反映出斜生栅藻对3种药物的毒性反应[37]。图 10为CTC及其异构体降解产物72 h暴露对斜生栅藻细胞内叶绿素a浓度的影响。结果表明,3种异构体降解产物对斜生栅藻叶绿素a浓度的影响具有明显差异,在10-5 mol·L-1浓度CTC和ICTC的胁迫下,叶绿素a的浓度与对照组相比分别显著下降了23.31%和15.95%,暴露浓度越小,对叶绿素a的抑制越小;在ECTC的暴露下,斜生栅藻叶绿素a含量与对照组无明显差异。结合图 8中藻细胞内ROS的升高及生长抑制情况,我们推测是藻细胞受到外界胁迫,大量ROS的积累破坏细胞内部结构,抑制叶绿素合成酶的活性,使叶绿素的浓度降低,影响藻细胞的光合作用,细胞的新陈代谢变慢,进而影响藻细胞的生物量[32]。
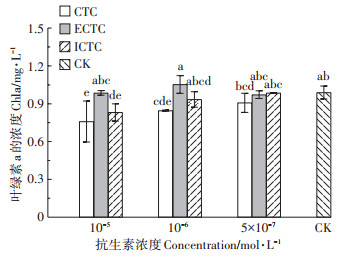
|
图 10 CTC及其异构体降解产物72 h胁迫下对斜生栅藻叶绿素a的影响 Figure 10 The effects of CTC and its isomer degradation products on chlorophyll-a of Scenedesmus obliquus in 72 h |
据已有研究报道,四环素类抗生素对藻类的毒性效应主要体现在抑制蛋白质合成和叶绿体生成方面,从而对藻类的生长产生抑制[38]。由图 11可见,在CTC及其异构体降解产物的胁迫下,藻细胞可溶性蛋白质的浓度均呈现下降趋势,且浓度越大,下降趋势愈显著,CTC和ECTC处理下的斜生栅藻的可溶性蛋白质的浓度分别下降了31.46%、22.76%、21.99%和24.05%、17.91%、12.57%。而ICTC胁迫对藻细胞可溶性蛋白质浓度的影响较小,不同处理下的浓度下降均低于10%,与对照组相比无明显变化。由此进一步可得CTC、ECTC、ICTC虽然具有相似的化学结构,但取代基空间构象的不同会导致药物与藻细胞中可溶性蛋白质的结合位点不同,因而产生不同的毒性效应[39]。
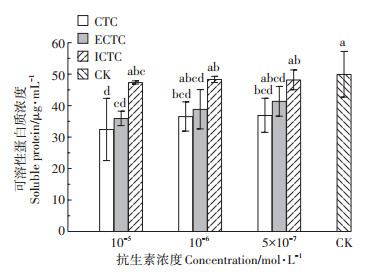
|
图 11 CTC及其异构体降解产物72 h胁迫对斜生栅藻可溶性蛋白质的影响 Figure 11 The effects of chlortetracycline and its isomers on soluble protein content of Scenedesmus obliquus in 72 h |
(1)CTC对斜生栅藻具有明显的生长抑制作用,且在斜生栅藻存在下,CTC转化产物主要以ICTC为主。CTC、ECTC、ICTC虽然结构类似,但对斜生栅藻有显著的异构体毒性差异,在相同的暴露浓度下,生长抑制作用表现为CTC>ECTC>ICTC。
(2)CTC母体药物对藻细胞的光合作用、蛋白质含量、活性氧及抗氧化酶与对照组相比均具有显著性差异,金霉素内酯化异构体(ICTC)对藻细胞则具有较低的毒性效应。
(3)金霉素抗生素在环境中不断地进行积累和代谢,在斜生栅藻存在下CTC最主要的中间产物为其内酯化产物及其差向异构化产物,CTC母体药物与其异构体降解产物虽然具有相似的化学结构,但取代基空间构象的不同会导致药物与藻细胞中的可溶性蛋白质的结合位点不同,因而对藻细胞产生不同的毒性效应。
| [1] |
Daghrir R, Drogui P. Tetracycline antibiotics in the environment:A review[J]. Environmental Chemistry Letters, 2013, 11(3): 209-227. DOI:10.1007/s10311-013-0404-8 |
| [2] |
Nathan C. Antibiotics at the crossroads[J]. Nature, 2004, 431(7011): 899-902. DOI:10.1038/431899a |
| [3] |
朱永官, 欧阳纬莹, 吴楠, 等. 抗生素耐药性的来源与控制对策[J]. 中国科学院院刊, 2015, 30(4): 509-516. ZHU Yong-guan, OUYANG Wei-ying, WU Nan, et al. Antibiotic resistance:Sources and mitigation[J]. Bulletin of the Chinese Academy of Sciences, 2015, 30(4): 509-516. |
| [4] |
伊丽丽, 焦文涛, 陈卫平. 不同抗生素在剖面土壤中的吸附特征[J]. 环境化学, 2013, 32(12): 2357-2363. YI Li-li, JIAO Wen-tao, CHEN Wei-ping. Adsorption characteristics of three types of antibiotics in the soil profiles[J]. Environmental Chemistry, 2013, 32(12): 2357-2363. DOI:10.7524/j.issn.0254-6108.2013.12.020 |
| [5] |
周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染[J]. 生态毒理学报, 2007, 2(3): 243-251. ZHOU Qi-xing, LUO Yi, WANG Mei-e. Environmental residues and ecotoxicity of antibiotics and their resistance gene pollution:A review[J]. Asian Journal of Ecotoxicology, 2007, 2(3): 243-251. |
| [6] |
Kühne M, Ihnen D, Möller G, et al. Stability of tetracycline in water and liquid manure[J]. Journal of Veterinary Medicine Series A, 2000, 47(6): 379-384. DOI:10.1046/j.1439-0442.2000.00300.x |
| [7] |
Halling-Sorensen B, Sengelov G, Tjornelund J. Toxicity of tetracyclines and tetracycline degradation products to environmentally relevant bacteria, including selected tetracycline-resistant bacteria[J]. Archives of Environmental Contamination and Toxicology, 2002, 42(3): 263-271. DOI:10.1007/s00244-001-0017-2 |
| [8] |
Bu Q W, Wang B, Huang J, et al. Pharmaceuticals and personal care products in the aquatic environment in China:A review[J]. Journal of Hazardous Materials, 2013, 262(22): 189-211. |
| [9] |
Li D, Yang M, Hu J, et al. Determination and fate of oxytetracycline and related compounds in oxytetracycline production wastewater and the receiving river[J]. Environmental Toxicology and Chemistry, 2008, 27(1): 80-86. DOI:10.1897/07-080.1 |
| [10] |
Bartelt-Hunt S, Snow D D, Damon-Powell T, et al. Occurrence of steroid hormones and antibiotics in shallow groundwater impacted by livestock waste control facilities[J]. Journal of Contaminant Hydrology, 2011, 123(3): 94-103. |
| [11] |
李志裕. 药物化学[M]. 南京: 东南大学出版社, 2009: 380-405. LI Zhi-yu. Medicinal chemistry[M]. Nanjing: Southeast University Press, 2009: 380-405. |
| [12] |
顾觉奋. 抗生素[M]. 上海: 上海科学技术出版社, 2002: 265-280. GU Jue-fen. Antibiotics[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2002: 265-280. |
| [13] |
Loftin K A, Adams C D, Meyer M T, et al. Effects of ionic strength, temperature, and pH on degradation of selected antibiotics[J]. Journal of Environmental Quality, 2008, 37(2): 378-386. DOI:10.2134/jeq2007.0230 |
| [14] |
Fu L, Huang T, Wang S, et al. Toxicity of 13 different antibiotics towards freshwater green algae Pseudokirchneriella subcapitata and their modes of action[J]. Chemosphere, 2017, 168: 217-222. DOI:10.1016/j.chemosphere.2016.10.043 |
| [15] |
徐冬梅, 王艳花, 饶桂维. 四环素类抗生素对淡水绿藻的毒性作用[J]. 环境科学, 2013, 34(9): 3386-3390. XU Dong-mei, WANG Yan-hua, RAO Gui-wei. Cellular response of freshwater green algae to the toxicity of tetracycline antibiotics[J]. Environmental Science, 2013, 34(9): 3386-3390. |
| [16] |
姜思, 刘莹莹, 佟少明. 4种常用抗生素对莱茵衣藻生长及光化学活性的影响[J]. 生物加工过程, 2017, 15(2): 13-20. JIANG Si, LIU Ying-ying, TONG Shao-ming. Effects of four antibiotics on growth and photochemical activities of Chlamydomonas reinhardtii[J]. Chinese Journal of Bioprocess Engineering, 2017, 15(2): 13-20. DOI:10.3969/j.issn.1672-3678.2017.02.003 |
| [17] |
邹宁, 魏丕伟, 肖波, 等. 扁藻细胞电镜观察的制样技术[J]. 烟台教育学院学报, 2004, 10(3): 73-75. ZOU Ning, WEI Pi-wei, XIAO Bo, et al. Sample preparation methods of platymonas subcordiformis for the submicroscopic structure observation by transmission electric microscope(TEM)[J]. Journal of Yantai Vocational College, 2004, 10(3): 73-75. DOI:10.3969/j.issn.1673-5382.2004.03.022 |
| [18] |
Ouyang S H, Hu X G, Zhou Q X. Envelopment-Internalization synergistic effects and metabolic mechanisms of graphene oxide on singlecell Chlorella vulgaris are dependent on the nanomaterial particle size[J]. Acs Applied Materials & Interfaces, 2015, 7(32): 18104-18112. |
| [19] |
冯菁, 李艳波, 朱擎, 等. 浮游植物叶绿素a测定方法比较[J]. 生态环境, 2008, 17(2): 524-527. FENG Jing, LI Yan-bo, ZHU Qing, et al. Comparison of methods for phytoplankton chlorophyll-a concentration measurement[J]. Ecology and Environmental Sciences, 2008, 17(2): 524-527. DOI:10.3969/j.issn.1674-5906.2008.02.013 |
| [20] |
王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工, 2009, 23(3): 40-42. WANG Xiao-ping, XING Shu-li. Determination of protein quantitation using the method of Coomassie brilliant blue[J]. Tianjin Chemical Industry, 2009, 23(3): 40-42. DOI:10.3969/j.issn.1008-1267.2009.03.016 |
| [21] |
Lu L, Wu Y X, Ding H J, et al. The combined and second exposure effect of copper (Ⅱ) and chlortetracycline on fresh water algae, Chlorella pyrenoidosa and Microcystis aeruginosa[J]. Environmental Toxicology & Pharmacology, 2015, 40(1): 140-148. |
| [22] |
Halling-Sorensen B. Algal toxicity of antibacterial agents used in intensive farming[J]. Chemosphere, 2000, 40(7): 731-739. DOI:10.1016/S0045-6535(99)00445-2 |
| [23] |
Guo R X, Chen J Q. Phytoplankton toxicity of the antibiotic chlortetracycline and its UV light degradation products[J]. Chemosphere, 2012, 87(11): 1254-1259. DOI:10.1016/j.chemosphere.2012.01.031 |
| [24] |
李伟明, 鲍艳宇, 周启星. 四环素类抗生素降解途径及其主要降解产物研究进展[J]. 应用生态学报, 2012, 23(8): 2300-2308. LI Wei-ming, BAO Yan-yu, ZHOU Qi-xing. Degradation pathways and main degradation products of tetracycline antibiotics:Research progress[J]. Chinese Journal of Applied Ecology, 2012, 23(8): 2300-2308. |
| [25] |
Halling-Sorensen B, Lykkeberg A, Ingerslev F, et al. Characterization of the abiotic degradation pathways of oxytetracyclines in soil interstitial water using LC-MS-MS[J]. Chemosphere, 2003, 50(10): 1331-1342. DOI:10.1016/S0045-6535(02)00766-X |
| [26] |
Soeborg T, Ingerslev F, Halling-Sorensen B. Chemical stability of chlortetracycline and chlortetracycline degradation products and epimers in soil interstitial water[J]. Chemosphere, 2004, 57(10): 1515-1524. DOI:10.1016/j.chemosphere.2004.09.020 |
| [27] |
Solliec M, Roy-Lachapelle A, Gasser M O, et al. Fractionation and analysis of veterinary antibiotics and their related degradation products in agricultural soils and drainage waters following swine manure amendment[J]. Science of the Total Environment, 2016, 543(Part A): 524-535. |
| [28] |
Tran V S, Ngo H H, Guo W S, et al. Typical low cost biosorbents for adsorptive removal of specific organic pollutants from water[J]. Bioresource Technology, 2015, 182: 353-363. DOI:10.1016/j.biortech.2015.02.003 |
| [29] |
Rhiem S, Riding M J, Baumgartner W, et al. Interactions of multiwalled carbon nanotubes with algal cells:Quantification of association, visualization of uptake, and measurement of alterations in the composition of cells[J]. Environmental Pollution, 2015, 196(2): 431-439. |
| [30] |
Wang Y H, Liu J Z, Kang D, et al. Removal of pharmaceuticals and personal care products from wastewater using algae-based technologies:A review[J]. Reviews in Environmental Science and Bio-Technology, 2017, 16(2): 717-735. |
| [31] |
张劲强, 梁岩, 董元华, 等. 差向异构对四环素类药物的发光菌毒性研究[J]. 毒理学杂志, 2006, 20(5): 279-281. ZHANG Jin-qiang, LIANG Yan, DONG Yuan-hua, et al. Toxicity of tetracycline and their epi-isomers on the luminescent bacterium[J]. Journal of Toxicology, 2006, 20(5): 279-281. DOI:10.3969/j.issn.1002-3127.2006.05.001 |
| [32] |
段炼, 杜耀, 陆秋琳, 等. 离子液体1-丁基-3-甲基咪唑氯盐对斜生栅藻的毒性效应[J]. 中国环境科学, 2012, 32(5): 886-891. DUAN Lian, DU Yao, LU Qiu-lin, et al. Toxicity of 1-butyl-3-methylimidazolium chloride ionic liquid to Scenedesmus obliqnus[J]. China Environmental Science, 2012, 32(5): 886-891. DOI:10.3969/j.issn.1000-6923.2012.05.018 |
| [33] |
Qian H F, Chen W, Sheng G D, et al. Effects of glufosinate on antioxidant enzymes, subcellular structure, and gene expression in the unicellular green alga Chlorella vulgaris[J]. Aquatic Toxicology, 2008, 88(4): 301-307. DOI:10.1016/j.aquatox.2008.05.009 |
| [34] |
Xu D M, Li C D, Chen H, et al. Cellular response of freshwater green algae to perfluorooctanoic acid toxicity[J]. Ecotoxicology & Environmental Safety, 2013, 88(2): 103-107. |
| [35] |
Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. International Journal of Biochemistry & Cell Biology, 2007, 39(1): 44-84. |
| [36] |
张军, 王文科, 耿雅妮, 等. 黑麦草抗氧化酶对Cd、Zn和Pb复合污染的响应[J]. 农业环境科学学报, 2018, 37(6): 1117-1124. ZHANG Jun, WANG Wen-ke, GENG Ya-ni, et al. The response to the combined pollution of cadmium, zinc, and lead by the antioxidant enzyme activity of Lolium perenne L.[J]. Journal of Agro-Environment Science, 2018, 37(6): 1117-1124. |
| [37] |
Gu S R, Zheng H, Xu Q Q, et al. Comparative toxicity of the plasticizer dibutyl phthalate to two freshwater algae[J]. Aquatic Toxicology, 2017, 191: 122-130. DOI:10.1016/j.aquatox.2017.08.007 |
| [38] |
张浩, 罗义, 周启星. 四环素类抗生素生态毒性研究进展[J]. 农业环境科学学报, 2008, 27(2): 407-413. ZHANG Hao, LUO Yi, ZHOU Qi-xing. Research advancement of eco-toxicity of tetracycline antibiotics[J]. Journal of Agro-Environment Science, 2008, 27(2): 407-413. DOI:10.3321/j.issn:1672-2043.2008.02.001 |
| [39] |
Volkers G, Petruschka L, Hinrichs W. Recognition of drug degradation products by target proteins:Isotetracycline binding to Tet repressor[J]. Journal of Medicinal Chemistry, 2011, 54(14): 5108-5115. DOI:10.1021/jm200332e |
 2019, Vol. 38
2019, Vol. 38


